Гібридна лапароскопічна панкреатодуоденальна резекція при періампулярних новоутвореннях
Земсков С.В.1, Квасівка О.О.2, Васильонок Я.В.2, Пепенін І.О.2, Мойсеєнко А.Б.2, Паренюк Р.Ю.2, Копчак К.В.2
- 1Національний медичний університет ім. О.О. Богомольця, Київ, Україна
- 2Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
Резюме. Панкреатодуоденальна резекція (ПДР) є радикальним хірургічним лікуванням при новоутвореннях періампулярної зони. Під нашим спостереженням знаходилося 169 пацієнтів, яким виконано ПДР. З них 39 (23,1%) хворим виконано гібридну ПДР. Лапароскопічні панкреатодуоденальні резекції (ЛПДР) статистично не відрізнялися за часом (6 год 40 хв проти 6 год 0 хв, р=0,08) з відкритою групою. Інтраопераційна крововтрата при лапароскопічних резекціях варіювала в межах 50–750 мл, у середньому становивши 310±350 мл; у відкритих резекціях втрата крові була більшою (100–900 мл, середній показник 400±400 мл), хоча медіана відрізнялася несуттєво (310 vs 400 мл, p=0,15). Загальна частота ускладнень суттєво не відрізнялася у групі гібридних ПДР (45%) проти відкритих ПДР (39%).
Одержано 3.09.2025
Прийнято до друку 15.09.2025
DOI: 10.32471/clinicaloncology.2663-466X.34974
ВСТУП
ПДР, або операція Уїппла, або панкреатодуоденектомія, залишається основним і єдиним радикальним методом лікування резектабельних злоякісних новоутворень періампулярної зони — раку голівки підшлункової залози, ампули Фатера, дистального відділу холедоха та пухлин дванадцятипалої кишки. Останніми десятиліттями в хірургії активно впроваджуються мінімально інвазивні технології, які довели свої переваги при багатьох локалізаціях новоутворень, зокрема й при резекціях дистального відділу підшлункової залози [1, 2]. Проспективні дослідження підтверджують, що лапароскопічні резекції тіла і хвоста підшлункової залози супроводжуються меншою кількістю інтра- та післяопераційних ускладнень, а також швидшим відновленням, і нині лапароскопічна дистальна панкреатектомія вважається новим стандартом лікування для доброякісних і злоякісних пухлин тіла-хвоста підшлункової залози [2, 3].
Водночас використання лапароскопічного підходу при ПДР тривалий час залишалося спірним через значну технічну складність операції та побоювання щодо безпеки [4]. Лише у високоспеціалізованих центрах накопичені серії успішних ЛПДР, які продемонстрували технічну можливість і онкологічну доцільність, порівнянну з відкритими операціями [4]. Ретроспективні порівняльні дослідження і метааналізи свідчать, що при ЛПДР вдається зменшити інтраопераційну крововтрату та тривалість госпіталізації без підвищення рівня ускладнень чи зниження виживаності порівняно з відкритим втручанням [5, 6]. Зокрема, за даними метааналізу K. Chen та співавт. (2018), ЛПДР асоціюються з меншою середньою крововтратою (на ~370 мл менше) та коротшим перебуванням у стаціонарі (у середньому на ~4 дні менше) при статистично рівних показниках частоти панкреатичних нориць, радикальності (R0) і загальної виживаності, хоча операційний час при ЛПДР був довшим на близько 1,5 год [1]. Аналогічно метааналіз S.H. Shin та співавт. (2017) свідчить, що повна ЛПДР потребує в середньому на ~117 хв більше часу, проте скорочує післяопераційну госпіталізацію в середньому на ~3,7 доби порівняно з відкритою операцією; при цьому загальний рівень ускладнень і панкреатичних нориць не відрізняється між групами [7]. Отже, у досвідчених центрах ЛПДР є технічно здійсненною та потенційно дозволяє поліпшити окремі короткострокові результати.
Незважаючи на обнадійливі результати окремих центрів, впровадження ЛПДР відбувається повільно. За даними глобального опитування 2016–2017 рр., лише близько 29% хірургів виконували ПДР мінімально інвазивно, тоді як лапароскопічні дистальні панкреатектомії виконували ~79% опитаних. Головними причинами, що стримують хірургів від виконання ЛПДР, назвали відсутність спеціальної підготовки та тривалу криву навчання [8]. У дослідженнях зазначено, що для опанування ЛПДР хірургу може знадобитися від ~20 до ≥40 випадків, щоб досягти прийнятних показників тривалості операції та ускладнень [9]. Крім того, рандомізовані дослідження ЛПДР мали суперечливі результати. Зокрема, багатоцентрове дослідження LEOPARD-2 (Нідерланди) достроково зупинили через тенденцію до вищої післяопераційної летальності в лапароскопічній групі: у 90-денний період померло 5 із 50 (10%) пацієнтів після ЛПДР проти 1 із 49 (2%) після відкритої операції. Хоча різниця не досягла статистичної значущості (р=0,20), цей тривожний сигнал викликав обговорення безпеки методики. При цьому основна кінцева точка дослідження (час до відновлення функціонального стану) не свідчить про жодні переваги лапароскопічного доступу (медіана ~10 днів в обох групах). Автори дійшли висновку, що ЛПДР не дає очевидних переваг щодо відновлення, а більш висока (хоч і не достовірна) летальність у групі ЛПДР викликає занепокоєння щодо безпеки, особливо зважаючи на те, що операції виконували досвідчені хірурги у високоспеціалізованих центрах [10]. Ці результати підкреслили важливість фактора навчальної кривої та відбору пацієнтів для ЛПДР [6].
Альтернативною стратегією впровадження лапароскопічних підходів стала гібридна ЛПДР. Під «гібридною» мають на увазі комбіновану техніку, при якій резекційний етап виконується лапароскопічно, а реконструктивний — через мінілапаротомію [11–19]. Такий підхід покликаний поєднати переваги малоінвазивної дисекції (краща візуалізація, менша травматизація тканин, зменшення крововтрати) зі збереженням надійності ручного накладення анастомозів через мінірозріз. У нещодавно опублікованому метааналізі (Vladimirov M. та співавт., 2022) порівняно результати гібридної ЛПДР і відкритої ПДР (аналіз 14 досліджень, 371 пацієнт) і підтверджено безпеку гібридної методики у високоспеціалізованих центрах. Гібридні операції характеризувалися достовірно довшою тривалістю (середня різниця ~67 хв) порівняно з відкритими, натомість за всіма іншими показниками — об’єм крововтрати, частота гемотрансфузій, післяопераційні ускладнення — статистично значущих відмінностей не виявлено. Так, гібридна ЛПДР розглядається як ефективний проміжний етап на шляху від традиційної лапаротомії до повністю лапароскопічної (або роботизованої) панкреатодуоденектомії [5]. Досвід окремих центрів також вказує, що лапароскопічно-асистована ПДР може забезпечувати не гірші онкологічні результати при відборі відповідних пацієнтів [7]. У зв’язку з цим актуальним є аналіз власного досвіду використання гібридної ЛПДР та порівняння її результатів із традиційною відкритою технікою.
МЕТА
Визначити переваги та недоліки гібридної ЛПДР порівняно з відкритою ПДР у лікуванні періампулярних новоутворень, проаналізувати короткострокові результати та ускладнення, а також зіставити отримані дані з інформацією з літературних джерел.
МАТЕРІАЛИ І МЕТОДИ дослідження
Дизайн дослідження: проведено одноцентрове ретроспективне порівняльне дослідження. Проаналізовано медичні дані пацієнтів, яким виконано ПДР через періампулярні новоутворення за період з 2017 до 2024 рр. Усього за цей термін здійснено 139 ПДР, із них 33 лапароскопічні гібридні резекції (основна група) та 106 відкритих резекцій (група порівняння). Критеріями залучення пацієнтів до основної (лапароскопічної) групи були передопераційно встановлена резектабельність пухлини, відсутність значного судинного залучення (інвазії в портальну вену чи магістральні артерії), а також відсутність тяжких форм коморбідних захворювань (для безпечного виконання лапароскопії). Пацієнтам із судинною інвазією (за даними КТ) первинно обирали відкриту тактику; отже, випадки комбінованих резекцій судин увійшли лише до відкритої групи.
Передопераційна підготовка: усі пацієнти проходили стандартне обстеження, включно з лабораторними аналізами (клінічним і біохімічним аналізом крові, коагулограмою, онкомаркером СА 19-9), електрокардіографією та візуалізацією пухлини (мультиспіральною комп’ютерною томографією (МСКТ) з внутрішньовенним контрастуванням / магнітно-резонансною томографією (МРТ) з внутрішньовенним контрастуванням), гастро- / колоноскопія. Тактика лікування визначалася на мультидисциплінарному онкологічному консиліумі. У випадках механічної жовтяниці методом вибору була біліарна декомпресія. Загалом у 78 (73,5%) пацієнтів відкритої групи та 14 (42,4%) пацієнтів лапароскопічної групи до хірургії виконували черезшкірну черезпечінкову холангіостомію / ендобіліарне стентування (ЧЧХС / ЕБС) як перший етап лікування.
Порівняння груп гібридних лапароскопічних та відкритих ПДР, кількість пацієнтів і частка (%) у межах кожної групи наведені в табл. 1.
| Метод декомпресії | Гібридна ЛПДР (n=33) | Відкрита ПДР (n=106) |
| ЧЧХС | 5 (15,2%) | 29 (27,4%) |
| ЕБС жовчних проток (через ЕРХПГ) | 9 (27,3%) | 35 (33,0%) |
| Обхідний біліодигестивний анастомоз | 0 (0,0%) | 14 (13,2%) |
| Без декомпресії | 19 (57,6%) | 28 (26,4%) |
Примітка: n — кількість пацієнтів у групі. В основній (гібридній) групі n=33, у контрольній (відкритій) — n=106. ЕРХПГ — ендоскопічна ретроградна холангіопанкреатографія.
Хірургічна тактика: всім пацієнтам виконано ПДР з лімфодисекцією регіонарних лімфатичних вузлів. В основній групі операції резекційний етап виконувався лапароскопічно. Після індукції загальної анестезії проводили діагностичну лапароскопію з ревізією черевної порожнини для виключення перитонеальних метастазів. Розташування троакарів адаптували залежно від статури пацієнта та локалізації пухлини (рис. 1).
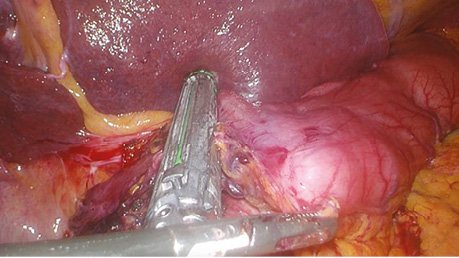
Лапароскопічний етап передбачав мобілізацію панкреатодуоденального комплексу наступними кроками: розкриття сальникової сумки, мобілізація печінкового кута ободової кишки, маневр Кохера з метою візуалізації нижньої порожнистої вени, мобілізації дванадцятипалої кишки. Шлунок або проксимальний відділ дванадцятипалої кишки пересікався лапароскопічною касетою (рис. 2).
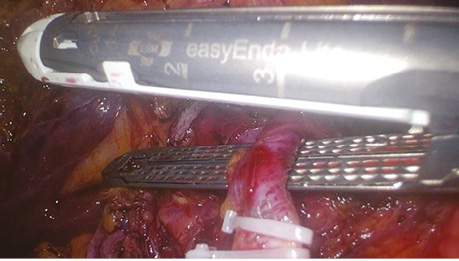
Далі виконували поетапну лімфодисекцію вздовж загальної печінкової артерії, гепатодуоденальної звʼязки (рис. 3).
Загальну жовчну протоку виділяли і пересікали проксимальніше відходження міхурової протоки; за наявності стента або дренажу — видаляли із загального жовчного протоку під час пересічення гепатикохоледоха. Після цього здійснювалася тунелізація під перешийком підшлункової залози для виділення верхньої брижової вени (ВБВ) та ворітної вени з подальшим пересіченням паренхіми перешийка підшлункової залози. Тонку кишку мобілізували та пересікали на 30 см дистальніше зв’язки Трейца. На завершення лапароскопічного етапу мобілізували гачкоподібний відросток підшлункової залози від верхньої брижової артерії (ВБА), уникаючи травми мезентеріальних судин. Після повного відділення панкреатодуоденального препарату та гемостазу видалений блок евакуйовували в контейнері через верхньо-середньо-серединну лапаротомію.
Реконструктивний етап у гібридній групі проводили через невеликий лапаротомний доступ. Доступ збільшували до ~5–8 см, після чого формували 3 анастомози: панкреатоєюноанастомоз, гепатикоєюноанастомоз (кінець у бік на 10 см дистальніше панкреатоєюноанастомозу) та гастроентероанастомоз бік у бік (або дуоденоєюноанастомоз кінець у бік при пілорусзберігальній методиці) позадуободово. Дренування черевної порожнини проводилося двома дренажами: № 1 — до панкреатоєюноанастомозу; № 2 — до гепатикоєюноанастомозу. У контрольній групі (відкрита ПДР) усі етапи — як резекційний, так і реконструктивний — виконувалися традиційно через верхньо-середньо-серединну лапаротомію.
Оцінка показників: для аналізу взяті основні інтраопераційні параметри (тривалість операції, об’єм інтраопераційної крововтрати, потреба в гемотрансфузіях), патогістологічні характеристики пухлин (нозологія, ступінь диференціювання, стан країв резекції), післяопераційні ускладнення та результати. Ускладнення класифіковано за Clavien – Dindo: до серйозних належать ускладнення III ступеня (потребували повторного втручання під наркозом) або IV ступеня (життєво небезпечні, потребували лікування у відділенні анестезіології та інтенсивної терапії); до помірних — ускладнення II ступеня (такі, що потребували медикаментозної терапії, переливання крові чи інвазивних маніпуляцій без наркозу). Післяопераційну панкреатичну фістулу (ПОПФ) оцінювали за сучасними критеріями Міжнародної групи з вивчення хірургії підшлункової залози (International Study Group for Pancreatic Surgery — ISGPS), 2016 р.: біохімічна фістула визначалася як підвищення амілази вмісту дренажу (>3 верхніх нормальних меж) без клінічного значення, тоді як клінічно значущі фістули класифікували як Grade B (що потребували зміни ведення, наприклад, антибіотикотерапії, додаткового дренування, підвищений вміст амілази в дренажах понад 14 діб у ≥3 рази від нормальних показників) або Grade C (нориці, які потребують повторного хірургічного втручання) [20, 21]. Смертність оцінювали на 30 та 90-й день після операції. Вторинні показники включали тривалість перебування в стаціонарі після операції (Length of Stay — LOS), частоту релапаротомій, необхідність ендоскопічних або пункційних інтервенцій для лікування ускладнень. Статистичну обробку здійснювали засобами описової статистики: для кількісних даних обчислені середні показники, стандартні відхилення та медіани (інтерквартильні межі), для якісних — частоти (%) з довірчими інтервалами. Порівняння груп проводили з використанням t-тесту або U-тесту Манна — Уїтні для безперервних показників та χ2-критерію Пірсона для частот з порогом значущості p <0,05.
РЕЗУЛЬТАТИ
Клінічна характеристика пацієнтів. Загальна кількість прооперованих хворих становила 139, з них 70 (50,4%) чоловіків і 69 (49,6%) жінок; середній вік пацієнтів — 59,5±12,4 року (діапазон від 38 до 79 років). У лапароскопічній групі з 33 пацієнтів чоловіків було 17 (51,5%), жінок — 16 (48,5%); середній вік становив 60,7±11,8 року. У відкритій групі (106 пацієнтів) чоловіків — 53 (50%), жінок — 53 (50%); середній вік — 58,3±12,9 року. Статевий та віковий розподіл між групами був подібним (р >0,3). У більшості випадків ПДР виконували через рак голівки підшлункової залози. Розподіл патології у лапароскопічній та відкритій групах відображає певний відбір: зокрема, у лапароскопічній групі було відносно більше хворих з нейроендокринними та гастроінтестинальними стромальними пухлинами (доброякісними або низькомалігнітними новоутвореннями), тоді як усі випадки недиференційованої карциноми та ацинарно-клітинної карциноми (агресивні рідкісні форми) припали на відкриті операції. Статистично значущої різниці в нозологічному спектрі між групами, утім, не відзначено (p=0,12) (табл. 2).
| Патологія (локалізація) | Гібридна ЛПДР (n=33) | Відкрита ПДР (n=106) |
| Протокова аденокарцинома підшлункової залози G1–G3 (голівка підшлункової залози) | 20 (61%) | 80 (75%) |
| Нейроендокринна пухлина (голівка підшлункової залози) | 5 (15%) | 13 (12%) |
| Інвазивна карцинома, асоційована з внутрішньопротоковим папілярним муцинозним новоутворенням) (голівка підшлункової залози) | 2 (6%) | 1 (1%) |
| Гастроінтестинальна стромальна пухлина дванадцятипалої кишки | 3 (9%) | 0 (0%) |
| Холангіокарцинома дистального відділу холедоха | 1 (3%) | 4 (4%) |
| Аденокарцинома великого дуоденального сосочка (ампула Фатера) | 1 (3%) | 5 (5%) |
| Аденокарцинома дванадцятипалої кишки | 1 (3%) | 3 (3%) |
| Усього пацієнтів | 33 (100%) | 106 (100%) |
Інтраопераційні показники. Гібридна ЛПДР потребувала в середньому дещо більшого операційного часу, ніж відкрита. Медіанна тривалість операції в лапароскопічній групі становила 6 год 40 хв (6,67 год; діапазон 4–8 год), тоді як у відкритій групі — 6 год 0 хв (6,0 год; діапазон 3–9 год). Різниця в середній тривалості (≈40 хв) була статистично нерелевантною (р=0,08). Внутрішньоопераційна крововтрата при лапароскопічних резекціях варіювала в діапазоні 50–750 мл, у середньому становивши 310±350 мл; у відкритих резекціях втрати крові були більшими (100–900 мл, середній показник 400±400 мл), хоча медіани відрізнялися несуттєво (310 vs 400 мл, p=0,15). У лапароскопічній групі 2 із 33 пацієнтів (6%) потребували переливання еритроцитарної маси чи компонентів крові під час або відразу після операції; у відкритій групі трансфузії були виконані у 2 із 106 випадків (1,9%). Частота інтраопераційних гемотрансфузій не мала достовірної різниці (p=0,21), хоча мала тенденцію до більшої потреби при лапароскопічному підході.
Ключові результати порівняння: тривалість операції, інтраопераційна крововтрата, потреба в гемотрансфузії, загальна частота післяопераційних ускладнень, 30-денна летальність та тривалість LOS наведені в табл. 3.
| Показник | Гібридна ЛПДР (n=33) | Відкрита ПДР (n=106) |
|---|---|---|
| Тривалість операції, годин (медіана, міжквартильний розмах (Interquartile range — IQR) | 6,7 (5,0–8,0) | 6,0 (4,0–9,0) |
| Об’єм крововтрати, мл (медіана, IQR) | 310 (100–450) | 400 (250–800) |
| Гемотрансфузія (кількість пацієнтів, %) | 2 (6,1%) | 2 (1,9%) |
| Загальна частота ускладнень (пацієнтів, %) | 15 (45%) | 42 (39%) |
| 30-денна післяопераційна летальність, n (%) | 1 (3,0%) | 6 (5,7%) |
| LOS, днів (медіана, IQR) | 12 (8–22) | 16 (8–44) |
Діаметр головної панкреатичної протоки за даними патогістології в лапароскопічній групі становив 3 мм (розмах 1–6 мм), що трохи менше, ніж у відкритій групі — 4 мм (1–10 мм). Щільність паренхіми підшлункової залози (непрямий фактор ризику фістули) у більшості пацієнтів обох груп була м’якою; хронічний панкреатит виявляли рідко (лише у 12% випадків відкритої та 9% лапароскопічної груп). Резекція та реконструкція судин: у відкритій групі виконано 5 випадків одночасної резекції портальної вени з венозною пластикою, 1 випадок резекції сегмента ВБВ; у лапароскопічній групі судинні резекції не проводили.
Окремим питанням є доцільність лапароскопічного доступу з онкологічної точки зору. У наших групах онкологічні результати (радикальність резекції, кількість видалених лімфовузлів) були еквівалентними: 96% пацієнтів мали R0-резекції в обох групах, середнє число досліджених лімфовузлів — 18 vs 17 відповідно (p>0,5). Ці дані підтверджують онкологічну адекватність малоінвазивного підходу. Раніше опубліковані дослідження також не виявили різниці в онкологічних показниках між ЛПДР і відкритою ПДР [7]. Зокрема, співвідношення R0-резекцій ~96% відповідає світовим стандартам і не залежало від типу доступу. Також довгострокова загальна виживаність при ЛПДР та відкритій ПДР не має статистичних відмінностей за умови зіставності груп. Отже, з урахуванням онкологічної доцільності, гібридна ЛПДР не поступається відкритій хірургії, що підтверджує можливість її імплементації в лікуванні злоякісних пухлин.
Післяопераційні ускладнення. Загальна частота післяопераційних ускладнень (будь-яких ступенів) становила 45% у лапароскопічній групі (15 із 33 пацієнтів) та 39% у відкритій групі (42 зі 106) — різниця статистично несуттєва (χ2, p=0,53). З них серйозні ускладнення (Clavien – Dindo III–IV) виникли у 8 пацієнтів (24%) після гібридної ПДР та у 23 пацієнтів (21,7%) після відкритої ПДР (p=0,78). Помірні ускладнення (Clavien II) відзначено у 7 (21%) та 19 (17,9%) хворих відповідно (p=0,64). Отже, структура післяопераційних ускладнень була подібною в обох групах (див. табл. 3). Найчастішими ускладненнями зафіксовані затримка випорожнення шлунка (післяопераційний гастростаз) [22] І–II ступенів — у 12% пацієнтів; внутрішньочеревні абсцеси, що потребували пункційного дренування (IIIa ступінь), — у 8% пацієнтів; кровотечі з анастомозів або ерозій (IIIb–IV ступені) [23] — ~5% пацієнтів; інфекції післяопераційної рани — 7%. ПОПФ виявлялася за рівнем амілази вмісту дренажу на 1-шу та 3-тю добу. Безсимптомна біохімічна панкреатична фістула (Grade A) виникла у 5 пацієнтів лапароскопічної групи (15%) та у 16 хворих відкритої групи (~15%); жоден з цих випадків не потребував інвазивного лікування, і дренажі були видалені після зниження рівня амілази. Клінічно значущі фістули (Grade B / C) розвинулися з приблизно рівною частотою — орієнтовно у 12% пацієнтів в обох групах (p >0,9). Частота повторних лапаротомій через ускладнення становила 3,0% (1/33) після гібридної ПДР та 5,7% (6/106) після відкритої ПДР (переважно з причин внутрішньочеревних кровотеч та перитоніту).
Протягом 1-го післяопераційного місяця помер 1 (3%) пацієнт з лапароскопічної групи та 6 (5,7%) осіб з відкритої групи (летальність — 30 днів, p=0,67). Єдиний смертельний випадок після гібридної резекції був зумовлений поліорганною недостатністю у звʼязку з панкреонекрозом кукси підшлункової залози у хворого з м’якою залозою і вузькою протокою. Летальність 6 осіб після відкритої операції сталася внаслідок гнійно-септичних та геморагічних ускладнень (3 арозивні кровотечі, 2 випадки панкреонекрозу кукси підшлункової залози, 1 інсульт). 90-денна післяопераційна смертність становила 3 і 7,5% відповідно (ще 2 пацієнти відкритої групи померли протягом 3 міс після операції від прогресування захворювання).
Тривалість стаціонарного лікування. Медіана LOS у групі лапароскопічних резекцій становила 12 діб (IQR 7–16; мінімум 6, максимум 30 діб). У групі відкритих резекцій медіана LOS становила 16 діб (IQR 10–25; розмах 7–82 доби). Різниця у строках госпіталізації є статистично значущою (p=0,04). У пацієнтів без післяопераційних ускладнень середня тривалість перебування становила 8 діб (гібридна ЛПДР) проти 14 діб (відкрита ПДР). Наявність ускладнень очікувано подовжувала госпіталізацію: у разі розвитку ускладнень середня LOS зростала до 20 днів у лапароскопічній групі та до 30 днів — у відкритій групі. На тривалість стаціонарного лікування впливало також застосування передопераційної декомпресії жовчних шляхів: хворі після ендобіліарного стентування або холангіостоми мали довший післяопераційний ліжко-день (у середньому +3 доби), ніж пацієнти, яких оперували первинно [1]. Повторні госпіталізації впродовж 30 днів після виписки відзначені у 2 пацієнтів (3,8%) відкритої групи та не зафіксовані в лапароскопічній групі.
ОБГОВОРЕННЯ
У представленому дослідженні проаналізовано досвід впровадження гібридної ЛПДР у нашій клініці та порівняно з результатами 33 лапароскопічно-асистованих і 106 відкритих резекцій, виконаних трьома хірургами. Отримані дані свідчать, що мінімально інвазивний підхід до резекції пухлин періампулярної зони є можливим і безпечним за умов ретельного відбору пацієнтів та наявності відповідного досвіду. Операційні та післяопераційні результати лапароскопічної (гібридної) ПДР виявилися принаймні не гіршими, ніж при відкритій лапаротомії, а за окремими показниками — навіть кращими. Зокрема, у нашій лапароскопічній групі простежувалася тенденція до меншої інтраопераційної крововтрати (медіана 310 vs 400 мл) і достовірно коротшої тривалості LOS (12 vs 16 діб) порівняно з відкритою групою. Це збігається з даними світової наукової літератури: так, дослідники з Піттсбурга (Tian F. та співавт., 2020) виявили, що лапароскопічно-асистовані ПДР дозволяють зменшити об’єм крововтрати (медіана ~300 проти 500 мл) та не подовжують тривалість госпіталізації за умови відсутності серйозних ускладнень [7]. В іншому порівняльному аналізі (Mendoza A.S. та співавт., 2015) середня тривалість перебування після ЛПДР становила 12,6 доби, тоді як після відкритої — 18,6 доби (р=0,001). Коротше перебування у стаціонарі зумовлено швидшою реабілітацією хворих після малоінвазивної операції — зменшенням вираженості післяопераційного болю, ранньою активізацією та відновленням ентерального харчування [6].
Частота та структура післяопераційних ускладнень у нашому дослідженні були подібними в обох групах, різниця не досягла статистичної значущості. Загальний рівень ускладнень (39–45%) відповідає даним наукової літератури для ПДР — у діапазоні 30–50% у провідних центрах [9]. Зокрема, частота клінічно значущих панкреатичних нориць становить ~12% у кожній групі, що збігається із середнім рівнем виникнення ПОПФ двох ступенів (Grade B / C) ~20% за даними багатоцентрових серій [8]. У метааналізі H. Zhang та співавт. (2019) порівнювали ~1200 лапароскопічних і 8200 відкритих ПДР: частота післяопераційних фістул та тяжких ускладнень не відрізнялася між групами (відношення шансів (Odds ratio — OR) для фістули = 0,85; p=0,40), тоді як загальні післяопераційні ускладнення були достовірно нижчими в лапароскопічній групі (OR=0,57; p<0,01) [1]. У нашій лапароскопічній групі загальна частота ускладнень (45%) була дещо вищою, ніж при відкритій операції (39%), що можна пояснити впливом кривої навчання. Важливо відзначити, що гібридний підхід не призвів до збільшення кількості тяжких ускладнень та летальності. У нашій лапароскопічній когорті 30-денна смертність становила 3 проти 5,7% після відкритої ПДР. Наші результати збігаються з досвідом інших центрів, які повідомляли про нульову або низьку смертність при лапароскопічних резекціях у відібраних хворих. Це свідчить, що за належного відбору кандидатів та набуття досвіду лапароскопічно-асистована ПДР може виконуватися без підвищення ризику для життя пацієнта.
Наш досвід свідчить, що одним з вирішальних факторів успіху лапароскопічно-асистованої ПДР є відбір пацієнтів. Критерії, за якими ми обирали лапароскопічний шлях, включали відсутність значущого васкулярного інвазивного компонента пухлини, розмір пухлини до ~3 см, відсутність масивного злукового процесу (після попередніх операцій) та відносно широка головна панкреатична протока. Останній фактор особливо важливий для надійного накладення панкреатоєюноанастомозу: відомо, що дрібна протока і м’яка паренхіма ПЗ підвищують ризик розвитку панкреатичної нориці. Ми намагалися виконувати гібридні резекції у пацієнтів з діаметром протоки ≥3 мм, що мало полегшити формування анастомозу з мінілапаротомного доступу. У нашій лапароскопічній групі середній діаметр протоки становив 3 мм, тоді як у відкритій — 4 мм; хоча різниця статистично незначуща, відносно менший проток вказує, що далеко не всі випадки лапароскопічних резекцій були «легкими». Проте жорсткого критерію за розміром протоки ми не дотримувалися, і 5 із 33 лапароскопічних резекцій виконано у пацієнтів з вузькою протокою (<3 мм); з них у 3 випадках виникла біохімічна фістула, а один закінчився панкреонекрозом кукси. Це підтверджує, що фактори ризику розвитку фістули — м’яка залоза і маленька протока — залишаються актуальними і при гібридній ПДР [24], тому важливо враховувати їх при плануванні операції та профілактиці ускладнень. Загалом ретельний відбір випадків для лапароскопічного підходу значною мірою визначає кращі результати малоінвазивних втручань, про що слід пам’ятати при порівнянні з неселективними відкритими групами.
Однією з переваг гібридної лапароскопічної ПДР, що відзначається в науковій літературі, є можливість поетапного навчання хірургів. Спершу хірурги набувають досвіду лапароскопічної мобілізації панкреатодуоденального комплексу, поступово скорочуючи час резекційного етапу і підвищуючи його безпеку [5, 15]. Після опанування резекції в режимі «лапароскопія + мінілапаротомія» можна переходити до спроб повної лапароскопічної реконструкції. Такий етапний підхід довів свою ефективність у низці центрів — зокрема, за повідомленнями з Китаю (Tian F. et al., 2020), використання лапароскопічно-асистованої техніки як проміжного етапу дозволило поступово впровадити згодом і тотальну лапароскопічну панкреатодуоденектомію.Так, гібридна методика слугує важливою ланкою в процесі переходу від відкритої операції до мінімально інвазивної техніки [6]. Вона дозволяє хірургу відпрацювати основні етапи та маневри лапароскопічної дисекції, при цьому не подовжуючи надмірно тривалість загальної операції. За нашими спостереженнями, після ~20 перших лапароскопічних резекцій тривалість їх виконання зрівнялася з відкритими (≈6 год), а об’єм інтраопераційної крововтрати стабільно не перевищує 300 мл (що нижче, ніж при середньому відкритому рівні, на ~400–500 мл) [9]. У науковій літературі відзначено, що лапароскопічний підхід часто асоціюється зі зменшенням крововтрати завдяки прецизійній візуалізації та використанню сучасної енергії. Наші дані це підтверджують: попри відсутність статистично значущої різниці, 6 проти 2% частоти гемотрансфузій на користь відкритої групи фактично означають, що потреба в переливаннях крові при лапароскопічних резекціях не більша, а тенденційно менша [14]. Відповідно, можна очікувати, що з накопиченням досвіду переваги малоінвазивної техніки щодо об’єму крововтрати проявлятимуться чіткіше, як це представлено іншими авторами [1].
Важливо підкреслити, що успіх програми лапароскопічної панкреатодуоденектомії залежить від мультидисциплінарного підходу та організації в закладі [25]. Необхідна злагоджена робота команди хірургів, анестезіологів, операційних сестер; на випадок ускладнень — готовність ендоскопістів, лікарів з ультразвукової діагностики виконати мінімально інвазивні повторні втручання (наприклад дренування абсцесів). Наші результати досягнуті в умовах, що відповідають визначенню високого обсягу: понад 20 ПДР на рік, наявність команди з достатнім досвідом відкритих панкреатичних резекцій. У таких умовах гібридна (а в перспективі й повністю лапароскопічна) панкреатодуоденектомія може бути впроваджена без компромісів у безпеці та якості лікування [5]. Натомість у центрах з низьким хірургічним обсягом (<10–15 операцій Уїппла на рік) або без належної лапароскопічної підготовки варто утриматися від рутинного використання ЛПДР через потенційні ризики для пацієнтів. Поточні міжнародні тенденції вказують на необхідність централізації панкреатохірургічної допомоги та концентрації навчання мінімально інвазивної ПДР у великих референтних установах, що дозволить підвищити безпеку нової методики.
Обмеженням нашого дослідження є відбір пацієнтів. Так, залучення в лапароскопічну групу означає, що пацієнти мали сприятливіший прогноз у звʼязку з відсутністю судинних резекцій, що могло позитивно вплинути на її результати. Це частково нівелюється великим обсягом вибірки відкритої групи, до якої входили всі резекції і де показники є усередненими для реальної популяції хворих. Відсутність рандомізації компенсується зіставністю груп за основними демографічними ознаками та однорідністю хірургічної техніки (усі операції виконувалися в одному центрі, згідно з протоколом). Іншим обмеженням є відносно невеликий розмір лапароскопічної вибірки (n=33), що відображає ранню криву навчання; подальше накопичення випадків дозволить дати більш статистично обґрунтовану оцінку відмінностей між підходами. Попри це, наші результати загалом корелюють із опублікованими метааналізами та проспективними серіями щодо гібридної та лапароскопічної ПДР. Це підтверджує репрезентативність отриманих даних і дозволяє робити практичні висновки.
ВИСНОВКИ
- Гібридна лапароскопічна ПДР є безпечним і ефективним методом хірургічного лікування резектабельних періампулярних пухлин у відібраних пацієнтів. У досвідченому високоспеціалізованому центрі її короткострокові результати (частота післяопераційних ускладнень, панкреатичних нориць, летальність) не поступаються таким при традиційній відкритій операції.
- Лапароскопічний підхід дозволяє зменшити операційну травму, що проявляється меншою крововтратою та достовірно швидшою післяопераційною реабілітацією хворих. Пацієнти після лапароскопічно-асистованої ПДР проводять у стаціонарі менше часу і швидше повертаються до активного життя, ніж після лапаротомії (медіана перебування 12 проти 16 діб, p <0,05).
- Онкологічна радикальність та обсяг хірургічного втручання при гібридному підході не гірші за відкриту ПДР. У досліджених групах досягнуті рівнозначні показники R0-резекцій (~96%) і кількості видалених лімфовузлів; жодних компромісів щодо онкологічних принципів при лапароскопічній резекції не допущено. Довгострокові результати (віддалена виживаність, рецидивування) потребують подальшого спостереження, але за наявними даними не очікується їх погіршення у зв’язку з типом доступу.
- Панкреатичні нориці залишаються провідним специфічним ускладненням після ПДР незалежно від методики. У лапароскопічній групі частота фістул не вища, ніж у відкритій (≈15% біохімічних, 10–12% клінічно значущих). М’яка консистенція підшлункової залози і малий діаметр панкреатичної протоки є факторами ризику нориці також при гібридній ПДР, що слід враховувати при залученні пацієнтів та виборі техніки панкреатоєюноанастомозу.
- Впровадження лапароскопічної ПДР доцільно здійснювати поступово, починаючи з гібридної (лапароскопічно-асистованої) техніки. Гібридна ПДР слугує проміжним етапом, який дозволяє хірургічній команді отримати потрібний досвід лапароскопічної дисекції, не наражаючи пацієнта на надмірні ризики. Після опанування ~20–30 гібридних резекцій можливий перехід до виконання повністю лапароскопічних ПДР. Для успішного освоєння методики необхідні умови високого обсягу (не менше 15–20 ПДР на рік у центрі) та мультидисциплінарна підтримка. Враховуючи відсутність явних переваг у короткострокових результатах за даними рандомізованих досліджень, впровадження ЛПДР має відбуватися в рамках контрольованих програм навчання і, бажано, у контексті клінічних досліджень або регістрів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Chen, K., Liu, X.-l., Pan, Y., Maher, H., & Wang, X.-F. (2018). Expanding laparoscopic pancreaticoduodenectomy to pancreatic-head and periampullary malignancy: major findings based on systematic review and meta-analysis. BMC Gastroenterology, 18, 102. doi.org/10.1186/s12876-018-0830-y.
2. Nassour, I., Paniccia, A., Moser, A. J., & Zureikat, A. H. (2021). Minimally Invasive Techniques for Pancreatic Resection. Surgical Oncology, 30(4), 747–758. doi: 10.1016/j.soc.2021.06.007.
3. Yan, Y., Hua, Y., Chang, C., Zhu, X., Sha, Y., & Wang, B. (2023). Laparoscopic versus open pancreaticoduodenectomy for pancreatic and periampullary tumor: A meta-analysis of randomized controlled trials and non-randomized comparative studies. Frontiers in oncology, 12, 1093395. doi: 10.3389/fonc.2022.1093395.
4. Zhang, H., Lan, X., Peng, B., & Li, B. (2019). Is total laparoscopic pancreaticoduodenectomy superior to open procedure? A meta-analysis. World Journal of Gastroenterology, 25(37), 5711–5731. doi: 10.3748/wjg.v25.i37.5711.
5. Vladimirov, M., Bausch, D., Stein, H. J., Keck, T., & Wellner, U. (2022). Hybrid laparoscopic versus open pancreatoduodenectomy: a meta-analysis. World Journal of Surgery, 46(4), 901–915. doi.org/10.1007/s00268-021-06372-1.
6. Mendoza, A. S., Han, H. S., Yoon, Y. S., Cho, J. Y., & Choi, Y. (2015). Laparoscopy-assisted pancreaticoduodenectomy as minimally invasive surgery for periampullary tumors: a comparison of short-term clinical outcomes with open pancreaticoduodenectomy. Journal of Hepatobiliary-Pancreatic Sciences, 22(12), 819–824. doi.org/10.1002/jhbp.289.
7. Shin, S. H., Kim, Y.-J., Song, K. B., Kim, S.-R., Hwang, D. W., Lee, J. H., … Kim, S. C. (2016). Totally laparoscopic or robot-assisted pancreaticoduodenectomy versus open surgery for periampullary neoplasms: separate systematic reviews and meta-analyses. Surgical endoscopy, 31(9), 3459–3474. doi: 10.1007/s00464-016-5395-7.
8. Butturini, G., Marcucci, S., Molinari, E., Mascetta, G., Landoni, L., Crippa, S., & Bassi, C. (2006). Complications after pancreaticoduodenectomy: the problem of current definitions. Journal of Hepato-Biliary-Pancreatic Surgery, 13(3), 207–211. doi: 10.1007/s00534-005-1035-7.
9. Tian, F., Wang, Y. Z., Hua, S. R., Liu, Q. F., & Guo, J. C. (2020). Laparoscopic assisted pancreaticoduodenectomy: an important link in the process of transition from open to total laparoscopic pancreaticoduodenectomy. BMC Surgery, 20(1), 89. doi: 10.1186/s12893-020-00752-5.
10. van Hilst, J., de Rooij, T., Bosscha, K., Brinkman, D. J., van Dieren, S., Dijkgraaf, M. G., … Besselink, M. G. (2019). Laparoscopic vs open pancreatoduodenectomy for pancreatic or periampullary tumours (LEOPARD-2): a multicentre, patient-blinded, randomised controlled trial. Lancet Gastroenterology and Hepatology, 4(3), 199–207. doi: 10.1016/S2468-1253(19)30004-4.
11. van Hilst, J., de Rooij, T., Abu Hilal, M., Asbun, H. J., Barkun, J., Boggi, U., … Besselink, M. G. (2017). Worldwide survey on opinions and use of minimally invasive pancreatic resection. HPB (Oxford), 19(3), 190–204. doi: 10.1016/j.hpb.2017.01.011.
12. Croome, K. P., Farnell, M. B., Que, F. G., Reid-Lombardo, K. M., Truty, M. J., Nagorney, D. M., & Kendrick, M. L. (2014). Total Laparoscopic Pancreaticoduodenectomy for Pancreatic Ductal Adenocarcinoma. Oncologic Advantages Over Open Approaches? Annals of Surgery, 260(4), 633–640. doi: 10.1097/SLA.0000000000000937.
13. Yin, Z., Jian, Z., Hou, B., & Jin, H. (2019). Surgical and oncological outcomes of laparoscopic versus open pancreaticoduodenectomy in patients with pancreatic duct adenocarcinoma. Pancreas, 48(7), 861–867. doi: 10.1097/MPA.0000000000001363.
14. Wang, M., Li, D., Chen, R., Huang, X., Li, J., Liu, Y., … Qin, R. (2021). Laparoscopic versus open pancreatoduodenectomy for pancreatic or periampullary tumours: a multicentre, open-label, randomized controlled trial. The Lancet Gastroenterology & Hepatology, 6(6), 438–447. doi.org/10.1016/S2468-1253(21)00054-6.
15. Vissers, F. L., van Hilst, J., Burdío, F., Sabnis, S. C., Busch, O. R., Dijkgraaf, M. G., … Besselink, M. G. (2022). Laparoscopic versus open pancreatoduodenectomy: an individual participant data meta-analysis of randomized controlled trials. HPB, 24, 1592–1599. doi.org/10.1016/j.hpb.2022.02.005.
16. Valle, V., Pakataridis, P., Marchese, T., Ferrari, C., Chelmis, F., Sorotou, I. N., … Ielpo, B. (2025). Comparative analysis of open, laparoscopic, and robotic pancreaticoduodenectomy: A systematic review of randomized controlled trials. Medicina (Kaunas), 61(7), 1121. doi.org/10.3390/medicina61071121.
17. Tang, G., Zhang, L., Xia, L., Zhang, J., Chen, R., & Zhou, R. (2025). Comparison of short-term outcomes of robotic versus open pancreaticoduodenectomy: a meta-analysis of randomized trials and propensity-score-matched studies. International Journal of Surgery, 111, 1214–1230. doi.org/10.1097/JS9.0000000000001871.
18. Yan, Q., Xu, L. B., Ren, Z. F., & Liu, C. (2020). Robotic versus open pancreaticoduodenectomy: a meta-analysis of short-term outcomes. Surgical Endoscopy, 34(2), 501–509. doi.org/10.1007/s00464-019-07084-3.
19. Giovinazzo, F., Turri, G., Katz, M. H., Heaton, N., & Ahmed, I. (2016). Meta-analysis of benefits of portal–superior mesenteric vein resection in pancreatic resection for ductal adenocarcinoma. British Journal of Surgery, 103(3), 179–191. doi.org/10.1002/bjs.9969.
20. Bassi, C., Dervenis, C., Butturini, G., Fingerhut, A., Yeo, C., Izbicki, J., … Buchler, M. (2005). Postoperative pancreatic fistula: An International Study Group (ISGPF) definition. Surgery, 138(1), 8–13. doi.org/10.1016/j.surg.2005.05.001.
21. Bassi, C., Marchegiani, G., Dervenis, C., Sarr, M., Abu Hilal, M., Adham, M., … Buchler, M. (2017). The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula. Surgery, 161(3), 584–591. doi.org/10.1016/j.surg.2016.11.014.
22. Wente, M. N., Bassi, C., Dervenis, C., Fingerhut, A., Gouma, D. J., Izbicki, J. R., … Büchler, M. W. (2007). Delayed gastric emptying (DGE) after pancreatic surgery: A suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery, 142(5), 761–768. doi.org/10.1016/j.surg.2007.05.005.
23. Wente, M. N., Veit, J. A., Bassi, C., Dervenis, C., Fingerhut, A., Gouma, D. J., … Büchler, M. W. (2007). Postpancreatectomy hemorrhage (PPH): An International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery, 142(1), 20–25. doi.org/10.1016/j.surg.2007.02.001.
24. Callery, M. P., Pratt, W. B., Kent, T. S., Chaikof, E. L., & Vollmer, C. M. Jr. (2013). A prospectively validated clinical risk score accurately predicts pancreatic fistula after pancreatoduodenectomy. Journal of the American College of Surgeons, 216(1), 1–14. doi.org/10.1016/j.jamcollsurg.2012.09.002.
25. Zureikat, A. H., Beane, J. D., Zenati, M. S., Al Abbas, A. I., Boone, B. A., Moser, A. J., … Zeh, H. J. 3rd. (2021). 500 minimally invasive robotic pancreatoduodenectomies: One decade of optimizing performance. Annals of Surgery, 273(5), 966–972. doi.org/10.1097/SLA.0000000000003550.
Адреса для листування:
Пепенін Ілля Олексійович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: illia.pepenin@gmail.com
Correspondence:
Illia Pepenin
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: illia.pepenin@gmail.com














Leave a comment