Опыт применения дендритноклеточной аутовакцины в лечении больных немелкоклеточным раком легкого
Ганул А.В., Храновская Н.Н., Совенко В.М., Ганул В.Л., Гриневич Ю.А. , Орел В.Э., Скачкова О.В., Ситько В.В, Свергун Н.Н., Бороров Л.В., Борисюк Б.А., Кобзев О.И., Шевченко А.И., Семиволос А.В., Кондрацкий Ю.Н.
Резюме. В научно-исследовательском отделении опухолей органов грудной полости Национального института рака проводится изучение эффективности применения дендритноклеточной аутовакцины в послеоперационный период у больных немелкоклеточным раком легкого (НМРЛ). Получены результаты, демонстрирующие хорошую переносимость дендритноклеточной аутовакцины. Показано формирование выраженного антигенспецифического иммунного ответа после повторных введений дендритноклеточной аутовакцины, максимально проявляющегося после 4 ревакцинаций. Результаты выживаемости больных НМРЛ, получивших в послеоперационный период дендритноклеточную аутовакцину демонстрируют высокую эффективность данного метода и возможность его применения с минимумом побочных эффектов. Необходимы дальнейшее изучение показателей выживаемости у больных НМРЛ, получивших иммунотерапевтическое лечение, определение оптимального количества и частоты повторных введений.

Введение
В настоящее время нет стандартного метода, который мог бы быть рекомендован для лечения больных немелкоклеточным раком легкого (НМРЛ) в послеоперационный период. Долгие годы продолжаются дискуссии по поводу применения адъювантной полихимиотерапии у данной категории пациентов. И хотя многие исследования продемонстрировали обнадеживающие результаты применения послеоперационной химиотерапии у пациентов со II стадией заболевания, данный вид лечения не является стандартом, следовательно, поиски путей улучшения эффективности лечения активно продолжаются [1–4].
Большой интерес в связи с этим заслуженно вызывает возможность использования методов биотерапии в комплексном лечении больных раком легкого, в частности специфической активной иммунотерапии. В перечне иммунотерапевтических методов одно из ведущих мест занимают противоопухолевые аутовакцины. Данный метод направлен на активацию специфического противоопухолевого иммунитета с целью профилактики рецидивов и метастазов злокачественной опухоли после основного лечения [5].
Вместе с тем в многочисленных исследованиях было показано, что использование противоопухолевых вакцин первого поколения на основе цельных опухолевых клеток или отдельных пептидов опухолевых антигенов не всегда сопровождается достаточной эффективностью, поскольку иммунная система больного по ряду причин не выполняет свои функции [6–8]. Неэффективность иммунного ответа обусловлена низкой иммуногенностью опухолевых антигенов, потерей или изменением экспрессии антигенов MHC I класса на опухолевых клетках, нарушением регуляторной функции лимфоцитов и синтезом опухолевыми клетками иммуносупрессивных веществ. В связи с этим включение адъювантов в состав противоопухолевых вакцин для усиления иммунного ответа представляется обоснованным [9, 10].
Включение в состав противоопухолевых вакцин антигенпредставляющих дендритных клеток (ДК), используемых в качестве мощных естественных адъювантов, способствует усилению иммунного ответа на антигены опухоли. ДК играют определяющую роль в противоопухолевом иммунитете, поскольку они обладают способностью активировать все клетки, относящиеся к основным эффекторам противоопухолевого иммунитета, — цитотоксические Т-лимфоциты, Т-хелперы, натуральные киллерные клетки (НКК), индуцируют как первичный, так и вторичный иммунный ответ, развитие иммунологической памяти [11].
Общая схема иммунотерапии ДК-аутовакцинами состоит в генерации ДК in vitro из предшественников, их нагрузке соответствующими опухолевыми антигенами и реинъекции больному в режиме вакцинотерапии. Таким образом, иммунный ответ на опухолевые антигены начинается in vitro, где достаточно точно можно контролировать количество и функциональное состояние ДК, а заканчивается в организме образованием специфических цитотоксических Т-лимфоцитов.
Эффективность данного метода иммунотерапии в лечении злокачественных новообразований различных локализаций активно исследуется в мире в течение последних 15 лет [11–14]. Уже проведены около 100 различных клинических исследований, описывающих более 1000 случаев с использованием вакцинотерапии на основе ДК, в 15 различных странах. В настоящее время основной задачей является создание стандартизированных схем получения продукта и протоколов его применения для обеспечения максимальной клинической эффективности.
В Национальном институте рака (НИР) разработана оригинальная аутовакцина на основе ДК с использованием для их нагрузки модифицированных аутологичных опухолевых клеток с повышенными иммуногенными свойствами. Для модификации опухолевых клеток использована биоинженерная технология механохимической гетерогенизации (МХГ), предусматривающая обработку лиофилизированных опухолевых клеток с помощью микровибромельницы [15, 16]. В доклинических исследованиях с задействованием различных моделей опухолевого процесса была доказана целесообразность использования данного подхода для более эффективной стимуляции созревания ДК, усиления их функциональной активности и, как следствие, повышения иммунобиологической активности изготовленной таким способом ДК-аутовакцины [12, 16, 17].
Целью настоящего исследования было оценить эффективность применения аутовакцины на основе ДК, нагруженных МХГ опухолевыми клетками, в лечении больных НМРЛ.
Объект и методы исследования
В исследование включены 94 больных в возрасте 61,4±3,0 года с гистологически верифицированным диагнозом НМРЛ ІІБ–ІІІА стадии. Больным проведено оперативное лечение в объеме лобэктомии или пневмонэктомии. 41% пациентов не позднее чем за 28 дней до начала иммунотерапии в неоадъювантном режиме получали полихимиотерапию по схемам на основе препаратов платины. Путем рандомизации больные были распределены на 2 группы — основную и контрольную. Через 14 сут после оперативного вмешательства больным основной группы была проведена ДК-вакцинотерапия согласно схеме (рис. 1).
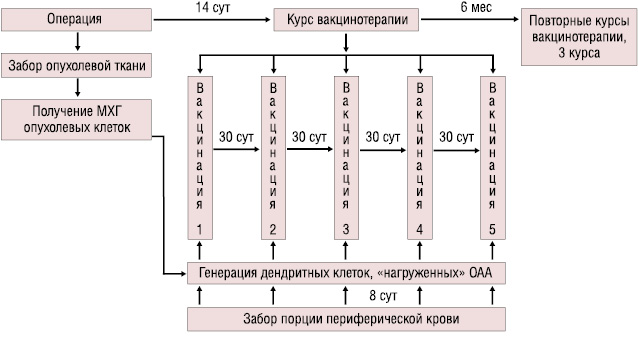
Курс вакцинотерапии составлял 5 инъекций с интервалом 30 сут. Больные получали 2–3 курса вакцинотерапии, от 10 до 15 внутривенных инъекций ДК-аутовакцины. Интервал между курсами составлял до 6 мес. В среднем за 1 инъекцию вводили 4,62±0,37×106 ДК, нагруженных МХГ опухолевыми клетками.
ДК получали из моноцитов периферической крови больных путем их инкубации в среде RPMI 1640 в течение 8 сут в присутствии гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) (или Г-КСФ), интерлейкина-4 (ИЛ-4), интерферона α (ИФН-α) при температуре 37 °C в атмосфере 5% СО2. В качестве источника опухолеассоциированных антигенов (ОАА) для нагрузки ДК использовали МХГ лиофилизированные опухолевые клетки, которые добавляли на 6-е сутки инкубации в концентрации 0,05 мг/мл. Для МХГ лиофилизированные опухолевые клетки обрабатывали в течение 5 мин в камере с мелющими шарами микровибромельницы MMVE-0,005 (Гефест, РФ) при интенсивности подвода механической энергии 20 Вт/ч [12].
Контроль качества ДК включал оценку их фенотипических характеристик. Уровень одновременной экспрессии CD86 и HLA-DR-антигенов на ДК составлял не менее 65%, CD83 — не менее 50%. Количество жизнеспособных клеток составляло не менее 95%, примесь лимфоцитов — не более 20% [12, 13].
До начала и в процессе иммунотерапии через 1 мес после каждого введения осуществляли мониторинг состояния клеточного иммунитета. Для оценки развития антигенспецифического клеточного иммунного ответа изучали способность Т-лимфоцитов периферической крови больных секретировать ИЛ-4 или ИФН-γ в присутствии МХГ опухолевых клеток.
Для определения секреторной активности Т-лимфоцитов использовали метод двухпараметровой проточной цитометрии, с помощью которого одновременно определяли цитокиновый профиль и субпопуляционный состав лимфоцитов. Лимфоциты инкубировали в течение 7 сут при 37 °C и 5% СО2 в присутствии 5 мкл МХГ опухолевых клеток в использованной для «нагрузки» ДК концентрации (опыт) или в присутствии только питательной среды (контроль, фоновая секреция). Далее клетки метили с помощью моноклональных антител к поверхностному антигену СD3 и внутриклеточным ИЛ-4 и ИФН-γ. Результат выражали в процентах.
С помощью метода проточной цитофлюориметрии определяли цитотоксическую активность (ЦА) лимфоцитов периферической крови по отношению к стандартным клеткам-мишеням К562. Определяли процент погибших клеток-мишеней при инкубации с лимфоцитами относительно количества спонтанно погибших клеток-мишеней.
Все проточно-цитометрические исследования выполнены на приборе FACSCalibur («Becton Dickinson», США) с использованием программы CellQuest-PRO для компьютеров Macintosh для получения и анализа данных.
Полученные результаты исследований обрабатывали статистически с помощью общепринятых методов вариационной статистики с использованием программ Exсel и STATISTICA 6.0. Выживаемость больных анализировали по методу Каплана — Мейера, достоверность отличий определяли по F-критерию Кокса. Статистически достоверной считали разницу между показателями при р<0,05.
Разрешение на применение данного вида аутовакцины получено в Центральной комиссии по вопросам этики Министерства здравоохранения Украины 05.11.2009 г. У всех больных было получено письменное информированное согласие на участие в исследовании.
Результаты и их обсуждение
Как показали результаты наблюдения, введение ДК-аутовакцины, как правило, не сопровождалось развитием каких-либо существенных побочных или токсических реакций. Не отмечено существенного ухудшения самочувствия больных и развития побочных явлений в виде аллергических реакций, регионарной лимфаденопатии или аутоиммунных расстройств, связанных с введением вакцины. Из нежелательных эффектов имело место лишь развитие гипертермической реакции с ознобом через 1–6 ч после инъекции у 10% больных, которую в случае крайней необходимости устраняли с помощью жаропонижающих средств.
Мы представляем данные клинической эффективности ДК-вакцинотерапии на основе анализа выживаемости больных НМРЛ в течение 5-летнего периода. На рис. 2 приведена кумулятивная опухолеспецифическая выживаемость больных.
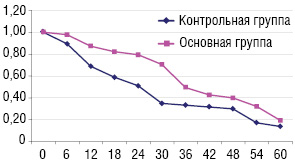
В течение 1 года были живы 78,5% больных в основной группе по сравнению с 66,2% в группе контроля (р=0,029). 3-летняя выживаемость больных, получавших ДК-аутовакцину, составила 49,1% против 33,1% пациентов в контрольной группе (р=0,0085). 5-летняя выживаемость больных основной группы составила 19,2% против 13,6% в контроле (р=0,0096). За период наблюдения прогрессирование заболевания отмечено у 28 больных (59,6%), получавших ДК-аутовакцину, и у 37 больных (78,7%), которым проводили только хирургическое лечение.
В клинике применяются различные методы иммуномониторинга для оценки эффективности противоопухолевых вакцин. Определение уровня развития антигенспецифического Т-клеточного иммунного ответа на ОАА считается базовым показателем в оценке и прогнозировании клинического ответа на проводимую активную специфическую иммунотерапию [18, 19]. Ряд методов его оценки основан на определении способности Т-лимфоцитов секретировать цитокины. Инкубация полученных от больного лимфоидных клеток с используемым для вакцинации ОАА приводит к усилению секреции цитокинов только сенсибилизированными клетками. Этот метод позволяет оценить формирование специфичности иммунного ответа на проведеную иммунотерапию и установить его тип.
Как показали результаты исследований, преобладание ИФН-γ-продуцирующей функции Т-лимфоцитов больных в ответ на ОАА зарегистрирована после 3–4-го введения ДК-аутовакцины (рис. 3).
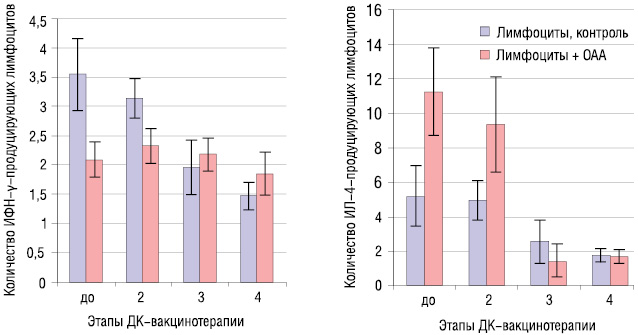
Именно в эти сроки наблюдается уменьшение секреции ИЛ-4, что свидетельствует о переключении иммунного ответа на ОАА с Тх-2-типа на Тх-1-тип и может расцениваться как показатель активации антигенспецифического клеточного иммунного ответа у больных, который является основой противоопухолевого иммунитета. Данные изменения в состоянии иммунной системы, свидетельствующие о развитии антигенспецифического иммунного ответа, установлены у 75% пациентов. Следует отметить, что у 11% больных формирование антигенспецифического иммунного ответа имело место на 2–3 курсе вакцинотерапии, то есть после 5–15 введений ДК-аутовакцины.
Особое значение в иммунном ответе на активную иммунотерапию имеют НКК, которые способны удалять опухолевые клетки разных типов, особенно клетки, имеющие сниженный уровень экспрессии молекул МНС I класса. После 3–4-го введения ДК активность НКК может усиливаться под действием цитокинов ИФН-γ, ИЛ-2, которые выделяют активированные сенсибилизированные лимфоциты, образующиеся в процессе проведения ДК-вакцинотерапии.
Результаты исследования ЦА лимфоцитов периферической крови больных в динамике проведения ДК-вакцинотерапии представлены на рис. 4.
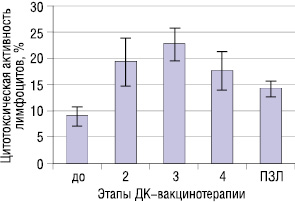
Как показали полученные результаты, ЦА лимфоцитов больных НМРЛ несколько снижена по сравнению с показателями практически здоровых людей (ПЗЛ). Первые 2 введения ДК, «нагруженных» ОАА, способствовали некоторому усилению функциональной активности НКК (p>0,05). Значительное повышение ЦА лимфоцитов у 75% больных было отмечено лишь после 3-го введения ДК.
Таким образом, результаты иммунологических исследований свидетельствуют о том, что формирование стойкого противоопухолевого специфического иммунного ответа на ОАА у большинства больных НМРЛ требует в среднем не менее 4 введений ДК-аутовакцины, что занимает около полугода. Исследуемые иммунологические параметры можно использовать в качестве критериев для индивидуализации схемы применения ДК-вакцинотерапии у больных НМРЛ.
Выводы
Результаты 1–5-летней выживаемости больных НМРЛ, получавших в послеоперационный период ДК-аутовакцину, демонстрируют перспективность применения данного метода для повышения эффективности основного лечения больных с минимумом побочных эффектов.
Показано формирование выраженного антигенспецифического иммунного ответа после повторных введений ДК-аутовакцины, максимально проявляющегося после 4 ревакцинаций, что является обоснованием для назначения не менее 5 введений ДК-аутовакцины на курс лечения.
ЛИТЕРАТУРА
1. Early stage and locally advanced (non-metastatic) non-small-cell lung cancer. (2010) ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up Annals of Oncology, 21, Issue suppl. 5: 103–115.
2. Karim-Kos H.E., de Vries E., Soerjomataram I. et al. (2008) Recent trends of cancer in Europe: a combined approach of incidence, survival and mortality for 17 cancer sites since the 1990s. Eur. J. Cancer, 44: 1345–1389.
3. Bray F.I., Weiderpass E. (2009) Lung cancer mortality trends in 36 European countries: secular trends and birth cohort patterns by sex and region 1970–2007. Int. J. Cancer, 126: 1454–1466.
4. Verdecchia A., Francisci S., Brenner H. et al. (2007)The EUROCARE-4 Working Group. Recent cancer survival in Europe: a 2000–02 period analysis of EUROCARE-4 data. Lancet Oncol., 8: 784–796.
5. Tрomas A., Hassan R. (2012) Immunotherapies for non-small-cell lung cancer and mesothelioma. Lancet Oncol., 13: e301–10.
6. Finn O.J. (2004) Противоопухолевые вакцины: между идеей и реальностью. Аллергология и иммунология, 5(2): 249–264.
7. Itoh K., Yamada A., Mine T., Noguchi M. (2009) Recent advances in cancer vaccines: an overview. Jpn. J. Clin. Oncol., 39(2): 73–80.
8. Rosenberg S.A., Yang J.C., Restifo N.P. (2004) Cancer immunotherapy: moving beyond current vaccines. Nature Medicine, 10(9): 909–915.
9. Copier J., Dalgleisha A.G., Brittenb C.M. et al. (2009) Improving the efficacy of cancer immunotherapy. European J. of Cancer, 45: 1424–1431.
10. Vergati M., Intrivici C., Huen N.-Y. et al. (2010) Strategies for Cancer Vaccine Development. Journal of Biomedicine and Biotechnology, 2010: 1–13.
11. Dendritic cells in cancer edited by Shurin M.R. and Salter R.D. (2009) Springer: 396 p.
12. Храновская Н.Н., Гриневич Ю.А. (2008) Антигенпредставляющие дендритные клетки миелоидного происхождения: фенотип, функции, противоопухолевая активность, использование в специфической иммунотерапии больных со злокачественными новообразованиями. Гріневич Ю.Я. (ред.). Специфічна імунотерапія в онкології. К.: Здоров’я, 81–144.
13. Гриневич Ю.А., Храновская Н.Н. (2007) Вакцины на основе антигенпрезентирующих дендритных клеток в иммунотерапии больных со злокачественными опухолями. Онкология, 9(4): 365–370.
14. Palucka K., Banchereau J. (2012) Cancer immunotherapy via dendritic cells. Nature Reviews/Cancer Volume, 12(4): 265–267.
15. Патент № 49483. Україна. МПК А61К 39/00, А61К 35/14. Храновская Н.Н., Совенко В.М., Скачкова О.В. и др. Спосіб імунотерапії хворих на рак легені/заявник та патентовласник Національний інститут раку. U200912738. 08.12.2009. 26.04.2010. Бюл. № 8, 2010 р.
16. Храновская Н.Н., Орел В.Э., Гриневич Ю.А., Бендюг Г.Д. и др. (2007) Влияние механохимически гетерогенезириванных опухолевых клеток на антиметастатический эффект дендритных клеток при иммунизации животных с карциномой Льюис. Журнал АМН Украины, 13(3): 553–556.
17. Патент № 24077. МПК А61К 39/00. Храновская Н.Н., Бендюг Г.Д., Гриневич Ю.А. и др. Способ противоопухолевой иммунотерапии опухолевыми клетками (2007) А200507740. 04.08.2005. 25.06.2007. 25.06.2007, Бюл. №9, 2007 р.
18. Tuyaerts S. (2011) Dendritic cell therapy for oncology roundtable conference. Journal of Immune Based Therapies and Vaccines, 9: 1.
19. Hoos A., Eggermont A.M.M., Janetzki S. et al. (2010) Improved Endpoints for Cancer Immunotherapy Trials. J Natl Cancer Inst., 102: 1388–1397.
Досвід застосування дендритноклітинної аутовакцини в лікуванні хворих на недрібноклітинний рак легені
Резюме. У науково-дослідному відділенні пухлин органів грудної порожнини Національного інституту раку проведено вивчення ефективності застосування дендритноклітинної аутовакцини у післяопераційний період у хворих на недрібноклітинний рак легені. Отримано результати, що демонструють хорошу переносимість дендритноклітинної аутовакцини. Показано формування вираженої антигенспецифічної імунної відповіді після повторних введень дендритноклітинної аутовакцини, яка максимально проявляється після 4 ревакцинацій. Результати виживаності хворих на недрібноклітинний рак легені, які отримали в післяопераційний період дендритноклітинну аутовакцину, демонструють високу ефективність даного методу та можливість його застосування з мінімумом побічних ефектів. Необхідні подальше вивчення показників виживаності хворих на недрібноклітинний рак легені, які отримали імунотерапевтичне лікування, визначення оптимальної кількості и частоти повторних введень.
Ключові слова: рак легені, вакцинотерапія, дендритні клітини.
Experience of using dendritic cell autovaccine in non-small-cell lung cancer patients
Summary. In thoracic department of the National Cancer Institute studied the effectiveness of dendritic cell autovaccine in the postoperative period in non-small-cell lung cancer patients. The results, showing good tolerance dendritic cell autovaccine. Shows the formation of the expressed antigen immune response after repeated injections dendritic cell autovaccine, as manifested after 4 revaccination. Results of survival patients non-small-cell lung cancer who received postoperative dendritic cell autovaccines demonstrate the high efficiency of the method and its applicability with a minimum of side effects. Further study of survival of patients non-small-cell lung cancer who received immunotherapy treatment, monitoring of compliance with the best mode of repeated injections.
Key words: lung cancer, vaccine therapy, dendritic cells.














Leave a comment