Молекулярно-генетична характеристика хворих на множинну мієлому в Україні
Костюкова Н.И. 1, Россоха З.И. 2, Пилипенко Г.В. 3, Ермолицкая И.П. 4, Киселева М.Я. 5, Аджигитова Л.В. 6, Харчевская Т.И. 7, Гаркуша М.Г.8, Выдыборец С.В. 1, Горовенко Н.Г. 1
- 1Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
- 2Референс-центр з молекулярної діагностики МОЗ України, Київ
- 3Черкаський обласний онкологічний диспансер, Черкаси
- 4Кіровоградська обласна лікарня
- 5Крымский республиканский институт «Онкологический клинический диспансер», Симферополь
- 6Областное коммунальное учреждение «Больница скорой медицинской помощи», Черновцы
- 7Запорожская областная клиническая больница
- 8Херсонская областная клиническая больница
Резюме. У роботі проведено порівняльний аналіз частоти поліморфних варіантів генів, задіяних у біотрансформації цитостатичних ліків у хворих на множинну мієлому (ММ). Нами визначено частоту делеційного поліморфізму генів GSTT1, GSTM1, частоту генотипів за поліморфними варіантами А313G, С3435Т генів GSTP1, MDR1 у 137 хворих на ММ, які не відрізнялися у пацієнтів з різних регіонів України. Виявлено генетичну схожість хворих на ММ європейських популяцій та України за дослідженими генами. Отримані результати вказують, що генотип СС за поліморфізмом С3435Т гена MDR1є предиктором розвитку ММ з несприятливим перебігом за рахунок формування в переважній більшості типу Бенс-Джонса. Перспектива подальших досліджень полягає у вивченні ролі генетичних факторів у механізмі формування фенотипу відповіді на лікування з оцінкою ризику розвитку рефрактерних форм ММ.

Вступ
На сьогодні з’явилися нові можливості в лікуванні хворих на множинну мієлому (ММ) завдяки застосуванню, окрім стандартних схем терапії, препаратів імунологічної спрямованості. Проте повідомлення про успіхи, отримані при застосуванні талідоміду, бортезомібу тощо, продемонстрували також, що ці лікарські засоби, як і ті, що входять до стандартних схем, не завжди забезпечують ефективну відповідь на лікування [2–4].
Дані літератури свідчать про залежність ефективності лікарських засобів від поліморфізму генів, що кодують ферменти, задіяні в метаболізмі фармакологічних препаратів. Швидкість перетворення ліків, або їх перетворення до активних сполук, залежить від наявності та активності ферментів у пацієнтів, що вказує на індивідуальні відмінності, генетично детерміновані [7, 8, 16, 17].
Поліморфізм генів біотрансформації ліків має також етнічні та популяційні особливості, що свідчить про необхідність урахування результатів попередніх генетичних досліджень із визначення розповсюдженості поліморфних варіантів генів та їх асоціацій з ризиком розвитку рефрактерних форм ММ [16]. В Україні такі дослідження досі не проводили.
Метою даної роботи стало дослідження розповсюдженості поліморфних варіантів генів, причетних до метаболізму ліків, у хворих на ММ із різних регіонів України.
Матеріали та методи дослідження
Для досягнення поставленої мети нами відібрано можливі гени-кандидати, поліморфізм яких впливає, за даними джерел літератури [5–17], на метаболізм цитостатичних препаратів, що застосовуються для лікування ММ. Обстежено 137 пацієнтів із різних регіонів України, у яких у 2007–2011 рр. вперше встановлено діагноз ММ. Застосовували стандартні схеми лікування хворих на ММ. Молекулярно-генетичним методом у пацієнтів проведено дослідження делеційного поліморфізму генів GSTT1, GSTM1, А313G поліморфізму гена GSTP1, C3435T поліморфізму гена MDR1. На проведення дослідження отримано дозвіл етичної комісії. Усі пацієнти після ознайомлення з інформаційним листом надали згоду на участь у проведенні дослідження.
Серед хворих на ММ було 60 (43,79%) осіб чоловічої статі та 77 (56,21%) жіночої. Середній вік пацієнтів становив 56 (27–80) років. У гематологічних відділеннях для встановлення діагнозу застосовано стандартні методи його верифікації на підставі клінічної картини, показників гемограми та біохімічних тестів, імунохімічного, морфологічного (мієлограми), гістологічного (трепанобіопсія) дослідження кісткового мозку та додаткових інструментальних методів.
У обстежених хворих клінічна картина характеризувалася розвитком анемічного синдрому, болями різної інтенсивності в кістках, у понад 30% пацієнтів розвивався геморагічний синдром. У 67,3% хворих відзначали блідість шкірних покривів, у 40,4% — інтоксикаційний синдром та у 36,5% пацієнтів клінічна маніфестація відбувалася на фоні зменшення маси тіла. Ознаки ураження нервової системи у вигляді периферичної больової поліневропатії зустрічалися рідше — у 13,5%, гепатомегалія — у 9,6% хворих.
У хворих, залучених до дослідження, застосовано молекулярно-генетичний метод з використанням полімеразної ланцюгової реакції та полімеразної ланцюгової реакції з визначенням поліморфізму довжини рестрикційних фрагментів для визначення розповсюдженості поліморфних варіантів генів GSTT1, GSTM1, GSTP1, MDR1.
Статистичний аналіз проводили з використанням критеріїв χ2 та Ірвіна — Фішера за допомогою програми Statistica 7.
Результати дослідження та їх обговорення
Переважна більшість хворих, залучених у дослідження, були з Північної (29,92%) та Центральної (34,30%) частини України. Частка пацієнтів з Південної України становила 21,16%, із Західної — 13,13%. 1,45% хворих були зі Сходу України.
Аналіз клінічних даних показав, що середній вік хворих та статевий розподіл не мали вірогідних відмінностей у різних регіонах України. Серед пацієнтів з Центральної та Західної України дещо зростав відсоток осіб жіночої статі, який становив відповідно 61,22 та 66,66%. Клінічна картина початку та перебігу захворювання не різнилася залежно від регіону проживання.
Загалом у 137 пацієнтів із ММ серед населення України нами виявлено делеційний поліморфізм гена GSTT1 у 20,43% хворих, а делеційний поліморфізм гена GSTM1 — у 50,36%. Представлено результати дослідження делеційного поліморфізму генів GSTT1, GSTM1 глутатіон-S-трансфераз (GSTs) у хворих на ММ з різних регіонів України (рис. 1, 2). Як видно (див. рис. 1), частота делеційного поліморфізму гена GSTT1 у пацієнтів з ММ з різних регіонів України вірогідно не різнилася, хоча була тенденція до підвищення частоти GSTT1 делеційного поліморфізму у хворих з Центральної України порівняно з іншими регіонами Півночі та Півдня України (див. рис. 1).
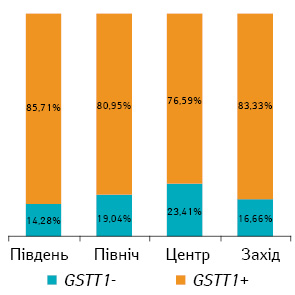
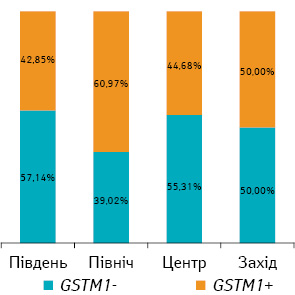
Серед обстежених 137 пацієнтів з ММ були 2 особи жіночої статі зі Східної України, у яких не виявлено делеційного поліморфізму GSTT1, тоді як делеційний поліморфізм GSTM1 зареєстровано в 1 хворої. Тому нам не вдалося оцінити частоту досліджуваних поліморфних варіантів генів у пацієнтів зі Східної України. Частота делеційного поліморфізму GSTM1 мала тенденцію до зниження у хворих з Північної України порівняно з пацієнтами з Центральної та Південної, але не вірогідну (див. рис. 2).
Отримана частота делеційного поліморфізму генів GSTT1, GSTM1 вірогідно не відрізнялася від їх розповсюдженості у хворих на ММ представників європеоїдної раси. За даними, наведеними в дослідженні C. Schlthuizen та співавторів [14], у пацієнтів з ММ з Нідерландів частота генотипу GSTT1− становила 27%, а генотипу GSTM1− — 50% [7]. У російсько-американському дослідженні [8] визначено, що частота генотипу GSTT1− становила 22%, а генотипу GSTM1− — 50% у пацієнтів з ММ.
Серед 137 пацієнтів з ММ з України нами виявлено генотип AA гена GSTP1 у 37,23%, AG — у 54,72%, GG — у 8,03%. У хворих на ММ з Південної України підтверджено тенденцію до підвищення частоти GG генотипу гена GSTP1 порівняно з іншими регіонами України (рис. 3). У 2 пацієнток зі Східної України виявлено генотипи AA та AG гена GSTP1.
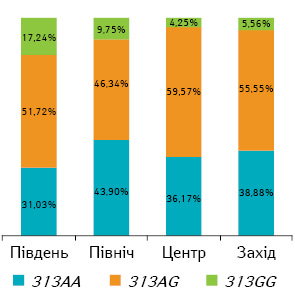
Dasgupta та співавтори встановили наступну частоту генотипів гена GSTP1 у 222 хворих на ММ британського походження: AA — 44%, AG — 39%, GG — 17% [7]. У 204 хворих з Нідерландів [14]частота генотипів гена GSTP1 вірогідно не відрізнялася і становила: AA — 37%, AG — 48%, GG — 15%. У 143 пацієнтів з ММ із Франції [9] відзначали невірогідне підвищення частоти генотипу AA— 51,74%, ймовірно, за рахунок зниження частоти генотипів AG і GG серед цих пацієнтів відповідно 37,06 і 11,18%. Таким чином, нами не виявлено вірогідних відмінностей у частоті генотипів за поліморфізмом А313G гена GSTP1 у хворих на ММ, що проживають в Україні, порівняно з аналогічними хворими з європейських популяцій.
У дослідженні R.K. Dasgubta та співавторів продемонстровано, що поліморфні варіанти гена GSTP1 модулюють результати лікування хворих на ММ та впливають на показники виживаності пацієнтів [7]. Можливий функціональний ефект досліджених поліморфних варіантів гена GSTP1 пов’язують з впливом поліморфних варіантів гена на ензиматичну активність ферменту-ізомеру та його детоксикаційну спроможність [9], яка бере участь у метаболізмі цитостатичних препаратів. При попередньому плануванні дослідження ми звернули увагу, що варто аналізувати поліморфні варіанти гена MDR1, оскільки в літературних джерелах наявні відомості про асоціації певних поліморфних варіантів цього гена з результатами лікування хворих на ММ. Теоретичні відомості вказують на те, що залежно від генотипу існують різні функціональні варіанти Р-глікопротеїну, задіяного в метаболізмі лікарських препаратів [6, 9, 11, 13].
У загальній групі 137 пацієнтів з України частота генотипу CC становила 25,54%, генотипу CT — 46,71%, TT — 27,73%. Одержана частота вірогідно не відрізнялася від аналогічної у 115 хворих на ММ з Італії [6], у яких виявлено наступну частоту генів: СС — 28,69%, СТ — 47,82%, ТТ — 23,47%, та у 147 пацієнтів із Франції [10], у яких частота цих генотипів становила: СС — 36,73%, СТ — 38,77%, ТТ — 24,48%. У обстежених хворих на ММ із 4 регіонів України нами не виявлено вірогідних відмінностей у частоті генотипів за поліморфізмом С3435Т гена MDR1 (рис. 4), хоча у пацієнтів із Західної України відзначено тенденцію до зниження частоти ТТ генотипу гена MDR1. У 2 пацієнток зі Східної України виявлено генотип TT гена MDR1.

Результати більшості досліджень вказують на те, що на рівень захворюваності впливають популяційні відмінності. Так, серед представників європейських популяцій захворювання зустрічається з частотою від 2,6 на 100 000 населення в Англії до 3,3 на 100 000 населення в Швеції, а в Україні — 1,6 на 100 000 населення [1]. Найвищу захворюваність виявлено у представників негроїдної раси в США — 8,25 на 100 000 населення, а найнижчу в Китаї — 1,0 на 100 000 населення [4, 5]. Виявлені відмінності, на нашу думку, пов’язані з генетичною гетерогенністю генів, асоційованих з ймовірним розвитком захворювання. Але переконливих даних щодо ролі генетичної компоненти в розвитку ММ не отримано. Водночас у більшості згаданих нами робіт вказано на те, що генетична компонента є важливою складовою відповіді на лікування, і її необхідно вивчати для того, щоб індивідуалізувати використання існуючих схем та протоколів.
У 66 обстежених нами хворих, пролікованих у Київському центрі трансплантації кісткового мозку, визначено методом імунофіксації тип мієломи. 74,24% цих пацієнтів мали G тип, 13,63% — Бенс-Джонса тип, 10,6% — A тип, 1,51% — D тип. Отримана частота окремих типів ММ в обстежених пацієнтів узгоджуються з даними інших авторів. Для хворих з Бенс-Джонса типом прогноз щодо перебігу захворювання та відповіді на лікування є найбільш несприятливим порівняно з A і G типами [2].
Відмінності в перебігу захворювання при різних типах мієломи пов’язували з експресією генів множинної лікарської стійкості та генів, залучених до метаболізму лікарських засобів. Тому ми проаналізували досліджені гени залежно від типу мієломи в обстежених хворих (рис. 5). Тип D виявлено в 1 хворого, тому цей результат не враховано при вивченні розподілу поліморфних варіантів генів GSTT1, GSTM1, GSTP1, MDR1 залежно від типу мієломи.
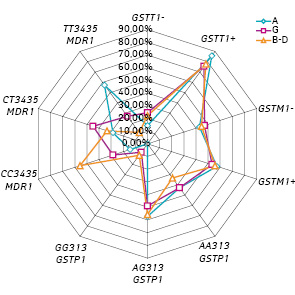
Проведено порівняння розповсюдженості досліджуваних генотипів генів GSTT1, GSTM1, GSTP1, MDR1 у хворих з різними типами мієломи. Як видно з рис. 5, у пацієнтів з різними типами мієломи були відмінності в розповсюдженості генотипів, які насамперед стосувалися гена MDR1. Наведено результати вивчення розповсюдженості поліморфних варіантів гена MDR1 у хворих з різними типами ММ (таблиця).
Таблиця Розподіл частоти генотипів за поліморфізмом С3435Т гена MDR1 у хворих із різними типами ММ
| Ген | Генотип | Тип А (n=7) | Тип G (n=49) | Тип Б-Д (n=9) | Тип D (n=1) | ||||
|---|---|---|---|---|---|---|---|---|---|
| n | n | n | % | n | % | n | % | ||
| MDR1 (C3435T) |
CC | 1 | 14,28 | 14 | 28,57 | 5 | 55,55 | 0 | 0 |
| CT | 2 | 28,57 | 22 | 44,89 | 3 | 33,33 | 1 | 100 | |
| TT | 4 | 57,14 | 13 | 26,53 | 1 | 11,11 | 0 | 0 | |
У хворих на ММ з типом Бенс-Джонса була вірогідно підвищена частота генотипу СС гена MDR1 (χ2=3,88; р=0,0488) та визначалася тенденція до зниження частоти генотипу ТТ гена MDR1 (χ2=2,86; р=0,0907) порівняно з їх частотою у хворих на ММ з типом А. При типі G частота генотипу СС гена MDR1 була вищою, ніж у хворих з А типом, але нижчою, ніж у хворих з Бенс-Джонса типом, — встановлені відмінності не були вірогідними. Подібну тенденцію виявлено для ТТ генотипу гена MDR1: у хворих з G типом відзначали зниження частоти порівняно з пацієнтами з типом А, але ця частота була вищою, ніж у хворих з Бенс-Джонса типом.
За доведеними даними, особи з ТТ генотипом за поліморфізмом С3435 гена MDR1 характеризуються зниженням рівня Р-глікопротеїну та підвищенням рівня цитостатичних препаратів у клітині, що на сьогодні не пов’язують з токсичним ефектом [9, 16, 14], а розглядають як сприятливий предиктор у формуванні фенотипу відповіді на лікування [6].
Отримані нами результати щодо асоціації певних типів мієломи з поліморфними варіантами гена MDR1 вказують на його ймовірну участь у механізмах формування певних типів ММ. Виходячи з результатів статистичного аналізу, у осіб з генотипом СС гена MDR1 вірогідно частіше відбуватиметься формування Бенс-Джонса типу захворювання.
Висновки
Проведена нами робота дозволила визначити частоту делеційного поліморфізму генів GSTT1, GSTM1, частоту генотипів за поліморфними варіантами А313G, С3435Т генів GSTP1, MDR1 у хворих на ММ, яка не різнилася в пацієнтів з різних регіонів України. Виявлено генетичну схожість хворих на ММ з європейських популяцій та України за дослідженими генами. Отримані результати вказують на те, що за наявності генотипу СС за поліморфізмом С3435Т гена MDR1 у хворих вірогідно частіше виявляють ММ з типом Бенс-Джонса. Перспектива подальших досліджень полягає у вивченні ролі генетичних факторів у механізмі формування фенотипу відповіді на лікування з оцінкою ризику розвитку рефрактерних форм ММ.
Список використаної літератури
1. Бюлетень Національного канцер-реєстру № 13 — «Рак в Україні, 2010–2011».
2. Крячок І.А. (2005) Клініко-лабораторні маркери прогнозу перебігу захворювання та відповіді на комбіноване лікування із включенням високодозової хіміотерапії та трансплантації стовбурових клітин у хворих на множинну мієлому. Укр. мед. часопис, 4(48) VІІ–VІІІ: 132–138.
3. Крячок І.А. (2010) Сучасні стандарти діагностики та лікування хворих на множинну мієлому. Укр. мед. часопис, 2(76) ІІІ/ІV: 91–97.
4. Серафин Н.Я., Лукавецький Л.М., Цяпка О.М. та ін. (2007) Лікування хворих на множинну мієлому: досвід та перспективи. Онкологія, 9(2): 159–163.
5. Becker N. (2011) Epidemiology of Multiple Myeloma. T. Moehler and Goldschmidt (eds.) Multiple Myeloma. Springer-Verlag Berlin Heidelberg (DOI: 10,1007/978–3-540–85772–3_ 2).
6. Buda G., Maggini V., Galimberti S. et al. (2007) MDR1 polymorphism Influences the outcome of multiple myeloma. Br. J. Haemat., 137: 454–456.
7. Dasgupta R. K., Adamson P. J., Davies F. E. (2003) Polymorphic variation in GSTP1 modulates outcome following therapy for multiple myeloma. Blood., 102(7): 2345–2350.
8. DeVita V.T., Hellman S., Rosenberg S.A. et al. (Eds) (1997) Principles and Practice of Oncology. Cancer, 2–5th ed.
9. Dumontet C., Landi S., Reimen T. et al. (2010) Genetic polymorphisms associated with outcome in multiple myeloma patients receiving high-dose melphalan. Bone Marrow Transplantation, 45: 1316–1324.
10. Linsenmeyer M.E., Jefferson S., M. Wolа M. et al. (1992) Levels of expression of the mdr l gene and glutathione S-transferase genes 2 and 3 and response to chemotherapy in multiple myeloma. Br. J. Cancer., 65: 471–475.
11. Maggini V., Buda G., Martino A. et al. (2008) MDR1 diplotypes as prognostic markers in multiple myeloma. Pharmacogenet Genomics, 18(5): 383–389.
12. Hahn T., Zhelnova E., Sucheston L. et al. (2010) A Deletion Polymorphism in Glutathione-S-Transferase Mu (GSTM1) and/or Theta (GSTT1) Is Associated with an Increased Risk of Toxicity after Autologous Blood and Marrow Transplantation. Biol Blood Marrow Transplant 16: 801–808.
13. Hodges L.M., Markova S., Chinn L.W. et al. (2011) Very important pharmacogene summary: ABCB1 (MDR1, P-glycoprotein). Pharmacogenet Genomics, 21(3): 152–161.
14. Schilthuizen C., Broyl A., Holt B. et al. (2007) Influence of genetic polymorphisms in CYP3A4,CYP3A5, GSTP1, GSTM1, GSTT1 and MDR1 genes on survival and therapy-related toxicity in multiple myeloma. Haematologica, 92(02): 277–278.
15. Maggini V., Buda G., Martino A. et al. (2008) MDR1 diplotypes as prognostic markers in multiple myeloma. Pharmacogenet. Genomics, 18(5): 383–389.
16. Vangsted A., Klausen Tobias W., Vogel U. et al. (2012) Genetic variations in multiple myeloma II: association with effect of treatment. Eur. J. Haematol., 88(2): 93–117.
17. Van Ness B., Ramos C., Haznadar M. et al. (2008) Genomic variation in myeloma: design, content, and initial application of the Bank On A Cure SNP Panel to detect associations with progression-free survival. BMC Medicine, 6(26): 1–14.
Молекулярно-генетическая характеристика больных множественной миеломой в Украине
Резюме. В работе проведен сравнительный анализ частот полиморфных вариантов генов, вовлеченных в трансформацию цитостатических препаратов у больных множественной миеломой (ММ). Нами определена частота делеционного полиморфизма генов GSTT1, GSTM1, частота генотипов по полиморфным вариантам A313G, C3435T генов GSTP1, MDR1 у 137 больных ММ из Украины, которые не отличались у пациентов из разных регионов. Выявлено генетическое сходство больных ММ европейских популяций и Украины по исследованным генам. Полученные результаты показали, что генотип СС гена MDR1 является предиктором развития ММ с неблагоприятным течением за счет формирования преимущественно типа Бенс-Джонса. Перспектива дальнейших исследований состоит в определении роли генетических факторов в механизме формирования фенотипа ответа на лечение с оценкой риска развития рефрактерных форм ММ.
Ключевые слова: множественная миелома, гены, полиморфизм.
Molecular-genetic characteristics of patients with multiple myeloma in Ukraine
Summary. Conducted work allowed us to determine frequency of deletion polymorphism of genes GSTT1, GSTM1, frequency of genotypes according to polymorphous variants А313G, С3435Т genes GSTP1, MDR1 in 137 patients with multiple myeloma (MM), who did not differ from patients of different regions of Ukraine. Genetic similarity was determined in patients with MM from European populations and patience from Ukraine according to studied genes. Received results show that genotype СС according to polymorphism С3435Т of gene MDR1 is predictor of development of MM with unfavorable process at the expense of formation in most cases of type of Bence Jones. Perspective of further researches means studying the role of genetic factors in mechanism of formation the phenotype of reaction on treatment with evaluation of risk of development of refractory forms of MM.
Key words: multiple myeloma, genes, polymorphism.














Leave a comment