Доброякісні захворювання передміхурової залози
Трудности диагностики и дифференциальной диагностики туберкулеза и опухолевидных заболеваний предстательной железы. Лечебная тактика
И.М. Русинко, Н.М. Русинко, М.В. Челпанова, О.Г. Коноплева, Т.Н. Орлова
КУ «Днепропетровское 12-е территориальное медицинское объединение Днепропетровского областного совета», Днепропетровск, Украина
Вступление. До настоящего времени нет общепринятой классификации туберкулеза предстательной железы (ТПЖ). Туберкулезный процесс в предстательной железе (ПЖ) проходит все характерные стадии специфического воспаления: бугорковую, казеозную, казеозно-некротическую. Различают острую и хроническую формы ТПЖ.
И.С. Камышан (2003) представил клинико-морфологическую дифференциацию ТПЖ следующим образом:
- бугорково-инфильтративная форма;
- туберкулема;
- кавернозная форма — блокированные или дренирующиеся каверны.
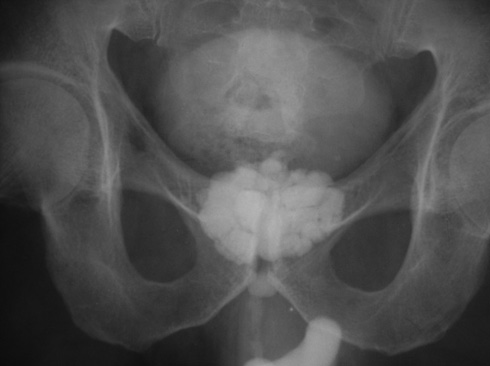
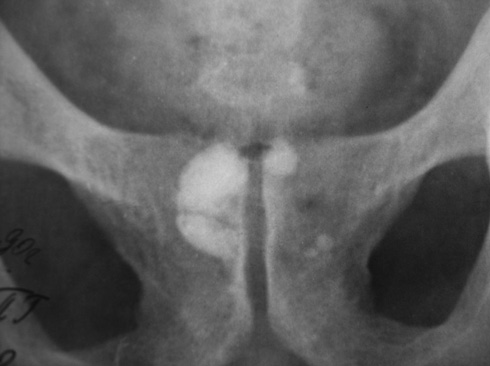
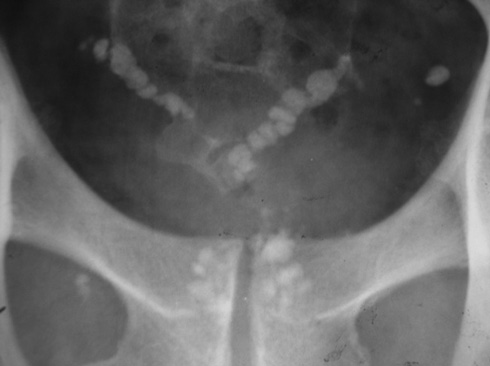
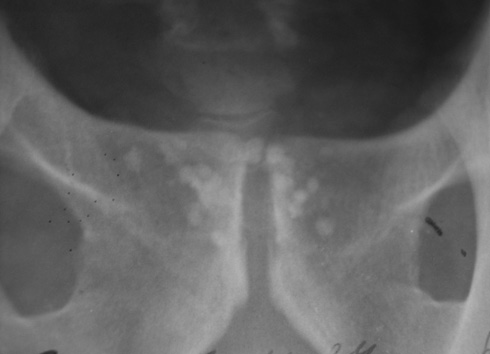
Нами (И.М. Русинко, Н.М. Русинко, 2008) выделен как исход деструктивного ТПЖ специфический простатокальциноз, что является осложнением кавернозной формы ТПЖ.
Материалы и методы исследования. Мы провели анализ 365 историй болезней пациентов, переболевших туберкулезом мужских половых органов. ТПЖ диагностировали в 95,2% случаев, из них в 62% случаев — деструктивный ТПЖ. В 36% деструктивного ТПЖ был выявлен специфический простатокальциноз.
У части больных с ТПЖ при пальпации ПЖ выявляют плотные безболезненные или слабоболезненные инфильтраты. ПЖ ассиметричная, бугристая. При этом участки уплотнения чередуются с участками размягчения. Иногда могут иметь место участки флюктуации над кавернами. После опорожнения каверн прощупываются зоны западения. Если очаги воспаления локализуются в глубине паренхимы ПЖ, возможно отсутствие пальпаторных изменений. Исследование мочи при ТПЖ помогает выявить терминальную гематурию или пиурию. Особое место в диагностике ТПЖ занимает бактериологическое исследование ее секрета и эякулята. Важную роль в диагностике ТПЖ играют Ro-урологические методы исследования, трансректальная сонография ПЖ, которая позволяет объективно оценить состояние паренхимы и достоверно выявить характер, объем и локализацию наибольших изменений ее эхоструктуры, выявить инфильтраты, туберкулемы, деструктивные и кистозные изменения при туберкулезном поражении в ранних стадиях развития специфического процесса. Важную роль в верификации ТПЖ играет биопсия ПЖ.
Результаты. Проводят дифференциальную диагностику ТПЖ и рака, доброкачественной гиперплазии ПЖ, склероза и камней ПЖ. Особые трудности встречаются при дифференциальной диагностике ТПЖ и рака ПЖ. Правильный диагноз можно установить на основании клинико-лабораторных данных, Ro-урологических исследований, пункционной биопсии ПЖ, определения уровня простатспецифического антигена (ПСА), специфических антител (IgG) к микобактериям туберкулеза, с помощью иммуноферментного анализа в сыворотке крови, ректальной сонографии ПЖ с трансректальной биопсией, аспиратов из тканей ПЖ. Эти диагностические мероприятия позволили значительно повысить дифференциальные возможности на ранних стадиях рака или ТПЖ.
Различия в клинических проявлениях посттуберкулезного склероза и неспецифического склероза ПЖ можно объяснить тем, что фибропластические процессы при ТПЖ носят очаговый характер, а при неспецифическом склерозировании ПЖ — диффузный. Именно очаговость патологических изменений характерна для посттуберкулезного склероза ПЖ.
Выводы. Общепризнанным является тот факт, что антибактериальная терапия при ТПЖ должна проводиться длительно — до 18–20 мес. Многие антибактериальные препараты часто не достигают терапевтической концентрации в тканях ПЖ. С целью создания достаточного содержания этих препаратов в тканях ПЖ используют оральный, парентеральный и ректальный методы введения лекарств. С целью повышения эффективности кумуляции антибактериальной терапии в ПЖ практикуется введение этих препаратов методом непрямой лимфотропной терапии. В комплекс лечения целесообразно вводить рассасывающие средства, иммуномодуляторы, антиоксиданты, ферменты, анальгетики, α1-адреноблокаторы. При нарушении половой функции — коррекция сексуальных расстройств андрогенами. Необходимо соблюдать индивидуальный подход к назначению физиотерапевтических методов лечения, лечебных массажей ПЖ.
Учитывая склерозирование стромы ПЖ при ТПЖ, по показаниям операцией выбора при данной патологии следует считать трансуретральную резекцию ПЖ.
Ефективність використання ендогенних простатоселективних цитомединів у хворих із симптомами нижніх сечових шляхів при доброякісній гіперплазії передміхурової залози
Є.А. Литвинець, Р.Р. Антонів
Івано-Франківський національний медичний університет, Україна
Вступ. У лікуванні доброякісної гіперплазії передміхурової залози (ДГПЗ) широко застосовують препарати рослинного і біологічного походження. Якщо дія фітопрепаратів на передміхурову залозу та симптоматику при доброякісній гіперплазії широко відома та активно пропагується, ефективність препаратів тваринного походження вивчена недостатньо. В останні роки при захворюваннях передміхурової залози почали застосовувати препарати біологічного походження, виділені із передміхурової залози великої рогатої худоби — біорегуляторні пептиди класу цитомединів. Доведено, що ці речовини, чинячи органотропну дію на передміхурову залозу, здатні впливати на різні ланки патогенезу захворювань передміхурової залози шляхом впливу на процеси диференціювання в популяції клітин, з яких вони виділені. Крім цього, вони мають протизапальний та імуномодулюючий ефект, впливають на показники гемостазу, підсилюють синтез антигістамінових і антисеротонінових антитіл та покращують мікроциркуляцію в пошкодженому органі.
Метою нашого дослідження було вивчення ефективності застосування екстракту передміхурової залози великої рогатої худоби для симптоматичного лікування хворих на ДГПЗ.
Матеріали та методи. Під нашим спостереженням протягом місяця перебували 30 хворих на ДГПЗ із помірно вираженими симптомами у нижніх сечових шляхах. Всім пацієнтам проведене клінічне обстеження даної патології згідно з існуючими стандартами. Ні у кого з обстежених не було ознак ураження верхніх сечових шляхів та інших показань до хірургічного лікування. Середній вік хворих становив 64,5±2,5 року. Хворі отримували препарат у вигляді ректальних супозиторіїв в дозі 100 мг 1 раз на добу протягом 30 днів.
Результати. На основі даних анамнезу, аналізів і трансректального ультразвукового дослідження у 22 (73,3%) пацієнтів діагностовано супутній хронічний простатит. В результаті проведеного лікування встановили, що всі 30 пацієнтів із ДГПЗ, які отримували екстракт передміхурової залози великої рогатої худоби протягом 30 днів відзначали позитивний ефект. При цьому виражений позитивний ефект був 9 (30,0%) пацієнтів, добрий ефект — у 12 (40,0%) і задовільний — 9 (30,0%). Також на момент закінчення прийому препарату покращилися всі клінічні показники перебігу захворювання. Так, кількість балів по шкалі ІРSS зменшилася з 14,2±2,2 до 9,8±1,6 бала, тобто на 4,4 бала. Середнє значення оцінки якості життя знизилося з 3,8±0,5 до 2,6±0,4 бала (р<0,05). Максимальна швидкість потоку сечі через 30 днів лікування зросла з 9,4±0,8 до 13,2±0,7 мл/с (тобто на 3,8 мл/с) (р<0,05). Зазначено зменшення кількості залишкової сечі з 68,5±12,4 мл до лікування до 28,5±7,5 мл — після лікування. На фоні прийому препарату незначно зменшився і об’єм передміхурової залози з 49,5±5,4 см3 до лікування до 45,4±3,8 см3 — після лікування.
Препарат добре переносився хворими. Побічних ефектів у жодному випадку не відзначено, що свідчить про добру переносимість і безпечність екстракту передміхурової залози великої рогатої худоби.
Таким чином, аналіз результатів лікування показує, що застосування препарату в більшості випадків дозволяє добитися позитивних результатів щодо клініко-об’єктивних параметрів, досягти стійкого клінічного ефекту.
Висновки. Препарати на основі екстракту передміхурової залози великої рогатої худоби можуть бути рекомендовані для лікування ДГПЗ з помірними проявами захворювання із урахуванням показань та протипоказань. Дані препарати більш ефективні у хворих на ДГПЗ із супутнім хронічним простатитом.
Підвищення ефективності лікування хворих із гострою затримкою сечі, зумовленою доброякісною гіперплазією передміхурової залози
C.П. Пасєчніков1, Н.О. Сайдакова2, Я.М. Клименко1
1Національний медичний університет ім. О.О. Богомольця, Київ, Україна
2ДУ «Інститут урології НАМН України», Київ, Україна
Гостра затримка сечі (ГЗС) — досить часте ускладнення доброякісної гіперплазії передміхурової залози (ДГПЗ), що істотно впливає на якість життя хворих. Цей стан потребує надання невідкладної допомоги, яка полягає в дренуванні сечового міхура шляхом катетеризації або цистостомії. У подальшому для відновлення самостійного сечовипускання застосовують α-адреноблокатори, провідне місце серед яких заслужено посідає тамсулозин. Ефективність такого лікування, за даними більшості дослідників, становить 35–70% (McNeill S.A., 2004, Lucas M.G., Stephenson T.P., Nagrund V., 2005; Desgrandchamps F., De La Taille A., Doublet J.D., 2006). Такі показники є недостатніми, а отже потребували поглибленого дослідження.
На основі консервативного лікування 79 хворих із ГЗС, зумовленою ДГПЗ, розроблено методику прогнозування результатів застосування тамсулозину для відновлення самостійного сечовипускання. Її використання передбачає вивчення карти оцінки хворих із ГЗС та прогностичної таблиці визначення наслідку консервативного лікування (таблиця).
Таблиця. Прогностична таблиця визначення наслідку консервативного лікування ГЗС, зумовленої ДГПЗ
| Ступінь ризику | Сума балів | Імовірність невдалої ССБК |
|---|---|---|
| І | <0 | 10% |
| ІІ | 0–3 | 60% |
| ІІІ | >3 | 91,7% |
Тамсулозин пацієнти отримували в стандартній дозі 0,04 мг 1 раз на добу з моменту катетеризації сечового міхура і протягом наступних 3 днів.
Проведення консервативного лікування тільки в групі прогностично сприятливих щодо відновлення самостійного сечовипускання хворих згідно з розробленою таблицею забезпечує високу ефективність тамсулозину. Відповідно, відмова від його призначення пацієнтам із потенційно невдалим результатом лікування, згідно з таблицею, заощаджує пацієнтам час і витрати на лікування. За час впровадження розробленого способу з 2008 по 2013 р. його було застосовано у 214 хворих із ГЗС, зумовленою ДГПЗ. Продемонстровано позитивні результати лікування тамсулозином у 90,6% хворих. Діагностична ефективність розробленого способу становить близько 89%.
Таким чином, використання тамсулозину у відібраних хворих забезпечує відновлення самостійного сечовипускання у понад 90% випадків, що вдвічі перевищує ефективність звичайних α-адреноблокаторів.
Вплив інфікованості Ureaplasma urealyticum на клінічний перебіг захворювання та розвиток ранніх післяопераційних ускладнень у хворих на доброякісну гіперплазію передміхурової залози
С.П. Пасєчніков1, М.В. Мітченко2, В.С. Грицай1, А.С. Глєбов2
1Національний медичний університет ім. О.О. Богомольця, кафедра урології, Київ, Україна
2ДУ «Інститут урології НАМН України», відділ запальних захворювань, Київ, Україна
Вступ. Не виключено, що наявність хронічної урогенітальної інфекції може впливати на характер перебігу захворювання і створювати загрозу розвитку цілої низки ускладнень у ранній післяопераційний період лікування доброякісної гіперплазії передміхурової залози (ДГПЗ). У літературі й досі відсутні публікації, які висвітлюють вплив збудників уреаплазмозу на виникнення післяопераційних ускладнень у хворих на ДГПЗ.
Мета дослідження — вивчити особливості клінічних проявів захворювання та зв’язок виникнення ранніх післяопераційних ускладнень (РПУ) відкритої простатектомії у хворих на ДГПЗ із наявністю Ureaplasma urealyticum в генітальних екскретах (ГЕ) та інтраопераційно видаленій тканині передміхурової залози (ПЗ).
Матеріали та методи. В результаті проведеного дослідження обстежено 152 хворих на ДГПЗ, у яких проведено планову черезміхурову простатектомію. Усім хворим, крім загальноклінічного обстеження, проводили ультразвукове дослідження (об’єм ПЗ, кількість залишкової сечі), кількісну оцінку симптомів сечовипускання (IPSS, QоL), цитологічні дослідження ГЕ (зіскрібок із сечівника і секрету ПЗ). Інфікованість Ureaplasma urealyticum вивчали за допомогою полімеразної ланцюгової реакції (ПЛР) у ГЕ та у видаленій під час операції тканині ПЗ. До І групи ввійшли 25 пацієнтів, у яких виявлено Ureaplasma urealyticum. ІІ групу склали 127 пацієнтів, не інфікованих цим збудником. Для характеристики перебігу раннього післяопераційного періоду у хворих враховували такі показники: довготривала (більше 7 діб) або профузна (включаючи гемотампонаду сечового міхура) макрогематурія, нагноєння рани, розвиток гострого пієлонефриту, гострого уретриту, гострого орхіепідидиміту.
Результати. За допомогою ПЛР в ГЕ та інтраопераційно видаленій тканині ПЗ 152 хворих у 25 (16,4%) виявлено ДНК Ureaplasma urealyticum, що зумовило включення цих пацієнтів у І групу. Інфекційно-запальні захворювання ПЗ та/або сечівника ідентифіковано у 21 (84,0±7,3%) хворого І групи та 82 (64,6±4,2%) пацієнтів ІІ групи (р<0,02). Об’єм залишкової сечі у хворих на ДГПЗ, інфікованих Ureaplasma urealyticum, вірогідно більший (129,7±13,4 мл), ніж у пацієнтів, не інфікованих цим збудником (98,6±6,0 мл), але вірогідної різниці між об’ємами ПЗ не відзначено (99,5±13,2 та 96,8±5,5 мл відповідно). Пацієнти досліджуваних груп мали однаково високий ступінь тяжкості симптомів захворювання в нижніх сечовивідних шляхах, який оцінювали за допомого шкали IPSS (у хворих І групи — 24,7±0,7 проти 23,2±0,5 бала — у ІІ групі; р>0,05). Вірогідної різниці між якістю життя також не виявлено. Структуру РПУ у хворих на ДГПЗ залежно від виявлення Ureaplasma urealyticum представлено в таблиці.
Таблиця. Структура РПУ у хворих на ДГПЗ залежно від виявлення ДНК Ureaplasma urealyticum
| Ускладнення | Кількість хворих | p | |||
|---|---|---|---|---|---|
| Інфіковані Ureaplasma urealyticum (n=25) |
Неінфіковані Ureaplasma urealyticum (n=127) |
||||
| n | %±m | n | %±m | ||
| Нагноєння рани | 3 | 12,0±6,5 | 3 | 2,4±1,4 | >0,05 |
| Гострий орхіепідидиміт | 4 | 16,0±7,3 | 7 | 5,5±2,0 | >0,05 |
| Гострий уретрит | 4 | 16,0±7,3 | 9 | 7,1±2,3 | >0,05 |
| Гострий пієлонефрит | 2 | 8,0±5,4 | 9 | 7,1±2,3 | >0,05 |
| Усього інфекційно-запальних ускладнень | 13 | 52,0±10,0 | 28 | 22,0±3,7 | <0,005 |
| Довготривала або профузна макрогематурія | 5 | 20,0±8,9 | 17 | 13,4±3,0 | >0,05 |
| Усього | 18 | 72,0±9,0 | 45 | 35,4±4,2 | <0,001 |
Висновки.
1. Серед хворих на ДГПЗ, які потребують планового хірургічного лікування, ступінь інфікованості ГЕ та тканини ПЗ Ureaplasma urealyticum становить 16,4%.
2. У пацієнтів, інфікованих Ureaplasma urealyticum, вірогідно частіше виявляють хронічний запальний процес у ПЗ та/або сечовому міхурі (84,0%).
3. У інфікованих хворих об’єм залишкової сечі вірогідно в 1,3 раза більший.
4. Частота виникнення РПУ у пацієнтів, інфікованих Ureaplasma urealyticum, в 2 рази перевищує таку у неінфікованих хворих за рахунок в 2,4 раза вищої частоти виникнення інфекційно-запальних ускладнень.
Порівняльна оцінка хірургічних методів лікування доброякісної гіперплазії передміхурової залози
Е.О. Стаховський, Ю.В. Вітрук, О.А. Войленко, П.С. Вукалович, О.Е. Стаховський, В.А. Котов
Національний інститут раку, відділення пластичної та реконструктивної онкоурології, Київ, Україна
Вступ. На даний час розроблено та успішно використовують велику кількість хірургічних методів лікування доброякісної гіперплазії передміхурової залози (ДГПЗ), що потребує глибшого початкового обстеження пацієнтів для вибору найбільш раціонального та економічно виправданого методу в кожній конкретній клінічній ситуації.
Мета дослідження — оцінити ранні післяопераційні ускладнення та ефективність хірургічного лікування хворих на ДГПЗ.
Матеріали та методи. Проведено аналіз лікування 163 хворих на ДГПЗ, які з 2008 по 2012 р. перебували на лікуванні у відділенні пластичної та реконструктивної онкоурології Національного інституту раку. Вік хворих становив від 56 до 79 років (65,4±7,5). Тривалість захворювання — від 6 міс до 14 років — зумовлена тим, що близько 80% хворих отримували консервативну терапію, яка викликала тимчасове суб’єктивне покращення.
Залежно від проведеного лікування хворих розділено на 2 групи. У першу групу ввійшли 79 (48,5%) пацієнтів, в яких проведено трансуретральну резекцію (ТУР) передміхурової залози, в другу — 84 (51,5%) хворих, яким виконано черезміхурову аденомектомію. Критерієм слугував об’єм передміхурової залози: так, при об’ємі <80 см3 проводили ТУР передміхурової залози, при ≥ 80 см3 — черезміхурову аденомектомію (за Е.О. Стаховським).
Результати. Рання кровотеча з ложа передміхурової залози мала місце у 5 (6,3%) хворих після ТУР та у 1 (1,2%) — після черезміхурової аденомектомії. Поява кровотечі в пацієнта після аденомектомії пов’язана із послабленням кисетного шва на 2-гу добу та усунена шляхом зворотного затягування кисета, компресії ложа передміхурової залози катетером Фолея. У пацієнтів після ТУР компресія ложа передміхурової залози не ліквідувала адекватно кровотечу, що змусило провести інтенсивну гемостатичну та замісну терапію і зупинити гематурію.
У 4 (5,1%) хворих, в яких проведено ТУР, в післяопераційний період виникли ознаки часткового нетримання сечі, що не відзначено у пацієнтів, в яких виконано аденомектомію. Орхіепідидиміт розвинувся у 1 (1,3%) хворого з І групи. Один пацієнт ІІ групи загинув на 6-ту добу після операції від тромбоемболії легеневої артерії, незважаючи на проведену антикоагулянтну терапію.
У 34 (43%) хворих після ТУР та 44 (52,4%) — після аденомектомії відновився нормальний акт сечовипускання на 4-ту добу, у 42 (53,2%) пацієнтів І групи та 40 (47,6%) ІІ групи — на 5-ту добу. У 3 (3,8%) хворих після ТУР не відновився природній акт сечовипускання після видалення катетера. У таких пацієнтів проведено повторну ТУР, яка передбачала видалення власне передміхурової залози, що дозволило відновити прохідність міхурово-уретрального сегмента та адекватний акт сечовипускання у 2 (2,5%) хворих. У 1 (1,3%) випадку причиною порушення сечовипускання був клапан ложа передміхурової залози.
Таким чином, загальна кількість післяопераційних ускладнень після ТУР передміхурової залози була статистично вищою (р<0,05), ніж після черезміхурової аденомектомії (17,7 проти 4,8% відповідно). Водночас достовірної різниці між обома групами щодо показника післяопераційного ліжко-дня (8,3±2,1 та 7,7±2,3 відповідно) не виявлено (р=0,24).
Висновки. Черезміхурова аденомектомія — ефективний метод хірургічного лікування ДГПЗ при об’ємі передміхурової залози 80 см3, який дозволяє адекватно відновити прохідність міхурово-уретрального сегмента, досягти ефективного гемостазу, запобігти виникненню ранніх післяопераційних ускладнень та скоротити післяопераційний ліжко-день.
Склероз предстательной железы — как причина инфравезикальной обструкции
Э.А. Стаховский, П.С. Вукалович, Ю.В. Витрук
Отделение пластической и реконструктивной онкоурологии, Национальный институт рака, Киев, Украина
Исследования, возглавляемые профессором В.С. Карпенко, позволили установить новую нозологическую единицу — «склероз предстательной железы» (СПЖ), которая утверждена III Съездом урологов СССР и внесена в классификацию ВОЗ. В связи с этим изменились взгляды на ряд патологических состояний, разработана новая лечебная тактика. СПЖ — это комплексное заболевание, обусловленное соединительнотканным замещением паренхимы и стромы железы, а также морфофункциональными изменениями в пузырно-уретральном сегменте (Карпенко В.С., 1982). Вследствие рубцово-склеротического процесса в предстательной железе шейка мочевого пузыря становится ригидной, малоподвижной, предстательная часть мочеиспускательного канала суживается и укорачивается, сдавливаются протоки семенных пузырьков, пронизывающие паренхиму предстательной железы.
Причинами развития СПЖ являются многочисленные патологические процесы, развивающиеся как в самой железе, так и в организме больного в целом. Причинами СПЖ являются: хронический простатит, инфаркт предстательной железы или склероз подвздошных артерий, нарушение венозного оттока из предстательной железы, рефлюкс мочи в предстательную железу, травматические или ятрогенные повреждения железы, дисбаланс половых гормонов, ряд медицинских препаратов, вызывающих развитие соединительной ткани в предстательной железе.
Результаты гистологических и гистохимических исследований позволили В.С. Карпенко и А.М. Романенко (1980) разработать гистологическую классификацию СПЖ, в которой отражены стадии склерозирующего процесса: I стадия — СПЖ с очаговой гиперплазией паренхимы; II стадия — СПЖ с атрофией паренхимы; III стадия — СПЖ (фиброз) в сочетании с нодозной аденоматозной гиперплазией; IV стадия — СПЖ (фиброз) с кистозной трансформацией; V стадия — цирроз предстательной железы. Согласно данной классификации не исключается возможность сочетания отдельных форм заболевания. Необходимо также отметить, что атрофию предстательной железы, развивающуюся в связи с половой инволюцией у лиц пожилого возраста, нельзя путать со СПЖ.
СПЖ сопровождается нарушением акта мочеиспускания, характерным для инфравезикальной обструкции, и хронической задержкой мочи. Из-за отсутствия клинико-лабораторных признаков, патогномоничным для СПЖ и важное диагностическое значение имеет правильная интерпретация жалоб и данных комплексного обследования — ректального исследования, рентгенологического (обзорная, экскреторная урография, уретроцистография), урофлоуметрического, уродинамического и ультразвукового исследования (УЗИ).
В.С. Карпенко предложил для лечения СПЖ следующие операции — парциальную простатэктомию, субтотальную резекцию предстательной железы, простатэктомию, простатовезикулэктомию, аденомопростатэктомию.
Исходя из вышеизложенного, целью данной работы было изучить особенности инфравезикальной обструкции при некоторых формах СПЖ и предложить эффективную тактику оперативного лечения.
Материал и методы. Клиническому анализу и оперативному лечению подвергнуты 210 больных СПЖ, которые находились в клинике пластической и восстановительной урологии, а также онкоурологии Национального института рака.
Больные подвергнуты комплексному клиническому обследованию, которое включало лабораторные методы исследования, изучение жалоб, оценку состояния предстательной железы по данным УЗИ и ректального исследования, оценку тонуса детрузора и внутреннего сфинктера по данным электромиографии, урофлуометрии, уродинамометрии, уретроцистографии и экскреторной урографии. Во всех случаях отмечали нарушение акта мочеиспускания, характерное для инфравезикальной обструкции, которое проявлялось: затрудненным мочеиспусканием — у 178 (84,8%), истончением струи мочи — у 175 (83,3%), поллакиурией — у 155 (73,8%) и никтурией — у 138 (65,7%) пациентов.
Результаты. В результате комплексного клинического обследования выделены группы больных, которые характеризовали 3 варианта клинического течения СПЖ. Так, первую группу составили 56 (26,7%) больных СПЖ, осложненным уретерогидронефрозом, вторую — 103 (49%) пациента со СПЖ в сочетании с нодозной аденоматозной гиперплазией и третью — 51 (24,3%) больной СПЖ после раннее перенесенной неэффективной аденомэктомии.
В 82% случаях объем предстательной железы не превышал 40 см3. По данным восходящей и нисходящей уретроцистографии определяли характерные для СПЖ симптомы — сужение и ригидность предстательной части уретры, которые характеризовались отсутствием формирования шейки мочевого пузыря на микционной уретроцистограмме. Отмечали симптом фонтанирования струи у больных с небольшими аденоматозными узлами, имеющими изгиб кпереди, но при этом предстательная часть канала не была удлинена. Задняя часть мочеиспускательного канала и мочевой пузырь образовывали прямой уретровезикальный угол. Инфравезикальная обструкция характеризовалась снижением тонуса внутреннего сфинктера, повышением профиля давления в задней уретре и проявлялась тремя вариантами нарушения функции мочевыводящего тракта — компенсацией мочевого пузыря, декомпенсацией и декомпенсацией с нарушением функции верхних мочевыводящих путей. Данные изменения отражали стадийность развития инфравезикальной обструкции: I стадия инфравезикальной обструкции СПЖ отмечена у 71 (33,8%) больного, характеризовалась общим индексом IPSS от 0 до 7 баллов, урофлуометрическим индексом >10 мл/с, при этом объем остаточной мочи составлял <50 мл без эктазии верхних мочевых путей. II стадия диагностирована у 83 (39,5%) пациентов, характеризовалась общим индексом IPSS от 8 до 19 баллов, урофлуометрическим индексом от 5 до 10 мл/с, объемом остаточной мочи от 50 до 150 мл без эктазии верхних мочевых путей. III стадия отмечена у 56 (26,7%) больных, характеризовалась общим индексом IPSS от 20 до 35 баллов, урофлуометрическим индексом <5 мл/с, объемом остаточной мочи >150 мл и наличием эктазии верхних мочевых путей.
В зависимости от степени анатомо-функциональных изменений проводили следующие оперативные вмешательства: парциальную простатэктомию — у 23 (10,9%), субтотальную простатэктомию — у 33 (15,7%), аденомэктомию с резекцией предстательной железы — у 42 (20%), аденомопростатэктомию — у 47 (22,4%), простатэктомию — у 38 (18,1%), простатовезикулэктомию — у 27 (12,6%) пациентов. У больных с осложнениями, обусловленными СПЖ, вышеуказанные операции дополнены цистолитотомией, дивертикулэктомией, уретероцистонеостомией. Данная тактика лечения оказалась эффективной в 86% случаев.
Выводы. СПЖ характеризуется стадийностью нарушения уродинамики, в конечном итоге приводя к двустороннему уретерогидронефрозу и хронической почечной недостаточности. В патогенезе развития мегауретера при СПЖ лежат следующие факторы: повышение давления в простатической части уретры, декомпенсация детрузора и хроническая задержка мочи, которые вызывают функциональную, а в последующем и органическую обструкцию интрамуральных отделов мочеточников. Простатэктомия и варианты ее модификации являются эффективным способом лечения СПЖ и его осложнений.
Терминология, характеризующая операции на предстательной железе, должна быть пересмотрена с учетом заболевания простаты — аденома, склероз или рак, и отражать суть хирургического вмешательства, что будет способствовать более эффективному лечению и профилактике болезней предстательной железы.
Історія запровадження і досвід виконання залобкової простатектомії у хворих на гіперплазію передміхурової залози в урологічній клініці Вінницького національного медичного університету ім. М.І. Пирогова
І.В. Барало
Вінницький національний медичний університет ім. М.І. Пирогова, Вінниця, Україна
Вступ. Історія залобкової простатектомії (ЗП) в хірургії гіперплазії передміхурової залози (ГПЗ) розпочалася з теоретичного обґрунтування можливості такої операції van Stockum в 1909 р., опрацювання методики на трупах А.Т. Лідським в 1919 р. та застосування в клініці Т. Millin в 1945 р. В урологічній клініці ВНМУ (тоді — медичного інституту ім. М.І. Пирогова) виконання першої ЗП ухвалено в 1968 р. професором М.В. Піневичем і виконано асистентом Б.Ф. Гурським. У подальшому проблему вдосконалення методики ЗП розробляв доцент П.І. Пивоваров, завдяки його наполегливим зусиллям методикою ЗП оволоділи всі хірурги клініки, відтоді проведено 1995 ЗП у хворих на ГП.
Мета. Проаналізувати досвід виконання ЗП у клініці порівняно з золотим стандартом лікування ГП трансуретральною резекцією передміхурової залози (ТУРПЗ).
Матеріали та методи дослідження. Для статистичного аналізу створено ретроспективну вибіркову сукупність історій хвороб пацієнтів, яким в урологічній клініці ВНМУ на базі урологічного відділення Вінницької обласної клінічної лікарні ім. М.І. Пирогова з приводу ГП проводили з 2000 по 2012 р. одномоментні ЗП (n=1050) та ТУРПЗ (n=600). Вивчали всі без винятку історії хвороби. Головними показниками для порівняння обрали тривалість післяопераційного перебування пацієнтів у стаціонарі та частоту зареєстрованих у картках стаціонарних хворих ускладнень. Статистичний аналіз виконано на персональному комп’ютері за допомогою статистичного пакету Microsoft Excel 2003.
Результати. Перші ЗП тривали до 2,5–3 год, середня крововтрата становила до 1000 мл, після вдосконалення техніки операції її тривалість не перевищує 1–1,5 год, крововтрата рідко сягає за 300 мл. Особливістю модифікації ЗП, яку застосовують в клінічній практиці, є: попереднє прошивання і перев’язка Z-подібними лігатурами дорзального венозного комплексу без розсічення лобково-простатичних зв’язок, короткий поперечний розтин передньої фіброзної строми довжиною 1,5–2 см.
Після видалення вузлів гіперплазії — гемостаз на задньому півколі шийки сечового міхура і відновлення цілісності сечоміхурово-уретрального сегмента за допомогою Z-П-подібних вікрилових № 2–0 лігатур із зав’язуванням вузлів назовні з боку адвентиційного шару.
У разі неускладненого перебігу післяопераційного періоду користуємося правилом 3–5–7: на 3-тю добу відключаємо систему зрошення сечового міхура і видаляємо страхові дренажі з простору Retzius, на 5-ту добу видаляємо уретральні дренажі і у випадку успішного відновлення сечовипускання — на 7-му добу виписуємо пацієнта зі стаціонару. Середній вік оперованих хворих в групах достовірно не відрізнявся: після ЗП — 68,29±0,31 року; ТУРПЗ — 68,18±0,41 року (р=0,44). Частота зареєстрованих післяопераційних ускладнень також була несуттєвою: в групі ЗП — 4,82%, в групі ТУРПЗ — 6,25% (р=0,07). Лише тривалість перебування в стаціонарі була коротшою: після ТУРПЗ — 6,9±0,19 ліжко-дня; після ЗП — 10,2 ±0,15 ліжко-дня (р=0,01).
Висновки. При розмірах передміхурової залози за даними ТРУЗД >60 см3 ефективним методом лікування є ЗП, яка прекрасно зарекомендувала себе в клінічній практиці. Ця операція супроводжується незначною кількістю ускладнень і мінімальною летальністю.
Методика «ідеальної» аденомектомії
Е.О. Стаховський, Ю.В. Вітрук
Національний інститут раку, відділення пластичної та реконструктивної онкоурології, Київ, Україна
Вступ. Існує безліч способів та методик черезміхурової аденомектомії, але досі виникають ускладнення, які у 15–30% можуть нівелювати очікуваний позитивний результат, що призводить до тривалого перебування хворого в стаціонарі та збільшення тривалості післяопераційного ліжко-дня.
З огляду на це нами розроблено комплекс перед-, інтра- і післяопераційних заходів та новий спосіб хірургічного лікування хворих на ДГПЗ, який ефективно забезпечує гемостаз, регенерацію післяопераційної рани, профілактику післяопераційних ускладнень та скорочує перебування хворого в стаціонарі.
Мета дослідження: вдосконалити методику черезміхурової аденомектомії та оцінити її ефективність при доброякісній гіперплазії передміхурової залози об’ємом >80 см3.
Матеріали та методи. Проведено аналіз лікування 84 хворих на ДГПЗ, яким виконано черезміхурову аденомектомію за Е.О. Стаховським.
6 (7,1%) пацієнтів госпіталізовано із повною затримкою сечі (уретральний катетер), 4 (4,8%) — із цистостомічним дренажем, 18 (21,4%) — ознаками ішурії парадоксу. У решти 56 (66,7%) хворих об’єм залишкової сечі коливався від 140 до 480 мл. Загальний індекс IPSS коливався від 24 до 35 балів (29,9±2,8), індекс якості життя — від 3 до 6 балів (5,0±0,9). Об’єм передміхурової залози становив від 82 до 186 см3.
Операцію проводили під спінальною анестезією, яка забезпечувала ефективне знеболення протягом усього хірургічного втручання, дозволяла пацієнту безболісно дихати і кашляти без відчуття будь-якого дискомфорту.
Спосіб черезміхурової аденомектомії полягав у наступному: після видалення гіперплазованої залози гемостаз проводили за допомогою накладання знімного кисетного вікрилового шва на шийку сечового міхура. Перший шов накладали на задню окружність (5–7 год), потім проксимальний кінець нитки проводили по лівій окружності (7–12 год), дистальний кінець — по правій окружності шийки міхура (5–12 год) (рис. 1а). Наступний етап: кінці кисетного шва проводили через стінку сечового міхура на передню черевну стінку. По сечовивідному каналу в сечовий міхур на металевому провіднику одночасно вводили триходовий катетер Фолея та поліхлорвініловий дренаж (на кінці мав 3 бокові дірки). Дренаж встановлювали в ложе передміхурової залози, а катетер Фолея — в сечовий міхур. Кінці нитки кисетного шва фіксували на передній черевній стінці за допомогою системи турнікетів так, що вона утримувала нитку в натягнутому стані. За допомогою кисетного шва, виведеного над лоном, виконували гемостаз та відокремлювали ложе передміхурової залози від сечового міхура (рис. 1б). Цілісність передньої стінки сечового міхура відновлювали безперервно-вузловим вікриловим швом. Через 12–16 год після операції здійснювали аспірацію виділень з ложа передміхурової залози шляхом приєднання до дренажу активної аспірації. Пацієнта активізували, йому дозволяли вставати та ходити. Кисетний шов послабляли через 24–48 год після операції шляхом видалення верхньої та середньої фіксаційних трубок (рис. 1в). Гемостатичну нитку та уретральні дренажі видаляли на 3-тю, 4-ту і 5-ту добу після операції (рис. 1г).
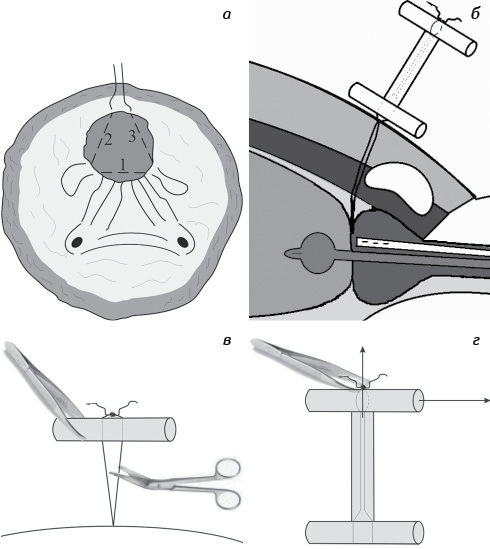
Результати. У 1 (1,2%) хворого виникла кровотеча на 2-гу добу після операції, пов’язана із послабленням кисетного шва, проте усунена зворотнім затягуванням кисета, компресією ложа передміхурової залози катетером Фолея.
У 12 (14,3%) хворих відновився акт сечовипускання на 3-тю добу, у 44 (52,4%) — на 4-ту, а у 28 (33,3) — на 5-ту добу після операції, однак він характеризувався дизурією, яка з кожним днем зменшувалася. Ознак нетримання сечі не виявлено в жодному випадку. Це вказувало на те, що запропонована методика дає можливість адекватно відновити прохідність міхурово-уретрального сегмента та відновити акт сечовипускання.
Один пацієнт другої групи загинув на 6-ту добу після операції від тромбоемболії легеневої артерії, незважаючи на проведену антикоагулянтну терапію. Тільки у 2 (2,4%) хворих виникло пізнє ускладнення у вигляді орхіепідидиміту.
Через 3 і 6 міс проведено контрольне обстеження: показник індексу симптомів IPSS становив у середньому 8,5±7,3 бала, показник якості життя — 1,9±0,9 бала, середня швидкість сечовипускання — 12,2±5,4 мл/с, рівень залишкової сечі не перевищував 50 мл.
Висновки. Комплекс заходів при черезміхуровій аденомектомії завдяки кисетному шву на шийку сечового міхура, компресії ложа передміхурової залози балоном катетера Фолея і окремого дренування ложа передміхурової залози з активною аспірацією — передбачає профілактику післяопераційних кровотеч, сприяє швидкій регенерації ложа та попереджає гнійно-септичні ускладнення, відновлює внутрішній сфінктер сечового міхура та знижує можливість виникнення нетримання сечі. Водночас проведення знеболення супроводу дозволяє швидко відновити нормальний загальний стан пацієнтів та скоротити їх перебування в стаціонарі.
Использование биполярной трансуретральной резекции для лечения доброкачественной гиперплазии предстательной железы
Р.Н. Молчанов1,2, С.Н. Глущенко2
1ГУ «Днепропетровская медицинская академия МЗ Украины», Днепропетровск, Украина
2Клиника «Гарвис», Днепропетровск, Украина
Биполярная трансуретральная резекция (БТУР) предстательной железы является современной альтернативой монополярной технологии лечения доброкачественной гиперплазии предстательной железы (ДГПЖ).
Целью исследования явилась оценка эффективности и безопасности БТУР у больных с ДГПЖ.
Пациенты и методы. У 48 пациентов в возрасте от 52 до 80 (69,7 ±6,9) лет проведено БТУР предстательной железы с использованием резектоскопа Karl Storz 26 CH и генератора Erbe VIO 300D с блоком для выполнения биполярной резекции.
Результаты. Объем предстательной железы у пациентов составил от 36 до 157 (81,1±33,1) мл, время оперативного вмешательства — от 35 до 189 (81,5 ± 34,4) мин. Установлено достоверное различие удельной скорости иссечения ткани предстательной железы у пациентов с ее объемом до 90 мл (0,83±0,27 мл/мин) и более 90 мл (1,11± 0,30 мл/мин) (Z=3,04760, p =0,002307). У всех прооперированных пациентов мы не отмечали признаков ТУР-синдрома. После операции дренирование мочевого пузыря катетером осуществляли в течение 3,6±1,7 сут (от 2 до 10). У 1 пациента (2%) выявили интраоперационное кровотечение, потребовавшее гемотрансфузии. Повторная ревизия с целью удаления кровяных сгустков и остановки кровотечения из ложа удаленной аденоматозной ткани осуществлена у 2 (4%) пациентов в течение 12 ч послеоперационого периода.
Выводы. БТУР является эффективным и безопасным методом оперативного лечения ДГПЖ. Возможность увеличения длительности операции за счет значительного снижения риска возникновения ТУР-синдрома позволяет использовать БТУР для лечения пациентов с большим объемом предстательной железы как альтернативу открытому оперативному вмешательству.














Leave a comment