Цитоморфологічні, цитогенетичні та імуноцитохімічні особливості ендометріоїдного раку яєчника
Ярощук Т.М. , Болгова Л.С., Туганова Т.М., Мариненко С.В., Логінова Є.О. , Магась Т.А. , Алексеенко О.И.
Резюме. Представлено цитоморфологічні, цитогенетичні та імуноцитохімічні особливості ендометріоїдного раку яєчника за матеріалами зіскрібків з видалених під час операції пухлин у 4 жінок різного віку. Виявлено 2 варіанти цитологічної картини з округло-овальних та призматичних клітин. Встановлено високий вміст як загальної кількості ядерець, так і їх активних типів (компактних та перехідних нуклеолонемних), що може свідчити про несприятливий прогноз захворювання. Імуноцитохімічне дослідження з моноклональними антитілами (цитокератином 7 і 20) та епітеліальним антигеном (Веr-EP4) може бути корисним у диференційній діагностиці морфологічних варіантів раку яєчника.
Вступ
 Рак яєчника (РЯ) займає 8-ме місце в структурі загальної онкологічної захворюваності та 3-тє серед пухлин жіночої статевої системи. В Україні реєструють стабільно високі показники захворюваності на злоякісні пухлини яєчників (15,1 на 100 тис. населення) з тенденцією до зростання [13].
Рак яєчника (РЯ) займає 8-ме місце в структурі загальної онкологічної захворюваності та 3-тє серед пухлин жіночої статевої системи. В Україні реєструють стабільно високі показники захворюваності на злоякісні пухлини яєчників (15,1 на 100 тис. населення) з тенденцією до зростання [13].
Відомо, що раціональне лікування новоутворень яєчника можливе тільки з урахуванням морфологічного діагнозу та розповсюдженості пухлинного процесу [9, 10, 11]. Золотим стандартом морфологічної діагностики РЯ є гістологічне дослідження. Однак останнім часом усе ширше використовують цитологічний метод як на етапі обстеження хворих, так і під час оперативного втручання з метою визначення стадії процесу. Об’єктом цитологічного дослідження є вільна перитонеальна рідина, змиви з черевної порожнини, матеріали пункцій пухлин яєчника, дугласового простору, лімфатичних вузлів, відбитки з пухлин та ін. [3–5, 15, 16, 18, 22].
Діагностика пухлин яєчника залишається одним з найбільш складних питань онкоморфології, що зумовлено їх надзвичайно різноманітною гістологічною структурою. У клінічній практиці частіше діагностують епітеліальні пухлини яєчника. Однією з гістологічних форм, яка належить до групи пухлин поверхневого епітелію, є ендометріоїдний рак яєчника (ЕРЯ). Його частка становить приблизно 20% від усіх оваріальних видів раку та майже 5% усіх новоутворень яєчника. Як правило, ЕРЯ діагностують у жінок у віці понад 50 років. Пухлина частіше одностороння, кістозно-солідна, з сосочковими розростаннями по внутрішній поверхні кістозної порожнини, часто поєднується з ендометріозом (42%) чи раком ендометрія (15–20%) [20]. Згідно з гістологічною класифікацією ВООЗ «ендометріоїдні пухлини яєчника — це новоутворення, які мають морфологічні ознаки пухлин, що розвиваються в ендометрії». Едометріоїдний тип раку яєчника надзвичайно поліморфний. Існують численні його гістологічні варіанти: ЕРЯ з плоскоклітинною метаплазією, ЕРЯ на поверхні яєчника, злоякісна ендометріоїдна аденофіброма, секреторний варіант, оксифільний тип, війчастий тип, ажурний варіант, нейроендокринний варіант, сертоліомоподібний варіант [6, 18].
K. Tushur та співавтори [21] при зіставленні результатів інтраопераційного цитологічного дослідження відбитків з пухлин яєчника та результатів гістологічного дослідження виявили низьку діагностичну ефективність (66,6%) цитологічної діагностики ЕРЯ порівняно з іншими гістологічними типами пухлин. Водночас, аналізуючи дані літератури, ми виявили лише поодинокі роботи, присвячені вивченню ЕРЯ на клітинному рівні [1, 2, 8].
Мета роботи — вивчити цитоморфологічні, цитогенетичні та імуноцитохімічні особливості ЕРЯ.
Матеріали та методи
Вивчено та проаналізовано клітинний склад цитологічних препаратів ЕРЯ, отриманих методом зіскрібків з видалених пухлин яєчника 4 пацієнток у віці 41; 42; 46 і 75 років. Препарати забарвлювали за методом Паппенгейма. Цитоморфологічні ознаки ЕРЯ визначали за спеціально розробленою «Схемою цитологічних ознак для формалізованої оцінки якісного та кількісного складу клітин пухлин яєчника», що включає 47 ознак. Оцінюючи цитологічні препарати, визначали загальну характеристику клітин (кількість, розташування, розмір та форму). Розмір клітин та їх складових порівнювали з розміром еритроцита: малий розмір — у 1,5–2 рази більший від еритроцита, середній — у 2–5 разів більший і великий — у ≥5 разів більший. Вивчали характерні ознаки цитоплазми (збереженість, тинкторіальні властивості), враховували її морфофункціональні ознаки — наявність вакуолізації та зернистості. Оцінювали характеристики ядра і ядерець (форма, розмір, контур, структура хроматину, ступінь забарвлення). Відзначали фонові компоненти.
Для виявлення ядерцеутворювальних регіонів (ЯУР) хромосом цитологічні препарати забарвлювали азотнокислим сріблом за методикою W. Howell, D. Black [17]. Дослідження основних варіантів ЯУР хромосом проводили відповідно до класифікації й робочої схеми ідентифікації морфофункціональних типів ядерець [12, 14].
Проведено імуноцитохімічні дослідження з моноклональними антитілами («Dako», Данія) — цитокератином 7 і 20 (СК7, СК20), епітеліальним антигеном (Веr-EP4). Усі дослідження проводили за допомогою світлового мікроскопа Olympus CX41. Діагноз ЕРЯ верифіковано гістологічним дослідженням операційного матеріалу.
Результати
У переважній більшості препаратів ЕРЯ виявлено значну кількість клітин, розташованих у групах (61%) та порізно. У 2 випадках клітини мали округлу та овальну форму, а в 2 інших — переважно призматичну.
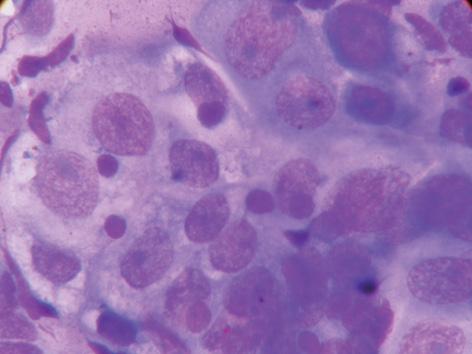
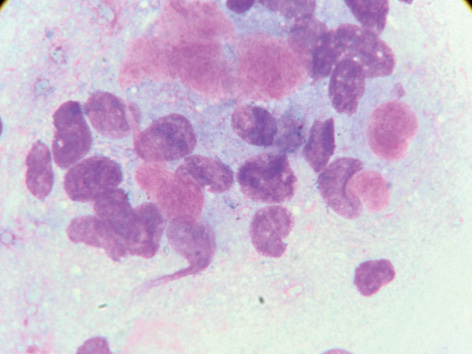
У препаратах 2 хворих на ЕРЯ виявлено відносно мономорфні клітини, що мали дрібні та середні (80%) розміри. Частіше вони містили одне округле чи овальне ядро з нерівним чітким контуром. За тинкторіальними властивостями переважали гіперхромні ядра з рівномірною дрібнобрильчастою структурою хроматину. У частині клітин виявлено нерівномірний хроматин з утворенням просвітів (рис. 1, 2). Відзначено як поодинокі, так і численні дрібні ядерця з нечітким контуром. Переважна більшість клітин (75%) мали помірно розвинену базофільну цитоплазму слабкого та помірного ступеня забарвлення. У більшості клітин, розміщених поодинці, цитоплазма була лізована і зливалася з загальним фоном препарату. Виявлено в незначній кількості групи пухлинних клітин з гіпохромними ядрами та розвиненою світлою цитоплазмою (див. рис. 2). Окремі клітини містять дрібні вакуолі (10–15%) чи мають базофільну зернистість (30%) у цитоплазмі (див. рис. 1).
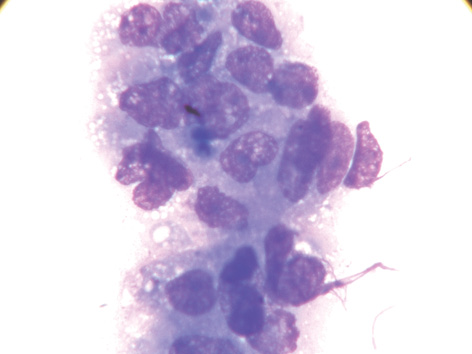
У препаратах інших 2 хворих виявлено значну кількість призматичних клітин у вигляді груп (95%) (рис. 3). Інтенсивно забарвлені пухлинні клітини з мінімальними ознаками атипії паралельно та щільно прилягають одна до одної, нагадуючи групи клітин ендометрія. Цитоплазма пухлинних клітин витягнута, інтенсивно базофільна. Гіперхромні ядра призматичних клітин розміщені переважно ексцентрично (100%). Структура хроматину більшості ядер рівномірна дрібнозерниста та дрібнобрильчаста (40%), у поодиноких випадках — компактна. Переважають ядра з множинними поліморфними ядерцями з чіткими контурами. Виявляють пласти пухлинних клітин, які нагадують бджолині стільники. У центрі пласта клітини мають округлу форму з тонким обідком інтенсивно базофільної цитоплазми, по краю набувають витягнутої, призматичної форми. Подібні структури є характерними для клітин ендометрія (рис. 4).
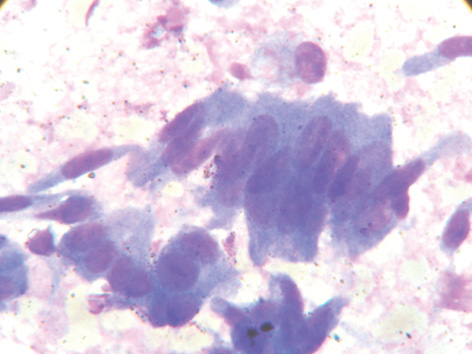
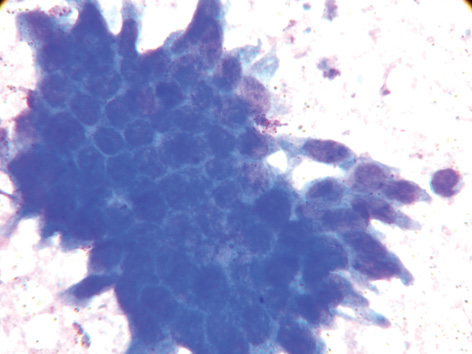
Досліджуючи препарати ЕРЯ, виявили характерний фон мазка, представлений оксифільними масами. Кількість слизоподібної субстанції, яка формувала маленькі чи великі «озера», розміщені між клітинами, у кожному випадку була різною. ЇЇ колір, відповідно, теж — від світло-рожевого по всьому препарату (у більшості випадків) до яскраво-малинового (25%) (рис. 5).
У кожному випадку ЕРЯ проведено якісне типування основних типів ядерець у 100 ядрах пухлинних клітин (таблиця).
Таблиця. Показники основних морфофункціональних типів ядерець у клітинах ЕРЯ; n=4
| № з/п | Кількість клітин, % | Компактні ядерця, n (M±m) | Нуклеолонемні ядерця (власне та перехідні), n (M±m) | Кільцеподібні ядерця, n (M±m) | Мікроядерця, n (M±m) | Загальна кількість основних типів ядерець/середній вміст в одному ядрі |
|---|---|---|---|---|---|---|
| 1 | Залозисто-папілярна ендометріоїдна карцинома* | |||||
| 100 | 54 (0,54±0,02) 5,50% |
151 (1,51±0,02) 15,50% |
196 (1,96±0,03) 20,20% |
572 (5,72±0,07) 58,80% |
973/ 9,73±0,10 |
|
| 2 | Помірно диференційована ендометріоїдна карцинома* | |||||
| 100 | 53 (0,53±0,02) 5,90% |
157 (1,57±0,02) 17,40% |
178 (1,78±0,02) 19,80% |
513 (5,13±0,08) 56,90% |
901/ 9,01±0,09 |
|
| 3 | Ендометріоїдна карцинома* | |||||
| 100 | 35 (0,35±0,01) 4,82% |
150 (1,50±0,01) 20,66% |
150 (1,50±0,01) 20,66% |
391 (3,91±0,03) 53,86% |
726/ 7,26±0,03 |
|
| 4 | Ендометріоїдна карцинома* | |||||
| 100 | 30 (0,30±0,01) 5,18% |
149 (1,49±0,03) 25,70% |
89 (0,89±0,01) 15,36% |
312 (3,12±0,04) 53,76% |
580/ 5,80±0,04 |
|
*Гістологічний діагноз.
У препаратах хворої Т. з діагнозом залозисто-папілярної ендометріоїдної карциноми вміст усіх видів ядерець становив 973; М=9,73±0,10. Кількість компактних ядерець — 0,54±0,02 (5,50%). Середній вміст нуклеолонемних ядерець у ядрах — 1,51±0,02 (15,50%). Нуклеолонемні ядерця представлені тільки перехідними формами (100,0%). Кількість малоактивних кільцеподібних ядерець становила 1,96±0,03 (20,20%), а неактивних мікроядерець — 5,72±0,06 (58,80%).
У препаратах хворої Б. з діагнозом помірно диференційованої ендометріоїдної карциноми виявлено 901 ядерце; М=9,01±0,09. Середній вміст компактних ядерець становив 0,53±0,02 (5,90%). Середній вміст нуклеолонемних ядерець у ядрі — 1,57±0,02 (17,40%). Із них ядерця перехідного типу становили 100,0%. Кількість малоактивних кільцеподібних ядерець дорівнювала 1,78±0,02 (19,80%), а неактивних мікроядерець — 5,13±0,08 (56,90%).
У препаратах хворої Р. з діагнозом ендометріоїдної карциноми виявлено 580 ядерець; М=5,80±0,04. Вміст компактних ядерець — 0,30±0,01 (5,18%). Виявлено середній вміст нуклеолонемних ядерець — 1,49 ± 0,03 (25,70%), із них власне нуклеолонемні ядерця становили 6,04%, а перехідні форми — 93, 96%. Кількість кільцеподібних — 0,89±0,01 (15,36%) та неактивних мікроядерець — 3,12±0,04 (53,76%).
У зразках препаратів хворої Л. з діагнозом ендометріоїдної карциноми виявлено 726 ядерець у 100 ядрах; М=7,26±0,03. Вміст активних компактних ядерець — 0,35±0,01 (4,82%). Середній вміст нуклеолонемних ядерець — 1,50±0,01 (20,66%). Із них кількість ядерець перехідного типу дорівнювала 100%. Кількість малоактивних кільцеподібних ядерець — 1,50±0,01 (20,66%), а неактивних мікроядерець — 3,91±0,03 (53,86%) (рис. 6, 7).
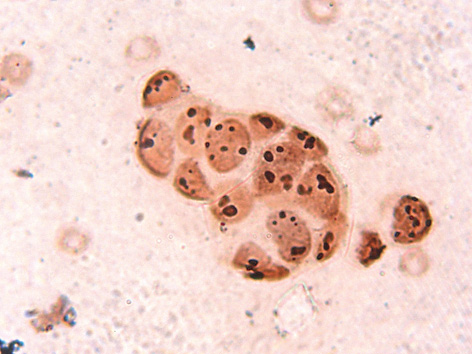
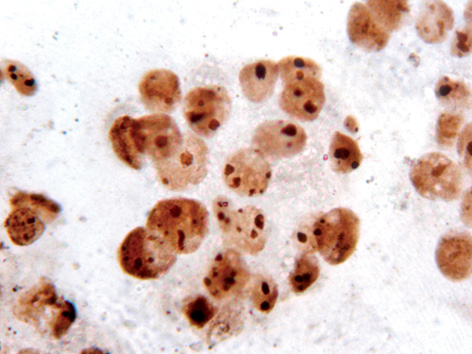
Таким чином, загальна кількість всіх морфофункціональних типів ядерець варіювала від 580 (5,80±0,04) до 973 (9,73±0,10); М=7,95±0,07. При типуванні середній і процентний вміст компактних ядерець був у діапазоні показників від 0,30±0,01 (4,82%) до 0,54±0,02 (5,90%); М=0,43±0,01 (5,30%). Кількість нуклеолонемних ядерець у ядрі коливалася від 1,49±0,03 до 1,57±0,02, відносний вміст — від 15,50 до 25,70%; М=1,52±0,02 (19,80%). Кількість малоактивних кільцеподібних ядерець виявляли в діапазоні від 0,89±0,01 (15,36%) до 1,96±0,03 (20,66%); М=1,53±0,02 (19,0%). Вміст неактивних мікроядерець становив від 3,12±0,04 (53,76%) до 5,72±0,07 (58,80%); М=4,47±0,05 (55,80%).
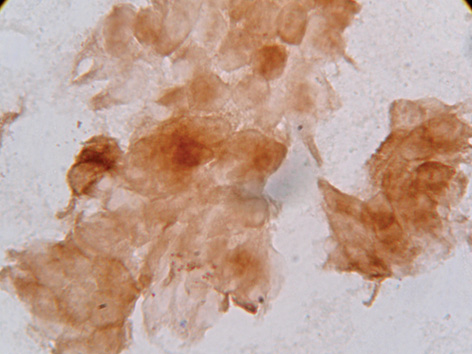
При проведенні імуноцитохімічного дослідження в усіх випадках виявлено позитивну експресію з Ber-EP4 та СК7 (рис. 8) та негативну експресію з СК20, що є додатковою молекулярно-біологічною ознакою ЕРЯ.
Висновки
Проведене дослідження дозволило виявити певні цитоморфологічні, цитогенетичні та імуноцитохімічні особливості ЕРЯ. Так, для даного гістологічного типу пухлини характерні мінімальні ознаки атипії клітин, що ускладнює його оцінку та зумовлює низьку ефективність цитологічної діагностики.
Результати досліджених основних типів ядерець у клітинах ЕРЯ дозволили встановити високий вміст як загальної кількості ядерець, так і їх активних типів (компактних та перехідних нуклеолонемних), що може свідчити про несприятливий прогноз захворювання.
Імуноцитохімічне дослідження з моноклональними антитілами (СК7, СК20) та епітеліальним антигеном (Веr-EP4) може бути використане як додатковий метод у диференційній діагностиці морфологічних варіантів РЯ.
Список використаної літератури
1. Айнбиндер Н.М., Колосов А.Е., Липова В.А. (1979) Цитоморфологическая диагностика эндометриоидных опухолей яичника. Вопросы онкологии, 25(3): 56–59.
2. Вотинцев А.А., Разин А.П. (2006) Морфологическая диагностика и оценка прогрессии эндометриоидного овариального рака. Фундаментальные исследования, 9: 46–48.
3. Григорук О.Г., Базулина Л.М., Добровольская Л.Н. и др. (2007) Возможности пункционного метода диагностики при злокачественных опухолях яичников. Пробл. клин. мед., 2: 81–85.
4. Григорук О.Г. (2007) Пункционная биопсия в диагностике онкологических заболеваний женских половых органов. Акушерство и гинекология, 4: 51–53.
5. Ивинская И.В. (2003) Роль цитологических исследований в диагностике опухолей яичников. Мат. V всероссийского съезда клин. цитологов России. Новости клин. цитологии России, 7(1–2): 55.
6. Карселадзе А.И. (2005) Клинико-морфологическая диагностика опухолей яичников. Прил. к журн. «Архив патологии»: 23–26.
7. Лагутина Е.Н., Сергеева Т.С. (2003) Значение цитологического метода в интраоперационной диагностике опухолей яичников. Мат. V всероссийского съезда клин. цитологов России. Новости клин. цитологии России, 7(1–2): 62.
8. Новичков Е.В., Новичкова О.Н. (2008) Морфологическая характеристика и прогноз рецидива эндометриоидного рака яичников. Уральский мед. журн., 8: 75–78.
9. Питерская Е.А., Гладилин Г.П., Жандарова Л.Ф. (2009) Цитоморфологические особенности эпителиальных опухолей яичников. Клин. лаб. диаг., 4: 28–29.
10. Протасова А.Э., Орлова Р.В., Раскин Г.А. (2011) Новые возможности верификации злокачественных опухолей яичника. Опухоли женск. репрод. системы, 4: 84–86.
11. Свінціцький В.С. (2010) Комплексне лікування хворих на злоякісні пухлини яєчника: автореф. дис. … д-ра мед. наук. Київ, 40 с.
12. Туганова Т.Н., Болгова Л.С., Махортова М.Г. и др. (2004) Морфофункциональные типы ядрышек в цитологической диагностике фиброаденом и рака молочной железы. Новости клинической цитологии России, 8(1–2): 27–30.
13. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2012) Рак в Україні, 2010–2011. Бюлетень Національного канцер-реєстру України, 13, Київ, 123 с.
14. Челидзе П.В., Зацепина О.В. (1988) Морфофункциональная классификация ядрышек. Успехи современной биологии, 105(2): 252–267.
15. Яровая Н.Ю., Мельникова Н.В. (2009) Дооперационная цитологическая диагностика новообразований яичника. Новости клин. цитологии России, 13(1–2): 17–19.
16. Banbyopadhyay A. (2012) Fine-needl aspiration cytology of ovarian tumors with histological correlation. J. Cytol., 29(1): 35–40.
17. Howell W.M., Black D.A. (1980) Controlled silver staining of nucleolar regions with protective colloidal developer a one step method. Experientia, 36: 1014.
18. Mehdi G. (2010) Image-guided fine-needl aspiration cytology of ovarian tumors: an assessment of diagnostic efficacy. J. Cytol., 27(3): 91–95.
19. Soslow R.A. (2008) Histologic subtypes of ovarian carcinoma: an overview Intern. J. Gynecol Pathol., 27: 161–174.
20. Tavassoli F.A., Deville P. (eds.) (2003) World Health Organization classification of tumours. Pathology and genetics of tumours of the breast and female genital organs. Lyon: IARSPress: 130–37.
21. Tushur K., Asaranti K. (2005) Intra-operative cytology of ovarian tumours. J. Obstet. Gynecol. India, 55(4): 345–349.
22. Ugus A. (2005) Fine-needl aspiration cytology of ovarian lesions. Acta Cytol., 49: 144–8.
Цитоморфологические, цитогенетические и иммуноцитохимические особенности эндометриоидного рака яичника
Резюме. Представлены цитоморфологические, цитогенетические и иммуноцитохимические особенности эндометриоидного рака яичника по материалам соскобов с удаленных во время операции опухолей у 4 женщин различного возраста. Выявлено 2 варианта цитологической картины из округло-овальных и призматических клеток. Определено высокое содержание как общего количества ядрышек, так и их активных форм (компактных и переходных нуклеолонемных), что может свидетельствовать о неблагоприятном прогнозе заболевания. Иммуноцитохимическое исследование с моноклональными антителами (цитокератином 7 и 20) и эпителиальным антигеном (Веr-EP4) может быть полезным в дифференциальной диагностике морфологических вариантов рака яичника.
эндометриоидный рак яичника, цитоморфологические, цитогенетические и иммуноцитохимические особенности.














Leave a comment