Цитомегаловирусная инфекция у гематологических и онкологических пациентов, получающих цитостатическую терапию (обзор и клинический случай)
Кущевой Е.В., Крячок И.А., Степанишина Я.А., Мартынчик А.В., Филоненко К.С.
Резюме. В обзоре приведены сведения о роли цитомегаловируса (ЦМВ) в развитии органной патологии у пациентов на фоне цитостатической и иммуносупрессивной терапии, клинических вариантах цитомегаловирусной болезни (ЦМВБ), современных возможностях лабораторной диагностики ЦМВ и их практическом применении. Рассмотрены подходы к профилактике и терапии ЦМВ-ассоциированной патологии, описана этиотропная терапия ЦМВ. Представленный клинический случай ЦМВ-пневмонии у пациентки с лимфомой Беркитта на фоне интенсивной полихимиотерапии демонстрирует сложности в диагностике и лечении этого осложнения и его влияние на успех противоопухолевой терапии.
Введение
В структуре смертности пациентов с онкологическими заболеваниями, которым проводится полихимиотерапия (ПХТ), существенную роль играют инфекционные осложнения. Особо актуальна эта проблема при лечении онкогематологических заболеваний, при которых сама болезнь вызывает значительную иммунодепрессию. По данным некоторых авторов, она может составлять около 30% всех летальных исходов при интенсивной, особенно высокодозовой терапии, и конкурирует со смертностью от основного заболевания.
К сожалению, проблема инфекционных осложнений в онкологической практике в нашей стране остается недооцененной. И если терапии бактериальной инфекции в последнее время уделяется больше внимания, инфекционные осложнения другой этиологии (вирусы, простейшие, грибы) зачастую остаются вне поля зрения клиницистов, хотя именно течение этих инфекций наиболее тяжелое, вызывающее высокий процент летальных исходов и в последнее время выявляемое чаще. Внедрение в практику высокоинтенсивных схем ПХТ, в том числе миелоаблятивных, трансплантация солидных органов и гемопоэтических стволовых клеток увеличила число пациентов с лекарственно-индуцированной иммуносупрессией. С другой стороны, введение в практику алгоритмов антимикробной терапии снизило смертность пациентов от бактериальных инфекций, и они стали «доживать» до развития других, ранее крайне редких инфекций. В обзоре приводятся сведения о механизмах развития, особенностях диагностики, клинике и подходах к лечению цитомегаловирусной инфекции (ЦМВИ). Клинический случай, сопровождающий обзор, призван проиллюстрировать актуальность данной проблемы в повседневной практике врача-онколога, проводящего пациентам цитостатическую терапию.
Этиология, патогенез
ЦМВИ была впервые описана в конце XIX в. под названием «поцелуйная болезнь», так как предполагалось, что заражение происходит через слюну при поцелуях. Истинный же «виновник» цитомегалии — цитомегаловирус (ЦМВ), был открыт только в 1956 г.
ЦМВ представляет собой ДНК-содержащий вирус рода Cytomegalovirus (Cytomegalovirus hominis) семейства Herpesviridae, главной биологической особенностью которого являются его пожизненное персистирование и возможная реактивация в организме инфицированного человека [15, 30]. Кроме того, для ЦМВ характерна тропность к различным органам и тканям и, как следствие, разнообразие клинических проявлений. ЦМВ при внедрении in vivo и in vitro в клетки вызывает их аномалии. Характерным морфологическим признаком клетки, пораженной ЦМВ, является цитомегалия с вирусными включениями в цитоплазме. При микроскопии описывается эффект «глаз совы» (рис. 1). Однако перечисленные морфологические признаки не подтверждают наличие ЦМВИ органа или ткани.
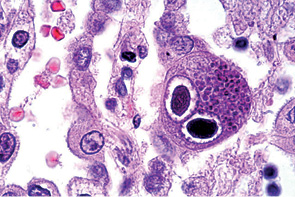
После первичного заражения ЦМВ сохраняется в организме постоянно, находясь в латентной форме в различных тканях и биологических жидкостях. Клиническая манифестация заболевания с возможным развитием тяжелых форм происходит, как правило, у пациентов с иммунодефицитными состояниями, чаще приобретенного характера (например при проведении цитостатической, иммуносупрессивной терапии). Согласно различным опубликованным данным число серопозитивных лиц среди взрослого населения колеблется от 60 до 100% в зависимости от региона и социально-экономических условий жизни [3, 15]. В развивающихся странах инфицирование большей части носителей ЦМВ происходит в детстве, в то время как в развитых до 50% «молодых взрослых» являются ЦМВ-серонегативными [15]. Существенны колебания инфицированности ЦМВ в разных социальных группах. Так, около 60% популяции США являются ЦМВ-позитивными, а в группе риска (например среди мужчин-гомосексуалистов) эта цифра превышает 90% [7, 12, 32].
Клеточный иммунитет является самым важным фактором контроля ЦМВИ в организме. Пациенты с нарушениями клеточного звена иммунитета относятся к группе высокого риска реактивации ЦМВ и развития цитомегаловирусной болезни (ЦМВБ) — инвазивной симптоматической инфекции. Нормальный уровень ЦМВ-специфических CD4+ и CD8+ лимфоцитов имеет решающее значение в устойчивости к развитию первичной инфекции и реактивации ЦМВ. При исследовании пациентов, получивших аллогенную трансплантацию костного мозга (ТКМ), было установлено, что при нарушении развития ЦМВ-специфических CD4+ и CD8+ лимфоцитов повышается риск развития ЦМВ-пневмонии. Но среди реципиентов, получивших инфузию CD8+ лимфоцитов, не описано ни одного случая ЦМВ-пневмонии [29].
Инфицирование ЦМВ происходит при сексуальных контактах с инфицированным человеком, трансплацентарно, при переливании компонентов крови, инфицированных вирусом или при трансплантации органов или костного мозга от серопозитивных доноров. Первичная инфекция у серонегативных индивидуумов сопровождается появлением анти-ЦМВ IgM в течение 4–7 нед после первичного инфицирования (могут персистировать до 20 нед).
Клиника и диагностика
Проявления ЦМВБ разнообразны ввиду отсутствия тропности к какой-либо одной ткани организма. Клинически значимые инфекции развиваются, как правило, у пациентов с иммунодефицитом той или иной степени. У иммунокомпетентных пациентов в течении ЦМВИ в большинстве случаев не отмечают каких-либо проявлений (асимптомная ЦМВИ). У пациентов с различной степенью иммунодефицита ЦМВИ в основном проявляется в виде ЦМВБ. В исследовании J. Kim и соавторов (2011) оценивалась ЦМВИ при трансплантации печени. Отмечено влияние ЦМВБ как фактора риска смертности и отторжения трансплантата у реципиентов и отсутствие такого влияния у больных только с ЦМВИ (виремия) [16].
Риск развития ЦМВБ у пациентов с онкологическими/гематологическими заболеваниями повышается при применении противоопухолевых препаратов, обладающих Т-супрессивным эффектом (например цитарабин, высокие дозы циклофосфамида, метотрексата или кортикостероидов, алемтузумаб, ритуксимаб, флударабин [10, 22, 23]).
ЦМВИ с точки зрения инфекционного процесса имеет 3 основные формы [8].
- первичная инфекция, при которой серонегативный пациент (никогда не имевший контакта с возбудителем) заражается либо при контакте с другим пациентом, имеющим активную инфекцию, или путем передачи крови или тканей с латентной виремией от серопозитивных доноров;
- реактивация, отмечаемая у серопозитивного пациента при нарушении его иммунной системы;
- суперинфекция, возникающая у серопозитивного пациента при инфицировании его от другого пациента; при этом причиной развившейся инфекции является вирус, полученный вновь, а не персистирующий в организме хозяина ранее.
Клинически отличают латентную (бессимптомную) ЦМВИ и ЦМВБ, то есть развитие недостаточности какого-то органа вследствие ЦМВИ. Термин «ЦМВИ» определяется как выявление ЦМВ, его белков или нуклеиновых кислот в биологических жидкостях или тканях организма. ЦМВБ предполагает нарушение функции органа/ткани вследствие воздействия ЦМВ. Основная проблема в диагностике ЦМВБ состоит в выявлении и других патогенов и четком определении их роли в поражении органа/ткани [18].
ЦМВБ может реализовываться непосредственно вследствие поражения тканей организма вирусом или опосредовано через различные механизмы [26]. Прямой повреждающий эффект ЦМВ может проявляться угнетением костного мозга, пневмонией, гепатитом, панкреатитом, колитом, нефритом, энцефалитом, миелитом, нейропатией, ретинитом или увеитом, лихорадкой невыясненного генеза и пр. К основным непрямым эффектам относятся отторжение трансплантата, вторичные бактериальные и грибковые инфекции, ЦМВ-ассоциированный коронарный атеросклероз при трансплантации сердца [13].
ЦМВБ (то есть симптоматическая ЦМВИ) любой локализации проявляется нарушением функции пораженного органа с соответствующей клинико-лабораторной картиной и в общем существенно не отличается от поражения другой этиологии. Однако некоторые клинические особенности органной патологии позволяют внести ЦМВ в список дифференциальной диагностики. Например, цитостатическая терапия препаратами, снижающими уровень CD4+/CD8+ лимфоцитов, тяжелая интерстициальная пневмония, особенно возникшая на фоне адекватной антибактериальной и антимикотической терапии, ЦМВ-позитивный донор при трансплантации костного мозга (особенно если реципиент ЦМВ-негативный) существенно повышают риск развития именно ЦМВ-ассоциированной патологии. По сути, еще до начала противоопухолевой терапии клиницист может оценить степень риска развития ЦМВИ, а при появлении возможных клинических симптомов подтвердить или опровергнуть ЦМВ природу поражения органа или системы.
Смертность, ассоциированная с ЦМВИ, крайне низкая (<1%) у иммунокомпетентных больных. Однако она существенно повышается при ЦМВИ на фоне иммунодефицита и является значимой причиной в структуре смертности. Например, при интерстициальной ЦМВ-пневмонии у пациентов после аллогенной ТКМ смертность варьирует от 15 до 75% [15].
Пневмония, вызванная ЦМВ
Пневмония — одно из самых тяжелых осложнений ПХТ по поводу злокачественных заболеваний у пациентов с нейтропенией [19]. До 60% больных перенесли пневмонию на протяжении курса лечения. В исследовании, проведенном P. Jain и соавторами (2004), среди 104 пациентов с инфильтратами в легких на фоне иммунодефицита у 26% отмечали вирусную инфекцию, при этом основными возбудителями были ЦМВ и вирус простого герпеса [14], а также респираторный интерстициальный вирус [28].
Наиболее типичные признаки ЦМВ-пневмонии — одышка, снижение сатурации O2 крови, лихорадка. Рентгенологически выявляют интерстициальный инфильтрат (симптом «матового стекла»).
Наибольший риск развития ЦМВ-пневмонии (до 50%) отмечают у реципиента при трансплантации легких [32].
ЦМВ-гепатит
Характеризуется повышением уровня билирубина, что может сопровождаться повышением уровня ферментов. Диагноз устанавливается при наличии ЦМВ в материале биопсии печени, других маркеров ЦМВИ, а также при отсутствии других причин гепатита [18].
ЦМВ-гастрит/колит
Проявляется клиникой нарушения соответствующего отдела желудочно-кишечного тракта, поражением слизистой оболочки, выявляемым при эндоскопии при подтверждении ЦМВ-природы патологического процесса. Впервые ЦМВ-колит был описан в 1985 г. у двух гомосексуалистов-мужчин и проявлялся абдоминальной болью и диареей с геморрагией [20]. Выраженное воспаление и васкулит могут приводить к развитию ишемии и трансмурального некроза стенки кишки или желудка и, как следствие, к перфорации и перитониту.
ЦМВ-поражение центральной нервной системы
Диагноз устанавливается при наличии симптомов поражения центральной нервной системы и выявлении ЦМВ в ликворе или в ткани мозга, полученной при биопсии [18].
ЦМВ-ретинит
Высокий риск развития — при уровне CD4+ лимфоцитов <50 клеток/мкл. Является одной из наиболее характерных оппортунистических инфекций при СПИДе. Количество случаев ЦМВ-ретинита сократилось после введения высокоагрессивной антиретровирусной терапии (ВААРТ-терапии), однако ЦМВ-ретинит по-прежнему остается нередкой находкой. У пациентов с ЦМВ-ретинитом прогрессивно ухудшается острота зрения вплоть до развития слепоты при отсутствии терапии. Причем течение процесса может быть моно- или бинокулярным. Для предотвращения рецидива ЦМВ-ретинита необходимо длительное лечение.
ЦМВ-нефрит
Диагностируется при проявлениях почечной недостаточности и выявлении ЦМВ при биопсии почки. Определение ЦМВ в моче у пациентов с ренальной дисфункцией не является подтверждением ЦМВ-природы поражения почек [18].
ЦМВ-синдром
При трасплантации солидных органов определяется как повышение температуры тела >38 °С в течение минимум 2 дней в сочетании с нейтропенией или тромбоцитопенией при выявлении ЦМВ в крови. Применительно к реципиентам трансплантата костного мозга P. Ljungman и соавторы (2002) предлагают избегать данного термина ввиду того, что лихорадку и миелосупрессию могут вызывать и другие вирусы [18].
Реакция «трансплантат против хозяина» (РТПХ)
ЦМВИ может быть ассоциирована с острой РТПХ при аллогенной трансплантации костного мозга. В. Torok-Storb и соавторами (1997) проведено интересное исследование, изучавшее корреляцию генотипа ЦМВ gB 1–4 (вариации гена, кодирующего gB-гликопептид) и выраженности РТПХ [27]. Было установлено, что наличие gB3 и gB4 ассоциировано с более выраженной миелосупрессией и смертностью. Однако фенотип ЦМВИ не влиял на исход трансплантации солидных органов, только микст генотипов gB ассоциирован с удлинением клиренса вируса [21].
Диагностика ЦМВ-этиологии поражения того или иного органа является непростой задачей. ЦМВБ сопровождается неспецифическими симптомами, которые могут быть характерны для поражения какого-либо органа другим возбудителем. В этой ситуации лабораторные методы являются единственным способом верификации ЦМВБ, клинический диагноз ЦМВБ требует обязательного лабораторного подтверждения [9, 15, 17].
Поскольку в организме человека ЦМВ может находиться в латентном состоянии, в состоянии активной репликации, а также быть причиной клинически выраженной патологии (то есть ЦМВБ), целью лабораторного подтверждения ЦМВБ является не установление самого факта наличия ЦМВ в организме пациента, а доказательство этиологической роли ЦМВ в развитии органной патологии. А косвенные признаки активности вируса дают возможность прогнозировать развитие ЦМВБ и вовремя начать терапию.
Для выявления ЦМВ существует ряд методов, которые отличаются своей чувствительностью и специфичностью: цитологические, серологические, вирусологические и их модификации.
Вирусологическое исследование, являющееся золотым стандартом диагностики вирусных заболеваний, из-за трудоемкости и длительности используется редко.
Прямыми маркерами активной репликации ЦМВ являются: вирусемия, выявление ДНК вируса в крови, антигенемия.
Косвенными иммунологическими маркерами ЦМВИ являются сероконверсия (появление анти-ЦМВ IgM и/или низкоавидных анти-ЦМВ IgG у ранее серонегативных лиц), 4-кратное и более повышение титра анти-ЦМВ IgG в парных сыворотках [7]. Но выявление только анти-ЦМВ IgG не позволяет охарактеризовать период заболевания. Поэтому определение авидности анти-ЦМВ IgG существенно повышает ценность данного метода.
Среди методов, определяющих антигены ЦМВ, особое значение имеют иммуноцитохимический и быстрый культуральный (shell vial assay). Ранние и сверхранние вирусные антигены рр65 и рр72 выявляют в лейкоцитах крови только в период репликации вируса. При полуколичественном определении рр65 антигена в клетках крови на возможную манифестацию инфекции указывает наличие 25 и более позитивных клеток в 2·105 лейкоцитах [4, 5]. Появление в крови вирусного белка рр65 или/и главного белка сверхранней фазы репликации IE1 предшествует клиническим симптомам ЦМВИ, поэтому эти маркеры имеют определенное прогностическое значение. Недостатками указанных методов являются низкая специфичность при использовании поликлональных антител, высокая стоимость при использовании моноклональных антител, данные методики уступают по чувствительности молекулярным методам выявления возбудителя (ДНК ЦМВ), кроме того, не определяется точное количественное содержание возбудителя в биологической жидкости.
На сегодня в практике лабораторной диагностики активной ЦМВИ все большее внимание уделяется методикам, основанным на полимеразной цепной реакции (ПЦР), которая дает возможность прямого качественного и количественного выявления ДНК возбудителя в биологических жидкостях и тканях [6]. Последние годы ознаменовались подтверждением преимуществ метода ПЦР в лабораторной диагностике ЦМВ. Достоверным критерием высокой активности ЦМВ, доказывающим его этиологическую роль в развитии тех или иных клинических синдромов, служит титр ДНК ЦМВ, равный 1:1000 и более в 105 лейкоцитах крови [30, 31].
Определение ДНК ЦМВ в крови методом ПЦР имеет и большое прогностическое значение. Постепенное повышение уровня ДНК ЦМВ в лейкоцитах крови и плазме опережает развитие клинической симптоматики. С каждым повышением концентрации ДНК ЦМВ в плазме на 1,0 lg риск развития ЦМВБ возрастает в 3 раза. Выявление высокой концентрации ДНК ЦМВ в лейкоцитах крови или плазме требует безотлагательного начала этиотропной терапии. [3, 9, 25].
Таким образом, каждый из указанных методов имеет свои недостатки и преимущества. Серологические тесты не могут использоваться для диагностики активной инфекции. Культуральный метод нецелесообразен для клинических целей. Быстрый культуральный метод (shell vial assay) имеет низкую чувствительность. Выявления антигена рр65 — чувствительный и специфический метод диагностики. Real-time ПЦР более чувствительный и специфичный метод (для ранней диагностики), чем определение рр65 антигена, и это более надежный маркер мониторинга клиренса виремии [2, 9, 25, 30].
Лечение ЦМВ-ассоциированных болезней
Так как развитие ЦМВИ и ЦМВБ наиболее часто отмечают при ТКМ и трансплантациях солидных органов, подходы к проблеме ЦМВ наиболее разработаны для этой группы пациентов. Для других групп больных, получающих цитостатическую/иммуносупрссивную терапию по поводу онкологических заболеваний, основные существующие международные руководства по лечению инфекций либо не содержат рекомендаций о ЦМВ (Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer, IDSA), либо крайне лаконичны и оговаривают лишь некоторые клинические ситуации (Prevention and Treatment of Cancer-Related Infections Guidelines, NCCN). Одним из самых дискутируемых вопросов является сравнение эффективности профилактики и терапии болезней, вызванных ЦМВ.
При этом под терапией подразумевают упреждающую, или превентивную, (pre-emptive) терапию, направленную на предотвращение развития ЦМВБ.
С одной стороны, профилактическое назначение препаратов против ЦМВ может предотвратить развитие ЦМВБ при иммунодефиците, однако существенно повышает токсичность терапии, ее стоимость. Кроме того, риск развития ЦМВБ существенно зависит от клинической ситуации (ЦМВ-статус донора и реципиента, тип трансплантации, степень HLA-совместимости и пр.). В настоящее время не достигнут консенсус в оценке преимущества ЦМВ-профилактики или терапии. Обсуждая профилактику ЦМВ, следует отметить важную роль тщательного контроля переливаемых компонентов крови и применение антилейкоцитарных фильтров IV поколения [1].
Руководство по лечению и профилактике инфекций у онкологических пациентов (NCCN, 2013) рекомендует проводить профилактику реактивации ЦМВ или ЦМВБ при аллогенной трансплантации гемопоэтических стволовых клеток и при терапии алемтузумабом. Во всех остальных случаях показаны превентивная терапия или лечение развившейся ЦМВБ.
Препаратами выбора для лечения и профилактики ЦМВБ являются ганцикловир и валганцикловир. Другие противовирусные препараты — фоскарнет или цидофовир — препараты второй линии.
Ганцикловир (Ganciclovir) — синтетический аналог гуанина. Ингибирует репликацию ЦМВ. Его противовирусный эффект обусловлен образованием в пораженных вирусом клетках ганцикловиртрифосфата, нарушающего синтез ДНК вируса в результате конкурентного ингибирования ДНК-полимеразы и прямого включения в вирусную ДНК (последнее прекращает ее элонгацию). Профилактически назначается в дозе 5–6 мг/кг массы тела в/в каждые 12 ч 5 дней в неделю на необходимый период. С лечебной целью ганцикловир назначается в дозе 5 мг/кг массы тела в/в каждые 12 ч в течение 14 дней. При отсутствии детекции вируса в организме терапия прекращается. Если ЦМВ по-прежнему выявляют в биологических жидкостях, продолжают лечение ганцикловиром еще в течение 1–2 нед.
Валганцикловир (Valganciclovir) — пролекарство, L-валиловый эфир ганцикловира, после приема внутрь превращающийся в ганцикловир под действием кишечных и печеночных эстераз. Профилактически назначается в дозе 900 мг ежедневно. Лечебная доза — 900 мг 2 раза в сутки ежедневно в течение 2 нед. Рассматривается также дополнительное назначение валганцикловира 900 мг внутрь на протяжении 7 дней после негативного серологического исследования.
Основным побочным эффектом ганцикловира и его пролекарства является угнетение гранулоцитарного ростка кроветворения.
Фоскарнет (Focarnet), фосфономуравьиная кислота, также используется для профилактики и лечения ЦМВИ, в том числе вызванной штаммами ЦМВ, устойчивыми к ганцикловиру. Превентивная терапия предусматривает введение препарата в дозе 60 мг/кг массы тела 3 раза в сутки 14 дней; поддерживающая терапия — 90–120 мг/кг массы тела в сутки в одно введение. Фоскарнет следует назначать с осторожностью при нарушении функции почек, что связано с выраженным нефротоксичным эффектом.
Цидофовир (Cidofovir), фосфонометиловый эфир цитозина, ингибирует репликацию ЦМВ путем избирательного подавления синтеза вирусной ДНК. Продемонстрировал высокую эффективность при лечении ЦМВ-ретинита у больных ВИЧ/СПИДом. Может применяться в качестве терапии ЦМВ-пневмонии, в том числе вызванной штаммами, резистентными к ганцикловиру и фоскарнету (особенно если ранее проводилась профилактика данными препаратами). С целью профилактики препарат назначается в дозе 5 мг/кг массы тела внутривенно через каждые 7 дней. Одновременное введение пробенецида замедляет выведение цидофовира и существенно снижает нефротоксичность последнего. Лечебная доза цидофовира составляет 5 мг/кг массы тела через неделю на протяжении 2 нед с последующим переходом на введение с 2-недельным интервалом.
Анти-ЦМВ иммуноглобулин (ЦМВ-Ig). ЦМВ-Ig представляет собой фармацевтический препарат иммуноглобулина, полученный от здоровых доноров с высокими титрами ЦМВ. Его введение обеспечивает повышение титра анти-ЦМВ антител. ЦМВ-Ig применяется, как правило, в сочетании с перечисленными выше противовирусными препаратами. Наиболее часто применяется для лечения пневмонии, вызванной ЦМВ, в сочетании с ганцикловиром.
Клинический случай
Пациентка С., 38 лет, поступила в отделение онкогематологии Национального института рака с жалобами на опухолевое образование шеи справа, слабость, парестезии правой руки, головную боль, двоение в глазах. Диагноз: лимфома Беркитта, IVА стадия. Пораженные области: лимфатические узлы шеи справа с массивным прорастанием грудинно-сосцевидной мышцы и слюнной железы, очаговое поражение головного мозга. Поражение костного мозга не выявлено, однако в гемограмме исходно отмечена тромбоцитопения II–III степени. Диагностирован кандидоз ротовой полости на фоне иммуносупрессии из-за основного заболевания и длительного предшествующего приема глюкокортикостероидов.
После проведения циторедуктивной фазы химиотерапии для профилактики синдрома лизиса опухоли (циклофосфамид, преднизолон) с параллельной терапией кандидоза (флуконазол) начата терапия по протоколу GMALL-B-ALL/NHL 2002. Первый блок включал ритуксимаб, высокие дозы дексаметазона, винкристин, ифосфамид, высокодозовый метотрексат, цитарабин, этопозид.
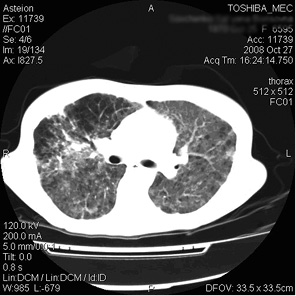
Токсичность по СТС АЕ: стоматит III степени, гематологическая (нейтропения и тромбоцитопения IV степени), фебрильная нейтропения (ФН). Начата терапия ФН согласно общепринятым алгоритмам, вводился Г-КСФ 5 мкг/кг/сут. При выходе из нейтропении диагностированы респираторный дистресс-синдром, отек легких, выраженная дыхательная недостаточность (частота дыхания — до 40/мин, SpO2 85%). При проведении компьютерной томографии выявлены признаки интерстициальной пневмонии (рис. 2). На фоне модификации антибактериальной и противогрибковой терапии сохранялась лихорадка. Методом ПЦР в крови дважды выявлен ЦМВ. Диагностирована ЦМВ-пневмония. Бронхоскопия для подтверждения ЦМВ-инфекции легких ввиду крайне тяжелого состояния пациентки не проводилась. Начата терапия ганцикловиром в дозе 5 мг/кг массы тела каждые 12 ч, состояние пациентки начало улучшаться вплоть до полной редукции признаков дыхательной недостаточности. На фоне терапии ганцикловиром развилась нейтропения IV степени, терапия ганцикловиром прерывалась, вводились Г-КСФ.
После получения двукратно отрицательного результата ПЦР ЦМВ начат второй блок химиотерапии (ритуксимаб, высокие дозы дексаметазона, винкристин, циклофосфамид, высокодозовый метотрексат, доксорубицин) на 31-й день, позже запланированного.
Осложнения при терапии: стоматит III степени, гематологическая (нейтропения и тромбоцитопения IV степени, анемия III степени), фебрильная нейтропения, гастроинтестинальная — диарея 3-й степени. Гипербилирубинемия до 73 мкмоль/л (за счет конъюгированного до 63 мкмоль/л) на фоне субнормального уровня других биохимических печеночных маркеров расценена как токсический внутрипротоковый холестаз. Выявлен ЦМВ в крови (ПЦР). Доминирующим в клинической картине был энтерит, в связи с чем пациентка получала полное парентеральное питание в соответствии с энергопотребностями в течение 14 дней, потом частичное (6 дней), морфин по поводу мукозита. Также проводились трансфузии компонентов крови, эмпирическая противомикробная терапия. Масса тела снизилась на 7 кг от исходной (12%). Диагностирована реактивация ЦМВ (положительный анализ методом ПЦР в крови), возобновлена терапия ганцикловиром. На фоне противовирусной терапии отмечалась положительная динамика течения энтерита, что было расценено как косвенный признак его ЦМВ-природы. Реактивация ЦМВИ, противовирусная терапия, ухудшение соматического состояния пациентки существенно задержали продолжение ПХТ, что при сверхагрессивной лимфоме оказалось фатальным — у пациентки диагностирована прогрессия лимфомы, приведшая к ее гибели.
Выводы
ЦМВ-инфекция и болезнь не являются часто диагностируемой проблемой у пациентов со злокачественными заболеваниями при проведении цитостатической терапии. Однако при развитии ЦМВБ у пациентов с той или иной степенью иммунодефицита летальность, ассоциированная с данным вирусом, может достигать 80%.
Диагностика ЦМВ остается сложной задачей ввиду того, что подтверждение ЦМВБ требует инвазивных процедур, которые часто либо недоступны в клинике, либо невыполнимы из-за тяжелого состояния пациента. Выявление ЦМВ в организме не является достаточным фактом, подтверждающим ЦМВ-природу поражения какого-либо органа.
ЦМВ-пневмония трудно поддается лечению даже при наличии современных противовирусных препаратов. Так, уровень смертности среди пациентов с ЦМВ-пневмонией у пациентов после ТКМ составляла около 85% до внедрения в практику ганцикловира и ЦМВ-специфического иммунного глобулина. После введения этих препаратов в практику смертность снизилась до 15–75% [24].
Оптимальной, на наш взгляд, является тактика, включающая оценку риска планируемой терапии, при высоком риске — проведение инициальной оценки инфекционного статуса пациента (не только ЦМВ) для более адекватного проведения эмпирической противомикробной терапии. На фоне терапии необходим мониторинг ЦМВ и быстрое начало терапии при подтверждении его реактивации. Однако, необходима тщательная дифференциальная диагностика органной патологии другой этиологии, особенно при невозможности гистологического подтверждения поражения ЦМВ. Терапия ЦМВИ и ЦМВБ должна проводиться наиболее активными в отношении ЦМВ препаратами.
Список использованной литературы
1. Румянцев А.Г., Масчан А.А. (2003) Трансплантация гемопоэтических стволовых клеток у детей. М., МИА: 910 с.
2. Allice T. et al. (2008) Evaluation of a novel real-time PCR system for cytomegalovirus DNA quantitation on whole blood and correlation with pp65-antigen test in guiding pre-emptive antiviral treatment. Journal of Virological Methods. Volume 148, Issues 1–2, March: 9–16.
3. Boeckh M. et al. (2011) Complications, Diagnosis, Management, and Prevention of CMV Infections: Current and Future. ASH Education Book December 10, vol. 2011, № 1: 305–309.
4. Boeckh M. et al. (2004) Optimization of quantitative detection of cytomegalovirus DNA in plasma by real-time PCR. J. Clin. Microbiol.; 42:1 142–1148.
5. Boivin G., Belanger R. et al. (2000) Quantitative analysis of cytomegalovirus (CMV) viremia using the pp65 antigenemia assay and the cobas amplicor CMV monitor PCR test after blood and marrow allogeneic transplantation. J. Clin. Microbiol.; 38: 4356–4360.
6. Bravo D. et al. (2011) Comparative Evaluation of Three Automated Systems for DNA Extraction in Conjunction with Three Commercially Available Real-Time PCR Assays for Quantitation of Plasma Cytomegalovirus DNAemia in Allogeneic Stem Cell Transplant Recipients J. Clin. Microbiol. August, 49, 8: 2899–2904.
7. Collier A.C., Meyers J.D., Corey L. et al. (1987) Cytomegalovirus infection in homosexual men. Relationship to sexual practices, antibody to human immunodeficiency virus, and cell-mediated immunity. Am. J. Med., Mar 23; 82 (3 Spec No): 593–601.
8. Heuman Douglas M. Cytomegalovirus Colitis. http://emedicine.medscape.com/ article/ 173151-overview
9. Florescu D.F., Kalil A.C. (2011) Cytomegalovirus infections in non-immunocompromised and immunocompromised patients in the intensive care unit. Infect. Disord. Drug Targets, Aug;11(4): 354–64.
10. Gallamini A., Zaja F., Patti C. et al. (2007) Alemtuzumab (Campath-1H) and CHOP chemotherapy as fi rst-line treatment of peripheral T-cell lymphoma: results of a GITIL (Gruppo Italiano Terapie Innovative nei Linfomi) prospective multicenter trial. Blood; 110: 2316–23.
11. Gracia-Ahufinger I. et al. (2010) Differences in cytomegalovirus plasma viral loads measured in allogeneic hematopoietic stem cell transplant recipients using two commercial real-time PCR assays. Journal of Clinical Virology. Volume 48, Issue 2, June: 142–146.
12. Guinan M.E., Thomas P.A., Pinsky P.F. et al. (1984) Heterosexual and homosexual patients with the acquired immunodeficiency syndrome. A comparison of surveillance, interview, and laboratory data. Ann. Intern. Med. Feb.;100 (2): 213–8.
13. Hubel K., Hegener K., Schnell R. et al. (1999) Suppressed neutrophil function as a risk factor for severe infection after cytotoxic chemotherapy in patients with acute nonlymphocytic leukemia. Ann. Hematol.; 78: 73–77.
14. Jain P., Sandur S., Meli Y. et al. (2004) Role of fl exible bronchoscopy in immunocompromised patients with lung infi ltrates. Chest; 125: 712–22.
15. Kauser Akhter, MD (2011) Cytomegalovirus Medscape //Updated: Aug 17.
16. Kim J.M., Kim S.J., Joh J.W. et al. (2011) Is cytomegalovirus infection dangerous in cytomegalovirus-seropositive recipients after liver transplantation? Liver Transpl. Apr; 17(4): 446–55.
17. Lasarotto T. et al. (2010) The Best Practices for Screening, Monitoring, and Diagnosis of Cytomegalovirus Disease, Part I. Clinical Microbiology Newsletter, January;
Volume 32, Issue 1: 1–6.
18. Ljungman P., Griffiths P., Paya C. (2002) Definitions of cytomegalovirus infection and disease in transplant recipients. Clin Infect Dis. Apr. 15; 34(8):1094–7.
19. Maschmeyer G., Link H., Hiddemann W. et al. (1994) Pulmonary infi ltrations in febrile patients with neutropenia: risk factors and outcome under empirical antimicrobial therapy in a randomized multicenter study. Cancer; 73: 2296–304.
20. Meiselman M.S., Cello J.P., Margaretten W. (1985) Cytomegalovirus colitis. Report of the clinical, endoscopic, and pathologic findings in two patients with the acquired immune deficiency syndrome. Gastroenterology, Jan; 88 (1 Pt 1): 171–5.
21. Manuel O., Asberg A., Pang X. et al. (2009) Impact of genetic polymorphisms in cytomegalovirus glycoprotein B on outcomes in solid-organ transplant recipients with cytomegalovirus disease. Clin. Infect. Dis. Oct. 15; 49(8): 1160–6.
22. Nquyen Q., Estey E., Raad I. et al. (2001) Cytomegalovirus pneumonia in adults with leukemia: an emerging problem. Clin. Infect. Dis.; 32: 539–45.
23. Nguyen D.D., Cao T.M., Dugan K. et al. (2002) Cytomegalovirus viremia during Campath-1H therapy for relapsed and refractory chronic lymphocytic leukemia and prolymphocytic leukemia. Clin. Lymphoma; 3: 105–10.
24. Reed E.C., Bowden R.A., Dandliker P.S. (1988) Treatment of cytomegalovirus pneumonia with ganciclovir and intravenous cytomegalovirus immunoglobulin in patients with bone marrow transplants. Ann. Intern. Med. Nov. 15; 109(10): 783–8.
25. Reinhard B. Raggam et al. (2010) Rapid quantitation of cytomegalovirus DNA in whole blood by a new molecular assay based on automated sample preparation and real-time PCR. Medical Microbiology and Immunology . Volume 199, Number 4: 311–316.
26. Rubin R.H. (1989) The indirect effects of cytomegalovirus infection on the outcome of organ transplantation. JAMA. Jun. 23–30; 261(24): 3607–9.
27. Torok-Storb B., Boeckh M., Hoy C. (1997) Association of specific cytomegalovirus genotypes with death from myelosuppression after marrow transplantation. Blood. Sep. 1; 90(5): 2097–102.
28. Vento S., Cainelli F., Temesgen Z. (2008) Lung infections after cancer chemotherapy. Lancet Oncol.; 9: 982–92.
29. Walter E.A., Greenberg P.D., Gilbert M.J. (1995) Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N Engl J Med. Oct 19; 333(16): 1038–44.
30. Watzinger F., Ebner K. et al. (2006) Detection and monitoring of virus infections by real-time PCR. Mol Aspects Med. Apr.-Jun.; 27(2–3): 254–98. Epub 2006, Feb. 14.
31. Yerly S. et al. (2007) Cytomegalovirus quantification in plasma by an automated real-time PCR assay Journal of Clinical Virology, April, Volume 38, Issue 4: 298–303.
32. Zhang L.J., Hanff P., Rutherford C. et al. (1995) Detection of human cytomegalovirus DNA, RNA, and antibody in normal donor blood. J. Infect. Dis. Apr; 171(4): 1002–6.
Цитомегаловірусна інфекція у гематологічних та онкологічних пацієнтів, що отримують цитостатичну терапію (огляд і клінічний випадок)
Резюме. В огляді наведено відомості про роль цитомегаловірусу (ЦМВ) у розвитку органної патології у пацієнтів на тлі цитостатичної й імуносупресивної терапії, клінічних варіантах цитомегаловірусної хвороби (ЦМВХ), сучасні можливості лабораторної діагностики ЦМВ та їх практичне застосування. Розглянуто підходи до профілактики та терапії ЦМВ-асоційованої патології, описана етіотропна терапія ЦМВ. Наведено клінічний випадок ЦМВ-пневмонії у пацієнтки з лімфомою Беркітта під час інтенсивної поліхіміотерапії демонструє складність діагностики та лікування цього ускладнення і його вплив на успіх протипухлинної терапії.
Ключевые слова: цитомегаловірус, ЦМВ, інтерстиціальна пневмонія, цитомегаловірусна інфекція, цитомегаловірусна хвороба, лімфома, поліхіміотерапія.
Cytomegalovirus infection in hematology and oncology patients receiving cytotoxic therapy (review and case report)
Summary. This review presents data of role of cytomegalovirus (CMV) in the organ pathology development in patients receiving cytostatic and immunosuppressive therapy, clinical variants of cytomegalovirus disease (CMVD), the modern possibilities of laboratory diagnosis of CMV and their practical application. Review considers approaches to the prevention and treatment of CMV-associated disease, describes etiological therapy of CMV. Clinical case of CMV pneumonia in a patient with Burkitt’s lymphoma on a background of intensive chemotherapy demonstrates the difficulties in diagnosis and treatment of this complication and their impact on the success of chemotherapy.
Key words: cytomegalovirus, CMV, interstitial pneumonia, cytomegalovirus infection, cytomegalovirus disease, lymhoma, chemotherapy.














Leave a comment