Стереотаксична біопсія в диференційній діагностиці лімфом головного мозку
Зинкевич Я.П., Цимбалюк В.И. , Главацкий А.Я. , Костюк К.Р. , Болюх А.А. , Попов А.А. , Шевелёв М.Н. , Пилипас Л.Ю.
Резюме. Проведено оцінку клініко-діагностичних особливостей 31 випадку лімфом головного мозку, діагностованих шляхом стереотаксичної біопсії. Діагноз верифіковано гістологічно, проведено імунофенотипування. Проаналізовано роль стереотаксичної біопсії у своєчасній діагностиці лімфом та вплив на тривалість безрецидивного періоду.
Резюме. Проведена оценка клинико-диагностических особенностей 31 случая лимфом головного мозга, диагностированных путем стереотаксической биопсии. Диагноз верифицирован гистологически, проведено иммунофенотипирование. Проанализирована роль стереотаксической биопсии в своевременной диагностике лимфом и влияние на продолжительность безрецидивного периода.
Введение
Лимфома центральной нервной системы (ЛЦНС) является редкой формой неходжкинских лимфом, возникающей в ЦНС. Поражение головного мозга может быть как первичным, в случае исходного развития лимфопролиферативного процесса в ЦНС (первичные ЛЦНС — ПЛЦНС), так и вторичным, за счет вовлечения невральных структур при метастазировании (генерализации) лимфом [1, 10, 15]. ПЛЦНС макроскопически характеризуется очаговыми образованиями в полушариях головного мозга, обычно в базальных ганглиях, мозолистом теле, перивентрикулярно, в 35% случаев отмечают мультифокальный рост опухоли [4]. Метастатическое распространение системной лимфомы в паренхиму мозга (вторичная лимфома) регистрируют в 1–7% аутопсийных случаев, по одним данным [2], и до 9% — по данным других авторов [3]. Вторичное поражение ЦНС при системной лимфоме чаще характеризуется вовлечением в процесс мозговых оболочек, черепномозговых нервов и спинномозговых нервных корешков, инвазией субарахноидального пространства и распространением лимфоидных клеток в структуры нервной системы [5]. Основными клиническими формами и первичных, и вторичных лимфом ЦНС считаются: 1) одиночные или множественные внутримозговые узлы; 2) диффузная менингеальная или перивентрикулярная инфильтрация (лептоменингеальная форма); 3) инфильтрация сетчатки или стекловидного тела — может предшествовать паренхиматозной или менингеальной опухоли или следовать за ними; 4) спинальная форма [4].
Исследования по поводу ЛЦНС ведутся на протяжении 80 лет, однако настоящий интерес к ней возник в последние годы. ПЛЦНС была впервые описана Bailey в 1929 г. как периваскулярная саркома [1]. Прежнее название ПЛЦНС — ретикулоклеточная саркома, а в ряде случаев ее относили к микроглиомам [6]. Усовершенствованные диагностические методики позволили окончательно установить лимфоидную природу ПЛЦНС.
Частота выявляемости ПЛЦНС составляет приблизительно от 0,3% до 1–3% от всех первичных опухолей мозга, 1% — от всех лимфом и около 10–12% — от всех экстранодальных лимфом, занимая 2-е место после лимфом желудка [16, 17, 19]. Согласно современным данным, заболеваемость в США составляет 5 случаев на 1 млн населения. Известные в других странах данные о заболеваемости существенно не отличаются от вышеуказанных (5–7,5 случая на 1 млн населения). Наиболее часто лимфомы диагностируют у пациентов с ослабленным иммунитетом, а также у больных с синдромом приобретенного иммунодефицита (СПИД) [16, 18]. Большинство последних работ подтверждают факт повышения частоты возникновения ПЛЦНС среди больных без иммунодефицита [7, 11]. По данным Программы по надзору, эпидемиологии и результатам лечения (The Surveillance, Epidemiology, and End Results Program — SEER) Национального института рака США (National Cancer Institute), количество случаев ПЛЦНС увеличилось втрое за период с 1973–1975 по 1982–1984 гг. Дальнейший анализ показал десятикратное или даже большее увеличение числа ПЛЦНС в интервале 1973–1992 гг. [8, 11]. Соотношение заболеваемости у иммунокомпетентных мужчин и женщин составляет 1,2–2,1. Среди ВИЧ-инфицированных пациентов 95% — мужчины (7:1 соответственно) [9, 11]. ПЛЦНС может возникать у пациентов всех возрастов, но чаще — в возрасте 60 лет и старше [12]. ЛЦНС диагностируют у 1–10% ВИЧ-инфицированных лиц, больных СПИДом, а в 0,6% случаев является его первым проявлением.
До начала применения высокоактивной антиретровирусной терапии число случаев развития ПЛЦНС у ВИЧ-инфицированных лиц постоянно росло. Данная схема лечения, влияя на количество CD4-клеток, может снижать частоту возникновения ПЛЦНС, поскольку вероятность ее развития обратно пропорциональна числу CD4-клеток. Множество онкологических и гематологических центров по всему миру изучают проблему ПЛЦНС, однако из-за редкости ПЛЦНС в популяции до сих пор нет ни одного рандомизированного исследования. В Украине данный диагноз практически не устанавливают, соответственно, не существует эпидемиологических данных [11].
В зависимости от характеристик клеточного состава все лимфоидные новообразования (новообразования, вовлекающие ростки лимфопоэза) разделяют на B-клеточные (85%) и Т-клеточные (15%) [13, 15]. Зрелые В- и Т-клеточные лимфомы называют «неходжкинскими лимфомами». Выделяют более 20 разновидностей Т-клеточных и 30 — В-клеточных неходжкинских лимфом. Из В-зрелоклеточных лимфом наиболее распространенной является В-крупноклеточная лимфома (30% от всех случаев неходжкинских лимфом) [14, 15, 21].
Материалы и методы исследования
С декабря 2005 г. по июнь 2013 г. с целью дифференциальной диагностики гистологической природы очаговых поражений головного мозга в Институте нейрохирургии им. акад. А.П. Ромоданова выполнено 461 стереотаксическую биопсию. В 31 случае диагностирована лимфома головного мозга, что составило 6,72% от общего количества пациентов. Среди пациентов было 14 (45,16%) женщин и 17 (54,83%) мужчин, соотношение 1:1,2 соответственно. Возраст пациентов — от 20 до 68 лет, медиана — 46,4 года. Время от появления первых симптомов заболевания до установления диагноза составило от 2 нед до 12 мес, в среднем — 2,6 мес.
Результаты и их обсуждение
Клинико-неврологические и нейрорадиологические данные были проанализированы ретроспективно. Специфических клинических проявлений не выявлено, симптоматика зависела от локализации очагового поражения. Общее клиническое состояние больных оценивали по шкале Карновского. В удовлетворительном состоянии (100–80 балов) было 13 (42%) пациентов, средней степени тяжести (70–50 балов) — 18 (58%) больных, тяжелых больных в наших наблюдениях не было. Сочетание общемозговой и очаговой симптоматики констатировано у большинства пациентов — 13 (41,93%). Только общемозговые симптомы зарегистрированы у 11 (35,48%), изолировано очаговый неврологический дефицит выявлен у 5 (16,12%) больных, и в 2 (6,45%) случаях диагностированы симптоматические эпилептические приступы.
В нейрохирургической практике основные трудности диагностики экстранодальных лимфом связаны с отсутствием достоверных клинических признаков лимфомы по данным неинвазивных методов исследования. Имеющиеся на сегодня методы нейровизуализации не удовлетворяют требованиям диагностики с абсолютной достоверностью, однако имеются определенные интраскопические особенности лимфом головного мозга. Дооперационные нейровизуализирующие исследования были выполнены во всех случаях. Компьютерную томографию (КТ; Brilliance, 64 slice) и магнитно-резонансную томографию (МРТ; Philips Intera, 1,5 Tl) проводили с внутривенным введением контрастного вещества. МРТ проводили по стандартному протоколу в 3 проекциях и в 3 режимах с получением Т1-, Т2-взвешенных изображений и FLAIR. Полученные данные (КТ, МРТ) использовали для планирования координат мишени биопсии и траектории хода биоптера. В 3 случаях мы применяли данные КТ в режиме перфузии (с целью определения объема крови, протекающей через опухоль, с последующей оценкой степени анаплазии, дифференциальной диагностики, определения оптимальной зоны биопсии), а также магнитно-резонансной спектроскопии (для оценки метаболизма опухоли и установления степени анаплазии, дифференциальной диагностики, выбора мишени для биопсии). По данным нейровизуализации, в 21 (67,74%) случае очаговое образование было единичным солидным, в 10 (32,26%) — множественным (рис. 1).
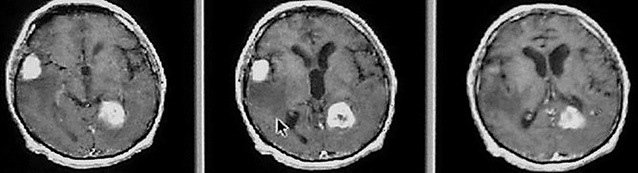
Новообразования в 14 (45,16%) наблюдениях локализовались в подкорковых структурах головного мозга (базальные ганглии), в 11 (35,48%) — различных отделах мозолистого тела с двусторонним распространением и в 6 (19,35%) случаях — височно-медианных отделах мозга. Нами отмечена тенденция к распространению образований к средней линии мозга, что согласуется с данными литературы [10]. По данным КТ, очаговое поражение в 43% было изоденсивным, в 42% — гиперденсивным и в 15% — гиподенсивным. Умеренно выраженный перифокальный отек регистрировали во всех наблюдениях, кист и кальцинатов не выявлено. По результатам МРТ на Т1-взвешенных изображениях 86% очаговых образований были гипоинтенсивными, 14% — изоинтенсивными. В Т2-режиме 82% очаговых поражений были гиперинтенсивными, 18% — изоинтенсивными. Накопление парамагнетика в 15 (48,38%) случаях было интенсивным однородным (рис. 2), в 6 (19,35%) — неинтенсивным фрагментарным (рис. 3), в 5 (16,12%) — интенсивным неоднородным и в 2 (6,45%) отмечали кольцевидный тип контрастирования (рис. 4).

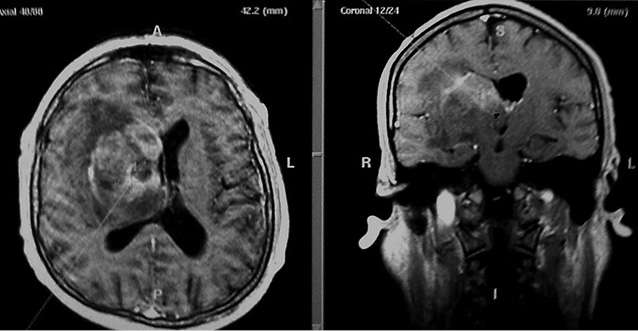
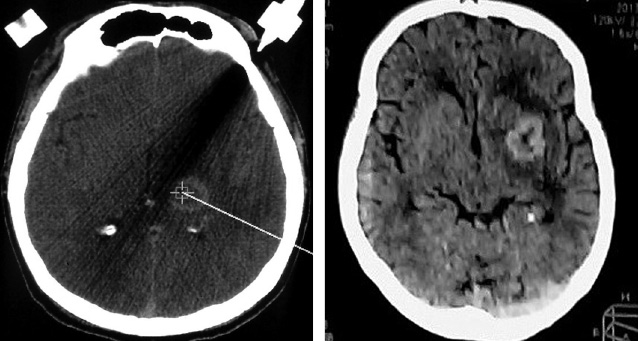
Анализируя показатели КТ-перфузии, мы выявили значительное увеличение среднего времени транзита крови во всех наблюдениях, в 2 случаях (при вторичной лимфоме) отмечено снижение показателей скорости кровотока (CBF) и объема кровотока (CBV) в сравнении с контралатеральными участками мозга. Напротив, при первичной лимфоме отмечена гиперперфузия (показатели CBF и CBV — повышены) (рис. 5).
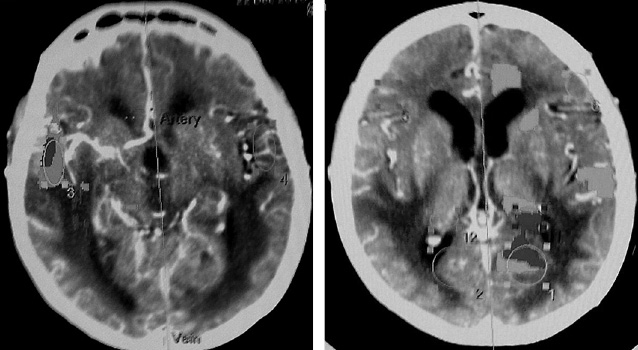
Согласно данным магнитно-резонансной спектроскопии, при среднем эхо (135 мс) определено значительное повышение концентрации холина, снижение концентрации креатина и значительное снижение концентрации N-ацетиласпартата. Оценку содержания метаболитов проводили в опухолевом узле, в зоне измененной паренхимы и в зоне перифокального отека. Полученную информацию использовали для определения оптимальной зоны биопсии. Целью проведения стереотаксической биопсии была гистологическая верификация лимфомы и дифференциальная диагностика с очаговыми поражениями иного происхождения. Дифференциальную диагностику проводили с глиальными опухолями мозга различной степени злокачественности, при множественном поражении с метастатичесими опухолями, воспалительными процессами бактериальной, вирусной природы, токсоплазменным энцефалитом на фоне ВИЧ-инфекции.
Координаты мишени биопсии и траекторию хода биоптера вычисляли с помощью стереотаксической системы CRW («Radionics», США) с использованием программ StereoFusion, Stereoplan, Stereocalc. Забор биологической ткани производили с использованием биопсийной иглы Nashold. В одном случае выполнена повторная биопсия. При однородной сруктуре очагового образования биопсию проводили в его центральной зоне (участки максимального накопления контрастного вещества). При неоднородной структуре очага (фрагментарное контрастирование) выполняли серийную биопсию, а траекторию хода биопсийной иглы рассчитывали так, чтобы она проходила наибольшее количество неоднородных по структуре участков новообразования. При симметричной локализации, с двусторонним рапространением опухоли, манипуляцию проводили со стороны недоминантной гемисферы. У пациентов с выраженной латерализацией процесса биопсию применяли с соответствующей стороны. Послеоперационных осложнений и летальности не было.
Новообразования гистологически верифицированы во всех случаях. Гистологический диагноз злокачественной лимфомы головного мозга (9590/3) устанавливали на основании микроскопического исследования в соответствии с патоморфологической классификацией ВОЗ опухолей ЦНС 2007 года [20].
У 13 (41,9%) пациентов верифицировать процесс не представлялось возможным в силу ряда объективных причин. В 41,9% случаев возникала необходимость дифференциального диагноза воспалительного процесса и лимфомы, что, прежде всего, связано с недостаточной репрезентативностью полученных образцов, разницей в структуре тканей, взятых из различных зон. С целью подтверждения гистологического диагноза лимфомы и определения ее фенотипа выполнено иммуногистохимическое исследование в 20 (64,5%) случаях. Иммуногистохимическое исследование (панель определяли после предварительного морфологического анализа) проводили с использованием стандартного комплекса стрептавидин-биотина и пероксидазы моноклональных антител в отработанных рабочих растворах. Для подтверждения диагноза лимфомы использовали специфичные иммуногистохимические маркеры CD20, CD45 и CD79a.
Первичная лимфома головного мозга диагностирована в 26 (83,87%) случаях, вторичная лимфома — 5 (16,13%). У большинства пациентов (64,5%) диагностирована неходжкинская B-крупноклеточная лимфома, в 35,5% случаев иммунофенотипирование не проводили. У 3 (9,67%) пациентов первичная лимфома головного мозга выявлена на фоне ВИЧ-инфицирования. В послеоперационный период всем пациентам назначали кортикостероиды — дексаметазон 16–24 мг. После подтверждения диагноза лимфомы головного мозга всех больных направляли на лечение к онкогематологам, а в случаях наличия ВИЧ — и к инфекционистам. В условиях специализированого отделения проводили лучевую терапию в дозе 10–64 Гр, а также курсы полихимиотерапии или же монохимиотерапии метотрексатом или темозоломидом (Темодал®) в конкоминантных и адъювантных режимах. В 2 случаях лечение дополнено антиретровирусной терапией. Катамнез известен у 12 (38,7%) больных в возрасте от 1 до 42 мес. Контроль осуществляли с учетом клинико-неврологического осмотра, шкалы Карновского и данных нейровизуализации. При контрольном осмотре общее состояние больных характеризовалось как >80 баллов по шкале Карновского, в неврологическом статусе регистрировали жалобы на периодически возникающую общемозговую симптоматику, при контрольном выполнении МРТ с внутривенным усилением данных о наличии очаговых изменений не получено (рис. 6).
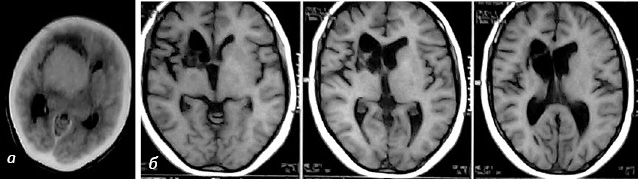
Средняя продолжительность безрецидивного периода составила 13,75 мес.
Выводы
Проанализировав наш материал и данные литературы, мы сделали следующие выводы:
1. Клиническая картина этой онконозологической формы неспецифична, данные нейровизуализационных методов исследования не являются патогномоничными, но позволяют заподозрить лимфому головного мозга.
2. КТ-перфузия и МРТ-спектроскопия позволяют получить дополнительную информацию о природе очагового поражения и использовать эти данные при планировании оптимальной зоны биопсии, а также оценивать эффективность проведенного лечения.
3. Стереотаксическая биопсия является стандартной, безопасной, информативной нейрохирургической методикой.
4. Достоверным подтверждением лимфомы головного мозга является гистологическая верификация с обязательным определением иммунофенотипа опухоли (стандарт).
5. Продолжительность жизни пациентов без лечения, по данным литературы, составляет не больше 2 мес. Соответственно, своевременная диагностика и вовремя назначенное лечение значительно повышают выживаемость пациентов и улучшают качество их жизни.
Список использованной литературы
1. Bailey P. (1929) Intracranial sarcomatous tumors of leptomeningeal origin. Arch. Surg.,18: 1359–1402.
2. Jellinger K., Radiaszkiewicz T. (1976) Involvement of the Central Nervous System in Malignant Lymphomas. Virchows Arch. (Path. Anat.), 370: 345–62.
3. Губкин А.В. (2003) Первичные лимфатические опухоли ЦНС. Руководство по гематологии, 2: 108.
4. Lister A., Abrey L.E., Sandlund J.T. (2002) Central Nervous System Lymphoma. Hematology, Vol. 1: 283–298.
5. Власов П.В., Шейх Ж.В., Курзанцева О.O., Сидоров Ю.А. (2004) Лимфома центральной нервной системы. Радиология-практика, 1: 24–30.
6. Helle T.L., Britt R.H., Colby T.V. (1984) Primary Lymphoma of the Central Nerous System. J. Neurosurg. 60: 94–103.
7. Ferreri A.J., Reni M., Villa E. (1995) Primary central nervous system lymphoma in immunocompetent patients. Cancer Treat. Rev., 21: 415–46.
8. Kadan-Lottick N.S., Skluzarek M.C., Gurney J.G. (2002) Decreasing incidence rates of primary central nervous system lymphoma. Cancer, 95: 193–202.
9. Henson J.W., Batchelor T.T. (2004) Intraocular lymphoma. In: Lymphoma of the Nervous System. Batchelor T.T. (ed.). Boston, MA: Butterworth-Heinemann, 183–188.
10. Алясова А.В. (1995) Состояние нервной системы у больных злокачественными неходжкинскими лимфомами. Нижегородский медицинский журнал, 2–3: 70–72.
11. Крячок И.А., Филоненко Е.С., Кущевой Е.В. и др. (2012) Первичные лимфомы ЦНС: от научных исследований к практике. Клиническая онкология, 6(2): 91–100.
12. Batchelor T., Loeffler J.S. (2006) Primary CNS Lymphoma. J. Clin. Oncol., 24(8): 1281–1288.
13. Тупицин Н.Н. (2007) Структура и функции иммунной системы человека. Клиническая онкогематология: руководство для врачей. Изд. 2-е, перераб. и доп./Под ред. М.А. Волковой. Медицина, Москва: 46–65.
14. Волкова С.А. Боровков Н.Н. (2012) Основы клинической гематологии. Нижний Новгород: НижГМА: 277–322.
15. Стамо А.П., Григорьева Б.Н., Киселева А.А., Авдонина Ю.Д. (2013) Поражение головного мозга при В-лимфопролиферативных заболеваниях. Лекции для врачей общей практики. Практическая медицина, 1: 55–59.
16. Abrey L.E., DeAngelis L.M., Yahalom J. (1998) Long-term survival in primary CNS lymphoma. J. Clin. Oncol., 16: 859–863.
17. Freeman C., Berg J.W., Cutler S.J. (1972) Occurrence and prognosis of extranodal lymphomas. Cancer, 29: 252–260.
18. Cancer Study Group: Epidemiology of brain lymphoma among people with or without acquired immunodeficiency syndrome (1996). J. Natl. Cancer Inst., 88: 675–679.
19. Galarza M., Gazzeri R., Elfeky H.A., Johnson II R.R. (2006) Primary diffuse large B-cell lymphoma of the dura mater and cranial vault: Case report and review of the literature. Neurosurg. Focus, 21(5): 1–4.
20. Louis D.N., Ohgaki H., Weistler O.D., Cavanee W.K. (eds). (2007) World Health Organization Classification of Tumors of the Nervous System. IARC, Lyon.
21. Гайдукова С.Н., Кариобеда О.А., Сивак Л.А. та ін. (2005) Первичная лимфома центральной нервной системы. Архив клинической медицины, 2: 23–27.
Данная информация предоставлена в качестве информационной поддержки врачам. Мнения, изложенные в материале, отражают точку зрения авторов и не обязательно совпадают с точкой зрения компании MSD. Материал предназначен для специалистов сферы здравоохранения и только для распространения на специализированных медицинских мероприятиях либо для публикации в специализированных изданиях.
Информация о лекарственном средстве. Информация для профессиональной деятельности медицинских и фармацевтических работников.
ТЕМОДАЛ. Р.с. МЗ Украины № UA/4893/02/01. Состав. 1 капсула содержит 5 мг, 20 мг, 100 мг, 140 мг, 180 мг или 250 мг темозоломида. Код ATC. L01A X03. Фармакотерапевтическая группа. Антинеопластические средства. Алкилирующие соединения. Фармакологические свойства. Темодал (темозоломид) — это имидазотетразиновое алкилирующее средство с противоопухолевой активностью. Показания. Лечение взрослых пациентов с впервые выявленной мультиформной глиобластомой в сопровождении радиотерапии и потом как монотерапия; детей в возрасте старше 3 лет и взрослых со злокачественной глиомой в форме мультиформной глиобластомы или анапластической астроцитомы при наличии рецидива или прогрессирования болезни после стандартной терапии. Противопоказания. Повышенная чувствительность к компонентам препарата или дакарбазину; пациенты с признаками выраженной миелосупрессии. Побочные реакции. Тошнота, рвота, запор, анорексия, головная боль и усталость, инфекция, простой герпес, инфекция ран, фарингит, кандидоз ротовой полости, лейкопения, лимфопения, нейтропения, тромбоцитопения, гипокалиемия, повышение уровня щелочной фосфатазы, увеличение массы тела и др. Категория отпуска. По рецепту. Производитель. Орион Фарма, Финляндия.Полная информация о применении лекарственного средства и полный перечень побочных реакций содержатся в инструкции по медицинскому применению препарата. Перед назначением препарата Темодал обязательно ознакомьтесь с инструкцией.














Leave a comment