Корекція анемічного синдрому у хворих на злоякісні лімфоми
Крячок И.А., Титоренко И.Б., Степанишина Я.А.
Резюме. Одним із найбільш частих симптомів, асоційованих зі злоякісними новоутвореннями, є анемія. Розглянуто сучасні рекомендації щодо застосування еритропоетинів для корекції хіміоіндукованої анемії у хворих зі злоякісним пухлинним процесом. Проведено аналіз ефективності еритропоетину (Епобіокрин, ПрАТ «Біофарма») у хворих із неходжкінською лімфомою і лімфомою Ходжкіна.
Резюме. Одним из наиболее частых симптомов, ассоциированных со злокачественными новообразованиями, является анемия. Рассмотрены современные рекомендации по применению эритропоэтинов для коррекции химиоиндуцированной анемии у больных со злокачественным опухолевым процессом. Проведен анализ эффективности эритропоэтина (Эпобиокрин®, ЧАО «Биофарма») у больных неходжкинской лимфомой и лимфомой Ходжкина, которые получали полихимиотерапию.
 Анемия — симптом, который наиболее часто отмечают у больных со злокачественным опухолевым процессом. Анемия может развиваться непосредственно в результате основного заболевания или, что значительно чаще — в качестве побочного эффекта лечения. Результаты многочисленных исследований продолжают демонстрировать распространенность анемии и ее прогностическую роль у больных онкологического профиля, подвергающихся специальному лечению.
Анемия — симптом, который наиболее часто отмечают у больных со злокачественным опухолевым процессом. Анемия может развиваться непосредственно в результате основного заболевания или, что значительно чаще — в качестве побочного эффекта лечения. Результаты многочисленных исследований продолжают демонстрировать распространенность анемии и ее прогностическую роль у больных онкологического профиля, подвергающихся специальному лечению.
В Европейском исследовании по изучению анемии при раке (European Cancer Anaemia Survey — ECAS), в которое включено более 15 000 пациентов из 750 клиник, показано, что на момент установления первичного диагноза анемию регистрировали у 35% пациентов, в период лечения эта цифра увеличилась до 49%. Во время ремиссии анемию отмечали в 31% случаев. Частота анемии выше у пациенток с опухолями репродуктивной системы и составляет 81%, при раке легкого — 77%, при лимфопролиферативных заболеваниях — 73%, раке грудной железы — 62%, опухолях желудочно-кишечного тракта — 61%, опухолях головы и шеи — 51% [1]. Миелосупрессивный эффект цитотоксических препаратов может накапливаться при повторных циклах химиотерапии, что приводит к постепенному повышению степени анемии. Так, в этом же исследовании частота анемии возросла с 19,5% после 1-го цикла химиотерапии до 46,7% — после 5-го.
Анемия — это патологический процесс, характеризующийся уменьшением количества эритроцитов и концентрации гемоглобина (Hb) в единице объема крови и развитием гипоксии тканей организма. Термин «анемия» без детализации не определяет конкретное заболевание, а указывает на изменения в анализах крови, то есть анемию следует считать одним из симптомов патологических состояний.
Основными патогенетическими механизмами развития анемии при онкологических и онкогематологических заболеваниях являются: сокращение срока жизни эритроцитов, уменьшение реутилизации железа костным мозгом, неадекватная реакция эритропоэтина (ЭПО) на наличие анемии, супрессия ранних эритроидных клеток; аутоиммунный гемолиз; вытеснение эритроидного ростка метастазами в костный мозг; влияние цитостатических препаратов на костный мозг и нарушение функции почек [2].
В зависимости от уровня Hb анемия различается по степени тяжести. Согласно рекомендациям (CTCAE, WHO, EORTC) выделяют 4 степени анемии (табл. 1).
Таблица 1. Классификация анемии по степени тяжести
| Рекомендации | Степени анемии | ||||
| 0 |
I Легкая |
II Умеренная |
III Выраженная |
IV Тяжелая |
|
| Уровень Hb, г/л | |||||
| National Cancer Institute, 2010 | ≥120 | 120—100 | 100—80 | 80—65 | <65 |
| World Health Organization, 2005 | ≥110 | <110—95 | 95—80 | 80—65 | <65 |
| European Organization for Research And Treatment of Cancer, 2007 | >120 г/л | ≤110—95 | 80—95 | 80—65 | <65 |
Частота и степень тяжести анемии зависят от типа опухолевого процесса, стадии и длительности заболевания, характера лечения (стандартная, высокодозная, платиносодержащая химиотерапия, лучевая, комбинированная терапия). К факторам, способствующим развитию анемии, относят также низкий исходный уровень Hb, женский пол, рефрактерность болезни к специальной терапии [3, 4].
Наиболее часто анемия развивается у пациентов, получающих химиотерапию и/или лучевую терапию (у 75% пациентов на фоне химиотерапии и 71,8% — при комбинированных методах лечения). Лучевая терапия сопровождается анемией у 38% больных [5].
Клинические последствия анемии в онкологии включают [6]: снижение эффективности противоопухолевой терапии и вероятности достижения эффекта лучевой терапии [16], повышение агрессивности опухоли и риска развития сопутствующих заболеваний.
Роль уровня Hb как фактора прогноза течения заболевания, эффективности лечения и раннего рецидива доказана в нескольких исследованиях при различных локализациях онкологического процесса: рак легкого [7], рак почки [8], колоректальный рак [9], гемобластозы [10], рак яичника [11], рак шейки матки [12], рак мочевыводящих путей [13].
Доказано влияние анемии на эффективность химиотерапии при колоректальном раке. У больных с развившейся анемией вероятность достижения ответа на химиотерапию значительно ниже, чем у пациентов без анемии, — в 29,2% против 40,4% случаев соответственно. Период до прогрессирования у больных без анемии составил 10,0 мес, с анемией — 11,7 мес [6, 14].
I. Moullet и соавторы в 1998 г. продемонстрировали, что при неходжкинских лимфомах (НХЛ) наличие анемии является неблагоприятным прогностическим фактором как для достижения общего ответа, так и для отдаленных результатов лечения (отмечено сокращение времени до прогрессирования заболевания и общей выживаемости) [15].
Анемия снижает ответ опухоли и на лучевую терапию [16]. Кислород необходим для уменьшения способности к репарации опухолевой ДНК, поврежденной в результате облучения. Известно, что дозы излучения, применяемые в условиях гипоксии для уничтожения опухолевых клеток, выше, чем используемые в условиях адекватной кислородной поддержки.
Выяснение причины анемии у больных с онкологической патологией имеет ключевое значение при выборе метода лечения. В настоящее время терапия анемии включает:
- устранение возможных причин анемии (коррекция дефицита цианокобаламина, железа, фолатов, витаминов, уменьшение кровопотери);
- переливание эритроцитарной массы;
- применение рекомбинантного человеческого ЭПО;
- лечение опухолевого процесса.
Согласно обновленным рекомендациям NCCN Guidelines (2014) по лечению анемии, индуцированной опухолевым процессом или химиотерапией, прежде всего необходимо оценить, имеются ли симптомы анемии (устойчивая тахикардия, учащенное дыхание, боль в груди, одышка при физической нагрузке, головокружение, обмороки, выраженная усталость при обычной деятельности), сопутствующая патология (хронические заболевания дыхательной, сердечно-сосудистой системы, патология цереброваскулярной системы) [17]. При отсутствии перечисленных симптомов необходимо определить факторы, повышающие риск их возможного развития: предыдущая миелосупрессивная терапия, предыдущая лучевая терапия; миелосупрессивность последующей терапии. При асимптоматической анемии и отсутствии вышеперечисленных симптомов пациенту показано наблюдение. При симптоматической или асимптоматической анемии, но с высоким риском развития симптомов, пациенту показана терапия анемии [18].
Переливание эритроцитарной массы предполагает быстрое повышение уровней Hb и гематокрита и, следовательно, является идеальным вариантом для пациентов, у которых необходима быстрая коррекция анемии. Хотя переливание имеет очевидные преимущества, все же оно не лишено побочных эффектов, включающих трансфузионные реакции, развитие сердечной недостаточности, вирусные инфекции, бактериальную контаминацию, перегрузку железом, иммуносупрессию. При повторных трансфузиях повышается риск сенсибилизации к редким антигенам эритроцитов, и могут появляться гемолитические реакции. Не существует единых рекомендаций для проведения гемотрансфузий. Британская гематологическая ассоциация (2001) рекомендует переливание эритроцитарной массы больным с уровнем Hb <70 г/л. У больных в возрасте ≥65 лет или имеющих патологию со стороны сердца, легких, гемотрансфузии могут использоваться при уровне Hb <80 г/л. Повышение уровня Hb до 80–90 г/л, как правило, является вполне достаточным для купирования клинически значимых проявлений анемии и устранения гипоксии тканей. В руководстве EORTC указано, что трансфузия эритроцитной массы обоснована при снижении уровня Hb <9,0 г/дл [18]. Согласно рекомендациям NCCN Guidelines (2014 г.) при асимптоматической анемии гемотрансфузию применяют при значении Hb <70 г/л для удержания уровня 70–90 г/л. При наличии у пациента симптоматической анемии (включая тахикардию, тахипноэ, гипотензию) целью переливания эритроцитарной массы является поддержание Hb 80–100 г/л. При сочетании анемии и острого коронарного синдрома, а также инфаркта миокарда необходимо удерживать уровень Hb >100 г/л [19].
При клиническом проявлении анемии следует проверить содержание железа, ферритина и общую железосвязывающую способность сыворотки крови. Дефицит железа отмечают у 32–60% больных онкологического профиля с анемией. При абсолютном дефиците железа (ферритин <30 нг/мл, насыщение трансферрином <20%) назначают препараты железа с длительностью приема 4 нед [20]. При более высоком уровне ферритина и степени насыщения трансферрина следует предполагать функциональный дефицит железа (ферритин 30–800 нг/мл и насыщение трансферрином 20–50%), целесообразно применение препаратов железа в комбинации с терапией ЭПО. Если уровень ферритина >300 нг/мл, а степень насыщения трансферрина ≥20%, то во введении препаратов железа нет необходимости [21].
В настоящее время для коррекции анемии в онкологии широкое распространение получили стимуляторы эритропоэза (erythropoiesis-stimulatingagents — ESAS), клиническая эффективность которых доказана в многочисленных клинических исследованиях. Известно, что при анемии у пациентов онкологического профиля отмечают абсолютное или относительное снижение продукции эндогенного ЭПО, дефицит которого может быть компенсирован путем введения экзогенных стимулятов эритропоэза: эпоэтина-α, эпоэтина-β, дарбэпоэтина-α.
Учитывая результаты многоцентровых рандомизированных исследований, несколькими международными организациями (ASH/ASCO, EHA, EORTC) были предложены рекомендации по применению ЭПО у пациентов с немиелоидными опухолевыми заболеваниями.
ЭПО назначают в начальной дозе 150 ЕД/кг 3 раза в неделю подкожно (п/к) или в дозе 40 000 ЕД еженедельно п/к. Дарбопоэтин применяют в начальной дозе 2,25 мкг/кг еженедельно п/к. Если повышение уровня Hb происходит более чем на 10 г/л в течение 2 нед, дозу препарата необходимо снизить на 25–50%. Дозу ЭПО следует повысить до 300 мг/кг, дарбопоэтина — до 4,5 мкг/кг, если уровень Hb через 2 нед не изменился, снизился или повысился менее чем на 10 г/л. Повторную оценку эффективности терапии проводят через 2–4 нед; если уровень Hb повышается более чем на 10 г/л — дозу следует снизить на 25–50%. Дозу ЭПО подбирают таким образом, чтобы удерживать Hb на уровне 120 г/л, при котором возможно избежать тромбоэмболических осложнений, в связи с угрозой которых достижение более высокого уровня Hb нежелательно [27]. Если уровень Hb превысил 120 г/л, введение ЭПО необходимо прекратить, дождаться снижения уровня Hb <120 г/л, после чего следует возобновить введение ЭПО в дозе, сниженной на 25% по сравнению с предыдущей. Уровень Hb на фоне лечения ЭПО не должен превышать 120 г/л [22].
Отсутствием ответа на терапию ЭПО считают повышение уровня Hb менее чем на 10 г/л в течение 4–6 нед, а также наличие положительной динамики со стороны симптомов анемии. Продолжение терапии >6–8 нед при отсутствии эффекта, несмотря на повышение дозы, считается нецелесообразным. После завершения химиотерапии лечение ЭПО следует продолжать в течение периода, эквивалентного 1–2 циклам химиотерапии [23].
Возможны и альтернативные схемы введения препарата: по 80 000 ЕД каждые 2 нед п/к или по 120 000 ЕД каждые 3 нед п/к.
Терапию ЭПО назначают, когда уровень Hb больного120 г/л. Также рекомендуется продолжать терапию ЭПО между курсами полихимиотерапии (ПХТ) и в период не более 6 нед с момента окончания химиотерапии. При назначении ЭПО необходимо обязательно оценить факторы риска развития тромбозов [24].
В нескольких рандомизированных клинических исследованиях продемонстрировано, что внутривенное введение препаратов железа позволяет повысить частоту ответа на лечение ЭПО с 25–70 до 68–93% [22]. При проведении ЭПО-терапии обязательно назначение препаратов железа при уровне ферритина <100 мкг/л и/или насыщения трансферрином <20%.
Эксперты FDA (Food and Drug Administration) считают возможным применение стимуляторов эритропоэза только для лечения анемии, вызванной химиотерапией. После завершения курса химиотерапии эти препараты следует отменить [25].
При отсутствии эффективности ЭПО больного нужно обследовать на наличие парциально-клеточной аплазии. Если у пациента выявлена эта патология, терапию ЭПО следует прекратить. В научных исследованиях, проведенных в 1998–2004 гг., зарегистрировано 197 случаев парциально-клеточной аплазии у пациентов, получавших ЭПО [26].
В последнее время больные раком живут дольше благодаря достижениям современной медицины, а паллиативная терапия может применяться в течение длительного периода. Поэтому лечение ЭПО показано не только пациентам, получающим радикальное лечение, но и больным, у которых проводится паллиативная химиотерапия [19]. Поддержание хорошего качества жизни путем коррекции анемии очень важно и у пациентов с прогрессирующим заболеванием и вероятной продолжительностью жизни больше чем несколько месяцев.
Объект и методы исследования
На базе отделения онкогематологии Национального института рака проводили анализ эффективности и переносимости препарата Эпобиокрин (раствор для инъекций во флаконах по 1 мл, 10 000 МЕ, производства ЧАО «Биофарма») у пациентов с лимфопролиферативными заболеваниями (НХЛ и лимфома Ходжкина — ЛХ) при лечении анемии, которая развилась вследствие ПХТ.
На украинском фармацевтическом рынке есть несколько лекарственных препаратов ЭПО, которые применяют для коррекции анемии при онкологических и онкогематологических заболеваниях. Препарат Эпобиокрин также широко используют как средство коррекции анемии, которая возникла вследствие проведения противоопухолевой терапии. Эпобиокрин зарегистрирован в дозировках 2000; 4000 и 10 000 МЕ, что позволяет индивидуально подобрать дозу.
Проанализированы данные 33 пациентов, среди которых 8 мужчин и 25 женщин в возрасте от 18 до 70 лет (средний возраст — 36,39±11,18 года). У 8 пациентов диагностирована НХЛ, у 25 — ЛХ. Распределение больных по диагнозу и стадии патологического процесса представлено в табл. 2.
Таблица 2. Распределение пациентов по диагнозу и стадии заболевания
| Диагноз | Стадия | |||||
| IIА | IIB | IIIA | IIIB | IVA | IVB | |
| ЛХ | 1 | 4 | 2 | 5 | 1 | 12 |
| НХЛ | 0 | 2 | 0 | 0 | 2 | 4 |
Все больные получали лечение по поводу основного заболевания. У пациентов с ЛХ проводили интенсивную терапию по схемам ВЕАСОРР-эск и ВЕАСОРР-14, у больных с НХЛ — по схемам СНОР и СНОЕР, у 1 пациента — по схеме R-CНОР. Гематологическая токсичность, которая была вызвана специфической терапией, повышалась с каждым курсом ПХТ. Одна пациентка получала терапию препаратом Эпобиокрин после 2-го курса ПХТ, 6 пациентов — после 4-го курса, 19 — после 5-го курса, 6 — после 6-го курса, 1 больная — после 7-го курса.
Препарат Эпобиокрин назначали п/к в дозе 10 000 МЕ 3 раза в неделю в течение 4 нед, при отсутствии эффекта дозу повышали в 2 раза на протяжении следующих 4 нед. Противопоказаниями к введению лекарственного средства были повышенная чувствительность к препарату. При дефиците железа пациенты получали препараты железа согласно рекомендациям. Критерием эффективности применяемой терапии считали прирост уровня гематокрита. Полный ответ предполагает нормализацию гематокрита, значительный, но неполный, — отсутствие необходимости в трансфузиях, уровень гематокрита ≥30% или повышение гематокрита ≥6%; незначительный ответ — уменьшение необходимости в гемотрансфузиях на 50%, повышение гематокрита ≥6%, но <30%; отсутствие ответа [28].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
До начала терапии ЭПО анемия II степени была у 9 пациентов; III степени — у 16; IV степени — у 8 больных. Показатели Hb, эритроцитов и гематокрита в динамике у данных больных приведены в табл. 3.
Таблица 3. Гематологические показатели пациентов, которые получали терапию Эпобиокрином до и после лечения
| Эритроциты, 10/л | р | Гемоглобин, г/л | р | Гематокрит,% | р | |
| До лечения | 2,55±0,44 | 74,68±8,16 | 21,1±3,61 | |||
| Через 4 нед | 2,99±0,66 | p2<0,05 | 86,36±16,88 | p2<0,05 | 25,43±5,53 | p2<0,05 |
| Через 8 нед | 3,1±0,40 | p4<0,05 | 93,36±7,17 | p4<0,05 | 28,89±2,78 | p4<0,05 |
р — сравнивали с соответствующим показателем.
Продолжительность терапии препаратом Эпобиокрин составляла от 4 до 8 нед, в среднем — 5,61±1,83 нед (4 нед — 20; 6 нед — 2; 8 нед — 11 пациентов).
Как свидетельствуют приведенные в табл. 3 данные, при назначении Эпобиокрина получены достоверные отличия по таким показателям, как уровень Hb и количество эритроцитов до и после лечения. Также достоверная разница отмечена в значениях гематокрита, который до лечения составлял 21,1±3,61, после лечения — 25,43±5,53 и 28,89±3,99 после 4 и 6 нед терапии соответственно (р<0,05).
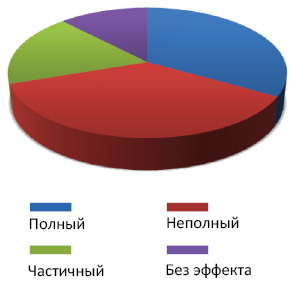
По данным анализа индивидуальных показателей после проведенного лечения ЭПО, у 11 (33,3%) больных зарегистрирован полный ответ, у 12 (36,4%) — неполный, у 6 (18,1%) — частичный, у 4 (12,1%) пациентов терапия оказалась неэффективной (рисунок).
Необходимость в гемотрансфузиях на фоне терапии составила: у 1 больной — 14 сеансов, у 2 пациентов — по 2, у 3 пациентов — по 1, у 27 больных трансфузии не проводили. Следует отметить, что значительное количество гемотрансфузий (14) было обусловлено наличием у больной П. анемии IV степени в момент установления диагноза (ЛХ, стадия ІVВ с поражением селезенки, забрюшинных лимфатических узлов, лимфатических узлов средостения).
Все больные получили лечение на фоне терапии сопровождения без редукции доз цитостатиков и увеличения интервала между курсами. Таким образом, применение ЭПО у пациентов с анемией, вызванной действием цитостатических препаратов, позволило не нарушать протокол лечения и провести его в полном объеме.
При применении препарата Эпобиокрин местных и общих побочных эффектов на фоне терапии не отмечено.
Выводы
1. Терапия химиоиндуцированной анемии у больных НХЛ и ЛХ с применением препарата Эпобиокрин является эффективной.
2. Положительный результат лечения анемии достигнут у 69,7% (полный ответ — 33,3% пациентов, неполный — 36,4%), при этом уровень гематокрита повысился до >30%. У 18,1% больных получен частичный ответ, уровень гематокрита повысился на 6–29%.
3. Применение ЭПО для лечения пациентов с анемией, вызванной действием цитостатических препаратов, позволило не нарушать протокол лечения и провести его в полном объеме.
Список использованной литературы
1. LudwigH., van Belle S., Barrett-Lee P. et al. (2004)The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur. J. Cancer, 40 (15): 2293–306.
2. Spivak J.L. (1994) Recombinant human erythropoietin and the anemia of cancer. Semin. Oncol., 21 (suppl 3): 3–8.
3. Birgegard G., Gascon P., Ludwig H. (2006) Evaluation of anaemia in patients with multiple myeloma and lymphoma: findings of the European CANCER ANAEMIA SURVEY. Eur. J. Haematol., 77 (5): 378–86.
4. Бессмельцев С.С., Абдулкадыров К.М. (2007) Множественная миелома. Современный взгляд на проблему. Алма-Аты, 480 с.
5. Ludwig H., Fritz E., Kotzmann H. et al. (1990) Erythropoietin treatment of anemia associated with multiple myeloma. N. Engl. J. Med. Engl. J. Med., 322: 1693–9.
6. Tampellini M., Saini A., Alabiso I. et al. (2006) The role of hemoglobin level in predicting the response to first-line chemotherapy in advanced colorectal cancer patients. Br. J. Cancer, 95: 13–20.
7. Watters J.S., O’Brien M.E.R., Ashley S. (2002) Management of Anemia in Patients Receiving Chemotherapy. J. Clin. Oncol., 20: 601–603.
8. Motzer R.J., Mazumdar M., Bacik J. et al. (1999)Survivaland Prognostic Stratification of 670 Patients With Advanced Renal Cell Carcinoma. J. Clin. Oncol., 17: 2530–2540.
9. Graf W., Bergstrom R., Pahlman L., Glimelius B. (1994) Appraisal of a model for prediction of prognosis in advanced colorectal cance. Eur. J. Cancer, 30 (4): 453–7.
10. Kern W. (2000) Multivariate analysis of prognostic factors in patients with refractory and relapsed acute myeloid leukemia undergoing sequential high-dose cytosine arabinoside and mitoxantrone (S-HAM) salvage therapy: relevance of cytogenetic abnormalities. Leukemia, 14(2): 226–31.
11. Eisenhauer E.A., Vermorlen J.B., VanGlabbeke M. (1997) Predictors of response to subsequent chemotherapy in platinum pretreated ovarian cancer: a multivariate analysis of 704 patients. Ann. Oncol., 8: 963–968.
12. Obermair A., Cheuk R., Horwood K. et al. (2001)Impact of hemoglobin levels before and during concurrent chemoradiotherapy on the response of treatment in patients with cervical carcinoma: preliminary results. Cancer, 92(4): 903–908.
13. Sengelov L., Kamby C., Geertsen P. et al. (2000) Redictive factors of response to cisplatin-based chemotherapy and the relation of response to survival in patients with metastatic urothelial cancer. Cancer Chemother Pharmacol., 46: 357–364.
14. Tampellini M., Saini A., Alabiso I. et al. (2006) The role of hemoglobin level in predicting the response to first-line chemotherapy in advanced colorectal cancer patients. Br. J. Cancer, 95: 13–20.
15. Moullet I., Salles G., Ketterer N. et al. (1998) Frequency and significance of anemia in non-Hodgkin’s lymphoma patients. Ann. Oncol., 9: 1109–1115.
16. Портнягин И.В., Рязанкина А.А., Квашнин А.В. (2008) Симптоматическая терапия при раке предстательной железы. Практ. онкол., 9(2): 117–123.
17. NCCN Guidelines (2014).
18. Aapro M., Link H. (2008) September 2007 update on EORTC guidelines and anemia management with erythropoiesis-stimulating agents. Oncologist, 13 (suppl. 3): 33–6.
19. NCCN clinical practice guidelines. Cancer and chemotherapy-induced anemia. V2 2012.
20. Henry D.H., Dahl N.V., Auerbach M. et al. (2007) Increased Importance of Intravenous Iron in Chemotherapy-Induced Anemia. Oncologist, 12: 231–242.
21. Moore R., Gaskell H., Rose P. et al. (2011) Meta-analysis of efficacy and safety of intravenous ferric carboxymaltose (Ferinject) from clinical trial reports and published trial data. BMC Blood Disord., 11: 4.
22. Бесова Н.С. (2009) Эритропоэтины в онкологии: показания к применению и проблемы. Современная онкология, 11 (4): 5–12.
23. Резолюция экспертного совещания по использованию эритропоэзстимулирующих препаратов (ЭСП) в онкологии от 3 ноября 2007 г. (2007) Совр. Онкол., 9 (4).
24. Treatment of Anemia with Erythropoietic Agents in Patients with Cancer — Adaption/Adoption of ASH-ASCO Guidelines, 2010.
25. Hedenus M., Birgegard G. (2009) The role of iron supplementation during epoietin treatment for cancer-related anemia. Med. Oncol., 26 (1): 105–15.
26. Веnnett C.L., Luminari S., Nissenson A.R. et al. (2004) Pure red-cell aplasia and epoetin therapy. N. Engl. J. Med., 351: 1403–8.
27. Bennett C.L., Silver S.M., Djulbegovic B. et al. (2008) Venosus thromboembolism and mortality associated with recombinant erythropoietin and darbepoetin administration for the treatment of cancer-associated anemia.JAMA, 299: 914–24.
28. Beguin Y. (1998) Prediction of response to optimize outcome of treatment with erythropoietin. Semin. Oncol., 25 (Suppl. 7): 27–34.














Leave a comment