Стан анального сфінктера після застосування неоад’ювантної променевої терапії у хворих на рак прямої кишки
Щепотін І.Б., Колесник А.А., Грабовий О.М., Іванкова В.С., Кротевич М.С., Безносенко А.П., Балабушко С.Б., Махмудов Д.Е.
Резюме. У цей час є достатньо підтверджень негативного впливу променевої терапії на функцію анального сфінктера (АС). Проте морфологічні зміни, які призводять до анальної інконтиненції після використання різних схем неоад’ювантної променевої терапії (НПТ), залишаються невивченими. Метою цього дослідження було вивчення гістологічних змін у тканині АС після використання різних схем НПТ у комбінованому лікуванні злоякісних пухлин прямої кишки. Проаналізовано гістологічні зміни тканини АС у 49 пацієнтів після НПТ і екстирпації прямої кишки. 12 пацієнтам проведено НПТ у сумарній дозі 20 Гр крупними фракціями, 14 хворим — 30 Гр дрібними фракціями, 13 пацієнтам — 50–60 Гр дрібними фракціями. До контрольної групи увійшли 10 пацієнтів, яким НПТ не проводили. Фіброз I ступеня спостерігається переважно в групах 20 і 30 Гр — у 75,1 і 64,3% відповідно. У групі 50–60 Гр фіброз II і III ступеня виявляли в 46,2 і 30,7% відповідно. Спостерігається тенденція до зменшення кількості нервових елементів при підвищенні дози опромінення, хоча достовірної різниці не отримано (р=0,28). Внаслідок променевої альтерації розвиваються дегенеративні та запальні зміни в тканині АС, які призводять до заміщення м’язових елементів фіброзною тканиною і є морфологічним субстратом для подальших функціональних змін.

Актуальність
Важливим фактором при виборі лікувальної тактики для пацієнтів, хворих на рак прямої кишки (РПК), є збереження функції анального сфінктера (АС) за умови досягнення низьких показників локальних рецидивів та високої 5-річної виживаності. Широке впровадження в хірургічну практику таких операцій, як низька передня резекція та проктектомія (інтерсфінктерна резекція), дозволило збільшити кількість сфінктерозберігаючих операцій до 80–90% у хворих із пухлинами дистального відділу прямої кишки [1–3]. Призначення комбінованого лікування із застосуванням неоад’ювантної променевої терапії (НПТ) чи хіміопроменевої терапії хворим на РПК дозволяє знизити частоту локальних рецидивів, покращити загальну виживаність [4–6]. Підвищення резектабельності та збереження сфінктерного апарату прямої кишки стали можливими завдяки регресії пухлини після променевої терапії [7–9]. Сьогодні НПТ застосовують як стандарт лікування згідно з багатьма рекомендаціями щодо лікування хворих на РПК [10, 11]. Проте до кінця не вивчені морфологічні зміни, що виникають в АС після променевої терапії.
Післяпроменеві реакції у вигляді прогресуючого фіброзу та дегенерації нервового апарату АС пояснюють незадовільну функцію утримання калу у віддалений період (12%) у хворих на рак жіночих статевих органів, які отримували променеву терапію, порівняно з контрольною групою (0,9%) [12].
Проведені в останнє десятиріччя дослідження з вивчення функціональних результатів комбінованого лікування хворих на РПК підтвердили підвищення частоти анальної інконтиненції після НПТ [13–15]. Функція АС може погіршуватися у зв’язку з розвитком променевого проктиту, прямим променевим пошкодженням м’язової тканини АС та фіброзними змінами стінки прямої кишки [16]. Важливо зауважити, що ці морфологічні та функціональні зміни АС розвиваються поступово, проявляється тенденція до прогресії у відстрочений період після отриманого лікування. Наразі морфологічні зміни, які призводять до анальної дисфункції після застосування різних режимів НПТ, залишаються недослідженими [15, 17].
Мета роботи — дослідити морфологічні зміни тканини АС після застосування різних схем та доз НПТ.
Об’єкт і методи дослідження
У дослідження було включено 49 хворих, у яких діагностовано злоякісні пухлини нижньоампулярного відділу прямої кишки (нижня межа пухлини — не вище 5 см від зубчатої лінії) і виконано хірургічне втручання в обсязі черевно-промежинної екстирпації з тотальною мезоректумектомією. Гістологічне типування новоутворень здійснювали з використанням рутинного (гематоксилін й еозин) забарвлення та імуногістохімічного (ІГХ) дослідження. Терапію проводили згідно з національними стандартами лікування хворих зі злоякісними новоутвореннями. Пацієнти були розподілені на 4 групи. Хворі 1-ї групи (n=12) отримали НПТ у сумарній дозі 20 Гр (4×5 Гр) з подальшим хірургічним втручанням через 5–7 діб. У 2-й групі хворих (n=14) сумарна доза становила 30 Гр (15×2 Гр), операція — через 2–3 тиж. Пацієнтам 3-ї групи (n=13) проводили НПТ 50–60 Гр (25–30×2 Гр), оперативне втручання — через 4–6 тиж. У контрольній 4-й групі (n=10) дослідили матеріал хворих, яким через об’єктивні причини не була проведена НПТ. Зона опромінення включала первинну пухлину, параректальну клітковину, незмінені ділянки прямої кишки проксимальніше та дистальніше пухлини на 3–5 см, тому при розташуванні пухлини в нижньоампулярному відділі до зони опромінення входить АС.
Після виконання хірургічного втручання відбувався забір фрагмента АС (внутрішнього та зовнішнього компонентів включно). Отриманий матеріал фіксували в забуференому 10% формаліні з pH 7,4 та ущільнювали у парафін із застосуванням гістіопроцесора «Histos-5» («Milestone», Італія). З парафінових блоків виготовляли гістологічні зрізи товщиною 5 мкм за допомогою мікротома «Microm НМ325» («Thermo Scientific», Німеччина). Зрізи забарвлювали гематоксиліном й еозином для загальної оцінки та за ван Гізоном для оцінки стану сполучнотканинних елементів. ІГХ визначення білка S-100 проводили з поліклональним кролячим антитілом («Dako», Данія) та нейроспецифічної енолази з моноклональним мишачим антитілом («Dako», Данія) відповідно до протоколу виробника з використанням системи детекції EnVisionTM FLEX («Dako», Данія) для візуалізації та оцінки нервових структур.
Отримані гістологічні препарати вивчали і фотографували за допомогою мікроскопа Olympus CX41 з камерою Olympus SP-500UZ (зб. ×100) за стандартизованих умов, а зображення обробляли із застосуванням програми Quickphoto Micro 2.3 (for Windows). Оцінку ступеня фіброзних змін АС проводили за M. da Silva [15], де заміщення м’язової тканини фіброзною становило: <10% — 0 ступінь, 10–30% — І ступінь, 30–50% — ІІ ступінь, >50% — ІІІ ступінь. Статистичний аналіз проводили з використанням програми SPSS версії 13.0 для Windows («SPSS Inc.», Чикаго, Іллінойс, США). Відмінності вважали достовірними при р<0,05.
Результати
Проведені дослідження показали, що в групі хворих, які отримали променеву терапію крупними фракціями (5×5 Гр), в АС відмічається незначний набряк, що проявляється розширенням прошарків пухкої волокнистої сполучної тканини, наявне деяке збільшення кількості фібробластів, а також лімфоцитарних та макрофагальних елементів. Іноді виявляються осередки запальної інфільтрації. Кровоносні мікросудини зазвичай помірно розширені, а в них часто спостерігається крайове стояння лейкоцитів. У деяких судинах можна бачити стаз і сладж.
У групі хворих, які отримали променеву терапію у сумарній дозі 30 Гр, відзначають більш виразні явища набряку та запальної інфільтрації. Набряк розповсюджується не тільки на ендомізій, а й на м’язові волокна. Останні при цьому нерівномірно потовщені, з просвітленою саркоплазмою і посмугованістю, яка втрачає чіткість. Між м’язовими волокнами досить часто зустрічаються осередки запальної інфільтрації. Іноді можна спостерігати явища плазморагії та мікрокрововиливи. Кровоносні судини зазвичай розширені. У них розповсюдженими є стази та сладжі, інколи відзначають тромбоз і діапедез еритроцитів. Місцями між пучками м’язових волокон виявляють осередки фібротизації та трансформацію пухкої волокнистої сполучної тканини у щільну.
Після опромінення у сумарній дозі 50–60 Гр в АС переважаючими є явища фіброзу та дегенерації м’язових елементів. При цьому виявляють численні осередки фіброзу різних розмірів, заміщення ендомізію щільною волокнистою сполучною тканиною. Місцями виникають осередки запальної інфільтрації, іноді формуються лейкоцитарні периваскулярні лімфоцитарні муфти. Збережені на цей момент м’язові волокна виглядають набряклими, часто не мають поперечної посмугованості, іноді спостерігається їх фрагментація.
Гістологічна оцінка розповсюдженості явищ фіброзу в АС після опромінення показала, що вони наростають при підвищенні дози НПТ (р=0,005) (таблиця).
Таблиця. Ступінь фіброзу АС залежно від доз опромінення
| Ступінь фіброзу | 20 Гр | 30 Гр | 50–60 Гр | Без НПТ |
| n (%) | n (%) | n (%) | n (%) | |
| 0 | 2 (16,6) | 3 (21,4) | 0 | 6 (60) |
| І | 9 (75,1) | 9 (64,3) | 3 (23,1) | 3 (30) |
| ІІ | 1 (8,3) | 2 (14,3) | 6 (46,2) | 1 (10) |
| ІІІ | 0 | 0 | 4 (30,7) | 0 |
| Усього | 12 | 14 | 13 | 10 |
Так, у групі хворих, які отримали променеву терапію в дозах 20 та 30 Гр, переважно відзначали фіброз І ступеня (75,1 та 64,3% відповідно). У групі пацієнтів, які отримали терапію в дозі 50–60 Гр, фіброз ІІ та ІІІ ступеня виявляли частіше (46,2 та 30,7% відповідно). Статистичні відмінності між групами хворих, які отримали НПТ 20 та 30 Гр, не є достовірними (р=0,23). Однак порівняно з результатами, отриманими в групі хворих без НПТ, в усіх групах із променевою терапією спостерігаються фіброзні зміни АС (р<0,05).
Важливо відмітити, що збільшення часового проміжку від моменту закінчення НПТ до оперативного втручання підвищує ступінь заміщення сполучними елементами. Так, у всіх хворих, яким оперативне втручання виконали через ≥8 тиж після опромінення, фіброзні утворення заміщували понад 50% м’язової тканини АС (рис. 1, 2).
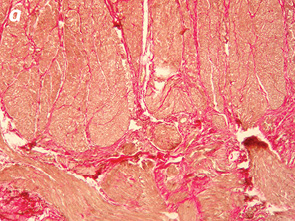
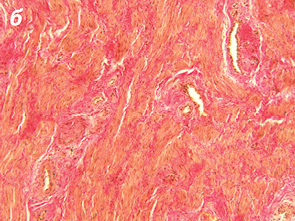
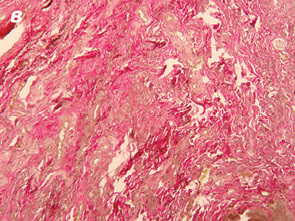
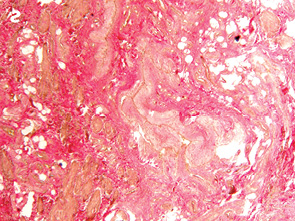
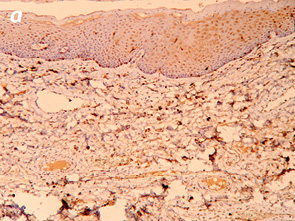
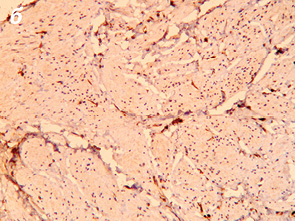
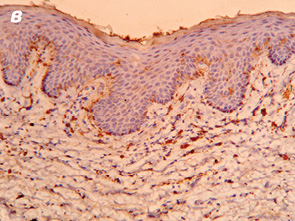
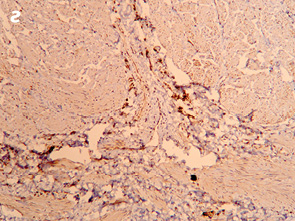
При проведенні ІГХ дослідження (антитіла проти S-100 та нейроспецифічна енолаза) кількість нервових елементів у групі без НПТ становила 5,4±1,3, у групі 30 Гр — 5,7±1,9, у групі 20 Гр — 4,7±1,2, у групі 50–60 Гр — 5,3±1,8, а відмінності між дослідженими групами не є статистично достовірними (р=0,28).
Обговорення
Принципово важливим медико-соціальним аспектом результатів лікування хворих на РПК є якість їх життя. З цих позицій оцінка впливу променевої терапії на функцію АС та пов’язані з ним зміни якості життя хворих на РПК заслуговують на особливу увагу. Низкою наукових праць із використанням анкет, клінічних досліджень та функціональних тестів доведено, що погіршення функції анального утримання калу в пацієнтів із РПК спричинене проведенням НПТ [13, 18–20]. Традиційно хірурги пов’язували нетримання калу після лікування РПК суто з наслідками хірургічного втручання, у той час як спеціалісти, що займаються променевою терапією іншої тазової патології, довели безпосередній вплив променевої терапії на якість життя хворих [12, 21–26]. Результати швецького когортного дослідження якості життя 1800 жінок, хворих на гінекологічний рак, довели переважання ознак анальної інконтиненції у пацієнток, яким була проведена променева терапія (12%), проти контрольної групи жінок без застосування променевої терапії (0,9%) [12]. Заслуговує на увагу проспективне дослідження, яке вивчало якість життя хворих на рак передміхурової залози до початку опромінення і через певні проміжки часу (в останній день опромінення, через 2 та 16 міс). Результати дослідження доводять статистично значущу різницю в частоті нетримання калу в хворих на пізніх термінах після опромінення порівняно з часом до початку лікування (p<0,05) [24].
Сфінктерозберігаючі операції все частіше використовують при розташуванні пухлини в нижньоампулярному відділі прямої кишки. НПТ є стандартом лікування РПК для досягнення онкологічних переваг — покращення загальної та безрецидивної виживаності, зниження частоти місцевих рецидивів, а також підвищення резектабельності пухлини та збільшення кількості сфінктерозберігаючих операцій. За даними проспективного рандомізованого дослідження, кількість сфінктерозберігаючих операцій була вищою в групі НПТ (39%) порівняно з групою післяопераційного опромінення (20%; р=0,004) [14]. Понад 75% пацієнтів, які отримували НПТ з метою лікування РПК, мали розлад дефекації [17]. Найбільш частими ускладненнями після опромінення були дизурія, нетримання калу та імперативні позиви до дефекації [27].
На сьогодні докази негативного впливу опромінення на функцію АС непрямі та неповні, оскільки відображені тільки клінічними та манометричними даними. Більшість досліджень ґрунтуються на неоднорідних даних літератури, поєднують проспективні та ретроспективні роботи, різнорідні схеми лікування (передопераційна та післяопераційна терапія), різні види опромінення та дози, які отримує АС, різні хірургічні втручання (з або без тотальної мезоректумектомії; інтерсфінктерна резекція, черевно-промежинна екстирпація, J-pouch резервуар та ін.), та оцінюють короткострокові та довгострокові результати [13–20]. Крім того, деякі дослідження не змогли продемонструвати значного порушення функції АС після променевої терапії [28, 29]. Складно інтерпретувати наявні в цей час дані, зокрема тому, що вже доведено негативний вплив хірургічного лікування на функцію сфінктера [25, 26].
Що більше впливає на функцію АС — хірургічне втручання чи опромінення — наразі невідомо. Механізм анального утримання є складним, включає багато структур та шляхів регуляції, і на кожен з них може впливати променева терапія.
У представленому дослідженні проаналізовано зміни нормальної м’язової тканини АС, спричинені променевою терапією. У результаті доведено, що розвиток сполучної тканини замість м’язової, який зростає пропорційно до підвищення дози опромінення, призводить до погіршення скоротливої функції сфінктера, а також до зменшення кількості нервових елементів, що неодмінно впливає на регуляцію роботи АС і може бути причиною анальної інконтинеції, яка виникає на пізніх строках після опромінення.
Дослідженнями останніх років доведено погіршення функціональних результатів лікування хворих, яким була виконана низька передня резекція або операція з частковою чи повною резекцією внутрішнього АС (інтерсфінктерна резекція, проктектомія), після НПТ [16, 30]. Базуючись на результатах нашого дослідження, можна припустити, що променева терапія має згубний вплив на функцію утримання калу після сфінктерозберігаючих оперативних втручань у хворих на РПК.
Кореляція між тяжкістю анальної інконтиненції, ступенем фіброзу та змінами нервових структур досі невідома, а довгострокові наслідки НПТ на функцію сфінктера до кінця не вивчені. Променеві ураження зазвичай починають розвиватися під час опромінення, прогресують з часом і, як правило, є незворотними. Ці процеси є поясненням поступового зниження якості життя хворих після сфінктерозберігаючих операцій порівняно з екстирпацією прямої кишки [31]. Для пухлин, розташованих вище анального каналу, планування більш точної зони опромінення може зменшувати променеве ураження сфінктера. У разі наднизьких пухлин, розташованих у безпосередній близькості або всередині анального каналу, використання НПТ з подальшою сфінктерозберігаючою операцією має бути чітко вмотивованим, оскільки функція опроміненого сфінктера з часом погіршується через розвиток фіброзу.
Висновок
НПТ у хворих на рак нижньоампулярного відділу прямої кишки призводить до суттєвих морфологічних змін АС. Внаслідок променевої альтерації розвиваються дегенеративні та запальні зміни, які призводять до заміщення м’язових елементів сфінктера фіброзною тканиною. Трансформація тканинного складу АС у хворих на РПК після променевої терапії є морфологічним субстратом для подальших функціональних порушень, що посилюються з часом. Існує статистично вірогідна залежність морфологічних змін АС від дози опромінення — найвищий ІІІ ступінь фіброзних змін (31%) спостерігається після опромінення у дозі 50–60 Гр.
Список використаної літератури
1. Щепотін І.Б., Колеснік О.О., Приймак В.В. та ін. (2011) Проблема локального контролю в лікуванні хворих на рак прямої кишки. Клин. онкол., Спец. выпуск І: 64–7.
2. Pettersson D., Cedermark B., Holm T. et al. (2010) Interim analysis of the Stockholm III trial of preoperative radiotherapy regimens for rectal cancer. Br. J. Surg., 97(4): 580–7.
3. Rouanet P., Rivoire M., Lelong B. et al. (2006) Sphincter preserving surgery after preoperative treatment for ultra-low rectal carcinoma. A French multicenter prospective trial: GRECCAR 1. J. Clin. Oncol. ASCO Annual Meeting Proceedings Part I., 24(18S): 3527.
4. Castaldo E.T., Parikh A.A., Pinson C.W. et al. (2009) Improvement of survival with response to neoadjuvant radiation therapy for rectal cancer. Arch. Surg., 144(2): 129–134.
5. Wong R., Tandan V., De Silva S. et al. (2008) Pre-operative radiotherapy and curative surgery for the management of localized rectal carcinoma (Review). The Cochrane Collaboration, Issue 4: 111.
6. Rödel C., Martus P., Papadoupolos T. et al. (2005) Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J. Clin. Oncol., 23(34): 8688–8696.
7. Baker B., Salameh H., Al-Salman M. et al. (2012) How does preoperative radiotherapy affect the rate of sphincter-sparing surgery in rectal cancer? Surg. Oncol., 21: 103–109.
8. Gerard J.P. (2005) Radiotherapy in the conservative treatment of rectal cancer. Evidence-based medicine and opinion. Radiother. Oncol., 74: 227–233.
9. Howard H., Gonzalez Q., Arnoletti P. et al. (2008) Prognostic factors and preoperative radiation therapy associated with sphincter preservation in patients with resectable rectal cancer. Am. J. Surg., 195: 239–243.
10. van de Velde C., Boelens P., Borras G. et al. (2013) EURECCA colorectal: Multidisciplinary management: European consensus conference colon & rectum. Eur. J. Cancer, published online 04 November 2013.
11. Benson A.l., Venook A., Bekaii-Saab T. et al. (2013) Rectal cancer. NCCN Clinical practice guidelines in oncology, Version 2.2014, published online 04 November 2013.
12. Lind H., Waldenström A.-C., Dunberger G. et al. (2011) Late symptoms in long-term gynaecological cancer survivors after radiation therapy: a population-based cohort study. Brit. J. Cancer, 105: 737–745.
13. Pollack J., Holm T., Cedermark B. et al. (2006) Long-term effect of preoperative radiation therapy on anorectal function. Dis. Colon Rectum, 49(3): 345–352
14. Sauer R., Becker H., Hohenberger W. et al. (2004) Preoperative versus Postoperative Chemoradiotherapy for Rectal Cancer. N. Engl. J. Med., 351: 1731–740.
15. da Silva M., Berho M., Wexner S. et al. (2003) Histologic analysis of the irradiated anal sphincter. Dis. Colon Rectum, 46(11): 1492–1497.
16. Nishizawa Y., Fujii S., Saito N. et al. (2011) The association between anal function and neural degeneration after preoperative chemoradiotherapy followed by intersphincteric resection. Dis. Colon Rectum, 54(11): 1423–1429.
17. Hayne D., Vaizey C., Boulos P. (2001) Anorectal injury following pelvic radiotherapy. Brit. J. Surg., 88(8): 1037–1048.
18. Gervaz P., Rotholtz N., Wexner S. et al. (2001) Colonic J-pouch function in rectal cancer patients: impact of adjuvant chemoradiotherapy. Dis. Colon Rectum, 44(11): 1667–1675.
19. Lundby L., Krogh K., Jensen V. et al. (2005) Long-term anorectal dysfunction after postoperative radiotherapy for rectal cancer. Dis. Colon Rectum, 48(7): 1343–1352.
20. Canda A., Terzi C., Gorken I. et al. (2010) Effects of preoperative chemoradiotherapy on anal sphincter functions and quality of life in rectal cancer patients. Int. J. Colorectal Dis., 25(2): 197–204.
21. Maeda Y., Høyer M., Lundby L. et al. (2011) Faecal incontinence following radiotherapy for prostate cancer: a systematic review. Radiother. Oncol., 98(2): 145–153.
22. Alevronta E., Lind H., Al-Abany M. et al. (2013) Dose-response relationships for an atomized symptom of fecal incontinence after gynecological radiotherapy. Acta Oncologica, 52(4): 719–726.
23. Budäus L., Bolla M., Bossi A. et al. (2012) Functional outcomes and complications following radiation therapy for prostate cancer: a critical analysis of the literature. Eur. Urol., 61(1): 112–127.
24. Pinkawa M., Piroth M., Fischedick K. et al. (2009) Self-assessed bowel toxicity after external beam radiotherapy for prostate cancer-predictive factors on irritative symptoms, incontinence and rectal bleeding. Radiat. Oncol., 4(36): 1–10.
25. Bryant C., Lunniss P., Knowles C. et al. (2012) Anterior resection syndrome. Lancet Oncol., 13(9): 403–408.
26. Ziv Y., Zbar A., Bar-Shavit Y. et al. (2013) Low anterior resection syndrome (LARS): cause and effect and reconstructive considerations. Tech. Coloproctol., 17(2): 151–162.
27. Gervaz P., Rotholtz N., Pisano M. et al. (2001) Quantitative short-term study of anal sphincter function after chemoradiation for rectal cancer. Arch. Surg, 136(2): 192–196.
28. Birnbaum E., Dreznik Z., Myerson R. et al. (1992) Early effect of external beam radiation therapy on the anal sphincter: a study using anal manometry and transrectal ultrasound. Dis. Colon Rectum, 35(8): 757–761.
29. Jang N., Han T., Kang S. et al. (2010) The short-term effect of neoadjuvant chemoradiation on anorectal function in low and midrectal cancer: analysis using preoperative manometric data. Dis. Colon Rectum, 53(4): 445–449.
30. Pietsch A., Fietkau R., Klautke G. et al. (2007) Effect of neoadjuvant chemoradiation on postoperative fecal continence and anal sphincter function in rectal cancer patients. Int. J. Colorectal Dis., 22(11): 1311–1317.
31. Cornish J., Tilney H., Heriot A. et al. (2007) A meta-analysis of quality of life for abdominoperineal excision of rectum versus anterior resection for rectal cancer. Ann. Surg. Oncol., 14(7): 2056–2068.
Состояние анального сфинктера после неоадъювантной лучевой терапии у больных раком прямой кишки
Национальный институт рака, Киев
Резюме. В настоящее время есть достаточно подтверждений негативного влияния лучевой терапии на функцию анального сфинктера (АС). Однако морфологические изменения, которые приводят к анальной инконтиненции после использования разных схем неоадъювантной лучевой терапии (НЛТ), остаются неизученными. Целью данного исследования было изучение гистологических изменений в тканях АС после использования разных схем НЛТ в комбинированном лечении злокачественных опухолей прямой кишки. Проанализировано гистологические изменения ткани АС у 49 пациентов после НЛТ и экстирпации прямой кишки. 12 пациентам проведена НЛТ в суммарной дозе 20 Гр крупными фракциями, 14 больным — 30 Гр дробными фракциями, 13 пациентам — 50–60 Гр дробными фракциями. В контрольную группу вошли 10 пациентов, которым НЛТ не проводили. Фиброз I степени отмечали преимущественно в группах 20 и 30 Гр, — у 75,1 и 64,3% соответственно. В группе 50–60 Гр фиброз II и III степени выявляли в 46,2 и 30,7% соответственно. Наблюдается тенденция к уменьшению количества нервных элементов при повышении дозы облучения, хотя достоверной разницы не получено (р=0,28). Вследствие лучевой альтерации развиваются дегенеративные и воспалительные изменения в ткани АС, которые приводят к замещению мышечных элементов фиброзной тканью и являются морфологическим субстратом для дальнейших функциональных изменений.
неоадъювантная лучевая терапия, рак прямой кишки, анальный сфинктер.
Адреса:
Колеснік Олена Олександрівна
Національний інститут раку
03022, Київ, вул. Ломоносова, 33/43
Тел.: (044) 259-01-70
E-mail: eakolesnik@ukr.net














Leave a comment