Випадок успішної ліквідації хілотораксу хірургічним методом у хворого на лімфому Ходжкіна
Яременко А.В.1, Галайчук І.Й.2, Бабанли Ш.Р.1, Гуменюк В.В.1, П’ясецький В.Й.1, Шкробот Л.В.1
- 1КУТОР «Тернопільський обласний клінічний онкологічний диспансер»
- 2Тернопільський державний медичний університет ім. І.Я. Горбачевського
Резюме. Описано клінічний випадок хірургічної ліквідації хілотораксу шляхом перев’язки грудної лімфатичної протоки у пацієнта із лімфомою Ходжкіна з ураженням середостіння. Трирічне спостереження за хворим, який після операції отримав хіміотерапію за схемою ABVD (6 циклів) і променеву терапію (у сумарній вогнищевій дозі 40 Гр), показало доцільність вибраної хірургічної та терапевтичної тактики щодо усунення хілореї та лікування пацієнтів з лімфомою Ходжкіна. Зроблено висновок, що у хворих онкологічного профілю слід дотримуватися активної хірургічної тактики з метою якнайшвидшої ліквідації хілотораксу.

Пошкодження грудної лімфатичної протоки (ГЛП) є не частим (1–4%), але серйозним ускладненням після операцій на органах грудної порожнини (ОГП), а також розширених шийних лімфатичних дисекцій [1, 3, 7]. Клінічно травма ГЛП проявляється хілотораксом, хілоперикардом або шийною лімфатичною фістулою. Хілоторакс, який супроводжується респіраторними змінами, метаболічним та імунологічним дисбалансом, належить до потенційно життєво небезпечних післяопераційних ускладнень [2, 8, 9]. Причини хілотораксу: езофагектомія (41,3%), лімфопроліферативні захворювання (17,2%), пульмон- або лобектомія (10,3%), травми (6,9%), тімомектомія, шийна лімфаденектомія, хіміотерапія, опромінення грудної клітки та ін. [3, 4, 6, 9]. Тривале консервативне лікування хілотораксу асоціюється зі смертністю у 50–82% випадків. Результати хірургічної перев’язки лімфатичної протоки є більш обнадійливими, смертність при цьому становить 10–16% [5, 9].
Клінічний випадок
Пацієнт Б., 43 років, госпіталізований у торакальне відділення Тернопільського обласного онкологічного диспансеру 11.04.2011 р. зі скаргами на загальну слабкість, задишку під час ходьби, підвищену температуру тіла до 37,2 ˚С. Вважав себе хворим протягом останніх двох місяців.
Обстеження
Маса тіла пацієнта — 81 кг, зріст — 180 см, площа поверхні тіла — 2,0 м. Під час рентгенографії ОГП виявлено тінь середостіння з поліциклічним контуром, зміщення трахеї вправо. За даними мультиспіральної комп’ютерної томографії (МСКТ), у верхньому відділі переднього середостіння з поширенням на задній відділ візуалізувалося об’ємне утворення негомогенної структури, неправильної овальної форми, з опуклими зовнішніми контурами, розмірами 86,0×71,0×70,0 мм, щільністю +42–71 HU. Пухлиноподібне утворення зміщувало стравохід і трахею праворуч і вперед (рис. 1). Крім того, були множинні паратрахеальні (розміром 5–11 мм), біфуркаційні (7–10 мм), парааортальні (4–9 мм), аксилярні (6 мм) лімфатичні вузли.
При ультразвуковому дослідженні органів черевної порожнини патологічних змін у печінці, селезінці та заочеревинних лімфовузлах не виявлено. За результатами фібробронхоскопії: бронхіальне дерево вільне, поверхневий ендобронхіт.
Загальний аналіз крові (11.04.2011 р.): еритроцити — 3,5•10/л, гемоглобін — 105,0 г/л, лейкоцити — 13,8•10/л, у тому числі паличкоядерні — 0,96•10/л, сегментоядерні — 10,2•10/л, лімфоцити — 2,30•10/л, моноцити — 0,27•10/л; швидкість осідання еритроцитів — 20 мм/год. Біохімічний аналіз крові: глюкоза — 5,4 ммоль/л, загальний білірубін — 11,72 мкмоль/л, сечовина — 5,8 ммоль/л, креатинін — 77,7 мкмоль/л, білок — 73,3 г/л, АсАТ — 0,58 мкмоль/л, АлАТ — 0,74 мкмоль/л.
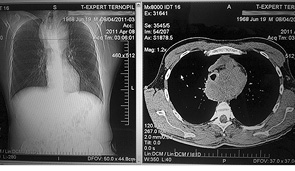
Рис. 1. МСКТ ОГП хворого під час госпіталізації
За результатами обстеження хворого встановлено клінічний діагноз: лімфома Ходжкіна? Тимома?
Трансторакальна аспіраційна біопсія пухлини виявилася неінформативною. 14.04.2011 р. виконано лівобічну діагностичну торакотомію. Під час ревізії виявлено, що пухлинний конгломерат займає усе верхнє середостіння, обмежений дугою аорти знизу, лівою підключичною артерією спереду, хребтом позаду. При ревізії заднього середостіння встановлено, що пухлинне утворення переходить на правий бік, з хребтом не зв’язане. Для морфологічного дослідження з трьох місць взято біоптати тканин розміром 2,5×2,0×1,5 см кожний та виконано пункційну аспіраційну біопсію глибоких шарів пухлини над дугою аорти. Висновок субопераційного цитологічного дослідження: лімфома Ходжкіна. Плевральну порожнину дреновано за Бюлау. Операцію завершено пошаровим ушиванням тканин. Призначено антибактеріальну та інфузійну терапію, надропарин кальцію, знеболювальні засоби.
За 1-шу добу з плевральної порожнини через дренажі виділилося 1000 мл серозного вмісту. На 2-гу добу (16.04.2011 р.) після операції виділення набули молочного забарвлення, діагностовано лівобічний хілоторакс. Найімовірніше, дефект ГЛП містився у місці її переходу на лівий бік в ділянці дуги аорти, де було проведено біопсію тканин пухлини під час діагностичної торакотомії. Хворому призначено безжирову дієту, інфузійну терапію загальним об’ємом до 3000–3500 мл. На 3-тю добу кількість хільозних виділень досягла 2200 мл при діурезі 1300 мл, на 4-ту — 2200 мл (діурез 1350 мл), на 5-ту добу (19.04.2011 р.) хілорея збільшилася до 3000 мл при діурезі 1780 мл.
Загальний аналіз крові (18.04.2011 р.): еритроцити — 3,63•10/л, гемоглобін — 109,0 г/л, лейкоцити — 11,0•10/л, у тому числі паличкоядерні — 0,55•10/л, сегментоядерні — 8,25•10/л, лімфоцити — 1,87•10/л (менше на 18,7% від вихідного рівня), моноцити — 0,33•10/л; швидкість осідання еритроцитів — 21 мм/год. Біохімічний аналіз крові (18.04.2011 р.): глюкоза — 7,21 ммоль/л, загальний білірубін — 11,72 мкмоль/л, сечовина — 7,4 ммоль/л, креатинін — 91,9 мкмоль/л, білок — 60,4 г/л (менше на 17,6% від вихідного рівня), калій — 5,18 ммоль, натрій — 130,6 ммоль, кальцій іонізований — 1,34 ммоль, хлор — 104 ммоль, АсАТ — 0,58 мкмоль/л, АлАТ — 0,74 мкмоль/л. За результатами рентгенографії ОГП (19.04.2011 р.) синуси вільні.
Враховуючи неефективність консервативної терапії, значний об’єм хільозних виділень (3000 мл/добу) та відносно задовільні лабораторні показники крові, вирішено виконати правобічну торакотомію і перев’язати грудну протоку в типовому місці. У день операції (20.04.2011 р.) о 5-й годині ранку хворий випив 300 мл 20,0% вершків для контрастування ГЛП. Через 3 год після цього змінився колір плевральних виділень — вони набули насиченого молочного забарвлення (рис. 2). Під час правобічної торакотомії виявлено пухлину верхньо-заднього середостіння розміром 80,0×70,0 мм без ознак інфільтрації легеневої тканини. Для ідентифікації місцезнаходження ГЛП розсічено медіастинальну плевру від діафрагми на 10,0 см вгору уздовж стравоходу, однак протоки в типовому для перев’язки місці не знайдено. Тоді розсічено медіастинальну плевру між низхідною аортою та непарною веною на рівні кореня легені. У цьому місці виявлено ГЛП білуватого кольору діаметром 2,0 мм (рис. 3). Контрастовану протоку взято на лігатури, двічі перев’язано та пересічено (рис. 4). Плевральну порожнину дреновано за Бюлау. Операцію завершено пошаровим ушиванням тканин.

Рис. 2. Колір плевральних виділень через 3 год після прийому 300 мл 20,0% вершків
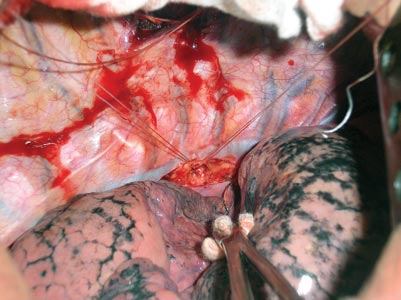
Рис. 3. ГЛП на лігатурах
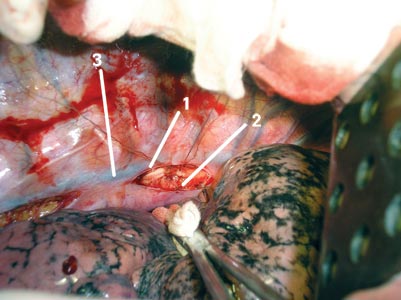
Рис. 4. ГЛП після перев’язування: 1 — дистальний відрізок (розширений); 2 — проксимальний відрізок (звужений); 3 — непарна вена
Перебіг післяопераційного періоду був без особливостей. Під час контрольної рентгенографії (21.04.2012 р.) плевральні синуси були вільні, візуалізувалися дренажні трубки. На 3-й день після повторної торакотомії по дренажах із правої плевральної порожнини були серозні виділення об’ємом 200 мл, а з лівої — 50 мл. У зв’язку з відсутністю хільозних виділень дренаж видалено. На 6-ту добу (26.04.2011 р.) видалено дренажні трубки з правої плевральної порожнини. Внаслідок лімфовтрати зменшилася абсолютна кількість лімфоцитів на 44,8% (з 2,30 до 1,27•10/л) і знизилася концентрація білка в крові на 28,5% (з 73,3 до 52,4 г/л). Дані рентгенографії ОГП (26.04.2012 р.): тінь середостіння розширена у верхніх відділах зі збільшеними паратрахеальними лімфовузлами; плевральні нашарування.
Результат патогістологічного дослідження (від 21.04.2011 р. № 7241-43): лімфома Ходжкіна, нодулярний склероз. Встановлено діагноз класичної лімфоми Ходжкіна з ураженням середостіння, варіант нодулярного склерозу, pS ІІ3–B (X) стадія.
Лікування
Проведено 4 цикли поліхіміотерапії (ПХТ) за схемою ABVD з інтервалом 28 днів. На рентгенограмі ОГП (6.06.2011 р.) після першого циклу ПХТ зафіксовано значне зменшення патологічної тіні середостіння. Третій та четвертий цикли ПХТ супроводжувалися лейкопенією (2,0–3,0•10/л).
За результатами МСКТ від 25.10.2011 р.: структури середостіння розміщені серединно, нормальної ширини; в корені лівої легені збільшений до 12,0×10,0 мм бронхопульмональний лімфовузол; паратрахеально ліворуч на рівні верхньої третини трахеї міститься конгломерат гіподенсивних лімфовузлів розміром 39,0×34,0×53,0 мм. Селезінка розміщена типово, нормальних розмірів, контури чіткі, внутрішня структура однорідна. Висновок: лімфома, паратрахеальний резидуальний процес зліва.
З урахуванням цих даних хворому проведено дистанційну променеву терапію на ділянку середостіння: разова вогнищева доза 2,0 Гр, сумарна вогнищева доза 40,0 Гр (джерело випромінювання Со). Після цього хворий отримав ще п’ятий і шостий цикли ABVD хіміотерапії. Досягнуто ремісії.
Проведено МСКТ (19.04.2012 р.) через 1 рік після торакотомій (рис. 5). За результатами дослідження: органи середостіння розміщені серединно; у корені правої легені бронхопульмональний лімфовузол розміром 10,0 мм, зліва — 4–6 мм. Паратрахеально ліворуч візуалізується гіподенсивна маса розміром 32,0×33,0×49,0 мм. Плевральні нашарування костальної плеври зліва. Плевральні порожнини та порожнина перикарда вільні. Висновок: паратрахеальний постпроменевий фіброз. При додаткових обстеженнях ознак рецидиву захворювання не виявлено. Продовжується динамічне спостереження за пацієнтом. Через 3 роки після операції він почуває себе задовільно, працездатний.
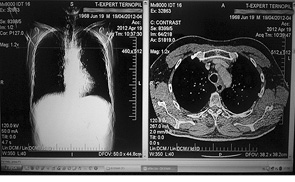
Рис. 5. МСКТ ОГП хворого після завершення хіміопроменевої терапії
Висновки
Лікувальна тактика, вибрана в цьому випадку, виявилася успішною як в хірургічному, так і в хіміотерапевтичному плані. У хворих онкологічного профілю слід дотримуватися активної хірургічної тактики з метою якнайшвидшого припинення хілореї. Перев’язка ГЛП є операцією вибору і ефективним методом ліквідації хілотораксу.
Подяка
За професійні поради, які сприяли успішному лікуванню хворого, автори висловлюють подяку завідувачу кафедри онкології Національної академії післядипломної освіти ім. П.Л. Шупика професору С.Д. Мясоєдову, завідувачу кафедри онкології та медичної радіології Львівського державного медичного університету професору Т.Г. Фецичу, завідувачу науково-дослідного відділу протиракової боротьби Національного інституту раку кандидату медичних наук Ю.Й. Михайловичу.
Список використаної літератури
1. Алгоритмы современной онкологии (2006)/Под ред. И.Б. Щепотина, Г.В. Бондаря, В.Л. Ганула. К.: Книга плюс. 304 c.
2. Андреєщев С.А., Мясоєдов С.Д., Бульба М.В. та ін. (2008) Хірургічна корекція персистуючого хілотораксу. Клінічна хірургія, 9: 5–9.
3. Спиридонов А.А., Аракелян В.С., Малинин А.А. и др. (2003) Тактика лечения экстра- и интраторакальных повреждений грудного протока и его притоков в сердечно-сосудистой хирургии. Анналы хирургии, 2: 39–46.
4. Ilczyszyn A., Ridha H., Durrani A.J. (2011) Management of chyle leak post neck dissection: a case report and literature review. J. Plast. Reconstr. Aesthet. Surg., 64 (9): 223–230.
5. Kumar S., Kumar A., Pawar D.K. (2004) Thoracoscopic management of thoracic duct injury: Is there a place for conservatism? J. Postgrad. Med., 50 (1): 57–59.
6. Paul S., Altorki N.K., Port J.L. et al. (2009) Surgical management of chylothorax. Thorac. Cardiovasc. Surg., 57 (4): 226–228.
7. Smoke A., Delegge M.H. (2008) Chyle leaks: consensus on management? Nutr. Clin. Pract., 23 (5): 529–532.
8. Talwar A., Lee H.J. (2008) A contemporary review of chylothorax. The Indian Journal of Chest Diseases & Allied Sciences, 50: 343–351.
9. Wemyss-Holden S.A., Launois B., Maddern G.J. (2001) Management of thoracic duct injuries after oesophagectomy. Br. J. Surg., 88 (11): 1442–1448.
Случай успешной ликвидации хилоторакса хирургическим методом у больного лимфомой Ходжкина
Тернопольский областной клинический онкологический диспансер
Тернопольский государственный медицинский университет
Резюме. Описан клинический случай хирургической ликвидации хилоторакса путем перевязки грудного лимфатического протока у пациента с лимфомой Ходжкина с поражением средостения. Трехлетнее наблюдение больного, который после операции получил химиотерапию по схеме ABVD (6 циклов) и лучевую терапию (в суммарной очаговой дозе 40 Гр), показало целесообразность выбранной хирургической и терапевтической тактики по устранению хилореи и лечению пациентов с лимфомой Ходжкина. Сделан вывод, что у больных онкологического профиля следует применять активную хирургическую тактику по скорейшей ликвидации хилоторакса.
хилоторакс, перевязка грудного лимфатического протока, лимфома Ходжкина.
Адреса:
Галайчук Ігор Йосифович
46001, Тернопіль, Майдан Волі, 1
Тернопільський державний медичний університет ім. І.Я. Горбачевського
Тел./факс: (0352) 26-86-48
E-mail: halaychuk@gmail.com














Leave a comment