Результати рандомізованого мультицентрового дослідження лікування хворих на лімфому Ходжкіна групи високого ризику за схемами ВЕАСОРР-еск та ВЕАСОРР-14
Крячок І.А.1, Новосад І.О.1, Титоренко І.Б.1, Каднікова Т.В. 1, Мартинчик А.В.1, Алексик О.М.1, Філоненко К.С.1, Пастушенко Я.В.1, Кущевий Є.В.1, Стратієнко В.В. 2, Олєйнік В.С.3, Амдієв А.А. 4
- 1Національний інститут раку, Київ
- 2Херсонський онкодиспансер
- 3Клінічна лікарня № 25, Харків
- 4Крымское Республиканское учреждение «Онкологический клинический диспансер», Симферополь
Резюме. У рамках рандомізованого мультицентрового дослідження «Оптимізувати лікування первинних хворих на лімфому Ходжкіна групи високого ризику» проведено порівняльний аналіз ефективності та токсичності лікування за схемами ВЕАСОРР-14 та ВЕАСОРР-еск. У результаті дослідження виявлено високу ефективність обох схем поліхіміотерапії — переваг однієї або іншої схеми лікування за безпосередніми результатами, 2-річною загальною та безрецидивною виживаністю не відзначено. Серед зареєстрованих видів токсичності переважала гематологічна різного ступеня тяжкості.

Лімфома Ходжкіна (ЛХ) належить до розповсюджених форм онкогематологічних захворювань. У країнах Європи і США показник захворюваності становить 4–6 і 2,8 на 100 тис. населення відповідно (V. Diehl et al., 2004). Ця патологія має найбільшу питому вагу серед онкологічних захворювань у людей молодих вікових груп (15–29 років) і становить понад 28% усіх злоякісних новоутворень. За даними Національного канцер-реєстру України, захворюваність у 2010 р. становила 2,62 на 100 тис. населення і щорічно в Україні діагностують приблизно 1,2 тис. нових випадків хвороби [1].
ЛХ займає особливе місце в історії онкології та гематології. У 1940-х роках ХХ століття загальна 5-річна виживаність ледь сягала 5%. Ситуація кардинально змінилася в кінці 70-х років, коли в практику почали впроваджуватися нові цитостатичні препарати, і ЛХ стала першим потенційно виліковним онкологічним захворюванням. Минуле десятиліття змінило уявлення про лікування первинних хворих на ЛХ. Оцінено результати попередніх програм лікування цієї патології, розроблено нові критерії розподілу хворих за прогностичними групами, запропоновано нові принципи терапії та нові лікувальні програми. У численних клінічних дослідженнях двох останніх десятиліть зафіксовано найкращі комбінації хіміотерапії (ХТ) та оптимальне поєднання променевої терапії та ХТ для лікування хворих на ЛХ [2]. Оптимізація та стандартизація хіміопроменевого лікування, широке використання в клінічній практиці сучасних методів діагностики дозволили підвищити 5-річну виживаність хворих на ЛХ до 70–90%, а також загальну 20-річну виживаність до 60–70%.
Незважаючи на досягнення позитивної відповіді на першу лінію терапії в більшості хворих, у 25–35% пацієнтів з ЛХ розвивається рецидив захворювання в перші 5 років [3]. Так, у розвинутих країнах 5-річна виживаність хворих на ЛХ рідко перевищує 60% [4].
На сьогодні відомо, що планування оптимальної ХТ у хворих із вперше встановленим діагнозом ЛХ необхідно проводити з урахуванням факторів несприятливого перебігу захворювання [5]. Застосування даних факторів для визначення прогнозу перебігу захворювання дає можливість більш диференційовано підходити до лікування хворих на ЛХ [6].
Пацієнти з ЛХ групи високого ризику повинні отримувати інтенсивну первинну поліхіміотерапію (ПХТ) в комбінації з променевою терапією. Ці факти стали основою для розробки більш інтенсивних режимів, таких як BEACOPP і Stanford V [7]. За даними окремих авторів, інтенсифікація терапії у таких хворих дозволяє отримати вищу частоту ремісії захворювання, однак може водночас підвищувати ризик смертності від інших причин. Тому оптимальні схеми ХТ, необхідна кількість курсів, обсяг променевої терапії та дози опромінення у хворих на ЛХ групи високого ризику є предметом безперервних дискусій і підставою для подальших досліджень. Нині також постає питання про значимість токсичних ефектів лікування. Метою терапії ЛХ на сьогодні є отримання максимального ефекту від терапії при мінімумі токсичних проявів та побічних явищ, а також збереження високої якості життя пацієнтів.
Як і в усьому світі, в Україні ведеться пошук найбільш ефективних комбінацій цитостатиків для підвищення ефективності та зменшення токсичності лікування. Зважаючи на оптимістичні дані, отримані при проведенні міжнародних досліджень з інтенсифікації лікування хворих на ЛХ групи високого ризику, в 2008 р. на базі відділення ХТ гемобластозів Національного інституту раку (НІР) розпочато проспективне мультицентрове рандомізоване дослідження «Оптимізувати лікування первинних хворих на ЛХ групи високого ризику».
Матеріали та методи
В основу даного дослідження покладено аналіз безпосередніх та віддалених результатів комплексного лікування 206 хворих на ЛХ стадії ІІВ, ІІІА, ІІІВ, ІVA, IVB з наявністю одного та більше факторів несприятливого прогнозу перебігу захворювання, які перебували на лікуванні у відділенні хіміотерапії гемобластозів НІР з 2009 до 2012 р. (дослідна група). У групу контролю увійшов 51 хворий із вперше встановленим діагнозом ЛХ групи високого ризику, які лікувалися у відділенні онкогематології НІР у період з 2000 до 2008 р. та отримували специфічну терапію за схемою ПХТ ABVD. Діагноз верифіковано згідно з міжнародною клініко-морфологічною класифікацією ВООЗ (2001) на підставі гістологічного матеріалу біопсії. Стадіювання проводили згідно з системою Ann-Arbor із використанням даних комп’ютерної томографії шиї, органів грудної, черевної порожнини, малого таза, із визначенням факторів прогнозу.
Розподіл хворих дослідної групи за протоколом лікування проводили шляхом рандомізації. Перша дослідна група пацієнтів отримала 6–8 курсів ПХТ за протоколом ВЕАСОРР-еск (ескальований), друга дослідна група — за протоколом ВЕАСОРР-14. Хворі з ІІВ стадією одержували променеву терапію на всі залучені зони в сумарній вогнищевій дозі (СВД) 30–36 Гр. Пацієнтам з ІІІ–IV стадією проводили курс променевої терапії на зони лімфатичних вузлів, що залишилися після лікування, >2 см в діаметрі або ПЕТ-позитивні вогнища.
Оцінку безпосередньої ефективності лікування в обох досліджуваних групах проводили після 4; 6; 8 курсів ПХТ згідно з критеріями Сheson (1999, 2007) [8]. Після закінчення первинної терапії кожні 6 міс проводили оцінювання відповіді на лікування з визначенням наявності ремісії або рецидиву захворювання. Виділяли ранній рецидив захворювання (виникнення прогресії до 12 міс) або пізній (прогресія захворювання після 12 міс та більше після завершення лікування). Первинно-резистентними формами вважали випадки виникнення прогресії захворювання на фоні терапії або протягом перших 6 міс після її закінчення.
Результати дослідження
У групі спостереження (n=206) було 92 чоловіки (44,66%) та 114 (55,33%) жінок. 174 пацієнти отримали лікування за дослідницькими протоколами у відділенні ХТ гемобластозів НІР, а 32 включено в дослідження в інших онкологічних закладах (Черкаський онкологічний диспансер, Полтавський онкологічний диспансер, міська клінічна лікарня № 25 м. Харкова, Київський обласний онкологічний диспансер, Херсонський онкологічний диспансер).
Вік хворих коливався від 18 до 61 року (середній вік становив 30,6±0,9 року). Майже половина пацієнтів дослідної групи на момент встановлення діагнозу були у віці 21–30 років (47,0%). Середній вік хворих І групи становив 30,72±7,6 року, а ІІ групи — 29,72±8,4 року (р>0,05).
До включення в дослідницький протокол в усіх хворих виявлено стандартні фактори ризику несприятливого прогнозу перебігу захворювання.
При аналізі дослідної групи за факторами ризику несприятливого прогнозу перебігу захворювання встановлено, що велику пухлинну мали 42,23% хворих групи ВЕАСОРР-еск та 51,56% групи ВЕАСОРР-14, прискорену швидкість зсідання еритроцитів (ШЗЕ) виявлено у 33,3 та 40,6% відповідно, більше 3 зон ураження — у 57,14 та 48,43% відповідно, В-симптоми — у 42,85 та 32,81% відповідно, екстранодальні ураження — у 23,81 та 28,12% відповідно, IV стадію захворювання — у 32,14 та 31,25% відповідно, рівень Нв, нижчий 105 г/л, — у 32,14 та 28,12% відповідно, кількість лімфоцитів <8% — у 15,47 та 15,62% відповідно, кількість лейкоцитів >15×109/л — у 14,28 та 14,06% відповідно, рівень альбуміну, нижчий 40 г/л, — у 10,71 та 15,62% відповідно. За факторами несприятливого прогнозу перебігу захворювання дослідні групи не відрізнялися (р>0,05). У 7 (6,3%) пацієнтів на момент встановлення діагнозу виявлено ураження кісткового мозку патологічними клітинами.
Серед факторів несприятливого прогнозу перебігу захворювання в групі контролю зафіксовано: об’єм пухлинної маси >10 см у 5 (9,8%) хворих, підвищену ШЗЕ — у 13 (25,49%) пацієнтів, більше 3 зон ураження — у 8 (15,68%) та екстранодальне ураження — у 17 (33,33%) пацієнтів, рівень гемоглобіну, нижчий 105 г/л, виявили у 12 (23,52%) хворих, кількість лейкоцитів >15×109/л — у 1 пацієнта (1,96%), кількість лімфоцитів <8% — у 1 (1,96%) хворого, рівень альбуміну та лактатдегідрогенази не визначено в жодного пацієнта.
Розподіл хворих обох досліджуваних груп за стадіями патологічного процесу та схемою лікування наведено в табл. 1.
За протоколом ВЕАСОРР-14 отримали лікування 96 (46,6%) хворих, тоді як за протоколом ВЕАСОРР-еск — 110 (53,4%) пацієнтів (р>0,05).
Загальна кількість курсів ПХТ за схемою ВЕАСОРР-еск становила 601 курс, за схемою ВЕАСОРР-14 — 588 курсів, середня кількість курсів на 1 хворого становила 5,46±0,98 та 6,12±1,02 відповідно (р>0,05). Тобто, обидві групи за кількістю хворих та курсів були рівнозначними.
Таблиця 1. Розподіл хворих на ЛХ групи високого ризику за стадією та схемою лікування (n=206)
| Стадія | ВЕАСОРР-еск (n=110) | ВЕАСОРР-14 (n=96) | р |
|---|---|---|---|
| ІІВ | 24 | 23 | >0,05 |
| ІІІА | 18 | 17 | >0,05 |
| ІІІВ | 24 | 19 | >0,05 |
| ІVА | 22 | 19 | >0,05 |
| ІVВ | 22 | 18 | >0,05 |
| Усього | 110 | 96 | >0,05 |
84 хворих із групи ВЕАСОРР-еск та 77 з групи ВЕАСОРР-14 закінчили лікування за розробленими протоколами, інші пацієнти продовжують лікування. 15 з групи ВЕАСОРР-еск та 11 хворим з групи ВЕАСОРР-14 протокол лікування змінено у зв’язку вираженою токсичністю терапії та проведено лікування за схемами АВVD або ВЕАСОРР-базовий. У 81,25% хворих групи ВЕАСОРР-еск та 63,88% групи ВЕАСОРР-14 лікування зупинено після 6-го або 7-го курсу при підтвердженні повної або часткової ремісії, у зв’язку з високою гематологічною токсичністю терапії.
Оцінка безпосередньої ефективності. Безпосередня загальна ефективність лікування за схемою ВЕАСОРР-еск становила 94,29%, частота повних ремісій — 68,4%, часткових ремісій — 25,89%, стабілізацію захворювання відзначено у 5,71% хворих. Після завершення терапії за схемою ВЕАСОРР-14 загальна ефективність дорівнювала 95,32%, частота повних ремісій — 75,01%, часткових ремісій — 20,31%, стабілізацію захворювання зафіксовано у 4,68% пацієнтів.
Безпосередню загальну відповідь на лікування хворих, що отримували схеми ВЕАСОРР-еск та ВЕАСОРР-14, представлено на рис. 1.
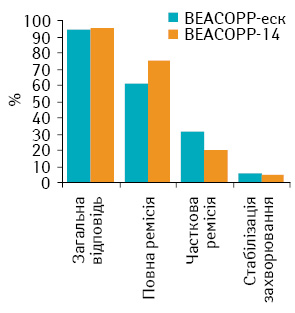
Отже, лікування хворих на ЛХ групи високого ризику з використанням схем ВЕАСОРР-еск та ВЕАСОРР-14 було високоефективним (загальна ефективність становила 94,29 та 95,32% відповідно; р>0,05). Частота повних та часткових ремісій після завершення терапії в досліджуваних групах також суттєво не відрізнялася (р=0,08).
Показник загальної безпосередньої ефективності лікування пацієнтів групи контролю виявився значно нижчим (80,39%) порівняно з його рівнем у дослідних групах (p<0,05).
Оцінка віддалених результатів лікування. Максимальний термін спостереження за хворими дослідних груп становив 52 міс, медіана — 24,7±1,6 міс, за пацієнтами групи контролю — в середньому 4,5 року.
У дослідній групі зафіксовано 10 випадків невдач лікування, серед яких: рецидиви захворювання — у 3,4% (7 хворих) випадків, прогресування хвороби — у 1,35% (3 хворих), смерть від ускладнень — у 1 хворого, смерть від прогресування — у 3.
Середній період спостереження за пацієнтами в групі ВЕАСОРР-еск становив 23,83±14,22 міс, у групі ВЕАСОРР-14 — 21,67±10,16 міс. У групі ВЕАСОРР-14 прогресію захворювання зареєстровано в 1 (1,04%) хворого через 1 міс після завершення лікування, у 2 (2,16%) пацієнтів розвинувся рецидив захворювання, в інших зберігається відповідь на лікування, і лише 1 хворий помер від прогресування. У групі ВЕАСОРР-еск прогресування хвороби під час лікування зафіксовано в 1 (0,9%) пацієнта, рецидив розвинувся після завершення лікування у 5 (4,5%) хворих, 2 особи померли від прогресування захворювання та 1 — від ускладнень.
Тривалість безрецидивного періоду в групі хворих контролю коливалася від 2 до 36 міс, у середньому становила 19,8±2,2 міс. Рецидив захворювання виник у 14 (27,45%) пацієнтів, також зафіксовано 10 (19,61%) смертей від прогресування захворювання за даний період спостереження.
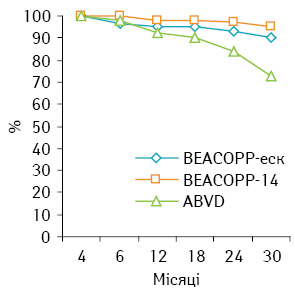
За результатами аналізу лікування хворих на ЛХ групи високого ризику дослідної групи виявлено, що безрецидивна 1-річна виживаність у групі, яка отримала терапію за схемою ВЕАСОРР-еск, становила 95,33%, а в групі ВЕАСОРР-14 — 97,95%, 2-річна безрецидивна виживаність — 90,01 та 95,09% відповідно (р>0,05).
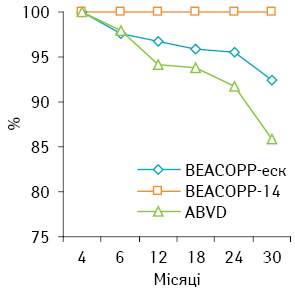
При оцінці загальної 1-річної виживаності встановлено, що в групі ВЕАСОРР-еск вона становить 96,66%, а в групі ВЕАСОРР-14 — 100%, 2-річна загальна виживаність — 95,55 та 100% відповідно (р>0,05).
Виявлено, що безрецидивна виживаність у групі хворих, які отримали лікування за схемою АВVD, значно нижча, ніж в обох дослідних групах (1-річна — 92,8%, 2-річна — 84,6%; р<0,05), що показано на рис. 2.
Загальна виживаність у групі хворих, що отримали терапію за схемою АВVD, значно нижча, ніж в обох дослідних групах (1-річна — 94,11%, 2-річна — 91,8%; р<0,05). Загальну виживаність у групах ВЕАСОРР-еск, ВЕАСОРР-14 та АВVD представлено на рис. 3.
Оцінка токсичності терапії хворих на ЛХ дослідної групи. Сумарно пацієнти обох досліджуваних груп отримали 1189 курсів терапії. Серед зареєстрованої токсичності переважала гематологічна різного ступеня, що виявлено при проведенні 65,75% курсів ПХТ за схемами ВЕАСОРР-еск та ВЕАСОРР-14. Серед проявів гематологічних ускладнень анемія розвинулася в 58,25% випадків, тромбоцитопенія — в 26,46%, нейтропенія — в 67,75% (табл. 2).
Таблиця 2. Гематологічна токсичність лікування за схемами ВЕАСОРР-14 та ВЕАСОРР-еск
| ВЕАСОРР-еск | ВЕАСОРР-14 | р | |||
|---|---|---|---|---|---|
| Загальна, % | ІІІ-IV ступеня, % | Загальна, % | ІІІ-IV ступеня, % | ||
| Анемія | 63,18 | 18,08 | 54,25 | 19,45 | <0,05 |
| Нейтропенія | 72,33 | 46,3 | 62,09 | 42,48 | <0,05 |
| Тромбоцитопенія | 27,65 | 12,45 | 19,9 | 9,45 | <0,05 |
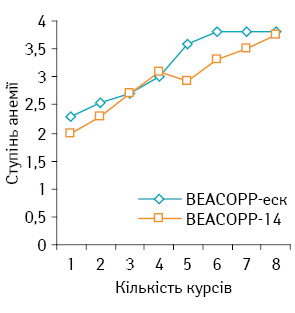
Cередній ступінь тяжкості анемії дещо вищий у хворих, що отримували лікування за схемою ВЕАСОРР-14, але різниця статистично недостовірна (р>0,05) (рис. 4).
Кількість гемотрансфузій, пов’язаних з наявністю анемії при проведенні лікування за схемою ВЕАСОРР-еск, становила 3,89%, за схемою ВЕАСОРР-14 — 6,1%. Слід відзначити, що значна кількість гемотрансфузій зумовлена наявністю у хворої П. анемії IV ступеня у момент встановлення діагнозу, у зв’язку з чим пацієнтка потребувала переливання еритроцитарної маси (загальна кількість переливань — 14). 10 хворих обох груп отримували альфа-еритропоетин. У цих хворих після 4 тиж лікування рівень гемоглобіну підвищився на 18,1% (до лікування середній рівень гемоглобіну становив 73,1±8,0 г/л, а після лікування — 86,36±16,36 г/л).
Ступінь нейтропенії залежно від кількості курсів вищий при проведенні лікування за схемою ВЕАСОРР-еск (рис. 5). Хворим з 9-го дня курсу ПХТ вводили колонієстимулюючий фактор (КСФ) у дозі 50 мкг/кг на 9, 10, 11-ту добу з профілактичною або лікувальною метою до підвищення рівня нейтрофілів ≥2 г/л. До початку наступного курсу майже у всіх хворих, яких лікували за схемою ВЕАСОРР-еск, відновлювався рівень гранулоцитів, що дозволяло вчасно розпочати наступний курс. У 12 пацієнтів при проведенні 6–8-го курсу в групі ВЕАСОРР-14 перед початком наступного курсу зберігалася нейтропенія III–IV ступеня, незалежно від призначення КСФ, тому наступний курс розпочато з затримкою в 4–7 днів. У 16 (3,7%) випадках курс ХТ ВЕАСОРР-14 не завершено у зв’язку з наявністю нейтропенії III–IV ступеня на 8-й день курсу ПХТ. Фебрильну нейтропенію виявили у 3,7% пацієнтів, які отримували лікування за схемою ВЕАСОРР-еск, у хворих групи ВЕАСОРР-14 — у 3,5% випадків. Тривалість фебрильної нейтропенії коливалася від 2 до 6 діб.
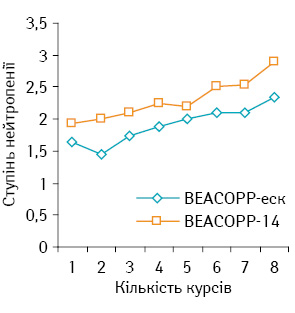
Ступінь тромбоцитопенії зростав від І ступеня на 1–2-му курсі терапії до ІІ–IV на 4-му та 8-му курсі. Жоден хворий не потребував призначення тромбоконцентрату для лікування ускладнень. Ступінь тромбоцитопенії дещо вищий при терапії за схемою ВЕАСОРР-еск (р>0,05) (рис. 6).
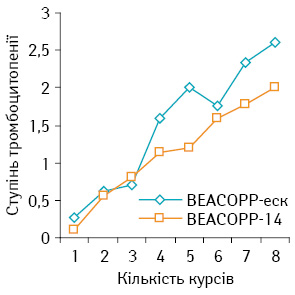
Негематологічні ускладнення помірно виражені в обох досліджуваних групах. Найбільш частими проявами були нудота та блювання різного ступеня — у 46,7% хворих. При лікуванні за схемою ВЕАСОРР-еск нудоту та блювання зафіксовано в 44,6% випадків, за схемою ВЕАСОРР-14 — у 31,3% пацієнтів. У подальшому, при проведенні повторних курсів ПХТ, частота й інтенсивність нудоти та блювання зростали.
Стоматит розвинувся після закінчення курсу ВЕАСОРР-еск у 6,1% пацієнтів, після курсу ВЕАСОРР-14 — у 11,79% випадків. У 7 хворих (5 пацієнтів з групи ВЕАСОРР-еск та 2 з групи ВЕАСОРР-14) діагностували нейропатію I ступеня, у 1 хворої, яка отримала лікування за схемою ВЕАСОРР-еск, розвинулися парез кишечнику та ниркова недостатність IV ступеня.
У 3,12% хворих, які отримували лікування за схемою ВЕАСОРР-14, виникла пневмонія, у 1,04% (1 пацієнт) — інфільтративний мастит.
У групі ВЕАСОРР-еск пневмонію під час лікування діагностували у 6 хворих (5,45%), абсцес аксилярної ділянки у 1 (0,9%) хворого. У 2 (1,81%) пацієнтів розвинувся гнійний парапроктит (після 1-го та 5-го курсів). Цим хворим призначено лікування за схемою АВVD. Отже, інфекційні ускладнення виявлено у 9 хворих, що отримували терапію за схемою ВЕАСОРР-еск (8,18%), тобто значно більше, ніж в групі ВЕАСОРР-14 (4,16%; р<0,05).
Після завершення лікування у 2 хворих зареєстровано асептичний некроз голівки стегнової кістки та у 1 — асептичний некроз голівки плечової кістки.
У 2 пацієнтів, що отримували лікування за схемами ВЕАСОРР-еск, після 6-го курсу терапії розвинувся токсичний гепатит, терапію зупинено.
Висновки
1. Для планування терапії хворих на ЛХ необхідно проводити обстеження з визначенням факторів ризику залежно від групи ризику.
2. Ефективність лікування пацієнтів з ЛХ групи високого ризику за схемою ABVD є незадовільною та становить 80,39%, безрецидивна 2-річна та загальна виживаність дорівнює 84,6 та 91,8% відповідно.
3. Лікування хворих на ЛХ групи високого ризику з використанням схем ВЕАСОРР-14 і ВЕАСОРР-еск є високоефективним, загальна ефективність терапії за схемою ВЕАСОРР-еск становить 94,29%, за схемою ВЕАСОРР-14 — 95,32%. Безрецидивна 2-річна та загальна виживаність за схемами ВЕАСОРР-еск становлять 90,01 та 95,55% відповідно, за схемою ВЕАСОРР-14 — 95,09 та 100% відповідно.
4. Токсичність терапії за схемами ВЕАСОРР-14 та ВЕАСОРР-еск переважно гематологічна. Її показники зіставні в обох дослідних групах. Частота виявлення анемії переважала в групі хворих, які отримували лікування за схемою ВЕАСОРР-14, тоді як нейтропенії — у групі хворих, яких лікували за схемою ВЕАСОРР-еск. Негематологічні ускладнення помірно виражені в обох дослідних групах, найбільш частими проявами були нудота та блювання різного ступеня — у 46,7% хворих.
Список використаної літератури
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2011) Рак в Україні. Бюл. нац. канцер-реєстру України. Київ, 13: 64–65.
2. Engert A., Eichenauer D.A., Dreyling M. (2009) Hodgkin’s lymphoma: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann. Oncol., 20 (Suppl 4: inv 108–inv109).
3. Lister A. (2008) Treatment of Stage IIIa Hodgkin’s Disease: Long Follow-Up Perspective. J. Clin. Oncol., 26(32): 5144–5146.
4. Diehl V. (2003) Advanced Hodgkin’s disease: ABVD is better, yet is not god enough! J. Clin. Oncol.; 21: 583–5.
5. Engert A., Diehl V., Franklin J. et al. (2009) Escalated-dose BEACOPP in the treatment of patients with advanced-stage Hodgkin’s lymphoma: 10 years of follow-up of the GHSG HD9 study. J. Clin. Oncol., 27(27): 4548–54.
6. Lister T.A., Crowther D. (1990) Staging for Hodgkin’s disease. Semin. Oncol., 17(6): 696–703.
7. Diehl V., Franklin J., Pfreundschuh M. et al. (2003) Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin’s disease. N. Engl. J. Med., 348: 2386–2395.
8. Cheson B.D., Pfistner B., Juweid M.E. et al. (2007) International Harmonization Project on Lymphoma. Revised response criteria for malignant lymphoma. J. Clin. Oncol., 25(5): 579–586.
Результаты рандомизированного мультицентрового исследования лечения больных лимфомой Ходжкина группы высокого риска по схемам ВЕАСОРР-эск и ВЕАСОРР-14
Резюме. В рамках рандомизированного мультицентрового исследования «Оптимизировать лечение первичных больных лимфомой Ходжкина группы высокого риска» проводится сравнительный анализ эффективности и токсичности лечения по схемам ВЕАСОРР-14 и ВЕАСОРР-эск. В результате исследования выявлена высокая эффективность обеих схем полихимиотерапии — преимуществ одной или другой схемы лечения по непосредственным результатам, 2-летней общей и безрецидивной выживаемости не отмечено. Среди зарегистрированных видов токсичности преобладала гематологическая разной степени тяжести.
Ключевые слова: лимфомa Ходжкина, химиотерапия, ВЕАСОРР-14, ВЕАСОРР-эск, эффективность, токсичность, выживаемость.
BEACOPP-14 vs BEACOPP-esc in patients with Hodgkin’s lymphoma from poor-prognosis group: analisys of prospective randomized multicenter trial
Summary. In a randomized, multicenter study «Optimize treatment of primary Hodgkin’s lymphoma patients with high-risk» presents a comparative analysis of the efficacy and toxicity of treatment regimens ВEAСOРР-14 and ВЕАСОРР-esс. The study revealed a high efficiency of both regimen of chemotherapy. No difference in results 2-year overall and disease-free survival in both regimens of chemotherapy. Among registered the prevailed toxicity was hematological toxicity varying degrees.
Key words: Hodgkin’s lymphoma, chemotherapy, BEACOPP-14, BEACOPP-esc, effectiveness, toxicity, survival rate.














Leave a comment