Урологія
Эволюция методов хирургической коррекции везикоуретрального сегмента при гиперплазии предстательной железы
П.С. Серняк1, С.Н. Шамраев1, Ю.А. Виненцов1, В.Г. Кобец2, А.Н. Кнышенко1
1Донецкий национальный медицинский университет им. Максима Горького, Донецк, Украина2
Донецкое областное клиническое территориальное медицинское объединение, Донецк, Украина
До второй половины 50-х годов XX ст. мы чаще выполняли двухмоментную чреспузырную простатэктомию (ЧПЭ). С бурным развитием анестезиологии началось широкое освоение этого вмешательства, которое проводили и с глухим швом мочевого пузыря. Затем внедрена ургентная ЧПЭ. С 1989 г. получили широкое распространение позадилобковая простатэктомия (ППЭ) и трансуретральная резекция предстательной железы (ТУРПЖ).
Цель работы — проанализировать эволюцию методов хирургической коррекции везикоуретрального сегмента при гиперплазии предстательной железы (ГПЖ).
Проведен анализ результатов хирургических методов лечения 6774 больных ГПЖ с 1989 по 2012 г. в клинике урологии Донецкого национального медицинского университета (ДонНМУ) им. Максима Горького. Большинство пациентов были в возрасте от 61 года до 80 лет (80,2%). У 92% прооперированных выявлены осложненные формы ГПЖ.
Анализ методов хирургического вмешательства при ГПЖ показал, что ЧПЭ выполнена у 1088 (16,1%) пациентов, ППЭ — 3421 (50,5%), ТУРПЖ — 2265 (33,4%). Оперированные больные были разделены на 5 групп: в первую группу включены пациенты с периодом наблюдения с 1989 по 1993 г., вторую — с 1994 по 1998 г., третью — с 1999 по 2003 г., четвертую — с 2004 по 2008 г., пятую — с 2009 по 2012 г. В первой группе ЧПЭ выполнена у 478 (29,1%), ППЭ — 940 (57,3%), ТУРПЖ — 223 (13,6%) больных. Летальность в первой группе после открытых вмешательств составила 2,3%, что на 1,4% больше по сравнению с ТУРПЖ за тот же период. Во второй группе ЧПЭ проведена у 322 (18,4%) пациентов, ППЭ — 1020 (58,4%), ТУРПЖ — 405 (23,2%); летальность после открытых хирургических вмешательств за анализируемый период составила 1,3%, после эндоскопических — 0,7%. В третьей группе ЧПЭ выполнена у 112 (11,8%) пациентов, ППЭ — 539 (56,8%), ТУРПЖ — 298 (31,4%); летальность составила 1,2 и 0,7% соответственно для открытой и ТУРПЖ. В четвертой группе ЧПЭ применена у 118 (10,3%) пациентов, ППЭ — 571 (49,8%), ТУРПЖ — 457 (39,9%). Летальность, как и ранее, после открытых вмешательств была выше, чем после эндоскопических, и составляла 1,2 и 0,5% соответственно. В пятой группе ЧПЭ выполнена у 58 (4,5%) больных, ППЭ — 351 (27,2%), ТУРПЖ — 882 (68,3%). Умерших после операции за период с 2009 по 2012 г. не было. После 2004 г. соотношение открытых хирургических вмешательств к эндоскопическим увеличилось в сторону последних.
Изучение проблемы ГПЖ отражает эволюцию хирургических методов лечения пациентов с этой болезнью в клинике урологии ДонНМУ им. Максима Горького. Критическая оценка двухмоментной ЧПЭ позволила перейти к одномоментной ЧПЭ с глухим швом мочевого пузыря и ургентной ЧПЭ, которые уменьшили количество гнойно-септических осложнений и улучшили реабилитацию больных. ЧПЭ показана при сопутствующих заболеваниях мочевого пузыря (дивертикул и/или резектабельная опухоль мочевого пузыря). Освоение ППЭ сократило продолжительность пребывания больных в стационаре, уменьшило количество послеоперационных осложнений и повысило качество жизни пациентов. Приобретение оборудования для диагностики и проведения эндоурологических вмешательств позволило с начала 90-х годов XX ст. внедрить ТУРПЖ при ГПЖ. В настоящее время лидирующую позицию в хирургическом лечении при ГПЖ занимает ТУРПЖ (65,5% от всех хирургических вмешательств в 2012 г.).
Порівняння показників урофлоуметрії у хворих із доброякісною гіперплазією передміхурової залози при хірургічному лікуванні залобковим та черезміхуровим доступом
І.В. Барало
Курс урології кафедри хірургії № 1, Вінницький національний медичний університет ім. М.І. Пирогова, Вінниця, Україна
При показаннях до хірургічного втручання у хворих їх доброякісною гіперплазією передміхурової залози (ДГПЗ) відкриті операції виконують при об’ємі передміхурової залози >80 см3. Як правило, це надлобковий черезміхуровий (ЧД) або залобковий позаміхуровий доступ (ПД). Промежинний доступ застосовують сьогодні при радикальній простатектомії у хворих на рак передміхурової залози. У лікуванні пацієнтів із ДГПЗ промежинний доступ майже не застосовують. Перевагою залобкового доступу перед черезміхуровим вважають відсутність травматизації детрузора.
Мета дослідження — порівняти показники урофлоуметрії на стаціонарному етапі лікування та в період подальшого спостереження після простатектомій ЧД та ПД.
У двох групах хворих із ДГПЗ, репрезентативних за віком та особливостями перебігу хвороби, яким в плановому порядку виконували простатектомію ЧД (n=25) та ПД (n=35), проводили урофлоуметрію на 8-му–10-ту добу в ранній післяопераційний період на стаціонарному етапі лікування та через 2 міс на етапі подальшого спостереження. Порівняння проводили, оцінюючи такі показники, як: кількість виділеної під час сечовипускання сечі (Vurea) та максимальна швидкість потоку сечі (Qmax). Дослідження виконували на вітчизняному урофлоуметрі «Уровін-1». Також порівнювали тривалість стаціонарного лікування. Достовірність різниці порівнюваних даних оцінювали за допомогою критерію відмінностей Стьюдента (р). Статистичну обробку даних виконували за допомогою програми Microsoft Excel на персональному комп’ютері з процесором Intel® Core™ i3-3227U CPU з оперативною пам’яттю 1,9 ГГц.
Показники урофлоуметрії напередодні виписки зі стаціонару були такими: у групі ЧД Vurea становила 118,8±26,2 мл, Qmax — 16,1±3,5 мл/с; в групі ПД Vurea — 137,8±23,3 мл (p=0,3), Qmax — 15,8±2,2 мл/с (p=0,5).
У віддалений післяопераційний період: у групі ЧД Vurea становила 202,5±33,1 мл, Qmax — 21,2±2,9 мл/с; у групі ПД Vurea — 201,7±40,2 мл (p=0,5), Qmax — 23,4±5,1 мл/с (p=0,4).
Післяопераційне перебування в стаціонарі в порівнюваних групах становило: у групі ЧД 14,4±0,6 ліжко-дня та в групі ПД 8,7±0,3 ліжко-дня (р<0,0001).
Проведені урофлоуметричні дослідження у хворих із ДГПЗ після операцій ЧД та ПД не виявили статистично достовірних відмінностей у відновленні накопичувальної здатності сечового міхура та максимальної швидкості сечовипускання. Це може свідчити про те, що відновлення прохідності уретри відбувається в післяопераційний період, незалежно від хірургічного доступу до вузлів гіперплазії. Значно менша тривалість післяопераційного перебування на ліжку у хворих після ПД пояснюється меншою травматизацією тканин, відсутністю рани стінки сечового міхура, майже повною відсутністю підтікання сечі в рану вже з 1-ї доби після операції.
Трансуретральна резекція при об’ємі доброякісної гіперплазії передміхурової залози більше 80 см3
О.С. Федорук1, В.Й. Вітрук2, Ю.А. Малевич2, Д.В. Осадчук2, В.В. Васильєв2
1Буковинський державний медичний університет,
Чернівці, Україна
2Тернопільська міська комунальна лікарня швидкої допомоги, Тернопіль, Україна
Вдосконалення хірургічних методів, розширення показань до їх проведення, а також профілактика післяопераційних ускладнень — запорука ефективного лікування хворих із доброякісною гіперплазією передміхурової залози.
Мета дослідження — оцінити ефективність трансуретральної резекції (ТУР) передміхурової залози при лікуванні хворих із доброякісною гіперплазією передміхурової залози великого об’єму.
Проведено ретроспективний аналіз лікування 548 хворих із доброякісною гіперплазією передміхурової залози, яким з 2007 по 2013 р. в Тернопільській міській лікарні швидкої допомоги виконано ТУР передміхурової залози. Вік пацієнтів становив від 49 до 86 років (69,5±8,8 року), тривалість захворювання — від 1 міс до 15 років (5,2±3,1 року). З гострою затримкою сечі було госпіталізовано 126 (23,0%), ознаками парадоксальної ішурії — 46 (8,4%), наявністю цистостомічного дренажу — 8 (1,5%) хворих.
Після проведеного комплексного обстеження, яке включало оцінку рівня простатичного специфічного антигену, пальцеве ректальне обстеження, ультразвукове дослідження (УЗД) органів сечовидільної системи із визначенням об’єму передміхурової залози і залишкової сечі та виключенням злоякісного захворювання, всім хворих проведено ТУР передміхурової залози з використанням резектоскопа фірми «Karl Storz» з петлею 27F.
Залежно від об’єму передміхурової залози хворих розподілено на дві групи: до першої групи включено 457 (83,4%) пацієнтів, в яких об’єм передміхурової залози становив ≤80 см3, до другої — 91 (16,6%) хворого з об’ємом передміхурової залози >80 см3. Слід відмітити, що серед пацієнтів другої групи у 42 (46,1%) випадках оперативне втручання виконували в ургентному порядку, в 33 (36,3%) — при вираженій супутній патології та протипоказаннях до відкритої методики, а в 16 (17,6%) — при категоричній відмові від черезміхурової аденомектомії.
За результатами УЗД: об’єм передміхурової залози становив 23–101 см3 (65,2±23,4 см3), об’єм залишкової сечі у хворих зі збереженим актом сечовипускання варіював від 90 до 350 мл (248±73 мл). Тривалість оперативного втручання становила 35–115 хв (70±25 хв). У жодного хворого обох досліджуваних груп не діагностовано ТУР-синдрому та кровотечі. Статистичної різниці в групах порівняння за віком, тривалістю захворювання, кількістю хворих із відсутністю акту сечовипускання та тривалістю операції не виявлено (p>0,05).
Кровотеча з ложа передміхурової залози в ранній післяопераційний період виникла у 14 (3,1%) хворих першої групи та 3 (3,3%) — другої, її ліквідували компресією ложа передміхурової залози балоном катетера Фолея та проведенням гемостатичної терапії. У всіх хворих відновлено адекватний акт сечовипускання, однак у 5 (1,1%) пацієнтів першої групи та 1 (1,1%) хворого другої групи після видалення катетера виникли ознаки часткового нетримання сечі, які зникли з плином часу.
Період катетеризації сечового міхура був достовірно довшим і становив 4,6±1,8 ліжко-дня — у пацієнтів другої групи проти 3,6±1,5 ліжко-дня — у хворих першої групи, так само, як і післяопераційний ліжко-день (5,8±1,6 проти 4,6±1,8 ліжко-дня відповідно), що в основному було пов’язано із більшим об’ємом видаленої тканини передміхурової залози (р=0,03).
ТУР при об’ємі передміхурової залози >80 см3 є операцією вибору, яка дозволяє отримати позитивні результати лікування при низьких показниках інтра- та післяопераційних ускладнень, а також скорочує перебування хворого в стаціонарі.
Аутоуретрографія — ефективний метод діагностики інфравезикальної обструкції у чоловіків
М.В. Зеляк
Івано-Франківський національний медичний університет,
Івано-Франківськ, Україна
Для діагностики стриктур уретри у чоловіків використовують ендоскопічні, променеві та уродинамічні методи. Контрастній ретроградній та мікційній цистоуретрографії надають першочергового значення. Однак традиційна методика ретроградної уретрографії не позбавлена недоліків: сечівник заповнюють рентгеноконтрастною речовиною вручну за допомогою шприца з гумовим наконечником, тому у зоні дії рентгенівського випромінювання опиняються руки лікаря та інші частини його тіла, що може призвести до їхнього променевого ураження. Для усунення зазначених недоліків запропоновано пристрої для уретроцистографії різних конструкцій, методики ретроградної динамічної дозованої уретроцистографії та аутоуретрографії. Остання методика передбачає введення рентгеноконтрастної речовини в сечівник самим хворим за допомогою шприца, з’єднаного з катетером Фолея. Однак і цей метод має певні недоліки.
Нами розроблено вдосконалену методику аутоуретрографії. Для попередження травматичних пошкоджень тканин статевого члена, покращення обтурації просвіту сечівника і підвищення діагностичної цінності уретрограм запропоновано пристрій для уретрографії у чоловіків.
Мета дослідження — оцінка ефективність запропонованої методики аутоуретрографії.
За допомогою аутоуретрографії з використанням вдосконаленого пристрою, яку доповнювали мікційною цистоуретрографією та, за необхідності, уретроцистоскопією, обстежили 257 чоловіків із дизурією віком 14–73 роки. Пристрій складався: з катетера з торцевим отвором та із закріпленого на ньому за допомогою двопроменевої вуздечки еластичного шнура, що утворював петлю, діаметр якої можна змінювати. На одному кінці еластичного шнура зроблено кільце з язичком, а на протилежному закріплено затискач. До петлі еластичного шнура за допомогою лігатури, кінці якої фіксовані на протилежних боках петлі, можна підвішувати вантаж. Кінець катетера виступав назовні за площину петлі приблизно на 1 см.
Усі пацієнти легко перенесли дослідження. Для його виконання, включаючи мікційну цистоуретрографію, потрібно було не більше часу, ніж для традиційної методики. Не спостерігали екстравазації рентгеноконтрастної речовини за межі просвіту сечівника. У всіх пацієнтів добре візуалізувалася передня уретра (рисунок).
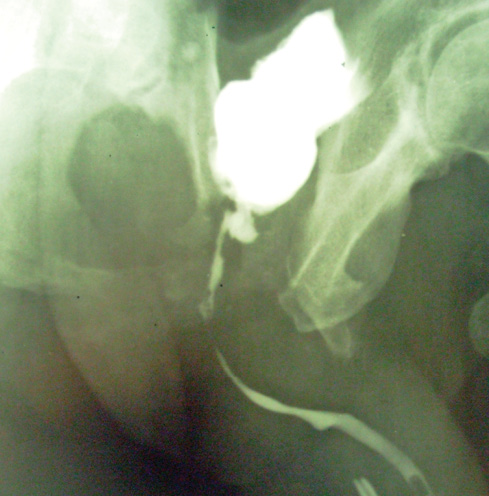
Рисунок. Аутоуретрограма хворого М. Численні запальні звуження сечівника, деформація сечового міхура та його шийки
У жодного хворого протягом кількох діб після дослідження не спостерігали уретрорагії, дизурії чи уретральної лихоманки. Ретроградного контрастування задньої уретри досягнули у 234 (91,05%) з 257 пацієнтів. На основі дослідження встановили, що 251 пацієнт мав рентгенологічні ознаки стриктури уретри, 4 — сечівниково-промежинну норицю, ще 2 — дивертикул сечівника.
Використання запропонованого нами вдосконаленого пристрою для уретрографії у чоловіків дозволяло легко проводити дозовану тракцію для вирівнювання згинів сечівника в пеноскротальному куті. Це значно підвищувало якість уретрограм, оскільки попереджувало накладання на рентгенограмах незмінених ділянок сечівника на уражені. Покращену методику і пристрій для уретрографії в чоловіків вдосконаленої конструкції можна застосовувати навіть у пацієнтів зі стенозом дистального відділу сечівника, який пропускає лише катетер № 4 за шкалою Шар’єра.
Удосконалена методика аутоуретрографії є нетравматичною для пацієнтів, дозволяє знизити ризик пошкодження сечівника та уникнути опромінення лікаря.
Використання PRP для лікування синдрому хронічного тазового болю і порушень сечовипускання у жінок у період менопаузи
В.В. Лисенко¹, О.М. Чайка¹, О.В. Лук’янчук¹, В.В. Сажиєнко1, О.Д. Меленевський²
1Центр реконструктивної та відновної медицини (Університетська клініка) Одеського національного медичного університету, Одеса, Україна
²Урологічне відділення міської лікарні № 10, Одеса, Україна
Синдром хронічного тазового болю і больовий синдром сечового міхура зумовлені, в першу чергу, атрофічними змінами тканин, тканинною гіпоксією та є частою причиною зниження якості життя жінок у період менопаузи. Раніше в експерименті на тваринах нами доведено, що ін’єкції PRP (Platelet-rich plasma) сприяють неоангіо- і нейрогенезу та покращують трофічні якості слизової оболонки сечового міхура (Костєв Ф.І. та ін. (2013) Вісник морфології, 2(19): 264–268). Таким чином, використання PRP у пацієнток з атрофічними змінами сечового міхура і піхви може вплинути на синдром хронічного тазового болю у цієї категорії хворих.
Мета роботи — вивчити вплив ін’єкцій PRP на інтенсивність синдрому хронічного тазового болю і больового синдрому сечового міхура пацієнток у період менопаузи.
У дослідженні взяли участь 40 пацієнток із больовим синдромом сечового міхура і синдромом хронічного тазового болю у період менопаузи. Пацієнтів із загальної вибірки шляхом рандомізації розподілено на дві клінічні групи. У досліджуваній групі (n=20) застосовували місцеву гормональну замісну терапію препаратами, що містять естрогени, та внутрішньоміхурову терапію, що супроводжувалися парауретральною ін’єкцією PRP. Контрольну групу (n=20) сформували пацієнтки, у яких проводили тільки місцеву замісну гормональну терапію та внутрішньоміхурову терапію. Оцінювали інтенсивність больового синдрому за шкалою VAS і якість життя пацієнток за даними опитувальників. Статистичну обробку проводили за допомогою програмного забезпечення Statistica 6.0 («StatSoftInc.», США).
При оцінці ефективності лікування, за даними опитувальників, у досліджуваній групі відзначали зниження середнього значення інтенсивності болю з 6,7±0,25 до 1,2±0,24 бала, тоді як в контрольній групі цей показник становив 6,55±1,35 і 4,05±2,3 бала відповідно. Таким чином, обидві методики були ефективними в лікуванні хворих із синдромом хронічного тазового болю і больовим синдромом сечового міхура, але достовірно більш значуще зниження інтенсивності больових відчуттів реєстрували у досліджуваній групі (t=5,3, p=0,000034) порівняно з контрольною.
Використання парауретральних ін’єкцій PRP покращує трофічні властивості тканин тазового дна, що супроводжується статистично достовірним зменшенням вираженості синдрому хронічного тазового болю і больового синдрому сечового міхура.
Слід використовувати парауретральні ін’єкції PRP у випадках неефективності традиційної місцевої замісної гормонотерапії атрофічних кольпітів, циститів у пацієнток у період менопаузи або у тих випадках, коли естрогенотерапія протипоказана.
Досвід застосування трансобтураторної субуретральної петльової пластики набором «Укртехмедслінг» при лікуванні жінок зі стресовим нетриманням сечі
В.І. Горовий¹, В.П. Головенко¹, Р.К. Балацький², Н.В. Магалецька³
¹Вінницька обласна клінічна лікарня ім. М.І. Пирогова,
Вінниця, Україна
²Вінницька міська лікарня швидкої медичної допомоги,
Вінниця, Україна
³Житомирська обласна клінічна лікарня ім. Г.Ф. Гербачевського, Житомир, Україна
Стресове нетримання сечі, за даними літератури, трапляється у кожної 3–4-ї жінки віком старше 40 років, за відсутності пролапсу тазових органів хірургічне втручання виконують лише у 5–10% пацієнток. Серед хірургічних методів лікування найпопулярнішим сьогодні є малоінвазивний трансобтураторний слінг (субуретральна петльова пластика, у гінекологічній літературі — уретропексія). Майже кожна розвинена країна випускає свій набір для трансобтураторного слінга.
Мета дослідження — вивчити безпосередні та віддалені результати виконання трансобтураторного слінга за допомогою вітчизняного набору «Укртехмедслінг» у жінок зі стресовим нетриманням сечі.
За останні 3 роки трансобтураторний слінг набором «Укртехмедслінг» (методика inside-out) виконано у 21 жінки зі стресовим нетриманням сечі. Вік хворих коливався від 36 до 72 років, середній — 46,3 року. Нетримання сечі І ступеня (нетримання сечі лише у вертикальному положенні) відмічено у 16 (76,2%) пацієнток, ІІ ступеня (нетримання сечі у вертикальному та лежачому положенні) — 5 (23,8%). Початкові ступені пролапсу тазових органів (цистоцеле, ректоцеле) відмічено у 2 (9,5%) жінок. Як слінг використовували поліпропіленову сітку «Українська кольчуга» довжиною 45 см та шириною 1,2 см.
Ускладнень під час виконання операції (пошкодження сечового міхура, уретри, гематома та кровотеча із рани та ін.) не зафіксовано. 20 (95,2%) пацієнток виписано з відділень із повним утриманням сечі, 1 (4,8%) — із покращенням (втрачала сечі значно менше, ніж до операції). У віддалений післяопераційний період рецидиву нетримання сечі та ерозії стінки піхви не відзначали, гіперактивність детрузора de novo виникала у 2 (9,5%) хворих.
Перші безпосередні та віддалені результати застосування трансобтураторного слінга вітчизняним набором «Укртехмедслінг» з використанням поліпропіленової сітки «Українська кольчуга» у жінок зі стресовим нетриманням сечі задовільні, що дозволяє рекомендувати дану методику для ширшого використання в практиці хірургів-урологів та хірургів-гінекологів.
Досвід хірургічного лікування при парапельвікальних кістах нирки
О.С. Федорук, М.С. Степанченко, К.А. Владиченко, В.В. Візнюк, Д.І. Волошинський
Буковинський державний медичний університет,
Чернівці, Україна
Парапельвікальні кісти (ПК) реєструють у 6% випадків вроджених ниркових кіст. За останні 5 років в урологічному відділенні лікарні швидкої медичної допомоги м. Чернівці перебували на лікуванні 14 хворих віком від 34 до 59 років (6 чоловіків і 8 жінок) із ПК. У 9 пацієнтів кісти розташовувалися у воротах правої та у 5 — лівої нирки.
Основним методом діагностики ПК була екскреторна урографія. Ультразвукове дослідження дозволяло визначити відношення кісти до ниркової ніжки, встановити розміри кісти, її локалізацію. Ці дані враховували при плануванні операції та вирішенні питання про первинну мобілізацію передньої чи задньої поверхні нирки. За нашими даними, достовірність методу становила 90%. Дані комп’ютерної томографії нерідко ставали вирішальними у визначенні об’єму і характеру операції, особливо у хворих із вираженим гідрокалікозом і потоншенням паренхіми нирки.
Усі 14 хворих із ПК нирки були оперовані. У 3 проведено висічення зовнішньої стінки кісти відкритим способом, у 1 виконано нефректомію у зв’язку з термінальною стадією гідронефротичної трансформації, у 10 висічення зовнішньої стінки кісти проведено ретроперитонеоскопічно. Оптимальним методом хірургічного втручання при ПК до появи у відділенні лапароскопічного обладнання було відкрите висічення зовнішньої поверхні кісти без видалення її задньої стінки для попередження пошкодження порожнинної системи нирки та подальшого виникнення післяопераційних сечових нориць, проте наразі такий об’єм оперативного втручання можна виконувати ендоскопічним методом. Серед переваг останнього: низька травматичність, скорочення ліжко-дня, порівняна легкість виконання операційного прийому у важкодоступних місцях та на малому просторі.
В 11 оперованих хворих проводили інтраопераційну біопсію паренхіми нирки. При аналізі результатів гістологічного дослідження тканини нирки, як правило, виявляли картину хронічного пієлонефриту. На наш погляд, розвиток хронічного пієлонефриту зумовлено розладом гемодинаміки нирки в результаті стиснення вен і зміщення артерій кістою. Гістологічні дослідження стінки кісти показали, що вона складалася з фіброзної тканини з ділянками гіалінозу та вогнищами лімфо-гістіоцитарної інфільтрації. У жодному випадку не зафіксовано малігнізації стінки кісти, що, на нашу думку, пов’язано зі своєчасною діагностикою та раннім оперативним втручанням.
Таким чином, діагностика ПК має починатися з ультразвукового сканування як скринінг-тесту або методу діагностичної орієнтації. Надалі може бути використана комп’ютерна томографія. Доцільним є виконання вазографічних досліджень, які дозволяють не тільки уточнити діагноз, але й скласти план оперативного лікування. Найефективнішим методом оперативного лікування є відеоендоскопічний, що підтверджено у клініці.
Сучасні бойові пошкодження сечового міхура
С.В. Головко, О.Ф. Савицький, П.П. Форостяний
Клініка урології, Головний військово-медичний клінічний ордена Червоної Зірки центр «Головний військовий клінічний госпіталь» Міністерства оборони України, Київ, Україна
Кафедра військової хірургії, Українська військово-медична академія, Київ, Україна
Мета дослідження — проаналізувати результати лікування поранених з пошкодженнями сечового міхура на сучасному етапі.
У дослідженні частота пошкоджень сечового міхура при закритій травмі становила 3,4%. Вогнепальні поранення реєстрували у 0,5% випадків. У 18% пацієнтів пошкодження сечового міхура поєднувалося з переломом кісток таза. Основними причинами розриву сечового міхура при закритій травмі є гідродинамічний ефект при його різкому стисненні, поранення стінки уламками кісток таза (частіше лобкової кістки), надмірна напруга лобково-міхурових зв’язок при розходженні відламків лобкових кісток чи симфізу.
При пошкодженнях сечового міхура метою операції було відновлення цілісності стінок сечового міхура, відведення сечі, за необхідності — дренування урогематом. При внутрішньочеревному пораненні виконували нижньосерединну лапаротомію з видаленням гематоми, яка, як правило, знаходилася у передочеревинній клітковині, звільнення черевної порожнини від крові, сечі, калу, ревізію органів черевної порожнини, висічення розірваних країв рани міхура, а потім зашивання дворядними вузловими швами (серозно-м’язовий і серезо-серозний шви). Встановлювали постійний катетер і надлобкову позаочеревинну епіцистостому, яка забезпечувала декомпресію сечового міхура, попереджувала утворення сечових запливів і запобігала неспроможності міхурових швів; проводили зашивання і дренування черевної порожнини. При заочеревинних пошкодженнях у ділянці дна міхура, сечоміхурового трикутника, шийки шви на рану накладали з боку слизової оболонки. Від зашивання утримувалися за відсутності кровотечі з країв міхурової рани, при значних технічних труднощах, підвищеному ризику операційного втручання. У цих випадках важливо поряд з епіцистостомією виконати адекватне дренування за Буяльським — Мак-Уортером і Купріяновим.
Рвані, розчавлені чи вогнепальні первинно-інфіковані рани сечового міхура економно висікали, надійно виконували гемостаз (лігування судин в рані), зближували і зашивали дворядними вузловими швами. Уламки кісток таза, які вільно лежали, і сторонні тіла видаляли. Після того, як доступні ранові отвори знайдено й зашито, розкривали сечовий міхур ближче до перехідної очеревинної складки. Проводили ревізію його порожнини, видалення сторонніх тіл, огляд дна і ділянки сечовивідного трикутника. Вогнепальні рани м’яких тканин загоювали із застосуванням VАC-систем, ультразвукової кавітації.
У разі пошкодження інших органів черевної порожнини в першу чергу виконували тимчасовий чи кінцевий гемостаз. Проникні рани шлунково-кишкового тракту тимчасово ізолювали від вільної черевної порожнини затискачами, серветками. Приділяли увагу вчасному переформатуванню колостоми як профілактиці інфікування сечових шляхів. При поєднаних пошкодженнях кісток таза виконували остеосинтез. Залежно від тяжкості травми проводили послідовне відновлення всіх пошкоджень чи обмежувалися втручаннями в рамках технології контролю ушкоджень (damage control).
Незалежно від локалізації пошкоджень сечового міхура, операційні втручання закінчувалися позауретральним відведенням сечі через надлобкову епіцистостому.
Основними причинами незадовільних результатів при лікуванні вогнепальних поранень сечового міхура були неповноцінне обстеження та інтраопераційна ревізія органів сечостатевої системи, необґрунтоване розширення об’єму операції, відведення сечі уретральним катетером без формування епіцистостоми.
Ендоваскулярний гемостаз у пацієнтів з кровотечею з нижніх сечових шляхів
С.В. Головко, О.Ф. Савицький, А.А. Кобірніченко, І.Л. Троїцький
Клініка урології, відділення рентген-кардіоваскулярної хірургії, Головний військово-медичний клінічний ордена Червоної Зірки центр «Головний військовий клінічний госпіталь» Міністерства оборони України, Київ, Україна
Кафедра військової хірургії, Українська військово-медична академія, Київ, Україна
Стійка гематурія із сечового міхура або передміхурової залози є потенційно небезпечним для життя станом, який посилює основні терапевтичні проблеми. У багатьох хворих кровотеча не може бути повністю контрольована консервативними заходами, такими як призначення рутинних гемостатичних препаратів, місцеве застосування холоду, дренування сечового міхура уретральним катетером з постійною іригацією його стерильними розчинами, інстиляції нітрату срібла чи ендоскопічна діатермія. Радикальне оперативне втручання не завжди можливе через високий операційний ризик у цій групі хворих. Ангіографія з емболізацією є малоінвазивним методом, який зарекомендував себе як безпечний та ефективний для контролю кровотечі з сечового міхура або передміхурової залози. Однак більшість результатів є даними клінічних досліджень та невеликими за об’ємом вибірки.
Мета дослідження — проаналізувати ефективність та результати застосування черезкатетерної артеріальної емболізації при рефрактерній кровотечі з нижніх сечовивідних шляхів, за неефективності консервативної гемостатичної терапії.
Ми проаналізували історії хвороби 24 чоловіків, середній вік 72 роки (від 62 до 87 років), яким загалом виконано 26 ангіографічних процедур методом селективної артеріальної емболізації при тяжкій стійкій кровотечі з нижніх сечовивідних шляхів у клініці урології Головного військово-медичного клінічного центру з 2010 по 2013 р. Джерелом кровотечі був сечовий міхур у 19 хворих та передміхурова залоза — у 6. Після ретроградної перкутанної катетеризації стегнової артерії з однієї (20 випадків) або з двох (6 випадків) боків проводили селективну ангіографію внутрішніх клубових артерій, з подальшою суперселективною катетеризацією сечоміхурових або простатичних гілок та їх емболізацією унілатерально (6 випадків) і білатерально (18 випадків). Для емболізації використовувався кровоспинний засіб Гелатамп, емболізуючі тріс-акрил-желатинові мікросфери Embosphere та n-бутил-2-ціаноакриловий хірургічний клей. Оцінку результатів проводили клінічно та за допомогою контрольних ангіографій.
Зупинка кровотечі була досягнута у 19 хворих із 24 в середньому протягом 3 днів (від 2 до 5 днів), що становило 79,2% клінічної успішності. У решти 5 пацієнтів кровотеча продовжувалася (n=3) або рецидивувала (n=2) протягом 1 міс, але менш інтенсивно, ніж перед процедурою, та була контрольована повторною емболізацією. Середня тривалість спостереження становила 14 міс (від 2 до 26 міс). Післяопераційна летальність досягла 7,7% (2 хворих) та була пов’язана з супутньою серцево-судинною патологією. Жодних негайних або відстрочених ускладнень, пов’язаних з ангіографією або емболізацією, не зареєстровано.
Проведене дослідження засвідчує, що транскатетерна артеріальна емболізація є ефективною та безпечною для контролю кровотечі з нижніх сечовивідних шляхів та досягнення стійкого гемостазу у хворих похилого віку, з декомпенсованою супутньою патологією.
Тактика лікування онкологічних хворих з ятрогенним пошкодженням верхніх сечовивідних шляхів
Е.О. Стаховський, П.С. Вукалович, О.А. Войленко, Ю.В. Вітрук, О.А. Кононенко
Відділення пластичної та реконструктивної онкоурології, Національний інститут раку, Київ, Україна
З розширенням показань до оперативного лікування при злоякісних новоутвореннях органів черевної порожнини та малого таза, широким впровадженням в практику ендоурологічних та лапароскопічних операцій, а також частим застосуванням великофракційної променевої терапії вірогідність ятрогенного пошкодження сечовивідних шляхів зростає. Сьогодні залишається невирішеною проблема тактики лікування хворих онкологічного профілю з ятрогенним пошкодженням сечоводів. Складність проблеми полягає у варіабельності перебігу онкологічного процесу, тяжкості післяопераційних анатомо-функціональних змін, ускладнених пошкодженням сечового тракту.
Мета дослідження — удосконалити тактику лікування пацієнтів з ятрогенним пошкодженням сечоводів залежно від ступеня анатомо-функціональних змін та тяжкості перебігу онкологічного захворювання.
Клінічному аналізу підлягали 119 хворих з ятрогенними пошкодженнями 163 сечоводів, які з 2008 по 2014 р. перебували в Клініці пластичної та реконструктивної онкоурології. Середній вік пацієнтів становив 59,9±8,2 року. Чоловіків було 25 (21%), жінок — 94 (79%).
Хворим проведено комплексне обстеження, спрямоване на оцінку стану онкологічного захворювання, вивчення функції нирок та анатомо-функціональних змін сечовидільної системи, що включало: лабораторні аналізи, ультразвукове дослідження, екскреторну урографію, антеградну пієлоуретерографію, цистографію, комп’ютерну томографію, магнітно-резонансну томографію, кліренс-тести ендогенного креатиніну, динамічну реносцинтиграфію, цистоскопію, урофлоуметрію.
За результатами комплексного обстеження виділено дві групи хворих з ятрогенними пошкодженнями сечоводів: першу становили 74 (62,2%) хворих без онкологічної патології, другу групу — 45 (37,8%) пацієнтів, у яких діагностовано онкологічне захворювання або його прогресування, некомпенсована супутня патологія.
Ятрогенні пошкодження сечоводів у обох групах супроводжувалися порушенням уродинаміки, що проявлялося уретерогідронефрозом — 119 (100%) хворих, норицею сечовода — 17 (14,3%); хронічною нирковою недостатністю — 37 (31,1%).
Аналіз клінічного матеріалу показав, що у всіх пацієнтів з ятрогенними пошкодженнями сечоводів виконано різні види оперативних втручань: паліативні — 45 (37,8%), пластичні — 43 (36,1%), реконструктивні — 28 (23,6%) та органовиносні — 3 (2,5%).
Пацієнтам першої групи у 71 (96%) випадку проведено органозберігаючі операції, що передбачало відновлення цілісності та прохідності верхніх сечовивідних шляхів (ВСШ). Перкутанну нефростомію як перший етап лікування застосовували у 34 (47,9%) пацієнтів. Показанням до нефростомії була обструкція ВСШ, ускладнена у 24 (41,2%) пацієнтів гострим пієлонефритом, у 16 (61,8%) — хронічною нирковою недостатністю. У 43 (60,5%) хворих виконано пластичні оперативні втручання, у 28 (39,5%) — реконструктивні, що передбачали заміщення сечовода тонкою кишкою.
Термінальний уретерогідронефроз був причиною нефректомії у 3 (4%) випадках.
Пацієнтам другої групи (45 хворих) проведено паліативне дренування ВСШ. Перкутанна нефростомія дозволила знизити рівень креатиніну в крові шляхом підвищення загальної клубочкової фільтрації з 41,2±12,6 до 62,1±7,6 мл/хв (р<0,05), що дало можливість провести спеціальне лікування (поліхіміотерапія, дистанційна променева терапія). У результаті проведеної хіміопроменевої терапії у 5 (11,1%) хворих діагностовано повну регресію онкологічного захворювання, що дало можливість виконати реконструктивні операції з відновлення прохідності ВСШ, з метою покращення якості життя пацієнтів.
Вибір тактики лікування хворих онкологічного профілю з ятрогенними пошкодженнями сечоводів має ґрунтуватися на комплексному вивченні анатомо-функціональних змін у нирках і сечовивідних шляхах, а також ефективності лікування онкологічного захворювання.
Ятрогенні пошкодження сечоводів у пацієнтів з прогресуванням онкологічного захворювання, декомпенсованою хронічною нирковою недостатністю або некомпенсованою супутньою патологією потребують паліативного лікування, направленого на відведення сечі та збереження функції нирки.
Показання та особливості заміщення сечовода тонкою кишкою при ятрогенних «впливах» на сечоводи
Е.О. Стаховський, П.С. Вукалович, О.А. Войленко, О.Е. Стаховський, Ю.В. Вітрук, О.А. Кононенко
Відділення пластичної та реконструктивної онкоурології, Національний інститут раку, Київ, Україна
Реалізація нових методів лікування — лапароскопічних, ендоскопічних, підвищення онкологічної захворюваності та розширення показань до оперативного і комбінованого лікування сприяють збільшенню кількості ятрогенних пошкоджень сечоводів, що є однією з причин збільшення кількості нефректомій. Для відновлення цілісності верхніх сечовивідних шляхів (ВСШ) запропоновано велику кількість методів хірургічного лікування, які не завжди є ефективними. Недостатньо визначені показання та ефективність кишкової пластики сечоводів у лікуванні пацієнтів з ятрогенними пошкодженнями ВСШ.
Мета дослідження — проаналізувати показання та ефективність заміщення сечовода тонкою кишкою у лікуванні пацієнтів з ятрогенними пошкодженнями сечоводів.
Клінічному аналізу підлягали 53 пацієнти (68 уражених сечоводів) з ятрогенними пошкодженнями сечоводів, яким проведено обстеження та оперативне лікування із заміщенням сечовода ізольованим сегментом тонкої кишки.
Вік пацієнтів коливався в межах 21–67 років і в середньому становив 48,5±8,7 року. Чоловіків було 22 (41,5%), жінок — 31 (58,5%).
Хворим проведено комплексне обстеження з вивчення анатомо-функціональних змін сечовидільної системи та функції нирок — як до, так і після операції, що включало: лабораторні аналізи, ультразвукове дослідження, екскреторну урографію, антеградну пієлоуретерографію, цистографію, комп’ютерну томографію, магнітно-резонансну томографію, кліренс-тести ендогенного креатиніну, динамічну реносцинтиграфію, урофлоуметрію.
Віддалені результати вивчено у 45 (84,9%) хворих в термін від 3 міс до 25 років. Оцінку ефективності оперативного лікування виконували за 4-бальною шкалою.
Однобічний уретерогідронефроз діагностовано у 38 (71,7%) пацієнтів, двобічний — у 15 (28,3%).
Показанням до заміщення сечовода сегментом тонкої кишки були протяжні пошкодження сечовода з розвитком незворотних фіброзних змін в його стінці за відсутності ознак прогресування основного онкологічного захворювання, на фоні збереженої функції нирки (рівень клубочкової фільтрації на боці ураження >12 мл/хв).
Сегментарну кишкову пластику сечоводів виконано у 8 (15,1%) хворих, субтотальну — 16 (30,2%), тотальну — 14 (26,4%). У 15 (28,3%) пацієнтів проведено двобічну уретероілеопластику. При двобічній кишковій пластиці сечоводів використовували один кишковий трансплантат, який розташовували ізоперистальтично. Середня довжина тонкої кишки, яку застосовували для заміщення сечовода, становила 23,7±4,4 см. Анастомоз сечоводів у кишку накладали методом «кінець в бік». Кишковий трансплантат розміщували в черевній порожнині, а анастомози — екстраперитонеально.
З метою запобігання міхурово-кишковому рефлюксу проводили моделювання дистального відділу кишкового трансплантата. У 35 (66%) хворих проводили вивертання 2–3 см дистального відділу слизової оболонки кишки з формуванням манжетки. У 18 (34%) пацієнтів антирефлюксну манжетку доповнювали її моделюванням за методикою інтраілеальної пластики проф. Е.О. Стаховського, що передбачало формування в місці кишково-міхурового анастомозу двох окремих каналів.
Проведення інтраілеальної пластики дозволило зменшити кількість випадків міхурово-кишкового рефлюксу до 2 (11,1%) порівняно зі стандартною методикою манжетки, при якій рефлюкс спостерігали у 13 (37,1%) випадках (р=0,04; χ2=3,97).
Проведення нефректомії призвело б до розвитку хронічної ниркової недостатності у 32 хворих, однак виконання кишкової пластики сечовода дозволило зменшити цю кількість до 2 (р=0,003; χ2=11,5).
Аналіз згідно з критеріями оцінки ефективності лікування показав, що у 14 (32,6%) пацієнтів результат був відмінний, 16 (37,2%) — добрий, 11 (25,6%) — задовільний, 2 (4,6%) — незадовільний.
Кишкова пластика сечоводів дає можливість зберегти нирку та покращити її функцію, тим самим зменшити кількість хворих із хронічною нирковою недостатністю і довічною сечовою стомою.
З метою запобігання міхурово-кишковому рефлюксу ефективним є застосування інтраілеальної пластики з манжеткою за методикою проф. Е.О. Стаховського, з формуванням в дистальному відділі кишкового трансплантата двох окремих каналів.
Чрескожная пункционная нефростомия — малоинвазивный метод дренирования верхних мочевых путей
Ф.И. Костев1, Е.М. Ухаль 1, Р.В. Савчук 1, Р.А. Лунев 2, М.В. Шостак 1
1Одесский национальный медицинский университет,
Одесса, Украина
2Городская клиническая больница № 10 г. Одессы,
Одесса, Украина
Одной из важнейших проблем в урологии остается выбор метода ликвидации обструкции верхних мочевых путей (ВМП) и восстановления адекватного пассажа мочи. Эта проблема актуальна в онкоурологии, особенно в тех случаях, когда тяжелое состояние пациента является причиной крайне высокого риска открытой операции. Злокачественные новообразования зачастую протекают малосимптомно, сдавливая или прорастая мочеточники, приводя к выраженным функциональным и морфологическим изменениям паренхимы почки, что вызывает прогрессирование снижения функции и гидронефротической трансформации почки, инвалидизации больных. Основными онкологическими заболеваниями, приводящими к субренальной обструкции в запущенных стадиях, являются: рак шейки матки, рак мочевого пузыря, рак предстательной железы, рак тела матки, рак яичника, ректосигмоидальный рак, наличие метастазов в забрюшинных лимфатических узлах.
Цель исследования — определить показания и эффективность чрескожной пункционной нефростомии (ЧПНС) при обструктивных симптомах ВМП у больных с новообразованиями малого таза.
В период с 2007 по 2014 г. на базе кафедры урологии и нефрологии Одесского национального университета и Городской клинической больницы № 10 выполнено 167 ЧПНС по поводу обструкции ВМП у пациентов с новообразованиями малого таза. Возраст больных составил от 21 года до 84 лет, в среднем — 57±4,5 года; женщин было 95 (57%), мужчин — 72 (43%). Нефростомию выполняли под местной анестезией на ультразвуковом аппарате «Medelcom echotomoscope» с помощью насадки и конвексного датчика.
Уретерогидронефроз, одно- или двухсторонний, диагностирован у больных с новообразованиями различной локализации: рак шейки матки — 63 (37,7%), рак мочевого пузыря — 37 (22,2%), рак предстательной железы — 32 (19,1%), рак тела матки — 11 (6,6%), рак яичника — 5 (3%), ректосигмоидальный рак — 8 (4,8%), наличие метастатических изменений забрюшинных лимфатических узлов — 11 (6,6%).
Односторонняя ЧПНС выполнена в 122 (73%) случаях, двухсторонняя — в 45(27%). Основным принципом выбора одно- или двухстороннего стомирования являлась перспектива пациента для дальнейшего лечения, объем паренхимы почек, одно- или двухстороннее поражение почек. При сохранении паренхимы почек с обеих сторон на фоне субренальной анурии чаще проводили одностороннюю нефростомию в связи с тем, что адекватная функция одной почки полностью стабилизирует уровень азотистых шлаков и улучшает качество жизни пациента с одним дренажем.
Средний уровень креатинина до ЧПНС составил 485,59±25,12 мкмоль/л, после снизился до 140,19±16,32 мкмоль/л, через 3 нед уровень креатинина снизился до нормы.
Средний уровень мочевины при субренальной анурии составил 21,85±3,1 ммоль/л, через неделю после операции медиана снизилась до 8,8±1,3 ммоль/л, через 3 нед — практически стабилизировалась у всех пациентов. Снижение содержания азотистых шлаков дало возможность провести предоперационную подготовку с последующим оперативным лечением, подготовку к проведению химио- или лучевой терапии.
Основными осложнениями при проведении ЧПНС были: субкапсулярная гематома — 13 (7,8%), которую устраняли консервативными методами; интенсивное кровотечение из нефростомического дренажа — 4(2,4%), которое купировали краткосрочным пережатием дренажа; ренефростомия — 11 (6,6%).
ЧПН — малоинвазивный, эффективный и надежный метод дренирования ВМП при новообразованиях малого таза. Малоинвазивность, низкая интраоперационная травматичность, быстрота послеоперационной реабилитации для проведения дальнейшего специализированного лечения и относительно лучшее качество жизни пациентов по сравнению с другими методиками дренирования ВМП позволяют нам рекомендовать данное оперативное вмешательство.
Результаты уретерокаликоанастомоза у пациентов со сложной патологией верхних мочевых путей
В.Н. Лесовой, П.В. Мозжаков, В.И. Савенков, Д.В. Щукин, И.А. Гарагатый, И.М. Антонян
Харьковский национальный медицинский университет,
Харьковская медицинская академия последипломного
образования, Харьков, Украина
Мы проанализировали результаты модифицированной техники открытого уретерокаликоанастомоза у 20 пациентов с протяженными стриктурами верхней трети мочеточника.
В качестве первичной операции уретерокаликоанастомоз выполнен у 9 больных, в остальных случаях пациентам ранее проводили открытые или лапароскопические операции по поводу гидронефроза или мочекаменной болезни. У 16 пациентов диагностирована мочекаменная болезнь, у 2 — выраженный фиброз в области внутрипочечной лоханки, у 1 — посттравматические изменения верхней трети мочеточника, еще у 1 пациентки выявлен ретроперитонеальный фиброз с поражением мочеточников и лоханок обеих почек. В одном наблюдении анастомоз накладывали при проведении аутотрансплантации почки. Хорошее функциональное состояние почки отмечали у 14 из 20 пациентов. Толщина паренхимы <10 мм зафиксирована у 4 больных, в остальных наблюдениях этот параметр составлял не менее 16 мм.
Техника уретерокаликоанастомоза включала резекцию нижнего полюса почки под углом 45° с выделением нижней чашки в условиях тепловой ишемии. В большинстве случаев старались максимально сохранить стенки чашки и пересечь чашку на 5–7 мм дистальнее плоскости резекции паренхимы. Затем выполняли тщательное ушивание поврежденных сосудов и накладывали анастомоз между чашкой и мочеточником после снятия сосудистого турникета. Мочеточниковый стент удаляли через 2 мес после операции.
Результаты оценивали на основании анализа жалоб пациентов, клинической картины, данных ультрасонографии, мультиспиральной компьютерной томографии или экскреторной урографии.
Среднее время тепловой ишемии почки составило 11,4 мин (от 0 до 20 мин). Во всех случаях анастомоз накладывали в условиях хорошей видимости без какого-либо натяжения. Значительных послеоперационных осложнений, связанных с резекцией почки, не выявлено. Только у 3 больных отмечали мочевые свищи, которые исчезли самостоятельно на протяжении 2 нед после операции.
Результаты прослежены у всех 20 пациентов. Сроки наблюдения варьировали от 8 до 32 мес (в среднем 18,8 мес). Хорошие функциональные результаты отмечены у всех оперированных больных (отсутствие болевого синдрома, рецидива мочекаменной болезни и обострений пиелонефрита, хорошая функция оперированной почки). Однако ретенционные изменения сохранились у 4 пациентов с толщиной почечной паренхимы 7–9 мм, что расценено как удовлетворительный результат.
Уретерокаликоанастомоз обеспечивает хорошие функциональные результаты у большинства больных со сложной или рецидивной патологией лоханочно-мочеточникового сегмента. Приоритеты такого подхода мы видим в анастомозировании неизмененных тканей нижней чашки и мочеточника, а также в том, что анастомоз накладывают в условиях хорошей видимости.
В настоящее время очевидно, что результаты уретерокаликоанастомоза гораздо лучше при первичных операциях и у пациентов с сохранной почечной паренхимой.
Аналіз результатів промежинної пластики стриктур та облітерацій заднього відділу уретри після перелому кісток таза
В.І. Горовий, О.Л. Кобзін, О.М. Капшук, С.П. Дмитришин
Вінницька обласна клінічна лікарня ім. М.І. Пирогова,
Вінниця, Україна
Переломи кісток таза, за даними літератури, супроводжуються розривами заднього відділу уретри у чоловіків у 3–20% випадків, а у хворих із пошкодженнями задньої уретри перелом кісток таза трапляється більш ніж y 90% випадків. Лікування посттравматичних стриктур та облітерацій заднього відділу уретри є одним з найбільш складних розділів пластичної урології. Сьогодні золотим стандартом у лікуванні пацієнтів з цією патологією залишається анастомотична промежинна пластика уретри методом «кінець в кінець».
Мета роботи — аналіз результатів промежинної пластики уретри у хворих зі стриктурами та облітераціями заднього відділу уретри після перелому кісток таза.
Проаналізовано результати промежинної пластики уретри у 58 хворих зі стриктурами та облітераціями заднього відділу уретри після перелому кісток таза, які лікувалися в урологічному відділенні Вінницької обласної клінічної лікарні за останні 30 років (1985–2014 рр.). За віком хворі були розподілені таким чином: до 20 років — 3 хворих, 21–30 — 20, 31–40 — 11, 41–50 — 13, 51–60 — 6, старше 60 — 5. Усі пацієнти надійшли у відділення для проведення відновлювальної операції з надлобковим дренажем через 3–6 міс після перелому кісток таза та розриву заднього відділу уретри.
Облітерація заднього відділу уретри відмічена у 25 хворих, стриктура — у 33. Промежинну пластику уретри виконували за методом Русакова з висіченням рубцевих тканин заднього відділу уретри та накладанням анастомозу «кінець в кінець» за допомогою 6 лігатур (похромований кетгут, вікрил, дексон).
Час виконання промежинної пластики коливався від 2 до 3,5 год, у 5 (8,6%) хворих у зв’язку з крововтратою в операційній виконували переливання компонентів крові (еритроцитарна маса, свіжозаморожена плазма). У ранній післяопераційний період відмічено такі ускладнення: загноєння рани промежини у 4 (6,9%) хворих, кровотеча із шийки сечового міхура — 1 (1,7%), кровотеча з рани промежини — 1 (1,7%), уретро-промежинний свищ — 1 (1,7%), гнійний уретрит — 1 (1,7%), гострий епідидимоорхіт — 3 (5,2%), загострення хронічного пієлонефриту — 2 (3,4%), стресове нетримання сечі — 1 (1,7%). Усі пацієнти виписалися із відділення без надлобкового дренажу; задовільний акт сечовипускання за даними урофлоуметричного індексу та урофлоуметрії відмічено у 51 (87,9%) пацієнтів. Рецидив стриктури заднього відділу уретри виник у 7 (12,1%) хворих, із них 3 (5,2%) перенесли повторну промежинну пластику уретри, 4 (6,9%) — бужування уретри.
Промежинна пластика уретри з приводу стриктур та облітерацій заднього відділу уретри після перелому кісток таза дозволяє повноцінно відновити акт сечовипускання у 87,9% хворих.
Схема патогенезу пієлонефриту при пошкодженні нирки у хворих з політравмою
М.А. Довбиш, Ю.Л. Підгайний, О.Б. Унгурян, І.М. Довбиш, А.О. Губарь, М.В. Перев’язкіна
Запорізький державний медичний університет,
Запорізька міська лікарня екстреної та швидкої медичної допомоги,
Запоріжжя, Україна
Статистичні дані останніх років свідчать, що чисельність пацієнтів з різними травмами збільшилася і зберігається тенденція до подальшого її зростання, що диктує необхідність розробки нових методів діагностики і тактики лікування. Серед цих травм 3-тє місце займають пошкодження органів сечової системи, що становить 25–26,4% випадків.
Мета дослідження — вивчити характер морфофункціональних змін у нирці у хворих з політравмою.
Під спостереженням перебували 218 потерпілих з політравмою. Чоловіків — 161 особа (73,5%), жінок — 57 (26,5%).
У 30 хворих, що померли, провели морфологічне дослідження нирок, які не мали зовнішніх ознак розриву органа. Морфологічні зміни виявлено у 29 (96,7%) пацієнтів.
У хворих, що померли в першу добу, відмічено набряк капсули, ішемію клубочків, розширення кіркових та мозкових судин, стаз еритроцитів. На 3-тю добу виникає деструкція епітелію канальців, лімфоїдні інфільтрати в мозковій речовині, набряк інтерстицію, діапедезні крововиливи, плазморагії, судини різко розширені. Через 4–12 діб виявляють ішемізовані зморщені клубочки, зберігається ішемія інтерстицію, розширення судин та стаз, розширення канальців та пошкодження епітелію, виникає лейкоцитарна інфільтрація інтерстицію. На 14-ту добу зберігається лейкоцитарна інфільтрація, десквамація епітелію, розширення судин зі стазом еритроцитів. На 30-ту добу навколо клубочків і канальців виявляють сполучну тканину, що свідчить про склерозування органа.
Спостереження дало можливість запропонувати схему патогенезу пієлонефриту у хворих з політравмою. Згідно з нею при дії травмувальних факторів порушується мікроциркуляція в нирці, виникають набряк паренхіми та фіброзної капсули, гіпоксія та білкове насичення інтерстицію, деструктивно-дистрофічні зміни клубочків, канальців та лімфоцитарна інфільтрація інтерстицію, що свідчить про асептичне запалення. За наявності інфекції в організмі виникає лейкоцито-лімфоцитарна інфільтрація паренхіми з подальшим склерозуванням органа та порушенням його функції.
У хворих з політравмою, які не мали зовнішніх ознак розриву нирки, у 96,7% випадків відмічають морфологічні зміни, які призводять до склерозування органа. Головними змінами в нирці є порушення мікроциркуляції, набряк, гіпоксія, білкове насичення інтерстицію, лейкоцито-лімфоцитарна інфільтрація та склерозування органа.
Опасности и осложнения при проведении ретроградной пиелоуретерографии.
Тактика уролога (случаи из практики)
И.М. Русинко, Н.М. Русинко, Ю.С. Бурман, Е.Э. Улановская
КУ «Днепропетровское 12-е территориальное медицинское
объединение» Днепропетровского областного совета»,
Днепропетровск, Украина
Н.И. Пирогов писал: «Усовершенствования во врачебном искусстве можно добиться только путем изучения ошибок, допущенных у постели больного». Для признания своих ошибок необходимо известное гражданское мужество. О своих ошибках пишут весьма мало и крайне неохотно.
Урология своими значительными успехами многим обязана инструментальным и Ro-урологическим методам исследования, каждый из которых на определенном этапе внес вклад в ее развитие. Обстоятельный анализ ошибок и осложнений при ретроградной пиелоуретерографии еще не приведен.
Ретроградная пиелоуретерография впервые выполнена в 1906 г. Voelcker и Zichtenberg. При ретроградной пиелоуретерографии осложнения могут зависеть как от техники катетеризации мочеточников, так и от количества и скорости вводимого в верхние мочевые пути контрастного вещества. Риск, связанный с ретроградной пиелоуретерографией, снижается при строгом соблюдении техники выполнения исследования.
Наиболее серьезные осложнения при проведении ретроградной пиелоуретерографии связаны с запороговым повышением внутрилоханочного давления, приводящим к возникновению рефлюксов, дискинезии верхних мочевых путей, развитию острого пиелонефрита, а также с перфорацией почки и мочеточника.
Рефлюкс на пиелограмме — это видимое нарушение опорожнения почечной лоханки. Перфорация мочеточника или почки может произойти вследствие использования катетера с металлическим мандреном, грубого форсированного введения катетера при наличии препятствия (складка слизистой оболочки, конкремент, стриктура). Чаще подобные осложнения развиваются при насильственной катетеризации интрамурального и юкставезикального отделов мочеточника.
Различают ретроперитонеальную и интрамуральную экстравазацию контрастной жидкости. В большинстве случаев перфорация почки и мочеточника проходит бесследно. Чтобы уменьшить опасность проведения ретроградной пиелографии и одновременно получить дополнительную информацию рекомендуется проведение ее непосредственно перед оперативным вмешательством.
Ретроградную пиелографию назначают в случае, когда экскреторная урография малоинформативна. Она показана при обтурации мочеточника сгустками слизи, крови или конкрементов с целью восстановления проходимости мочеточника.
Нами проанализирован опыт проведения 450 ретроградных пиелографий у пациентов в возрасте от 18 до 80 лет. Осложнения чаще выявляли при форсированном проведении катетера, особенно в месте воспалительных изменений слизистой оболочки мочеточника. Наиболее тяжелыми осложнениями были:
- форникальные и тубулярные рефлюксы — 6 (1,3%) случаев;
- кровотечения — 15 (3,3%) случаев;
- перфорация мочеточника в юкставезикальном и интрамуральном отделах — 4 (0,9%) случая;
- перфорация мочеточника в нижней и средней трети — 4 (0,9%) случая;
- перфорация мочеточника в области стриктуры пиелоуретерального сегмента — 1 (0,2%) случай;
- перфорация почки — 1 (0,2%) случай.
Во всех случаях уретероррагии, перфорации почек и мочеточников проводили консервативную гемостатическую и противовоспалительную терапию. При перфорации мочеточника в области стриктуры выполнена пластика пиелоуретерального сегмента. При перфорации в юкставезикальном отделе мочеточника у пациентки с перекрестной тазовой дистопией почки выполнена нефрэктомия.
В случае развития осложнений при проведении ретроградной пиелоуретерографии показана своевременная и адекватная антибактериальная противовоспалительная терапия на фоне дренирования верхних мочевых путей. На рис. 1–3 представлены случаи из практики.
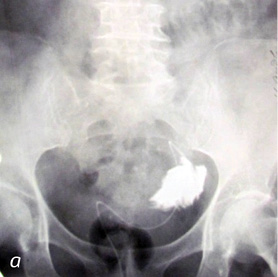
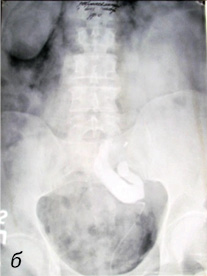
Рис. 1. Осложнения при проведении ретроградной пиелоуретерографии: а) пациент М. (60 лет) — перфорация правого мочеточника в верхней трети (перекрестная тазовая дистопия правой почки); б) пациент Ч. (45 лет) — стриктура пиелоуретерального сегмента (подвздошная дистопия левой почки)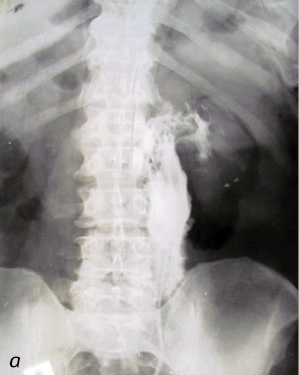
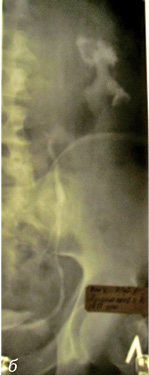
Рис. 2. Осложнения при проведении ретроградной пиелоуретерографии: а) пациент К. (50 лет) — перфорация в области стриктуры верхней трети левого мочеточника; б) пациент Д. (45 лет) — левосторонний пиелофорникальный рефлюкс
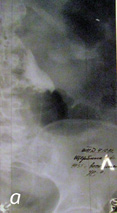
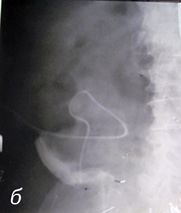
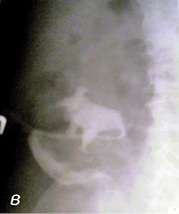
Рис. 3. Осложнения при проведении ретроградной пиелоуретерографии: а) пациентка Щ. (55 лет) — перфорация левого мочеточника в верхней трети; б) пациент М. (70 лет) — перфорация паренхимы единственной правой почки при попытке установки трубчатого дренажа через высокую уретеростому; в) уретеростомический дренаж установлен
Шляхи подолання ранніх урологічних ускладнень у хворих на інвазивний рак шийки матки
Л.І. Воробйова, Н.П. Ціп, О.В. Турчак, С.В. Неспрядько, Н.Ф. Лигирда, В.С. Свінціцький, Т.В. Дерменжи
Національний інститут раку, Київ, Україна
Останніми роками злоякісні епітеліальні пухлини матки, що представлені двома групами карцином — плоскоклітинним/аденогенним раком шийки матки та ендометріоїдним/неендометріоїдним раком тіла матки, стійко лідирують у структурі онкогінекологічної захворюваності. Щорічно в світі рак матки діагностують у 600 тис. жінок: більше 400 тис. випадків раку шийки матки та близько 190 тис. раку тіла матки. Захворюваність на ці злоякісні пухлини і смертність від них за останнє десятиріччя в світі зросли більш ніж на 23% і не мають тенденції до зниження.
Аналогічна ситуація спостерігається і в нашій державі. За даними Національного канцер-реєстру, рак шийки матки посідає 2-ге місце в структурі онкогінекологічної патології та становить 20,9 на 100 тис. жіночого населення України (2012 р.) і 6-те — у структурі смертності від злоякісних новоутворень. У лікуванні раку тіла та шийки матки використовують три основних методи: хірургічний, променевий та хіміотерапію.
При застосуванні кожного з методів можливий розвиток ускладнень, що суттєво знижують якість життя пацієнток. Типові ускладнення, що виявляють у хворих, лікування яких передбачало використання хірургічного методу, можна розподілити на 4 основні групи: урологічні, лімфодренажні, системні (внаслідок хірургічної менопаузи) та тромбоемболічні. Найчастішими ранніми та пізніми ускладненнями у онкогінекологічних хворих є урологічні ускладнення. Основний шлях подолання ранніх урологічних ускладнень — збереження тазових вегетативних нервів при проведенні оперативних втручань.
Мета дослідження − оцінити функцію нижніх сечовивідних шляхів після проведення розширеної пангістеректомії зі збереженням тазових вегетативних нервів у хворих на інвазивний рак шийки матки.
Для оцінки функції нижніх сечовивідних шляхів після проведення розширеної пангістеректомії зі збереженням тазових вегетативних нервів у хворих на рак шийки матки проведено дослідження — контроль у 40 пацієнток з інфільтративним раком шийки матки. У контрольну групу увійшли 20 пацієнток, яким проведено стандартну операцію (пангістеректомія III типу, С2 за класифікацією D. Qurleu, C.P. Morrow). Основна група — 20 пацієнток, яким виконано пангістеректомію III типу із збереженням тазового нерва (С1 за класифікацією D. Qurleu, C.P. Morrow). Вік хворих основної та контрольної груп не відрізнявся і коливався від 24 до 46 років (середній вік — 35,2±4,2 року).
Нервозберігаюча розширена гістеректомія матки полягала у виділенні нижнього гіпогастрального сплетіння, перетині тільки маткової гілки, що дозволяє зберегти гіпогастральний нерв, тазовий черевний нерв та міхурову гілку нижнього гіпогастрального сплетіння, а отже зберегти іннервацію сечового міхура.
У ранній післяопераційний період (на 2-гу–3-тю добу) скоротлива функція сечового міхура повністю відновлювалася у 80% пацієнток основної групи і лише у 20% хворих контрольної групи. Повне відновлення скоротливої функції сечового міхура зареєстровано через 7 діб в основній групі, 7–21 добу — в контрольній групі.
Збереження тазових вегетативних нервів дозволяє істотно знизити частоту ранніх урологічних ускладнень у хворих на інвазивний рак шийки матки, що обґрунтовує доцільність впровадження пангістеректомії С1 (за класифікацією D. Qurleu, C.P. Morrow) в протокол лікування пацієнтів з інвазивним раком шийки матки.














Leave a comment