Вплив неоад’ювантної хіміотерапії на функцію нирок та уродинаміку у хворих з інвазивним раком сечового міхура
Стаховський О.Е., Войленко О.А., Вукалович П.С., Котов В.А., Вітрук Ю.В.
Резюме. Мета: підвищити ефективність комплексного лікування та покращити якість життя хворих на інвазивний рак сечового міхура шляхом використання неоад’ювантної поліхіміотерапії та вивчення її впливу на функціональний стан сечовивідних шляхів. Матеріали та методи: 28 хворих на інвазивний рак сечового міхура, яким проведено неоад’ювантну хіміотерапію. Результати: неоад’ювантна поліхіміотерапія в 46,1% випадків відновила уродинаміку верхніх сечовивідних шляхів і покращила її в 15,4%. Висновки: випадки повної та часткової регресії пухлини дозволили виконати пацієнтам органозберігаюче оперативне втручання, що сприяло поліпшенню якості їх життя.

Вступ
Рак сечового міхура (РСМ) є одним із розповсюджених онкозахворювань органів сечовидільної системи. У 2009 р. в США діагностовано 70 980 нових випадків захворювання на РСМ та 14 330 смертей [1]. Майже третина хворих на інвазивний РСМ на момент встановлення діагнозу має недіагностовані метастази [2], поряд із тим, що 25% хворих піддаються радикальній цистектомії при вже наявних ураженнях лімфатичних вузлів.
В Україні, у 2009 р. вперше виявлено 4799 нових випадків захворювання на РСМ та 2227 смерті. Разом з тим, частка хворих, у яких вперше виявляють неінвазивні форми пухлини, досить низька і не перевищує 50% [3].
На сьогодні при інвазивному РСМ загальноприйнятим є виконання радикальної цистектомії, яка є золотим стандартом [4]. Однак при її проведенні кількість ускладнень становить 11–70%, а післяопераційна летальність досягає 12% [5]. Поряд з тим, питання резекції стінки сечового міхура у хворих з поодинокими ураженнями стінки або купола міхура залишається відкритим, оскільки прибічники органозберігаючої тактики оперативного лікування хворих на інвазивний РСМ стверджують про значно вищий рівень якості життя цієї категорії хворих, при цьому до 90% пацієнтів у період до 5 років мають локальний рецидив [6, 7].
Часте рецидивування, яке відмічають в перші 6–12 міс після операції у 35–85% хворих, підвищення злоякісності та інвазивності рецидивних пухлин у 0,7–20% хворих свідчить про агресивність даного захворювання та неефективність раніше проведеного лікування [8]. Тому сьогодні перед лікарями постає питання вибору оптимального методу лікування хворих на РСМ для виліковування пацієнта при максимальному збереженні якості життя.
Використання хіміотерапії у багатьох наукових центрах у 90-х роках минулого століття не дало очікуваних результатів, однак в окремих рандомізованих дослідженнях відмічено збільшення рівня 5-річної виживаності на 5% [9]. Випадки повної та часткової відповіді на поліхіміотерапію (ПТХ) із застосуванням нових малотоксичних хіміопрепаратів, дають підстави для перегляду показань та підходів до проведення органозберігаючої тактики лікування хворих на інвазивний РСМ [10, 11, 12].
Порушення уродинаміки верхніх та нижніх сечовивідних шляхів при поверхневому РСМ відмічають вкрай рідко: від 1,6 до 2,6% [13–15]. Однак при інвазивних формах РСМ клінічна картина значно погіршується, що в першу чергу обумовлено обструктивними проявами. На жаль, на сьогодні в літературі недостатньо висвітлені питання не тільки порушення уродинаміки при інвазивних формах РСМ, але й вплив хіміотерапії на її відновлення внаслідок регресії пухлини, що в свою чергу дозволяє підвищити якість життя пацієнтів
Мета роботи — покращити ефективність комплексного лікування та якість життя хворих на інвазивний РСМ шляхом використання неоад’ювантної поліхіміотерапії та вивчення її впливу на функціональний стан сечовивідних шляхів.
Матеріали і методи
Клінічному аналізу підлягали 28 хворих на інвазивний РСМ на стадіях захворювання Т2а–Т4а, яким у 2008–2010 рр. в науково-дослідному відділенні пластичної та реконструктивної онкоурології Національного інституту раку проведено первинне обстеження, 3–4 курси неоад’ювантної ПХТ за схемою Гемзар — Цисплатина з подальшою оцінкою її ефективності за критеріями RECIST та оперативне лікування. Чоловіків було 23 (82,1%), жінок — 5 (17,9%). Вік пацієнтів коливався від 36 до 74 років і в середньому становив 61,1±11,1 року. Первинний РСМ діагностовано у 22 (78,6%) хворих, рецидивний — у 6 (21,4%) пацієнтів.
Обстеження стану верхніх сечовивідних шляхів (ВСШ) та нирок починали з УЗД. Оцінювали розміри нирок, товщину паренхіми, наявність новоутворень, додаткових включень та ступінь ектазії порожнинної системи нирок та верхньої третини сечоводів. У подальшому проводили рентгенологічне дослідження з виконанням оглядової, екскреторної урографії з її модифікацією (діурезна урографія), що дозволили встановити анатомо-функціональні зміни у ВСШ та нирках.
Комп’ютерна томографія (КТ) давала додаткову інформацію про стан ВСШ та нирок у хворих на інвазивний РСМ, а саме: наявність конкрементів, солітарних кіст нирок. Проведення комп’ютерної 3D-реконструкції КТ знімків давала можливість більш якісної візуалізації стану нирок, ВСШ, але не замінювала екскреторну урографію. Уродинамічне обстеження дозволило оцінити функціональний стан нижніх сечовивідних шляхів.
Результати та їх обговорення
Після проведення ПХТ усім хворим виконано комплексне контрольне обстеження з оцінкою відповіді пухлини за критеріями RECIST. Результати обстеження та лікування хворих на інвазивний РСМ представлено в табл. 1.
| Відповідь на лікування за RECIST | Кількість пацієнтів, n (%) |
Середне значення, % регресії за RECIST |
|---|---|---|
| Повна регресія | 2 (7,1) | 100 |
| Часткова регресія | 14 (50) | 63,9±17,9 |
| Стабілізація | 9 (32,1) | 13,6±11,3 |
| Прогресія | 3 (10,7) | 33,4±2,9 |
Наведені в таблиці дані свідчать, що стабілізація пухлинного процесу за критеріями RECIST (регресію на (13,6±11,3%) відмічали в 9 (32,1%) випадках, прогресію — в 3 (10,7%) випадках (прогресія на (33,4±2,9%)), що стало показанням до виконання простатзберігаючої цистектомії.
У 14 (50%) хворих при проведенні контрольного обстеження відмічено часткову регресію пухлини в середньому на 63,9±17,9%, що дало можливість провести органозберігаюче оперативне лікування.
Повна регресія пухлини (100%) після проведення 3 курсів неоад’ювантної ПХТ при контрольному обстеженні діагностована в 2 (7,1%) випадках. Проведені контрольна цистоскопія з ТУР-біопсією стінки сечового міхура і патоморфологічне дослідження патології не виявило.
Проведене оперативне втручання після неоад’ювантної ПХТ дозволило провести рестадіювання РСМ. Загалом у 15 (53,6%) випадках відмічено зниження стадії захворювання за системою TMN. При цьому в 2 (7,1%) з них при проведенні патоморфологічного дослідження стінки сечового міхура пухлинних тканин виявлено не було (зріла м’язова тканина). Лише в 1 (3,6%) випадку при проведенні рестадіювання глибина інвазії пухлини збільшилася глибокого м’язового шару (Т2в) до паравезикальної клітковини (Т3в).
Підсумовуючи представлені дані, слід зазначити, що використання неоад’ювантної хіміотерапії у хворих на інвазивний РСМ привело в 7,1% випадків до повної, а в 50% — часткової ре гресії пухлинного процесу, що дозволило виконати пацієнтам органозберігаюче оперативне втручання та підвищити тим самим якість їх життя.
Проведене комплексне обстеження всіх хворих до та після проведення неоад’ювантної ПХТ виявило наступні зміни пасажу ВСШ, які представлені в табл. 2.
| Стан сечоводів | До ПХТ, n (%) | Після ПХТ, n (%) |
|---|---|---|
| Уретерогідронефроз | 13 (23,2) | 7 (12,5) |
| Сечоводів без змін | 43 (76,8) | 49 (87,5) |
| Статистична обробка | χ = 2,19 (р = 0,13) | |
Так, у 11 (39,3%) хворих РСМ викликав обструкцію інтрамурального відділу сечоводу, що приводило до розвитку уретерогідронефрозу, причому в 2 (7,1%) випадках він був двобічним. При контрольному обстеженні після проведення ПХТ уретерогідронефроз діагностовано у 6 (21,4%) хворих, (7 (12,5%) сечоводів — у 1 пацієнта двобічний уретерогідронефроз), причому у 5 (8,9%) випадках ступінь ектазії ВСШ залишився без змін, в 2 (3,6%) — ступінь ретенційних змін нирки та сечоводу зменшився з ІІІ до І–ІІ стадії. У 5 (17,9%) хворих ознак уретерогідронефрозу виявлено не було (рис. 1–4), при цьому у 1 з них до проведення ПХТ був діагностований двобічний уретерогідронефроз І стадії. Отже, проведення неоад’ювантної ПХТ дозволило в 6 (46,1%) із 13 випадків уретерогідронефрозу відновити уродинаміку ВСШ і покращити її в 2 (15,4%) випадках.
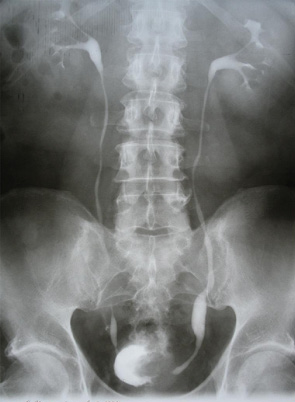
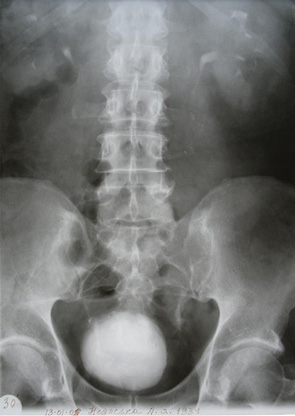
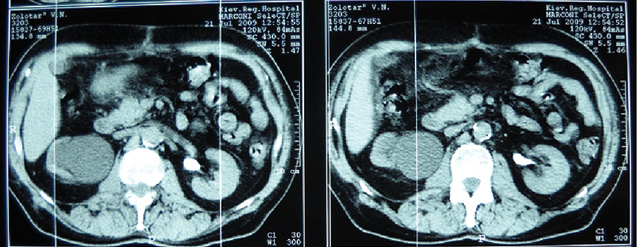
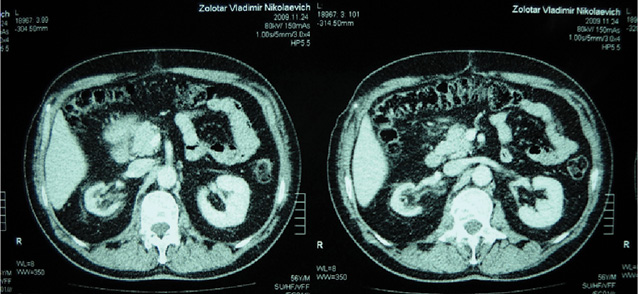
Наявність обструкції у ВСШ було підтверджено діурезною урографією. Задовільну секреторно-екскреторну функцію нирок до ПХТ виявляли у 17 (60,7%) пацієнтів, після — у 22 (78,6%). Проведений статистичний аналіз не виявив достовірної різниці в результатах обстеження уродинаміки ВСШ до та після ПХТ, що було обумовлено невеликою кількістю пацієнтів, включених у дослідження (χ=2,19 (р=0,13)), хоча нами відмічено позитивну динаміку змін ВСШ після проведення ПХТ.
Крім змін з боку ВСШ та сечового міхура, описаних вище, слід зазначити позитивний вплив неоад’ювантної ПХТ на ступінь порушення акту сечовипускання. При первинному обстеженні у 20 (86,9 %) пацієнтів чоловічої статі із 23 виявлено ознаки хронічної затримки сечі. Хворі скаржились на прискорене, ускладнене, болісне сечовипускання, відчуття неповного випорожнення сечового міхура, низький струмінь сечі, ніктурію до 2–4 разів за ніч, імперативні позиви до сечовипускання. Проведення ПХТ привело до покращення акту сечовипускання шляхом зменшення об’єму пухлини сечового міхура та об’єму передміхурової залози. Дані комплексного обстеження представлені в табл. 3.
| Показник | До ПХТ | Після ПХТ |
|---|---|---|
| Об’єм сечового міхура | 199,8±64,9 | 244,3±67,2 |
| Об’єм передміхурової залози | 46,2±18,7 | 34,6±12,4* |
| Об’єм залишкової сечі | 57,8±35,9 | 25,3±20,1* |
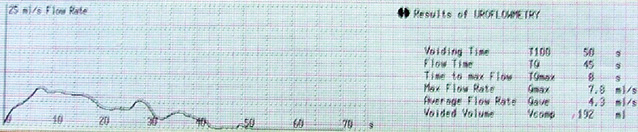
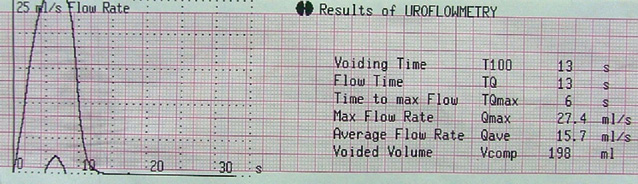
| Урофлоуметричний індекс (Qmax) | 14,3±7,2 | 21,9±6,8* |
| Урофлоуметричний індекс (Qave) | 8,4±3,3 | 11,8±3,2* |
| Час сечовипускання, с | 42,8±12,1 | 28,7±8,4* |
| І-PSS | 17,6±8,0 | 11,1±7,0* |
| QoL | 2,9±1,2 | 1,8±1,0* |
Примітка:
*розбіжність показників до та після ПХТ достовірна (р<0,05).
Так, проведення неоад’ювантної ПХТ дозволило достовірно зменшити об’єм передміхурової залози на 11,6 см³, покращити середню та максимальну швидкість сечовипускання відповідно на 3,4 та 7,6 мл/с (рис. 5, 6), зменшити об’єм залишкової сечі на 32,5 мл, скоротити час сечовипускання на 14,1 с, при цьому зменшити індекс простатспецифічних симптомів з 17,6 до 11,1 балів, покращити якість життя, пов’язану з порушенням сечовипускання з 2,9 до 1,8 бала.
Збільшення об’єму сечового міхура після проведення ПХТ з 199,8 до 244,3 мл є статистично недостовірним (р=0,06), що може бути пов’язано із збільшенням об’єму сечового міхура за рахунок регресії пухлини у 14 випадках, а з іншого боку — зменшенням функціональної ємності міхура за рахунок зменшення ступеня інфравезикальної обструкції.
Підсумовуючи, слід відмітити, що проведення неоад’ювантної хіміотерапії у хворих на інвазивний РСМ у більшості випадків дозволяє не лише зменшити об’єм пухлинного ураження, але й покращити акт сечовипускання за рахунок зменшення об’єму передміхурової залози та збільшення функціонального об’єму сечового міхура.
Висновок
Неоад’ювантна хіміотерапія при інвазивному раку сечового міхура в 57,1% викликає регресію пухлини (у 7,1% — повну та в 50% — часткову), що дозволило виконати пацієнтам органозберігаюче оперативне втручання та підвищити тим самим якість їх життя.
Проведення неоад’ювантної ПХТ у хворих на інвазивний РСМ дозволило в 46,1% випадків уретерогідронефрозу відновити уродинаміку ВСШ і покращити її в 15,4%.
У хворих на інвазивний РСМ після проведення неоад’ювантної ПХТ виявлено достовірне покращення функції нижніх сечовивідних шляхів та акту сечовипускання, яке виражалось у зменшенні об’єму передміхурової залози на 11,6 см³, покращенні максимальної урофлоуметрії на 7,6 мл/с, зменшенні об’єму залишкової сечі на 32,5 мл, зменшенні індексу простатспецифічних симптомів на 6,5 бала та покращення індексу якості життя на 1,1 бала.
Література
- 1. Jemal A., Siegel R., Ward E. et al. (2009) Cancer statistic. CA Cancer. J. Clin.; 59: 225–249.
- 2. Prout G.R. Jr., Griffin P.P., Shipley W.U. (1979) Bladder carcinoma as a systemic disease. Cancer; 43(6): 2532–9.
- 3. Рак в Україні, 2008–2009: захворюваність, смертність, показники діяльності онкологічної служби (2010) За ред. І.Б. Щепотіна. Бюл. національного канцер-реєстру України, № 11: 102 с
- 4. Shabsigh A., Korets R. et al. (2009) Defining early morbidity of radical cystectomy for patients with bladder cancer using a standardized reporting methodology. Eur. Urol., Jan; 55(1): 164–74. Epub 2008 Jul 18.
- 5. McCabe J.E., Jibawi A., Javle P.M. (2007) Radical cystectomy: defining the threshold for a surgeon to achieve optimum outcomes. Postgrad. Med .J., Aug; 83(982): 556–60.
- 6. Kageyama Y., Okada Y., Arai G. et al. (2000) Preoperative concurrent chemoradiotherapy against muscle-invasive bladder cancer: results of partial cystectomy in elderly or high-risk patients. Jpn. J. Clin. Oncol., 30 (12): 553–556.
- 7. Sternberg C.N., Calabro F. (2001) Neo-adjuvant chemotherapy in invasive bladder cancer. World. J. Urol., 19( 2): 94–98.
- 8. Ng A.K., Travis L.B. (2008) Second primary cancers: an overview. Hematol. Oncol. Clin. North. Am. Apr.; 22(2): 271–89, vii. Review.
- 9. Hall R.R. (2002) Updates results of a randomized controlled trial of neoadjuvant cisplatin (C), methotrexate (M) and vinblastine (V) chemotherapy for muscle-invasive bladder cancer. Integrational Collaboration of Trialists of the MRC Advanced Bladder Cancer Group. Proc. Am. Soc. Clin. Oncol., 21. Abstr. 710.
- 10. Teramukai S., Nishiyama H.,Matsui Y. et al. (2006) Evaluation for surrogacy of end points by using data from observational studies: tumor downstaging for evaluating neoadjuvant chemotherapy invasive bladder cancer. Clin. Cancer. Res., (12): 139–43.
- 11. Grossman H.B., Natale R.B., Tangen C.M. et al. (2003) Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N. Engl. J. Med., 349: 859–866.
- 12. Sternberg C.N., Collette L. (2006) What has been learned from meta-analyses of neo-adjuvant and adjuvant chemotherapy in bladder cancer? BJU Int., 98: 487–489.
- 13. Palou J., Rodriguez-Rubio F., Huguet J. et al. (2005) Multivariate analysis of clinical parameters of synchronous primary superficial bladder cancer and upper urinary tract tumors. J. Urol.;174(3): 859–61.
- 14. Holmang S., Hedelin H., Anderstrom C. et al. (1998) Long-term follow-up of a bladder carcinoma cohort: routine followup urography is not necessary. J. Urol.;160(1): 45–48.
- 15. Milla n-Rodriguez F., Che’chile-Toniolo G., Salvador-Bayarri J. et al. (2000) Upper urinary tract tumors after primary superficial bladder tumors: prognostic factors and risk groups. J. Urol.;164(4): 1183–7.
Влияние неоадъювантной химиотерапии на функцию почек и уродинамику у больных с инвазивным раком мочевого пузыря
Национальный институт рака, Киев
Резюме. Цель: повысить эффективность комплексного лечения и улучшить качество жизни больных инвазивным раком мочевого пузыря путем проведения неоадъювантной химиотерапии и изучения ее влияния на функцию мочевыводящих путей. Материалы и методы: 28 больных инвазивным раком мочевого пузыря, которым проведена неоадъювантная химиотерапия. Результаты: неоадъювантная химиотерапия в 46,1% случаев восстановила уродинамику верхних мочевыводящих путей и улучшила ее в 15,4%. Выводы: случаи полной и частичной регрессии опухоли позволили выполнить пациентам органосохраняющее оперативное вмешательство, что способствовало повышению качества их жизни.
инвазивный рак мочевого пузыря, неоадъювантная химиотерапия.














Leave a comment