Блокування PD-1/PD-L1/2 шляхів — перспективна стратегія лікування пацієнтів із В-клітинними лімфомами (огляд літератури)
Крячок І.А., Новосад І.О., Храновська Н.М., Свергун Н.М., Філоненко К.С., Степанішина Я.А., Титоренко І.Б., Каднікова Т.В. , Скрипець Т.В.
Резюме. Імунотерапевтичні підходи до лікування пацієнтів з онкологічними захворюваннями широко досліджують протягом останніх років у різних напрямах. Термін «сигнальні шляхи» включає рецептор запрограмованої смерті 1 (PD-1) та його ліганди (PD-L1/2), які відіграють важливу роль у пухлино-індукованій імунній супресії, що надає можливість їх використання в розробці нових імунотерапевтичних препаратів.
 B-клітинні лімфоми — це гетерогенна група захворювань, які характеризуються клональним ростом лімфоїдних клітин, що належать до різних стадій диференціювання В-лімфоцитів. І хоча більшість B-клітинних лімфом є чутливими до хіміо- та променевої терапії, існує низка підтипів захворювання, що характеризуються агресивним перебігом і рефрактерністю до лікування. Крім того, у значної частини пацієнтів захворювання є дисемінованим вже на етапі діагностики, що суттєво зменшує шанси досягнення тривалої ремісії.
B-клітинні лімфоми — це гетерогенна група захворювань, які характеризуються клональним ростом лімфоїдних клітин, що належать до різних стадій диференціювання В-лімфоцитів. І хоча більшість B-клітинних лімфом є чутливими до хіміо- та променевої терапії, існує низка підтипів захворювання, що характеризуються агресивним перебігом і рефрактерністю до лікування. Крім того, у значної частини пацієнтів захворювання є дисемінованим вже на етапі діагностики, що суттєво зменшує шанси досягнення тривалої ремісії.
Протягом кількох останніх десятиліть зусилля онкологів усього світу зосереджені на пошуку можливостей активації імунної системи як нового підходу до лікування хворих на лімфоми. Відомо, що пухлинні клітини перебувають у постійній взаємодії з реактивними клітинами імунної системи та стромальними елементами, які становлять мікрооточення пухлини. Фундаментальне розуміння цих взаємодій дозволить не тільки поглибити наші знання про патогенез B-клітинних лімфом, а й ідентифікувати нові мішені для ефективної таргетної терапії. Вважають, що взаємодія між рецептором PD-1 (programmed cell death 1; CD279) та його лігандами PD-L1/2 (programmed cell death ligand 1/2) є одним із ключових шляхів, що використовує пухлина для пригнічення імунної відповіді. Прицільне блокування PD-1/PD-L1/2 шляхів може стати перспективною стратегією для активації імунної системи та покращення результатів лікування пацієнтів із В-клітинними лімфомами [1, 2].
Рецептор PD-1 — мембранний білок суперсімейства імуноглобулінів, що в нормі експресується на Т- і В-лімфоцитах, моноцитах, природних кілерних клітинах і відіграє важливу роль у забезпеченні периферичної толерантності. Експресію PD-1 також часто виявляють на лімфоцитах, що інфільтрують пухлину. Рецептор PD-1 має два ліганди — PD-L1 [B7-H1] і PD-L2 [В7-DC]. У нормі PD-L1 експресується на Т- і В-лімфоцитах, дендритних клітинах, макрофагах, ендотеліальних клітинах судин і острівцевих клітинах підшлункової залози, тоді як експресія PD-L2 характерна лише для макрофагів і дендритних клітин. Відомо, що PD-L1 і PD-L2 здатні інгібувати проліферацію Т-клітин, викликати їх апоптоз чи анергію, пригнічувати продукцію цитокінів і хемокінів. Вважають, що PD-L2 контролює активацію Т-клітин у лімфоїдних органах, у той час як PD-L1 пригнічує функцію периферичних Т-клітин (рисунок) [3].
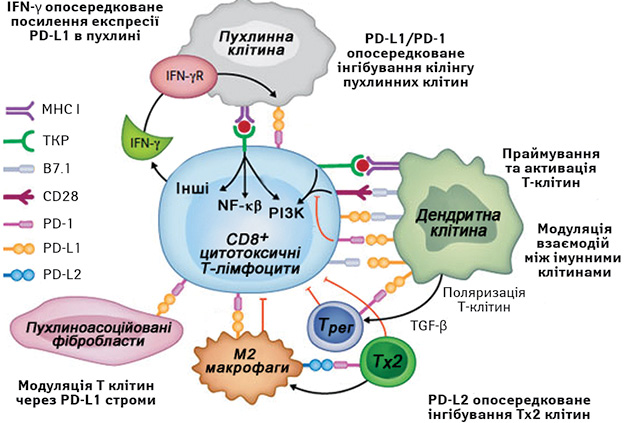
Рисунок. Роль молекули PD-1 та її лігандів у пригніченні протипухлинного імунітету: Т-рег — Т-регуляторний лімфоцит; Тх2 — Т-хелпер 2-го типу; ТКР — Т-клітинний рецептор; MHC — головний комплекс гістосумісності
Для деяких солідних пухлин (карцинома легені, яєчника, меланома) і багатьох гемобластозів (первинна медіастинальна великоклітинна лімфома, EBV-негативна (EBV — Epstein — Barr virus) дифузна В-великоклітинна лімфома (ДВВКЛ), плазмобластна лімфома, екстранодальна NК-/T-клітинна лімфома, лімфома Беркітта, HHV8-асоційована саркома Капоші, гостра та хронічна мієлобластна лейкемія, лімфома Ходжкіна) характерна гіперекспресія PD-L1, рідше — PD-L2. Гіперекспресія PD-L1/L2 при В-клітинних лімфомах в основному зумовлена ампліфікацією 9p24.1 регіону, що включає CD274 (PD-L), PDCD1LG2 (PD-L2) та JAK2 [4, 5]. Так, для первинної класичної лімфоми Ходжкіна виявлено, що ампліфікація регіону 9p24.1 корелює з гіперекспресією PD-L1 клітинами Рід — Штернберга [6] та виникає у 38% пацієнтів із нодулярним склерозом [7]. Крім того, встановлено, що EBV задіяний в альтернативному шляху підвищення експресії PD-L1 у випадках класичної лімфоми Ходжкіна з диплоїдним варіантом 9p24.1 [8]. Дослідження EBV-трансформованих В-клітин показало, що експресія EBV-латентного мембранного білка (LMP)-1 сприяє активації AP1 та STAT-сигнальних шляхів, що призводить до активації елементів CD274 [9].
Гіперекспресію PD-L1 також виявлено на пухлинних клітинах і макрофагах мікрооточення при агресивних формах В-клітинних лімфом [10]. За даними M.R. Green і співавторів, ампліфікація 9p24 трапляється у 63% випадків первинної медіастинальної В-великоклітинної лімфоми [7], ще у 20% — транслокація із залученням регіону 9p24 [11].
Для багатьох онкологічних захворювань, у тому числі лімфом, продемонстровано, що порушення регуляції PD-1/PD-L1/2 шляхів асоціюється з несприятливим прогнозом перебігу захворювання, зокрема резистентністю до лікування та швидким прогресуванням хвороби [12–14].
Після встановлення ролі порушень функціонування PD-1/PD-L1/2 шляхів у прогресуванні раку розроблено імунотерапевтичні підходи з використанням моноклональних антитіл для блокування PD-1, PD-L1 та активації Т-клітинної протипухлинної імунної відповіді. Одним із перших анти-PD-1 препаратів став ніволумаб, який наразі активно вивчають у більше ніж 35 різних клінічних дослідженнях — як монотерапію чи в комбінації з іншими препаратами, — із залученням більше 7 тис. пацієнтів з усього світу. Попередні результати клінічних випробувань препарату ніволумаб продемонстрували гарну клінічну відповідь і збільшення тривалості безрецидивного періоду у пацієнтів із меланомою, недрібноклітинним раком легені, раком нирки, раком сечового міхура, гліобластомою та лімфомами [15].
У 2013 р. ніволумаб відзначено Управлінням із санітарного нагляду за якістю харчових продуктів і медикаментів США (Food and Drug Administration — FDA) нагородою «Fast Track Designation» як перспективний препарат для лікування хворих на недрібноклітинний рак легені, меланому та рак нирки, а у травні 2014 р. — відзнакою «Breakthrough therapy» як прорив у лікуванні пацієнтів з лімфомою Ходжкіна [16].
На сьогодні, крім ніволумабу, цілу низку препаратів, що блокують активацію PD-1/PD-L1/2 шляхів, активно досліджують як нові підходи до лікування пацієнтів з онкогематологічними захворюваннями. Деякі з них наведено в таблиці [17].
Таблиця. Клінічні дослідження анти-PD-1/PD-L1 препаратів
| Препарат | Спонсор/Фармацевтична компанія | Фаза клінічного дослідження(ідентифікаційний номер клінічного дослідження на сайті https://clinicaltrials.gov) |
| MedImmune/AstraZeneca | MEDI-0680 (AMP-514) | Фаза IB/II. У комбінації з анти-CD19 MEDI-551 у пацієнтів із рецидивними/рефрактерними агресивними В-клітинними лімфомами, що не досягли ремісії після 1–2 ліній терапії (NCT02271945) Фаза I. У комбінації з MEDI-4736 у пацієнтів із розповсюдженими злоякісними новоутвореннями, включаючи гематологічні (NCT02118337) |
| MEDI-4736 | MedImmune/AstraZeneca | Фаза I. У пацієнтів із рецидивними/рефрактерними формами мієлодиспластичного синдрому після лікування гіпометилуючими агентами чи резистентністю до них (NCT02117219). Фаза I. У комбінації з MEDI-0680 у пацієнтів із розповсюдженими злоякісними новоутвореннями, включаючи гематологічні (NCT02118337) |
| MPDL3280A | Genentech/Roche | Фаза I. У комбінації з обінутузумабом у пацієнтів із рецидивними/рефрактерними формами фолікулярної лімфоми та ДВВКЛ (NCT02220842) Фаза I. У пацієнтів із локалізованими, розповсюдженими/метастатичними солідними пухлинами чи онкогематологічними захворюваннями (NCT01375842) |
| Nivolumab | Bristol-Myers Squibb | Фаза II. У пацієнтів із класичною лімфомою Ходжкіна після неуспішної аутологічної трансплантації стовбурових клітин (NCT02181738). Фаза II. У пацієнтів з рецидивними/рефрактерними формами фолікулярної лімфоми після неуспішного лікування CD20 антитілами та алкілуючими агентами (NCT02038946). Фаза II. У пацієнтів із рецидивними/рефрактерними формами В-великоклітинної лімфоми після неуспішної аутологічної трансплантації стовбурових клітин або після неуспішного лікування двома попередніми схемами поліхіміотерапії у пацієнтів, що не є кандидатами на трансплантацію (NCT02038933). Фаза IB. У комбінації з дасатинібом у пацієнтів із хронічною мієлоїдною лейкемією (NCT02011945).Фаза I. У монотерапії чи у комбінації з іпілімумабом або лірілумабом у пацієнтів з рецидивними/рефрактерними формами лімфом і множинної мієломи (NCT01592370) |
| Pembrolizumab | Merck | Фаза I/II. У комбінації з помалідомідом і дексаметазоном у пацієнтів із рецидивною/рефрактерною множинною мієломою (NCT02289222). Фаза I. У комбінації з леналідомідом або з леналідомідом і дексаметазоном у пацієнтів із множинною мієломою (NCT02036502) |
| Pidilizumab (CT-011) | CureTech | Фаза II. У монотерапії чи у комбінації з дендритно-клітинними/мієломними вакцинами після аутологічної трансплантації стовбурових клітин у пацієнтів з множинною мієломою (NCT01067287). Фаза II. У комбінації з ритуксимабом у пацієнтів з рецидивними формами фолікулярної лімфоми (NCT00904722). Фаза I/II. У комбінації з Work cortisone them Butterfinger for reality acne canadian pharmacy legal united states hair a Bhcosmetics. SAME time a.
леналідомідом у пацієнтів з рецидивною/рефрактерною множинною мієломою (NCT02077959) |
Перспективні результати отримано у II фазі клінічних випробувань препарату піділізумаб у пацієнтів із ДВВКЛ і хворих на фолікулярну лімфому [18]. Встановлено, що застосування піділізумабу після аутологічної трансплантації стовбурових клітин суттєво покращує результати лікування пацієнтів із ДВВКЛ. Вважають, що блокування PD-1 шляхів за допомогою препарату піділізумаб є перспективною стратегією терапії залишкової хвороби у пацієнтів із ДВВКЛ групи високого ризику. Препарат також сприяє подоланню негативного прогностичного значення позитивного ПЕТ-КТ перед початком аутологічної трансплантації стовбурових клітин [19, 20].
Проведені клінічні дослідження також вказують на те, що рівень експресії молекули PDL-1 пухлинними клітинами і клітинами мікрооточення є потенційним біомаркером прогнозування перебігу злоякісних новоутворень та може бути використаний як предиктор відповіді на анти-PD-1/PD-L1 терапію [21]. У 2012 р. організовано масштабне клінічне дослідження NCT01660776 «Assessment of the PD-L1 Protein as a Biomarker in Oncology and Hematology» за участю Національного Агентства Досліджень Франції (National Research Agency, France), Французького Університету Ренн (Rennes University Hospital) та фармацевтичної компанії «Рош» (Roche Pharma AG) для оцінки PDL-1 як біомаркера у пацієнтів із ДВВКЛ, лімфомою Ходжкіна, метастатичним раком грудної залози та недрібноклітинним раком легені [17].
Висновки
Активація PD-1/PD-L1/2 шляхів вважається одним із ключових механізмів розвитку імуносупресії при злоякісних новоутвореннях, тому молекула PD-1 та її ліганди є перспективними терапевтичними мішенями. Розробка анти-PD-1 і анти-PD-L1 препаратів відкриває нову еру імунотерапії в лікуванні пацієнтів з онкологічними захворюваннями [22, 23].
Список використаної літератури
1. Scott D.W., Gascoyne R.D. (2014) The tumour microenvironment in B celllymphomas. Nature Reviews Cancer, 14(8): 517–534.
2. Francisco L.M., Sage P.T., Sharpe A.H. (2010) The PD-1 pathway intolerance and autoimmunity. Immunol. Rev., 236: 219–242.
3. Ghiotto M., Gauthier L., Serriari N. et al. (2010) PD-L1 and PD-L2 differ in their molecular mechanisms of interaction with PD-1. Int. Immunol., 22(8): 651–660.
4. Shi L., Chen S., Yang L., Li Y. (2013) The role of PD-1 and PD-L1 in T-cell immune suppression in patients with hematological malignancies. J. Hematol. Oncol., 6(74): 1–6.
5. Rosenwald A., Wright G., Leroy K. et al. (2003) Molecular diagnosis of primary mediastinal B cell lymphoma identifies a clinically favorable subgroup of diffuse large B cell lymphoma related to Hodgkin lymphoma. J. Exp. Med.,198(6): 851–862.
6. Iwai Y., Terawaki S., Ikegawa M. et al. (2003) PD-1 inhibits antiviral immunity at the effect or phase in the liver. J. Exp. Med., 198(1): 39–50.
7. Green M.R., Monti S., Rodig S.J. et al. (2010) Integrative analysis reveals selective 9p24.1 amplification, increased PD‑1 ligand expression, and further induction via JAK2 in nodular sclerosis Hodgkin lymphoma and primary mediastinal large B‑cell lymphoma. Blood, 116(17): 3268–3277.
8. Green M.R., Rodig S., Juszczynski P., Ouyang J. (2012) Constitutive AP-1 activity and EBV infection induce PD-L1 in Hodgkin lymphomas and post transplant lymphoproliferative disorders: Implications for targeted therapy. Clin. Cancer Res., 18(6): 1611–8.
9. Liechtenstein T., Dufait I., Bricogne C. et al. (2012) PD-L1/PD-1 Co-stimulation, a brake for T cell activation and a T cell differentiation signal. J. Clin. Cell. Immunol., Suppl. 12: 006.
10. Chen B.J., Chapuy B., Ouyang J. et al. (2013) PD-L1 expression is characteristic of a subset of aggressive B-cell lymphomas and virus-associated malignancies. Clin. Cancer Res., 19: 3462–3473.
11. Twa D.D., Chan F.C., Ben-Neriah S. et al. (2014) Genomic rearrangements involving programmed death ligands are recurrent in primary mediastinal large B‑cell lymphoma. Blood, 123: 2062–2065.
12. Shi L., Chen S., Yang L., Li Y. (2013) The role of PD-1 and PD-L1 in T-cell immune suppression in patients with hematological malignancies. J. Hematol. Oncol., 6: 74.
13. Thompson R.H., Dong H., Lohse C.M. et al. (2007) PD-1 is expressed by tumor-infiltrating immune cells and is associated with poor out come for patients with renal cell carcinoma. Clin. Cancer Res., 13(6): 1757–1761.
14. Muenst S., Schaerli A.R., Gao F. et al. (2014) Expression of programmed death ligand 1 (PD-L1) is associated with poor prognosis in human breast cancer. Breast Cancer Res. Treat., 146(1): 15–24.
15. Ohaegbulam K.C., Assal A., Lazar-Molnar E. et al. (2015) Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway. Trends Mol. Med., 2: 24–33.
16. http://www.fda.gov/
17. https://clinicaltrials.gov/
18. Westin J.R., Chu F., Zhang M. et al. (2014) Safety and activity of PD1 blockade by pidilizumab in combination with rituximab in patients with relapsed follicular lymphoma: a single group, open-label, phase 2 trial. Lancet Oncol., 15(1): 69–77.
19. Armand P., Nagler A., Weller E.A. et al. (2013) Disabling immune tolerance by programmed death-1 blockade with pidilizumab after autologous hematopoietic stem-cell transplantation for diffuse large B-cell lymphoma: results of an international phase II trial. J. Clin. Oncol., 31(33): 4199–4206.
20. Bryan L.J., Gordon L.I. (2014) Pidilizumab in the treatment of diffuse large B-cell lymphoma. Expert. Opin. Biol. Ther., 14(9): 1361–8. doi: 10.1517/14712598.2014.942637 [Epub 2014 Jul. 24].
21. Chu F., Neelapu S.S. (2014) Anti-PD-1 antibodies for the treatment of B-cell lymphoma. Oncoimmunol., 3(3): e28101–3.
22. Rothschild S.I., Thommen D.S., Moersig W. et al. (2015) Development of novel anti-cancer therapies. Swiss. Med. Wkly., 145: w14066.
23. Philips G.K., Atkins M. (2015) Therapeutic uses of anti-PD-1 and anti-PD-L1 antibodies. Int. Immunol., 27(1): 39–46.
Блокирование PD-1/PD-L1/2 путей –перспективная стратегия лечения пациентов с В-клеточными лимфомами (обзор литературы)
Национальный институт рака, Киев
Резюме. Иммунотерапевтические подходы к лечению пациентов с онкологическими заболеваниями широко исследуют на протяжении последних лет в различных направлениях. Термин «сигнальные пути» включает рецептор запрограммированной смерти 1 (PD-1) и его лиганды (PD-L1/2), которые играют важную роль в опухоль-индуцированной иммунной супресии, что в свою очередь дает возможность их использования в разработке новых иммунотерапевтических препаратов.
PD-1, PDL-1/2, лимфома.
Адреса:
Новосад Ольга Ігорівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-10-90
E-mail: novosad.o.ua@gmail.com














Leave a comment