Інвазивні мікози в гематології. Сучасні стандарти діагностики і лікування
Резюме. Захворюваність на інвазивні мікози (ІМ) у пацієнтів онкогематологічного профілю, які отримують спеціальне лікування, достатньо висока. Ця група інфекцій відзначається високим рівнем смертності. Багато пацієнтів з онкогематологічними захворюваннями належать до групи високого ризику розвитку ІМ і потребують особливої уваги в контексті початку своєчасної супровідної терапії. Низька настороженість лікарів і неповноцінні знання про ІМ, труднощі в діагностиці, несвоєчасний початок терапії та інші фактори призводять до того, що навіть у західних клініках виживаність пацієнтів залишається незадовільною. Ми сподіваємося, що привернення уваги до цієї проблеми може сприяти поліпшенню ситуації, тому вирішили присвятити цикл статей діагностиці та лікуванню ІМ.
Резюме. Заболеваемость инвазивными микозами (ИМ) у онкогематологических больных, получающих специальное лечение, является достаточно высокой. Эта группа инфекций ассоциирована с высоким уровнем смертности. Многие пациенты с онкогематологическими заболеваниями принадлежат к группе высокого риска развития ИМ и требуют особого внимания в контексте начала своевременной сопроводительной терапии. Низкая настороженность врачей и неполные знания об ИМ, сложности в диагностике, несвоевременное начало терапии и другие факторы приводят к тому, что даже в западных клиниках выживаемость пациентов остается неудовлетворительной. Мы надеемся, что привлечение внимания к этой проблеме может привести к улучшению ситуации, поэтому решили посвятить цикл статей диагностике и лечению ИМ.

Введение
Несмотря на бурное развитие диагностических методик и появление современных противомикробных препаратов, диагностика и лечение инвазивных микозов (ИМ) остается сложной клинической задачей. Данные мировой литературы свидетельствуют об увеличении количества ИМ, особенно у пациентов с иммуносупрессией (после трансплантации гемопоэтических стволовых клеток (ТГСК), трансплантации органов; получавших химиотерапию или другое иммуносупрессивное лечение, находящихся в отделениях интенсивной терапии). Трудности и несвоевременность морфологических и микробиологических методов идентификации возбудителя, отсутствие высокочувствительных и высокоспецифических лабораторных тестов, низкая настороженность врачей приводят к слишком поздней диагностике ИМ, а соответственно, и отсроченному лечению. В результате ИМ по-прежнему характеризуются тяжелым течением заболевания и высокой смертностью.
На сегодня несколькими исследовательскими группами опубликованы рекомендации по лечению ИМ (ECIL, ESCMID, IDSA); кроме того, в клинические руководства по профилактике и лечению фебрильной нейтропении включены подразделы, посвященные ИМ (NCCN, ESMO, MSCCK и др.).
Нами подготовлена статья, посвященная вопросам диагностики, профилактики и лечения ИМ. В рамках работы мы также рассмотрим клинические исследования, послужившие основой для создания современных рекомендаций по ведению пациентов гематологического профиля с ИМ.
Диагностика ИМ
Грибы рода Candida (рис. 1).
*Фото из Microbe World (http://www.microbeworld.org/component/
jlibrary/?view= article&id=1097)
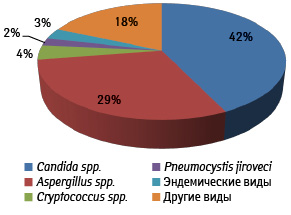
На современном этапе кандидоз по-прежнему является наиболее распространенной формой ИМ и инфекций кровяного русла (рис. 2). Однако при исследовании роли различных видов грибов в развитии ИМ у пациентов гематологического профиля выявлено снижение удельного веса кандидоза и рост аспергиллеза и других микозов, вызванных различными видами плесневых грибов. Это, вероятно, связано с применением флуконазола в качестве профилактики грибковых инфекций [1, 2].
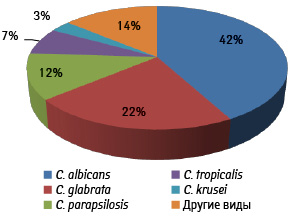
Обращают на себя внимание изменения спектра видов грибов рода Candida от C. albicans к другим видам (С. glabrata, С. krusei, С. tropicalis и др.) (рис. 3) [3].
Факторами риска развития этого заболевания являются: колонизация грибами рода Candida, длительная госпитализация, оперативные вмешательства на органах брюшной полости, использование парентерального питания, антибиотиков, центральных венозных катетеров, применение кортикостероидов или другой иммуносупрессивной терапии, высокий балл по шкале Acute Physiology and Chronic Health Evaluation (APACHE II), гемодиализ, искусственная вентиляция легких, сахарный диабет (табл. 1) [4, 5].
Таблица 1. Факторы риска развития инвазивного кандидоза (ИК)
| Колонизация грибами рода Candida (более 2 локусов) | Длительная госпитализация | Оперативные вмешательства на органах брюшной полости |
| Использование парентерального питания | Применение антибиотиков | Использование центральных венозных катетеров (более 5 дней) |
| Применение кортикостероидов или другой иммуносупрессивной терапии | Высокий балл по шкале APACHE II | Гемодиализ |
| Искусственная вентиляция легких | Сахарный диабет |
Клиническая картина инвазивного кандидоза (ИК) неспецифична и может варьировать от полного отсутствия симптомов до признаков тяжелого сепсиса. Использование визуализирующих методов обследования (компьютерная томография и др.) позволит выявить диссеминированное поражение внутренних органов (рис. 4). Микроскопический метод включает в себя исследование микробиологических образцов в нативном виде и при окрашивании или материала биопсии. Ограничениями в использовании микроскопии микробиологических образцов является возможность определения ИМ на этапе, когда в образце присутствует большое количество возбудителя (запущенная стадия заболевания), а также невозможность зачастую идентифицировать вид возбудителя, что не позволит назначить максимально правильную и своевременную терапию [6]. Исследование цитологического или гистологического материала — гораздо более чувствительный метод. Традиционное окрашивание (по Романовскому — Гимзе), а также окрашивание реактивом Шиффа и серебром дают возможность идентифицировать возбудителя. Особенно ценен этот метод при диагностике поражения внутренних органов различными видами плесневых грибов (Zygomycetes) [6]. Кроме того, этот материал может быть использован для исследования с помощью in situ гибридизации или полимеразной цепной реакции (ПЦР) (табл. 2).
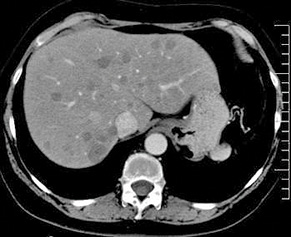
*Фото из Microbe World
(http://www.eurorad.org/mediafiles/
eurorad/0000007171/000011_text.jpg)
Таблица 2. Диагностические методы при ИМ
| Инвазивный кандидоз | Инвазивный аспергиллез (ИА) |
Визуализирующие методики
|
Визуализирующие методики
|
Микроскопические
|
Микроскопические
|
Бактериологические методы
|
Бактериологические методы
|
Серологические методы
|
Серологические методы
|
| ПЦР | ПЦР |
КТ — тут и далее — компьютерная томография; МРТ — магнитно-резонансная томография; БАЛ — бронхоальвеолярный лаваж.
Основным методом установления диагноза ИК является микробиологический. Чувствительность методики составляет 50%. Рекомендуется проведение последовательных посевов крови из различных мест (прямая венепункция, посев из катетера) в течение нескольких дней. Период инкубации может быть различным для разных видов Candida (2–5 сут). Рост грибов осуществляется как на стандартных, так и на специфических средах [7].
К числу немикробиологических методов относится ряд серологических методик и определение ДНК гриба с помощью ПЦР. Серологические исследования состоят в определении маннана, антиманнана и (1,3)-β-d-глюкана. Маннан является поверхностным антигеном грибов рода Candida. Чувствительность метода составляет 58%, специфичность — 93%. Чувствительность и специфичность антиманнана (антиманнановых антител) составляют 59 и 83% соответственно. При комбинированном использовании обоих методов чувствительность и специфичность возрастают до 83 и 86% соответственно [8]. Впрочем, следует помнить, что у пациентов с выраженной иммуносупрессией антитела к компонентам клеточной стенки гриба могут не образовываться. (1,3)-β-d-Глюкан также является компонентом клеточной стенки грибов. Этот метод не специфичен для какого-либо вида грибов, поэтому его используют как дополнительный. Он может быть применен в диагностике кандидоза и аспергиллеза, однако не криптококкоза и зигомикоза (из-за низкого содержания глюкана в клеточной стенке этих грибов). Такой тест валидирован для пациентов гематологического профиля, а вот у других категорий больных его использование не является оправданным. Положительное значение теста составляет около 70 пг/мл в тесте ELISA и 7 пг/мл — в тесте Wako Pure Chemical Industries, чувствительность — 77%, специфичность — >83% [9]. Панелью экспертов EORTC/MSG тест включен в диагностику всех ИМ. Негативное прогностическое значение теста (то есть достоверность данных об отсутствии возбудителя при негативном результате исследования) составляет >90%, поэтому он может быть успешно использован в качестве раннего диагностического метода [10].
К сожалению, все эти методы доступны в Украине в ограниченном количестве лабораторий, имеют высокую стоимость, некоторые требуют достаточно длительного ожидания результата, что связано с техническими сложностями (например отправка образцов за рубеж).
Определение нуклеиновых кислот грибов рода Candida является перспективным направлением в диагностике ИМ, обладающим высокими чувствительностью и специфичностью. Так, в метаанализе, опубликованном в 2009 г., эти показатели составили 88 и 75% соответственно. Авторы метаанализа акцентируют внимание на том, что в 16 исследованиях, включенных в работу, использовали различные методики выделения материала, праймеры и пр., поэтому сравнивать их очень сложно [11].
Грибы рода Aspergilla (рис. 5).
*Фото из Pathogenic Fungi Database (http://www.pfdb.net/photo/mirhendi_h/
box020909/standard/a_fumigatus_s.jpg)
При наличии ИМ, вызванного грибами рода Aspergilla, смертность от этой инфекции составляет около 60%, а у пациентов с аллогенной ТГСК или поражением структур центральной нервной системы (ЦНС) — практически 90% [12]. Длительность и глубина нейтропении играют ключевую роль в возникновении аспергиллеза у пациентов онкогематологического профиля. Длительность нейтропении более 3 нед обусловливает риск возникновения инфекции (в том числе грибковой) у 60% больных, при усугублении нейтропении до показателей абсолютного числа нейтрофилов <0,1 Г/л этот риск повышается до 100%. У пациентов после аллогенной ТГСК наблюдается 2 пика заболеваемости аспергиллезом: в течение первых 20 дней после трансплантации (на фоне длительной нейтропении) и после 100 дней (на фоне кортикостероидной терапии по поводу реакции «трансплантат против хозяина» — РТПХ) [13]. Если при ИК основным путем инфицирования является эндогенный (инвазия возбудителя через поврежденные кожные покровы), то при ИА главный источник инфекции — внешняя среда (воздух, почва, вода, домашние животные, проведение ремонтных работ). Особое внимание стоит обратить на риски инфицирования аспергиллами у курильщиков, а также при наличии ремонтных работ в больничных помещениях, что связано с более высокой вероятностью инфицирования [14].
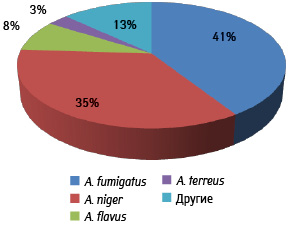
Наибольший удельный вес в развитии ИА имеют A. fumigatus (41%), A. niger (35%), A. flavus (8%) (рис. 6) [15].
Факторами риска возникновения ИА являются период индукции при острой миелодной лейкемии, аллогенная ТГСК и трансплантация солидных органов (табл. 3) [16].
Таблица 3. Факторы риска развития ИА
| Низкий риск | Средний риск | Высокий риск |
| Аутологичная ТГСК | Острая лимфобластная лейкемия | Острая миелоидная лейкемия (период первой индукции) |
| Лимфома Ходжкина | Хроническая лимфоцитарная лейкемия | Аллогенная ТГСК |
| Хронические миелопролиферативные заболевания | Лимфома | Трансплантация сердца, печени, легкого |
| Солидные злокачественные опухоли | Хронические обструктивные заболевания легких | |
| Множественная миелома | СПИД | |
| Трансплантация почек | Миелодиспластический синдром | |
| Хронические иммунодефицитные заболевания | ||
| Системная красная волчанка |
СПИД — синдром приобретенного иммунодефицита.
Клиническая картина может быть разнообразной в зависимости от локализации очагов. Наиболее часто поражаются легкие и головной мозг.
В диагностике аспергиллеза используются те же методы, что и при диагностике ИК (радиографические, микробиологические, серологические, ПЦР и др.) (см. табл. 2).
КТ грудной полости является методом, дающим веские основания заподозрить ИА. Симптом «halo» — снижение пневматизации легочной ткани вокруг очага уплотнения — наиболее известный признак аспергиллеза (рис. 7). При наличии симптомов, обусловленных поражением других органов, следует провести соответствующие радиографические обследования (например МРТ головного мозга). В течение первых 7 дней количество и размеры очагов могут увеличиваться, даже вопреки успешной терапии. Нужно с осторожностью относиться к результатам ранней радиографической оценки, так как такие изменения не будут являться прогрессированием заболевания и требовать изменения терапии. Симптом серпа (полумесяца) — серповидный участок просветления, обусловленный скоплением газа вокруг патологического очага (см. рис. 7). Этот признак появляется на поздней стадии развития ИА и свидетельствует о формировании некроза в очаге поражения. Такие симптомы могут быть характерными при наличии аспергиллеза у пациентов с нейтропенией и после ТГСК. Впрочем, эти радиологические находки требуют тщательной дифференциальной диагностики, особенно у других категорий больных [17, 18].
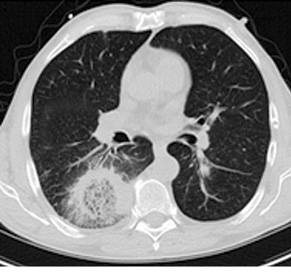
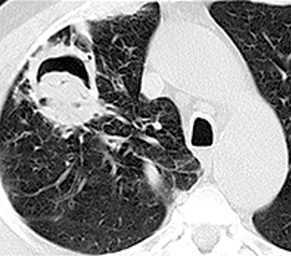
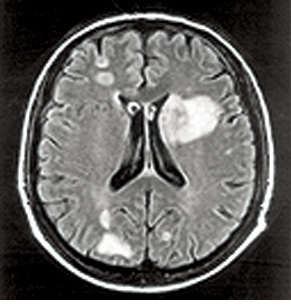
*Фото Radiopaedia (http://radiopaedia.org/articles)
Для проведения микробиологических исследований используется посев крови, материала биопсии, БАЛ. Следует еще раз отметить, что этот метод имеет существенные ограничения: длительность получения результата и трудности с забором материала для исследования, в том числе и из-за тяжелого состояния пациента.
Серологические методы включают определение галактоманнана и (1,3)-β-d-глюкана. Галактоманнан — один из компонентов клеточной стенки аспергиллы. Положительным считается результат >0,7–0,8 единиц в Европейских странах, >0,6 — в США в одном образце и >0,5 — в двух последовательных образцах сыворотки крови [19]. В ликворе тест считается положительным при уровне >0,5, в материале БАЛ — >1. С учетом развития медицинских технологий и появления новых, более чувствительных методик ожидается снижение уровня галактоманнана, который будет считаться положительным [20].
Чувствительность и специфичность этого теста при определении галактоманнана в сыворотке крови составляют около 80% и до 90–95% — при определении в материале, полученном при проведении БАЛ, или ликворе. При выполнении нескольких последовательных исследований эффективность метода повышается [21, 22]. В результате метаанализа, проведенного в 2006 г., были получены данные о средних показателях чувствительности и специфичности определения галактоманнана, которые составили 71 и 89% соответственно [23]. Ложноположительные результаты могут быть получены у пациентов, которым проводят антибактериальную терапию с пиперациллином тазобактамом, при других ИМ, у детей при высокой колонизации Bifidobacterium и др. Оценка в динамике уровня галактоманнана может быть использована как прогностический фактор течения ИМ и поводом для назначения сальвадж-терапии [24].
Метод доступен в Украине, однако, как и при исследовании маннана и антиманна, имеет высокую стоимость, а время до получения результата достаточно длительно.
При проведении ПЦР используется несколько таргетных генов, возможно исследование крови и других биологических жидкостей. Исследование крови в качестве источника для ПЦР имеет свои ограничения (небольшое количество аспергилл в крови, ингибирование реакции некоторыми компонентами крови). Использование в качестве источника материала биопсии или БАЛ является более достоверным, однако эти образцы сложно получить [25]. Применение нескольких методик (определение уровня галактоманнана и ПЦР или галактоманнана и (1,3)-β-d-глюкана) позволяет достичь положительного прогностического уровня 100% [26].
Другие грибковые инфекции
Постепенно возрастает количество ИМ, вызванных другими плесневыми грибами. Наиболее часто возбудителями ИМ становятся Fusarium spp., Scedosporium, Zygomycetes и др. Их удельный вес существенно увеличился за последние декады [15]. В диагностике этих видов наибольшую роль играют микробиологические методы. Также возможно применение ПЦР и других методик. Например, при фузариозе культура крови может быть положительной у 50% больных. Заболевания, вызванные грибами рода Fusarium, отличаются высокой смертностью (до 50–80%), зачастую резистентны к большому количеству антимикотиков. Мукормикозы (зигомикозы) часто проявляются сосудистой инвазией, тромбозами и, соответственно, некрозом тканей [27, 28].
Критерии установления диагноза ИМ
Философия антимикотической терапии основана на степени подтверждения наличия грибковой инфекции. Согласно Пересмотренным критериям European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group (2008), выделяют доказанную, вероятную и возможную грибковую инфекцию [29]. В эту классификацию внесены все ИМ, кроме Pneumocystis jiroveci.
Вероятная грибковая инфекция требует учета трех составляющих: фактор хозяина, клинические проявления, микологическое подтверждение (табл. 4). Доказанной грибковая инфекция является при наличии элементов клеток гриба в материале, полученном от пациента (табл. 5). При установлении диагноза возможной грибковой инфекции учитываются данные хозяина и клинические проявления. При этом микологическое подтверждение не получено.
Таблица 4. Критерии вероятной грибковой инфекции
| Фактор хозяина | Недавняя или длящаяся более 10 дней нейтропения (<500 клеток в мкл), совпадающая с появлением признаков инфекцииРеципиент аллогенной ТГКСДлительное применение кортикостероидов в дозе ≥0,3 мг/кг/сут более 3 нед (исключаются пациенты с аллергическим бронхопульмональным аспергиллезом)Лечение другими иммуносупрессорами, подавляющими Т-клеточное звено иммунитета (циклоспорин, блокаторы TNF-α, специфические моноклональные антитела (алемтузумаб), аналоги нуклеозидов) в течение последних 90 днейТяжелые наследственные иммунодефициты |
| Клинические проявления | Грибковая инфекция нижних отделов респираторного тракта: наличие одного из 3 симптомов:
Трахеобронхит:
Синоназальная инфекция: радиографические признаки синусита плюс 1 из 3 признаков:
Инфекция ЦНС: 1 из 2 признаков:
Диссеминированный кандидоз: 1 из 2 признаков после эпизода кандидемии в течение предыдущих 2 нед:
|
| Микологические критерии | Прямые тесты (цитология, микроскопия, культура)Плесневые грибы в мокроте, материале БАЛ, аспирате из синусовНепрямые тесты (детекция антигенов или элементов клеточной стенки) в плазме, сыворотке крови, материале БАЛ, ликворе) |
Таблица 5. Критерии доказанной грибковой инфекции
| Материал и метод | Плесневые грибы | Дрожжевые грибы |
| Микроскопия (стерильный материал) | Гистологическое, цитологическое или микроскопическое исследование, в котором выявлены гифы или меланизированные дрожжеподобные формы, а также признаки повреждения тканей организма | Гистологическое, цитологическое или микроскопическое исследование материала, обычно полученного из стерильных мест (не слизистые оболочки), в котором выявлены клетки дрожжевых грибов |
| Культура (стерильный материал) | Рост плесневых грибов или «черных дрожжевых грибов» в культуре из образцов, полученных в результате проведения стерильной процедуры забора материала из обычно стерильных и клинически или радиологически вовлеченных в патологических процесс очагов, связанных с инфекционным процессом (за исключением материала БАЛ, синусов, мочи) | Рост дрожжевых грибов в культуре из образцов, полученных в результате проведения стерильной процедуры забора материала из обычно стерильных мест, которые клинически или радиологически вовлечены в патологических процесс |
| Кровь | Рост плесневых грибов в культуре крови (например Fusarium spp.) при наличии признаков инфекционного процесса | Рост дрожжевых (например Cryptococcus или Candida spp.) или дрожжеподобных грибов (например Trichosporon spp.) в культуре крови |
| Серологический анализ ликвора | − | Определение криптококкового антигена в ликворе свидетельствует о диссеминированном криптококкозе |
Таким образом, ИМ являются сложными для диагностики заболеваниями, а соответственно, и для назначения адекватной терапии. Основным методом установления диагноза ИМ на сегодня по-прежнему является микробиологический. Однако существуют лабораторные методики, позволяющие достаточно быстро подтвердить диагноз ИМ у пациентов гематологического профиля (галактоманнан, маннан). Современные диагностические методики постоянно совершенствуются и дают возможность правильно установить диагноз, однако учеными не получены окончательные данные о наиболее эффективных алгоритмах верификации возбудителя. Новейшие техники, например ПЦР, пока еще не валидированы для использования в рутинной клинической практике, но ожидается, что в ближайшее время они будут внесены в руководства по диагностике и лечению ИМ у гематологических больных.
В Украине ситуация с диагностикой ИМ является еще более сложной в связи с ограниченной доступностью методов выявления грибковых инфекций, низкой настороженностью клиницистов и врачей лабораторий относительно ИМ. Впрочем, в ближайшее время ожидается улучшение диагностики этих инфекций благодаря появлению лабораторий, владеющих методикой определения уровня галактоманнана. Визуализирующие методы обследования также могут внести дополнительную информацию в установление диагноза и помочь заподозрить развитие ИМ.
Диагноз ИМ должен быть установлен согласно Пересмотренным критериям EORTC/MSG Consensus Group (2008) и определен как доказанная, вероятная или возможная грибковая инфекция. Проведение максимально адекватной диагностики ИМ позволит выбрать наиболее эффективное лечение.
Лечение ИМ
Терапия пациентов с ИМ остается одним из наиболее сложных вопросов современной медицины. К сожалению, не только в Украине, но и в развитых странах существуют неадекватные подходы к лечению при этих инфекциях. В первую очередь следует подчеркнуть, что антимикотическая терапия должна быть начата 1) своевременно и 2) в адекватных дозах. Отсрочка старта лечения даже на 12–24 ч повышает уровень смертности от грибковой инфекции в несколько раз [30]. В значительной части клиник, в том числе и зарубежных, терапия начинается несвоевременно и с нарушением доз препаратов [31].
Исходя из степени доказанности наличия грибковой инфекции, выделяют следующие варианты применения антимикотических препаратов: профилактическое, эмпирическое, превентивное и таргетное лечение.
Профилактическое применение антимикотиков используется при отсутствии каких-либо признаков инфекции в группе высокого риска (первичная профилактика). Вторичная профилактика проводится в случае наличия предшествующих эпизодов ИМ и сохранения возможности повторного его развития.
Эмпирическую терапию применяют в случае возможной грибковой инфекции (при наличии клинического подозрения, но в отсутствие какого-либо подтверждения с помощью объективных методов обследования). Превентивная терапия назначается при вероятной грибковой инфекции, то есть наличии лабораторных и радиографических признаков, без выделения культуры гриба. Таргетную терапию используют при доказанной грибковой инфекции.
Современные руководства довольно четко определяют алгоритмы лечения при ИМ, однако знания в этой области медицины довольно быстро меняются, что требует постоянного пересмотра руководств и коррекции клинической практики применения антимикотических препаратов.
Группы противогрибковых препаратов
Существуют три основных группы противогрибковых препаратов, которые используются в терапии ИМ.
Полиены. Длительное время препаратом выбора для лечения пациентов с ИМ оставался амфотерицин В дезоксихолатный комплекс (амфо В). Механизм действия этого препарата обусловлен его связыванием со стеролами, находящимися в клеточной мембране гриба, и нарушением проницаемости мембраны, в результате чего происходит выход внутриклеточных компонентов во внеклеточное пространство и лизис клетки гриба. Однако его эффективность является неудовлетворительной, он обладает высоким уровнем токсичности (уровень нефротоксичности при применении данного препарата составлял около 30%, а смертность возрастала в 6 раз) [32]. Синтез новых препаратов амфотерицина и использование альтернативных стратегий его введения позволили значительно снизить токсичность терапии без потери ее эффективности (24-часовое введение амфо В; аэрозольные формы липидного комплекса амфо В (АВЛК), липосомальный амфотерицин В (L-амфо В), коллоидная дисперсия амфотерицина В (АВКД)). Кроме этих препаратов, к группе полиенов принадлежат нистатин, леворин и др.
Триазолы (азолы). К этой группе препаратов относятся флуконазол, итраконазол, посаконазол, вориконазол и равуконазол. Последние три принадлежат ко II поколению этой группы препаратов. Механизм их действия ассоциирован с нарушением функционирования грибковых ферментов, связанных с цитохромом Р450, что приводит к нарушению синтеза элементов клеточной стенки (стеролов). Препараты из этой группы наиболее часто применяются в современной практике. Однако следует помнить, что все лекарственные средства следующих за флуконазолом поколений (итраконазол, посаконазол, вориконазол) требуют мониторинга терапевтических концентраций, что на данный момент невозможно проводить в Украине. Кроме того, препараты этой группы имеют лекарственные взаимодействия с некоторыми химиопрепаратами (например винкристином), что усложняет их назначение.
Эхинокандины (каспофунгин, микафунгин, анидулафунгин). Эта группа препаратов нарушает синтез (1,3)-β-d-глюкана, необходимого для построения клеточной стенки грибов. Именно эти препараты активно исследуются в последнее время и занимают новые ниши в противогрибковой терапии.
К сожалению, в Украине представлены не все необходимые противогрибковые препараты, а цена на имеющиеся достаточно высока. Тем не менее все препараты групп азолов и эхинокандинов, рекомендованные к применению современными руководствами, доступны в нашей стране.
Наиболее широко представлена группа производных азолов. Так, доступными являются различные формы флуконазола (27 как отечественных, так и зарубежных производителей). Достаточно большой выбор (8 производителей) препаратов итраконазола (пероральная форма). Зарегистрированы препараты вориконазола (2 производителя) в парентеральной и пероральной формах и единственный препарат посаконазола в форме пероральной суспензии. Также зарегистрированы все три препарата из группы эхинокандинов в парентеральной форме [33].
Профилактическое применение антимикотиков
Первичная профилактика. С целью профилактики ИМ рекомендованы к применению несколько препаратов. В наиболее ранних работах изучали роль флуконазола в профилактике инвазивных грибковых инфекций. Несколько плацебо-контролируемых исследований, посвященных изучению применения флуконазола в качестве профилактики ИМ, были проведены более 10 лет назад. Во всех исследованиях продемонстрированы преимущества применения этого препарата как по количеству случаев ИМ, возникших на фоне проведения профилактики, так и по показателю выживаемости пациентов по сравнению с группой плацебо [34–36]. В работе M.A. Slavin и соавторов (1995) количество доказанных ИМ составило 7% в группе флуконазола и 18% — в группе плацебо (р=0,004). K.A. Marr и соавторы (2000) продемонстрировали аналогичное соотношение количества ИМ в группах сравнения, однако при анализе распределения возбудителей оказалось, что частота возникновения инфекций, вызванных плесневыми грибами, была одинаковой в обеих группах (<1%; р=0,33). Это свидетельствует о невысокой эффективности профилактики инфекционных заболеваний, вызванных плесневыми грибами, проводимой с помощью флуконазола. Исследовали различные дозы флуконазола (от 50 до 400 мг/сут). Наиболее действенным оказалось профилактическое применение флуконазола в дозе 400 мг/сут [35].
С момента проведения этих исследований произошли существенные изменения в спектре возбудителей ИМ. Учитывая увеличение количества микозов, вызванных плесневыми грибами, не чувствительными к флуконазолу (особенно в более поздний период после аллогенной ТГСК — период развития РТПХ), возникла потребность в применении других препаратов. A.J. Ullmann и соавторы в 2007 г. опубликовали результаты рандомизированного исследования по сравнению эффективности посаконазола и флуконазола в профилактике ИМ у пациентов с выраженной РТПХ после аллогенной ТГСК. Количество всех ИМ составило 2,4% в группе участников, получающих лечение посаконазолом, и 7,6% — в группе применения флуконазола (р=0,004). Количество случаев развития ИА составило 1 и 5,9% соответственно (р=0,001) [37]. Плацебо-контролируемое исследование с применением аэрозольной формы L-амфо В в комбинации с флуконазолом показало преимущества этого вида профилактики: количество эпизодов доказанного или вероятного ИА составило 4,3% в группе пациентов, получающих лечение L-амфо В и флуконазолом, и 13,6% — в группе плацебо. Несмотря на высокий уровень (около ⅓ пациентов в обеих группах) отказа от терапии (ввиду технических сложностей использования такой формы препарата, невосприятия или непереносимости терапии), такая профилактика также может быть рекомендована для применения у пациентов с острыми лейкемиями [38].
Также опубликованы результаты исследований, сравнивающих эффективность вориконазола и флуконазола в качестве профилактики ИМ [39, 40]. В оба исследования были включены пациенты как в период нейтропении после проведения ТГСК, так и в период развития РТПХ. В первом при сравнении эффективности вориконазола и флуконазола не было продемонстрировано достоверной разницы в токсичности терапии и преимуществ в выживаемости без грибковых инфекций. Однако была зафиксирована тенденция к уменьшению количества ИМ в группе вориконазола (7,3% против 11,2%; p=0,12). При сравнении выживаемости в течение 180 дней после ТГСК без признаков ИМ и с длительностью профилактики более 14 дней в группе пациентов, получавших вориконазол и итраконазол, выживаемость была выше в группе больных, получающих терапию вориконазолом (49,1% против 34,%; p=0,0004).
В исследовании с применением итраконазола, результаты которого опубликованы F. Manichetti и соавторами в 1999 г., показаны преимущества применения итраконазола по сравнению с плацебо. Частота возникновения ИМ составила 24 и 33% соответственно (р=0,035). Количество инфекций, вызванных плесневыми грибами, составило 2 и 0,4% соответственно и было сопоставимо в обеих группах [41].
В рандомизированном исследовании, сравнивающем эффективность профилактики с использованием итраконазола и флуконазола у больных с ожидаемой длительностью нейтропении >10 дней, не выявлено каких-либо различий в эффективности и токсичности двух препаратов. Количество ИМ составило 1,6% в группе пациентов, которые получали итраконазол, и 2,0% в группе пациентов, у которых применяли флуконазол; количество эпизодов ИА составило 0,8 и 1,2% соответственно [42].
Каспофунгин показал схожую эффективность и токсичность по сравнению с итраконазолом при использовании в качестве профилактики ИМ в рандомизированном исследовании, опубликованном G.N. Mattiuzzi и соавторами в 2006 г. Всего в исследование были включены 200 пациентов, анализу доступны данные 192 больных. Количество случаев ИМ составило 5% в группе итраконазола и 7% — в группе каспофунгина, тогда как частота возникновения ИА достигала 1 и 5% соответственно [43].
Микафунгин продемонстрировал лучшую эффективность по сравнению с флуконазолом в крупном рандомизированном исследовании с включением 882 пациентов после ТГСК. Успех в терапии (который определялся как отсутствие возможной, вероятной или доказанной грибковой инфекции) был достигнут у 80% участников в группе микафунгина и 73,5% — в группе флуконазола (р=0,03). Однако количество вероятных или доказанных ИМ, а также аспергиллеза в группах микафунгина и флуконазола было сопоставимым (1,6% против 2,4%; р=0,481; 0,2 и 1,5%; р=0,071 соответственно) [44].
Необходимая длительность проведения противогрибковой профилактики у реципиентов аллогенной ТГСК составляет 90–100 дней. Однако применение препарата следует продолжать у пациентов, получающих иммуносупрессивную терапию в период РТПХ. В таком случае длительность профилактического применения противогрибковых препаратов не может быть точно определена (по результатам существующих исследований).
Суммарные данные по эффективности различных препаратов представлены в табл. 6.
Таблица 6. Результаты исследований по профилактике ИМ
| Автор | Тип исследования | Препараты | Количество ИМ, % | Количество ИА, % | Достоверность, p |
| Slavin M.A., 1995 [36] | Рандомизированное | Флуконазол Плацебо |
7,018,0 | − | 0,004 |
| Marr K.A., 2000 [35] | Рандомизированное (период наблюдения 8 лет) | Флуконазол Плацебо |
3,020,0 | 1,01,0 | 0,0010,33 |
| Manichetti F., 1999 [41] | Рандомизированное | Итраконазол Плацебо |
24,033,0 | 2,00,4 | 0,035>0,05 |
| Ullmann A.J., 2007 [37] | Рандомизированное | Посаконазол Флуконазол |
2,47,6 | 1,05,9 | 0,0040,001 |
| Rijnders B.J., 2008 [38] | Рандомизированное | Аэрозольный липосомальный амфотерицин В Плацебо |
− | 4,313,6 | 0,007 |
| Wingard J.R., 2007 [39] | Рандомизированное | Вориконазол Флуконазол |
7,311,2 | 3,06,0 | 0,120,09 |
| Marks D.I., 2009 [40] | Рандомизированное | Вориконазол Итраконазол |
1,32,1 | 0,42,0 | 0,540,12 |
| Glasmacher A., 2006 [42] | Рандомизированное | Итраконазол Флуконазол |
1,62,0 | 0,81,2 | >0,05 |
| Mattiuzzi G.N., 2006 [43] | Рандомизированное | Каспофунгин Итраконазол |
5,07,0 | 1,05,0 | >0,05 |
| van Burik J.A., 2004 [44] | Рандомизированное | Микафунгин Флуконазол |
1,62,4 | 0,21,5 | 0,4810,071 |
В табл. 7 описаны сводные рекомендации по профилактике ИМ у пациентов различных когорт, опубликованные двумя исследовательскими группами (ECIL и ESCMID) [45–47]. Итак, флуконазол остается препаратом выбора для проведения профилактики ИМ, однако лишь в той ситуации, когда у пациентов применяют диагностические методики, направленные на поиск инфекций, вызванных плесневыми грибами, а последующая терапия направлена против этих возбудителей (эмпирическая терапия). Посаконазол является препаратом выбора для проведения профилактики в период развития острой или хронической РТПХ. Однако следует помнить о необходимости мониторинга терапевтических концентраций препарата в сыворотке крови, особенно у пациентов с интерстинальной формой РТПХ. Вориконазол рекомендован для проведения профилактики ИМ в любой период после аллогенной ТГСК.
Таблица 7. Рекомендации по первичной профилактике грибковых инфекций ECIL-3 (2009), ESCMID для ИК (2012) и ИА (2014)
| Первичная профилактика ИМ у пациентов, получающих химиотерапию (индукция острого лейкоза, аутологичная ТГСК, терапия лимфом (при необходимости)) |
||||
| Название препарата | ECIL-3 | ESCMID-2012 | ESCMID-2014 | Примечание |
| Кандидоз | Аспергиллез | |||
| Флуконазол, 400 мг | СІ | СІ | − | Нет активности против аспергиллеза |
| Итраконазол, 7,5 мг/кг | СІ | СІ | DІІ | Рекомендуется терапевтический мониторинг, минимальная концентрация в сыворотке для:итраконазола: >0,5 мг/л, не одобрен у детей;вориконазола: 1,0–5,0 мг/л, не одобрен у детей до 2 лет;посаконазола: ≥0,5 мг/л, не одобрен у детей до 13 лет |
| Вориконазол, 4 мг/кг (6 мг/кг в 1-й день) 2 раза внутривенно или 200 мг 2 раза | − | − | − | |
| Посаконазол, 600 мг | АІ | СІІ | АІ | |
| Микафунгин, 50 мг | − | − | − | |
| L-амфо В, 50 мг | СІ | − | СІІ | Когда невозможно другое |
| L-амфо В (аэрозоль), 12,5 мг | − | − | СІІ | Только легочные формы |
| Каспофунгин, 50–70 мг | − | CI | СІІ | |
| Первичная профилактика ИМ у пациентов после аллогенной ТГСК (фаза нейтропении) | ||||
| Название препарата | ECIL-3 | ESCMID-2012 | ESCMID-2014 | Примечание |
| Кандидоз | Аспергиллез | |||
| Флуконазол, 400 мг | АІ | АІ | − | Нет активности против аспергиллеза, применять только при очень низкой локальной резистентности или качественных локальных диагностических и терапевтических алгоритмах |
| Итраконазол, 7,5 мг/кг, 2 раза | ВІ | ВІ | DІ | Рекомендуется терапевтический мониторинг (см. выше) |
| Вориконазол, 4 мг/кг (6 мг/кг в 1-й день) 2 раза внутривенно или 200 мг 2 раза | АІ (предварительно) | АІ | СІ | |
| Посаконазол, 600 мг | − | АІІ | ВІІ | |
| Микафунгин, 50 мг | СІ | АІ | СІІ | Спектр противогрибковой активности распространяется на Aspergillus spp. |
| L-амфо В | СІ | − | − | Когда невозможно другое |
| L-амфо В (аэрозоль), 12,5 мг | − | − | − | Только легочные формы |
| Каспофунгин, 50–70 мг | − | СІІ | − | |
| Первичная профилактика ИМ у пациентов после аллогенной ТГСК (фаза РТПХ) | ||||
| Название препарата | ECIL-3 | ESCMID-2012 | ESCMID-2014 | Примечание |
| Кандидоз | Аспергиллез | |||
| Флуконазол, 400 мг | СІ | АІ | Нет активности против аспергиллеза | |
| Итраконазол, 7,5 мг/кг, 2 раза | ВІ | СІ | СІІ | Рекомендуется терапевтический мониторинг (см. выше) |
| Вориконазол, 4 мг/кг (6 мг/кг в 1-й день) 2 раза внутривенно или 200 мг 2 раза | АІ (предварительно) | ВІ | СІІ | |
| Посаконазол, 600 мг | АІ | АІ | АІ | |
| Микафунгин, 50 мг | − | − | СІІІ | Спектр противогрибковой активности распространяется на Aspergillus spp. |
| L-амфо В | СІ | − | − | Когда невозможно другое |
У пациентов как в период индукции острой лейкемии, так и после аллогенной и аутологичной ТГСК применяют одни и те же препараты для проведения профилактики ИМ. Это обусловлено тем, что во многие исследования были включены больные из обеих терапевтических групп. Однако уровни доказательности применения этих препаратов несколько отличаются для пациентов в период индукции острой лейкемии и у реципиентов после аллогенной ТГСК.
Вторичная профилактика. Стандартных подходов к вторичной профилактике не существует, так как отсутствуют проспективные исследования в этой области, однако общая рекомендация по необходимости проведения вторичной профилактики описана как «АІІ» [16]. Несколько крупных ретроспективных исследований показали эффективность вторичной профилактики у пациентов после аллогенной ТГСК [48–50].
Таким образом, оптимальным препаратом для проведения профилактики ИМ во всех группах пациентов с онкогематологическими заболеваниями является посаконазол. Другие препараты — производные азолов — также могут эффективно применяться в профилактике ИМ. Впрочем, все лекарственные препараты второго поколения этой группы требуют определения уровней в сыворотке крови, что на данный момент невозможно в Украине. Не проведены проспективные исследования, которые позволили бы создать стандарты вторичной профилактики.
Эмпирическая терапия
Идея эмпирической терапии ИМ возникла в связи с существенным возрастанием смертности в ситуациях, когда противогрибковое лечение не было начато при возникновении симптомов инфекции, а исключить микоз как причину инфекции было невозможно.
Эмпирическая терапия грибковых инфекций должна быть начата у пациентов с фебрильной нейтропенией (ФН) при сохраняющейся лихорадке после 72–96 ч адекватной антибактериальной терапии [51]. На сегодня эта стратегия является общепринятой, хотя она никогда не подвергалась сравнению с другими терапевтическими подходами в клинических исследованиях.
Различные противогрибковые препараты исследованы в качестве эмпирической антимикотической терапии, однако количество рандомизированных исследований было небольшим (рис. 8). В 2011 г. британскими и французскими учеными опубликованы результаты метаанализа рандомизированных исследований в эмпирической, превентивной терапии, а также сравнение этих двух подходов. В 1-м анализе (сравнение антимикотиков в качестве эмпирической терапии) в систематический обзор были включены 7 исследований, доступных на тот момент [52].
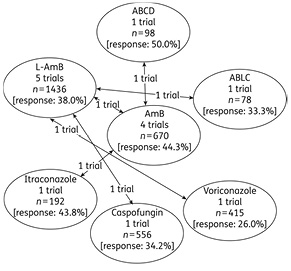
В исследование H.G. Prentice и соавторов 1997 г. были включены 134 взрослых и 204 ребенка с ФН, не ответивших на 4-е сутки на антибиотики широкого спектра действия. Все пациенты были рандомизированы на 3 ветви для проведения антимикотической терапии: группа пациентов, получающих амфо В и 2 группы применения L-амфо В в дозе 1 или 3 мг/кг/сут. Количество осложнений терапии было в 2–6 раз меньше в группе L-амфо В (р≤0,01), количество ответов на терапию составило 49% в группе амфо-В и 58–64% — в группе L-амфо В (р=0,03). Таким образом, по результатам данного исследования L-амфо В был существенно более безопасным и по крайней мере не менее эффективным, чем амфо-В [53].
Аналогичные результаты получены и в похожем исследовании T.J. Walsh и соавторов в 1999 г. [54].
В исследование M.H. White и соавторов (1998) вовлекались 213 пациентов с ФН, не ответивших на адекватную антибактериальную терапию. Участники были рандомизированы на лечение с применением АВКД или амфо В. Количество ответов сопоставлялось в обеих группах (50 и 43,2% соответственно; р=0,31), однако частота почечной недостаточности была значительно ниже в группе АВКД (р<0,01), инфузионные реакции возникали достоверно чаще в группе АВКД. Таким образом, результаты данного исследования показали, что препарат АВКД был не менее эффективным, чем амфо В, а частота нефротоксичности при применении АВКД — значительно ниже, однако инфузионные реакции чаще развивались в группе АВКД [55].
В последующих работах стандартом терапии, с которым проводили сравнение новых препаратов, стал L-амфо В.
Так, в рандомизированном исследовании J.R. Wingard и соавторов (2000) проведено сравнение эффективности и токсичности АВЛК и L-амфо В. 244 пациента рандомизированы на 3 группы для получения эмпирической антимикотической терапии с АВЛК и L-амфо В в дозе 3 или 5 мг/кг/сут. Эффективность терапии была сопоставима во всех группах, а профиль токсичности – лучше в группе L-амфо В. Частота развития нефротоксичности и инфузионных реакций была достоверно ниже в этой группе. Таким образом, в исследовании выявлены преимущества терапии с L-амфо В [56].
Исследование M. Boogaerts и соавторов (2001) с включением 384 пациентов с ФН показало сравнимую эффективность итраконазола и L-амфо В с более низким уровнем токсичности в группе итраконазола. Ответ на терапию составил 47 и 38%, а частота побочных явлений — 5 и 54% соответственно (р<0,001) [57].
В 2002 г. опубликованы результаты рандомизированного исследования T.J. Walsh и соавторов, в которое были включены 837 пациентов. Рандомизацию проводили на 2 группы; участники получали эмпирическую терапию вориконазолом или L-амфо В. Частота ответа на терапию была сопоставима в обеих группах (26% — в группе вориконазола и 30,6% — в группе L-амфо В). Количество побочных явлений, а именно инфузионных реакций и проявлений нефротоксичности, было достоверно меньше в группе вориконазола. Так, при сопоставимой эффективности частота осложнений терапии была значительно ниже в случае применения вориконазола [58].
Этой же группой авторов в 2004 г. опубликованы результаты крупного рандомизированного исследования по изучению эффективности и токсичности каспофунгина и L-амфо В, в котором приняли участие 1095 пациентов с ФН, не ответивших на адекватную антибактериальную терапию. Эффективность лечения была сопоставима в обеих группах: 33,9% — в группе каспофунгина и 33,7% — в группе L-амфо В. Нефротоксичность зарегистрирована в 2,6 и 11,5% случаев, а инфузионные реакции — у 35,1 и 51,6% участников соответственно (р<0,001). Таким образом, эффективность лечения была сопоставимой в обеих группах при значительно более благоприятном профиле токсичности в группе каспофунгина [59].
Микафунгин включен в список препаратов для эмпирической антимикотической терапии на основании результатов двух исследований. В ретроспективном исследовании X. Kubiak (2008) не выявлено достоверных различий в частоте возникновения ИМ и смертности пациентов от грибковых инфекций между группами микафунгина и каспофунгина (13,7 против 10,6% и 7,4 против 7,5% соответственно) [60]. В проспективном исследовании изучали эффективность микафунгина в терапии различных грибковых инфекций, частота ответа при проведении эмпирической противомикробной терапии составила 86,3% [61].
Суммарные данные по результатам различных исследований относительно эмпирической терапии ИМ представлены в табл. 8. Суммарные рекомендации по эмпирической терапии приведены в табл. 9 [45–47].
Таблица 8. Эффективность различных препаратов в эмпирической терапии ИМ
| Автор | Тип исследования | Препараты | Ответ на терапию, % | Достоверность |
| Prentice H.G., 1997 [53] | Рандомизированное | Амфо-В L-амфо-В (1 мг/кг/сут)L-амфо-В (3 мг/кг/сут) |
49,058,064,0 | 0,03 |
| White M.H. et al., 1998 [55] | Рандомизированное | АВКД Амфо В |
50,043,2 | 0,31 |
| Wingard J.R. et al., 2000 [56] | Рандомизированное | АВЛК L-амфо В (3 мг/кг/сут)L-амфо В (5 мг/кг/сут) |
57,723,519,8 | <0,001 |
| Boogaerts М., 2001 [57] | Рандомизированное | Итраконазол L-амфо В |
47,038,0 | >0,05 |
| Walsh T.J., 2002 [58] | Рандомизированное | Вориконазол L-амфо В |
26,030,6 | >0,05 |
| Walsh T.J., 2004 [59] | Рандомизированное | Каспофунгин L-амфо-В |
33,933,7 | >0,05 |
| Kubiak X., 2008 [60] | Ретроспективное | Микафунгин Каспофунгин |
13,710,6 | >0,05 |
| Ohta K., 2009 [61] | Проспективное | Микафунгин | 86,3 |
Таблица 9. Рекомендации по эмпирической терапии грибковых инфекций ECIL-3 (2009), ESCMID для ИК (2012) и ИА (2014)
| Название препарата | ECIL-3 | ESCMID-2012 Кандидоз |
ESCMID-2014 Аспергиллез |
| Флуконазол, 400 мг | СІ | CI | СІІ |
| Итраконазол, 7,5 мг/кг | ВІ | ВІ | СІІ |
| Вориконазол, 4 мг/кг (6 мг/кг в 1-й день) 2 раза внутривенно или 200 мг 2 раза | ВІ | ВІ | ВІІ |
| Микафунгин, 100–150 мг | ВІІ | BII | ВІІ |
| L-амфо В | AІ | AI | ВІ |
| АВКД | − | CI | СІ |
| АВЛК | − | BI | СІ |
| Каспофунгин, 50–70 мг | AІ | AI | АІ |
| Амфо В | DII | DII | DI |
Таким образом, L-амфо В и каспофунгин рекомендованы для применения в качестве эмпирической противомикробной терапии с уровнем доказательности АІ. Амфо-В липидный комплекс или коллоидный раствор, итраконазол, вориконазол, микафунгин также рекомендованы с доказательностью ВІ–ВІІ, амфо-В дезоксихолат — с ВІ и DI при отсутствии или наличии нарушения функции почек либо сочетанном приеме нефротоксичных препаратов.
Превентивная терапия
Развитие современных методик неинвазивной диагностики грибковых инфекций позволило внедрить стратегию превентивной терапии. Применение антимикотиков на основании диагностики ИМ путем комбинации данных клинической картины, рентгенологических и лабораторных методов позволяет избежать неселективности, токсичности и высокой стоимости, связанной с применением этих лекарственных средств в рамках эмпирической терапии [62]. В одном из исследований, в котором сравнивали стратегии назначения противогрибковых препаратов, показано, что ежедневный мониторинг галактоманнановой антигенемии в комбинации с КТ и БАЛ позволил снизить частоту назначения антимикотиков с 35% (как эмпирический подход) до 7,7% (как превентивная терапия) у пациентов с ФН. Кроме того, у 7% популяции пациентов в исследовании, у которых не отмечено лихорадки, выявлены грибковые инфекции [63]. Проведены два рандомизированных исследования, изучавших особенности эмпирического и превентивного подходов к назначению антимикотиков. В первом исследовании 409 пациентов получали амфо В или L-амфо В в качестве эмпирической терапии или превентивно (на основании результатов ПЦР). Количество назначений антимикотиков было существенно больше в группе превентивной терапии и составило 45% по сравнению с 30% в группе эмпирического лечения. Частота доказанных ИМ была сопоставима, достоверных различий в уровне смертности от ИМ не выявлено [64]. В другом исследовании терапию с назначением тех же препаратов применяли у 293 пациентов. Стратегия превентивного лечения базировалась на наличии позитивных результатов тестов на галактоманнан у больных с ожидаемой длительностью нейтропении >10 дней. Частота ИМ была достоверно выше в группе пациентов, получавших превентивную терапию (9,1% против 2,7% в группе эмпирического лечения), смертность от ИМ была ниже в этой группе (0 против 2,1% соответственно; р=0,011), а выживаемость достоверно не отличалась (97,3 против 95,1% соответственно; р>0,05). Эти данные позволили авторам утверждать, что превентивный подход не уступает по эффективности эмпирической терапии [65]. В еще одном исследовании британских ученых с участием 130 пациентов также изучали эффективность превентивной терапии. Диагностические тесты включали мониторинг с помощью ПЦР, галактоманнана и маннана, которые проводили 2 раза в неделю всем больным с нейтропенией и РТПХ. Количество вероятных и доказанных эпизодов ИМ составило 33,6%, а смертность по причине ИМ — 8%. Использование такой схемы диагностики увеличило лабораторные расходы на 71 733 фунта на 1 пациента; в то же время внедрение превентивной терапии, которое базировалось на результатах тестирования, позволило снизить затраты на противомикотическую терапию на 124 572 фунта.
Метаанализ последних двух (рандомизированных) исследований не показал существенных преимуществ применения превентивной терапии. Однако с учетом большого количества исследований, спектра препаратов, которые в них изучались (L-амфо В и амфо В), и современной стратегии лечения больных с ИМ окончательный ответ о целесообразности применения подхода превентивной терапии не получен [52].
Таким образом, вывод касательно наиболее эффективной стратегии лечения (эмпирическая или превентивная терапия) при ИМ до момента окончательного подтверждения этого диагноза на сегодня не получен. Учитывая диагностические возможности при ИМ в Украине, превентивный подход пока недоступен в нашей стране.
Таргетная терапия
Кандидоз. Современные взгляды на лечение пациентов с ИМ свидетельствуют о том, что любой эпизод кандидемии должен быть расценен как ИК, а лечение начато немедленно. Выбор терапии должен основываться на возможности развития резистентности к азолам 1-го поколения (после проведения профилактики этими препаратами), а также на наличии сопутствующих заболеваний с учетом профиля токсичности препаратов [66]. В исследованиях последних лет получают все больше данных в пользу применения эхинокандинов в лечении ИК.
Рандомизированное исследование, изучающее эффективность и токсичность флуконазола по сравнению с амфо В, опубликовано Rex J.H. в 1994 г. В исследовании участвовали 206 пациентов без глубокой нейтропении. Положительный ответ на терапию получен у 79% больных в группе амфо В и у 70% — в группе флуконазола (р=0,22). Таким образом, не выявлено достоверных отличий в терапии ИК в группах пациентов, которые применяли амфо В и флуконазол [67].
Другие исследования, сравнивающие эффективность и токсичность флуконазола и амфо В, также имели схожие результаты [68, 69].
Эта же группа авторов в 2003 г. опубликовала рандомизированное исследование по сравнению флуконазола (в дозе 800 мг) и флуконазола с амфо В у пациентов с ФН и гипотензией. Всего в исследование были включены 219 пациентов. Ответ на терапию составил 56% в первой группе и 69% — во второй (p=0,043). Авторы работы суммируют, что комбинация амфо В и флуконазола не обладает антагонизмом, эффективность лечения в этой группе выше, как и показатели нефротоксичности [70].
Крупное рандомизированное исследование, в котором сравнивали эффективность и токсичность каспофунгина и амфо В, показало сопоставимую эффективность препаратов и значительное снижение токсичности при применении каспофунгина (73,4 против 61,7% в группе амфо В) [71]. Таким образом, этот препарат рекомендован в качестве первой линии терапии пациентов с ИК.
В исследовании B.J. Kullberg и соавторы (2005) сравнивали эффективность внутривенной формы вориконазола с последующим переходом на пероральную и амфо В с переходом на флуконазол. В исследование были вовлечены 422 пациента (анализ проводили у 360). В обеих группах не выявлено разницы в эффективности (ответ на терапию составил 41% в обеих группах). При финальной оценке ответ на терапию составил 65% в группе больных, которые получали лечение вориконазолом, и 71% — в группе лечения амфо В/флуконазолом. Токсичность терапии была выше во второй группе [72].
В исследование A.C. Reboli и соавторов (2007) были включены 245 пациентов с ИК, которых рандомизировали в две группы для лечения с анидулафунгином и флуконазолом. Ответ на терапию составил 75,6% в группе анидулафунгина и 60,2% — в группе флуконазола (p=0,01). Других достоверных отличий в обеих группах (в том числе и в токсичности терапии) не выявлено [73].
В этом же году опубликованы результаты двух рандомизированных исследований с использованием микафунгина. В первом (Kuse E.R. и соавторы, 2007) 466 пациентов рандомизированы в группы для получения терапии микафунгином и L-амфо В. Ответ на лечение составил 89,6 и 89,7% соответственно (р>0,05). Токсичность была ниже в группе микафунгина [74].
В исследовании P.G. Pappas и соавторы сравнивали эффективность и безопасность микафунгина и каспофунгина. Участвовали 595 пациентов, которых распределили на 3 группы: для получения лечения микафунгином в дозе 100 и 150 мг и каспофунгином в дозе 70 мг с последующим снижением дозы до 50 мг. Ответ на лечение был достигнут в 76,4; 71,4 и 72,3% случаев соответственно. Каких-либо достоверных отличий эффективности и токсичности во всех трех группах не выявлено [75].
В 2013 г. J.N. Kanji и соавторы опубликовали систематический обзор рандомизированных исследований по лечению пациентов с ИК, в котором указали, что эхинокандины обладают наибольшей эффективностью и отличаются хорошим профилем токсичности [76]. Пока не получено данных о преимуществах какого-либо препарата группы эхинокандинов как в отношении эффективности, так и токсичности. То есть для терапии при ИК может быть применен любой препарат группы эхинокандинов (каспофунгин, микафунгин или анидулафунгин).
Длительность терапии ИК должна составлять не менее 14 дней после получения отрицательных результатов посева крови, при отсутствии клинических признаков инфекции.
Суммарные данные по эффективности различных препаратов представлены в табл. 10. Рекомендации по проведению таргетной терапии при ИК согласно ECIL-5 приведены в табл. 11, а ESCMID-2012 — в табл. 12 [47, 77].
Таблица 10. Эффективность различных препаратов в таргетной терапии ИК
| Автор | Тип исследования | Препараты | Ответ на терапию, % | Достоверность |
| Rex J.H., 1994 [67] | Рандомизированное | Амфо В Флуконазол |
79,070,0 | 0,22 |
| Rex J.H., 2003 [70] | Рандомизированное | Флуконазол (800 мг) Флуконазол (400 мг) + амфо В |
56,069,0 | 0,043 |
| Mora-Duarte J., 2002 [71] | Рандомизированное | Каспофунгин Амфо В |
73,461,7 | >0,05 |
| Kullberg B.J., 2005 [72] | Рандомизированное | Вориконазола с переходом на пероральную форму Амфо В с переходом на флуконазол (перорально) |
41,041,0 | >0,05 |
| Reboli A.C., 2007 [73] | Рандомизированное | Анидулафунгин Флуконазол |
75,660,2 | 0,01 |
| Kuse E.R. et al., 2007 [74] | Рандомизированное | МикафунгинL-амфо В | 89,689,7 | >0,05 |
| Pappas P.G. et al., 2007 [75] | Рандомизированное | Микафунгин (100 мг) Микафунгин (150 мг)Каспофунгин (70 мг, 50 мг) |
76,471,472,3 | >0,05 |
Таблица 11. Рекомендации по таргетной терапии ИК (Европейское руководство по профилактике и лечению ИМ у пациентов с лейкемиями и реципиентов трансплантатов гемопоэтических стволовых клеток ECIL-5), 2013 г.
| Препарат | Общая популяция | Пациенты с гематологическими заболеваниями |
| Микафунгин | АІ | АІІ |
| Анидулафунгин | АІ | АІІІ |
| Каспофунгин | АІ | АІІ |
| L-амфо B | АІ | АІІ |
| АВКД, АВЛК | ВІІ | ВІІ |
| Амфо В | СІ | СІІ |
| Флуконазол | АІ | СІІІ |
| Вориконазол | АІ | ВІІ |
Таблица 12. Рекомендации по таргетной терапии ИК ESCMID-2012
| Название препарата | Уровень рекомендаций |
| Флуконазол, 400 мг | |
| Итраконазол, 7,5 мг/кг | DIII |
| Вориконазол, 4 мг/кг (6 мг/кг в 1-й день) 2 раза внутривенно или 200 мг 2 раза | CII |
| Микафунгин, 100–150 мг | AII |
| L-амфо В, 3 мг/кг | ВІІ |
| АВКД | СІІІ |
| АВЛК, 5 мг/кг | CII |
| Каспофунгин, 50–70 мг | АІІ |
| Амфо В | DII |
| Анидулафунгин (+ вориконазол) | ВІІ |
Извлечение катетера. В случае кандидемии многие руководства рекомендуют извлекать венозный катетер [45, 46, 77]. Уровень рекомендаций, как правило, составляет ІІ или ІІІ, так как не получено однозначных данных о необходимости раннего извлечения катетера. Так, в анализе, включавшем 842 пациента, не выявлено преимуществ в выживаемости больных с кандидемией при раннем извлечении катетера [78]. Впрочем, в анализе 7 рандомизированных исследований с участием 1915 пациентов определено 2 фактора, достоверно влияющих на выживаемость участников: извлечение катетера и применение эхинокандинов [79].
Таким образом, в таргетной терапии больных с ИК ключевая роль принадлежит препаратам группы эхинокандинов. Все они рекомендованы для применения в этой когорте пациентов с равным уровнем доказательности. В случае катетер-ассоциированной кандидемии большинство руководств рекомендуют извлекать катетер.
Аспергиллез
Терапия первой линии. Невзирая на все попытки усовершенствования лечения при этой инфекции, терапия пациентов с аспергиллезом остается сложной задачей. Не проведено достаточного количества крупных рандомизированных исследований в этой области, сравнивающих различные препараты, в отличие от ИК. Так, в публикации B.E. de Pauw и C. Viscoli (2011) значится, что среди огромного количества исследований по антимикотической терапии найдено лишь небольшое число работ (12), в которых сравнивались препараты в лечении ИА, в 6 из них изучали эффективность терапии первой линии, и только в 1 было включено достаточное количество пациентов (сравнение эффективности вориконазола и амфо В дезоксихолата) [80]. В систематическом обзоре литературы, опубликованном N. Freemantle и соавторами (2011), проведен анализ всего трех доступных на тот момент рандомизированных исследований [52] (рис. 9).
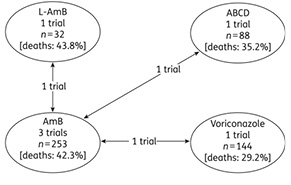
Недостаток хорошо спланированных крупных рандомизированных исследований не позволяет дать окончательные ответы на вопрос, какие препараты и в каких режимах применения являются оптимальными для лечения пациентов с аспергиллезом.
Первое рандомизированное исследование таргетной терапии ИМ опубликовано в 1998 г. A.C. Leenders и соавторами. Участниками стали 66 пациентов с доказанной или вероятной грибковой инфекцией, которых рандомизировали для получения терапии L-амфо В или амфо В. 66% больных в группе применения L-амфо В, и 56% в группе амфо В ответили на терапию (р=0,09). Частота полных ответов была достоверно выше в группе L-амфо В (р=0,03). Уровень смертности был также ниже в этой группе (р=0,03). Токсичность была выше в группе амфо В. Авторы исследования сделали вывод, что L-амфо В имеет преимущества как в эффективности лечения, так и в уровне токсичности по сравнению с амфо В [81].
R. Bowden и соавторы представили в 2002 г. результаты рандомизированного исследования по сравнению АВКД и амфо В. В эту работу были включены 174 пациента с ИА. Эффективность лечения была сопоставима в обеих группах (ответ составил 52% в группе АВКД против 51% в группе амфо В; р=1,0; смертность — 36 и 45% соответственно; р=0,4). Частота нефротоксичности была ниже в группе АВКД (р=0,002), однако длительность проявлений была больше (р<0,001). Частота инфузионных реакций была выше в указанной группе. Авторы делают вывод, что необходимы дальнейшие исследования эффективности и токсичности АВКД [82].
Однако в том же году опубликовано исследование R. Herbrecht и соавторов (2002), которое продемонстрировало существенные преимущества применения вориконазола по сравнению со стандартом терапии при ИА — амфо В. Это исследование сделало вориконазол золотым стандартом лечения пациентов с аспергиллезом.
В исследовании участвовал 391 пациент в возрасте старше 12 лет с различными гематологическими заболеваниями, а также реципиенты после аллогенной ТГСК с вероятным или доказанным ИА. Уровень ответа на лечение на 12-й неделе составил 52,8% в группе больных, которые получали вориконазол, и 31,6% в группе применения амфо В (р=0,0000…). Общая выживаемость составила 70,8 и 57,9% соответственно (р=0,02). Медиана выживаемости была существенно выше в группе вориконазола, а вот количество побочных явлений составило 343 события в группе вориконазола и 421 событие в группе амфо В дезоксихолата (р=0,02) [83]. Таким образом, вориконазол показал достоверно более высокую эффективность и низкую токсичность терапии по сравнению с амфо В.
По результатам ретроспективного исследования S. Schwartz и соавторов (2005) с включением 81 пациента с вероятным или доказанным ИА ЦНС, вориконазол также продемонстрировал свою эффективность в лечении ИА с поражением ЦНС. Положительный ответ достигнут у 35% пациентов, 46% больных умерли от ИА [84].
Существует ряд противопоказаний к назначению терапии азолами (проведение профилактики или лечения других ИМ азолами с противоплесневой активностью, взаимодействие с другими препаратами (сиролимус), почечная или печеночная недостаточность, смешанная грибковая инфекция (например Zygomycetes), наличие резистентных видов Aspergillus), которые не позволяют назначить вориконазол в первой линии терапии ИА.
В поисках альтернативных стратегий проведены другие исследования. Так, выполнено исследование с включением 201 пациента, в котором сравнивали эффективность стандартных доз L-амфо B (3 мг/кг/сут) и высоких доз (10 мг/кг/сут в течение первых 14 дней). Положительный ответ на терапию достигнут у 50 и 46 %больных в группах стандартных и высоких доз, а выживаемость на 12-й неделе составила 72 и 59% соответственно (р>0,05). Токсичность была достоверно выше в группе пациентов, получающих препарат в дозе 10 мг/кг/сут [85]. Впрочем, эффективность терапии в этом исследовании была схожа с результатами лечения с применением вориконазола, полученными в исследовании R. Herbrecht и соавторов (2002), что сделало L-амфо B в дозе 3 мг/кг/сут альтернативным препаратом терапии первой линии при ИА.
В проспективном исследовании, оценивающем эффективность каспофунгина, участвовали 129 пациентов с гематологическими заболеваниями, не получавших ТГСК (85% больных с нейтропенией). У 61 участника выявлены вероятные или доказанные ИМ. Частота полных и частичных ответов на терапию составила 33%, а 12-недельная выживаемость — 53% [86].
В исследовании, включавшем 42 пациента после аллогенной ТГСК, количество вероятных или доказанных ИМ составило 24 (57,1%) случая. Частота полного и частичного ответа на лечение достигла 42%, а 12-недельная выживаемость — 50% [87].
Начиная с 2005 г. опубликован ряд работ, посвященных изучению эхинокандинов в качестве терапии первой линии при ИА. В исследовании A. Candoni и соавторов (2005) каспофунгин изучали в первой линии терапии. Ответ на лечение составил 56% (18 из 32 пациентов). Не выявлено других побочных явлений, кроме транзиторного повышения уровня трансаминаз I–II степени у 12% пациентов [88].
В исследовании C. Viscoli и соавторов (2009) принимал участие 61 пациент. Ответ на терапию составил 33%, 12-недельная выживаемость достигла 53%. Профиль токсичности был удовлетворительным [89]. Из 42 пациентов после аллогенной ТГСК с вероятным или доказанным ИА, включенных в исследование EORTC, у 24 данные были доступными для анализа. У 10 (42%) больных достигнут положительный ответ на терапию каспофунгином. Выживаемость составила 50% на 12-й неделе наблюдения [90].
В рандомизированном исследовании, результаты которого опубликованы в 2015 г., изучали комбинированную терапию легочного ИА вориконазолом и анидулафунгином. Из 454 пациентов 277 включены в первичный анализ. Выживаемость у них составила 61% в группе вориконазола и 71% — в группе комбинированной терапии (р=0,077). Авторы исследования делают заключение о том, что комбинированное лечение ИА имеет статистически незначимые, однако клинически существенные преимущества в выживаемости пациентов; для получения окончательных ответов касательно эффективности этой комбинации необходимы дальнейшие исследования [91].
Сальвадж-терапия
Термин «сальвадж-терапия» применяют в случае неэффективности терапии первой линии или же отмены ее при непереносимости выбранного препарата. Согласно рекомендациям в качестве сальвадж-терапии могут быть использованы различные препараты, в том числе каспофунгин, вориконазол и L-амфо В.
По данным D.W. Denning и соавторов, ответ на сальвадж-терапию вориконазолом составил 38% (21 из 56 пациентов) [92].
В 2003 г. коллективом авторов во главе с D.P. Kontoyiannis опубликованы результаты применения комбинации каспофунгина с L-амфо В в качестве сальвадж-терапии ИА. Такое лечение было применено у 65% пациентов. Общий ответ составил 42%, а в группе задокументированного прогрессирующего аспергиллеза — 18% [93]. В этом же году представлены результаты исследования по изучению эффективности итраконазола у рефрактерных к амфо В пациентов с легочным ИА. В группе из 21 участника, включенных в исследование, ответ на лечение составил 52%. У 82% больных во время периода внутривенной терапии и 52% пациентов во время перорального лечения зарегистрированы побочные явления [94].
Частота позитивного ответа на терапию каспофунгином составила 41% (22 из 54 пациентов), включая нескольких больных, у которых применение одного и более препаратов было неэффективным [95].
В другом исследовании с участием 48 пациентов с рефрактерностью к другим антимикотическим препаратам (90% участников) или с их непереносимостью ответ на лечение каспофунгином получен у 44% лиц. Переносимость терапии была удовлетворительной [96].
Микафунгин в качестве первой линии или сальвадж-терапии исследовали британские ученые в группе, состоящей из 225 пациентов. Положительные ответы на терапию зарегистрированы у 6 (50%) из 12 больных, получавших микафунгин в монорежиме в первой линии, и 9 (40,9%) из 22 пациентов, у которых применяли его в качестве сальвадж-терапии. В группе комбинированной терапии частота ответов составила 29,4% (5 из 17) и 34,5% (60 из 174) для первичной и сальвадж-терапии соответственно [97].
В проспективном исследовании T.J. Walsh и соавторы (2007) изучали эффективность посаконазола у рефрактерных пациентов с ИА. 107 участников получали лечение с этим препаратом и 86 больных были включены в группу контроля (другой вид терапии). В первой группе ответ составил 42 против 26% — во второй группе (р=0,006) [98].
В табл. 13 приведены суммарные результаты клинических исследований различных препаратов в терапии ИА, а в табл. 14 и 15 — рекомендации ECIL-5 и ESCMID-2014 по лечению ИА [47, 77].
Таблица 13. Эффективность различных препаратов в таргетной терапии ИА
| Исследование | Тип исследования | Противогрибковый препарат |
Ответ, % | p |
| Терапия первой линии | ||||
| Leenders A.C. et al., 1998 [81] | Рандомизированное | L-афмо В Амфо В |
66,0 56,0 |
0,09 |
| Ellis et al., 1998 | Рандомизированное | L-афмо В, 1 мг/кг L-афмо В, 4 мг/кг |
58,0 52,0 |
>0,05 |
| Caillot D. et al., 2001 [94] | Проспективное | Итраконазол | 48,0 | |
| Bowden R. et al., 2002 [82] | Рандомизированное | АВКД Амфо В |
52,0 51,0 |
>0,05 |
| Herbrecht R. et al., 2002 [83] | Рандомизированное | Амфо В Вориконазол |
32,0 53,0 |
0,0000 |
| Candoni A. et al., 2005 [88] | Проспективное | Каспофунгин | 56,0 | |
| Denning D.W., 2006 [97] | Проспективное | Микафунгин в монорежиме Микафунгин в комбинированной терапии |
50,0 29,4 |
|
| Viscoli C. et al., 2009 [89] | Проспективное | Каспофунгин | 33,0 | |
| Cornely O.A. et al., 2007 [85] | Рандомизированное | Липосомальный амфотерицин В, 3 мг/кг Липосомальный амфотерицин В, 10 мг/кг |
50,0 46,0 |
>0,05 |
| Herbrecht R. et al., 2010 [87] | Проспективное | Каспофунгин | 42,0 | |
| Cornely O.A. et al.,AAC 2011 [85] | Рандомизированное | Каспофунгин,70–200 мг 1 раз в сутки | 54,0 | |
| Marr K.A. et al., 2015 [91] | Рандомизированное | Вориконазол Вориконазол + анидулафунгин |
61,0 71,0 |
0,077 |
| Сальвадж-терапия | ||||
| Denning D.W., 2002 [92] | Проспективное | Вориконазол | 38,0 | |
| Kontoyiannis D.P., 2003 [93] | Проспективное | Каспофунгин + L-амфо В | 42,0 | |
| Caillot D., 2003 [94] | Проспективное | Итраконазол | 52,0 | |
| Maertens J. et al., 2004 [95] | Проспективное | Каспофунгин | 41,0 | |
| Kartsonis N.A. et al., 2005 [96] | Проспективное | Каспофунгин | 44,0 | |
| Denning D.W. et al., 2006 [97] | Проспективное | Микафунгин в монорежиме Микафунгин в комбинированной терапии |
40,9 34,5 |
|
| Walsh T.J. et al., 2007 [98] | Проспективное | Посаконазол Другая терапия |
42,0 26,0 |
0,006 |
Таблица 14. Рекомендации по таргетной терапии ИА (Европейское руководство по профилактике и лечению ИМ у пациентов с лейкемиями и реципиентов трансплантатов гемопоэтических стволовых клеток ECIL-5), 2013 г.
| Терапия первой линии | ||
| Вориконазол | АІ | 2 раза по 6 мг/кг в 1-й день, потом 2 раза по 4 мг/кг (переход на пероральный препарат: C-III) |
| Амфо В | ВІ | Доза 3 мг/кг |
| АВЛК | ВІІ | Доза 5 мг/кг |
| Каспофунгин | СІІ | |
| Итраконазол | СІІІ | |
| АВКД | СІ | |
| Вориконазол + анидулафунгин | СІ | |
| Другие комбинации | СІІІ | |
| Против применения амфо В | АІ | |
| Сальвадж-терапия | ||
| Амфо В | BII | Отсутствуют данные при неэффективности вориконазола |
| АВЛК | BII | Отсутствуют данные при неэффективности вориконазола |
| Каспофунгин | BII | Отсутствуют данные при неэффективности вориконазола |
| Итраконазол | СIIІ | Недостаточно данных |
| Посаконазол | BII | Отсутствуют данные при неэффективности вориконазола |
| Вориконазол | BII | Если не использовался в качестве терапии первой линии |
| Комбинация | BII | Разные нерандомизированные исследования |
Таблица 15. Рекомендации по таргетной терапии ИА ESCMID-2014
| Название препарата | Уровень рекомендаций |
| Итраконазол, 7,5 мг/кг | CIII |
| Вориконазол, 4 мг/кг (6 мг/кг в 1-й день) 2 раза внутривенно или 200 мг 2 раза | AII |
| Микафунгин, 100–150 мг | CII |
| L-амфо В, 3 мг/кг | ВІІ |
| АВКД | DII |
| АВЛК, 5 мг/кг | CIII |
| Каспофунгин, 50–70 мг | СІІ |
| Амфо В | DII |
| Анидулафунгин (+ вориконазол) | СІІ |
Дополнительные виды лечения
Дополнительно к антимикотическим препаратам в лечении ИА могут быть использованы хирургические техники. Этот метод применим, например, при наличии очагов в ЦНС или параназальных синусах. Удаление очага ИА при его локализации в легких рядом с крупными сосудами может предотвратить развитие жизнеугрожающего кровотечения. Также есть данные о положительном влиянии на исход ИА применения гранулоцитарного колониестимулирующего фактора и инфузий гранулоцитов как средства для восстановления функции иммунной системы [99].
Таким образом, лечение ИА остается сложной клинической задачей. Это связано с недостаточным количеством адекватных исследований в этой области, высокой стоимостью терапии, значительным количеством неудач. Тем не менее препаратом выбора в лечении ИА является вориконазол. Альтернативным вариантом терапии при этой патологии является L-амфо В. В сальвадж-терапии ИА могут применяться различные препараты.
Другие плесневые грибы
Вориконазол и L-амфо В являются препаратами выбора терапии ИМ, вызванных грибами рода Fusarium и Scedosporium spp., а посаконазол — препаратом второй линии лечения [100, 101]. Применение L-амфо В является оптимальным в лечении инвазивного мукормикоза. В этой ситуации также возможно назначение более высоких доз амфо В липидного комплекса (5–7,5 мг/кг/сут), а посаконазол может быть избран в качестве препарата второй линии терапии [102]. Возможно использование комбинации препаратов. Так, в лечении криптококкоза применяют комбинацию амфо В и флуцитозина [103]. В лечении всех перечисленных выше ИМ антимикотическая терапия должна сопровождаться хирургическим иссечением некротических масс, а также лечением предшествующих состояний (сахарный диабет, повышенное содержание железа, длительная терапия стероидами, нейтропения).
Длительность лечения инфекций, вызванных плесневыми грибами, не определена. По мнению большинства авторов, этот период должен составлять 6–12 нед, однако он может колебаться в зависимости от тяжести инфекции, состояния пациента, наличия побочных явлений терапии и других факторов.
Выводы
Заболеваемость ИМ у больных онкогематологического профиля, получающих специальное лечение, является достаточно высокой. Лечение ИМ — важный и сложный вопрос в современной онкогематологии. Эта группа инфекций отличается достаточно высоким уровнем смертности. Многие пациенты с онкогематологическими заболеваниями принадлежат к группе высокого риска развития ИМ и требуют особого внимания в контексте начала своевременной сопроводительной терапии. Клиническая картина ИМ может быть разнообразной и не иметь специфических признаков. Низкая настороженность врачей и неполноценные знания об ИМ даже в развитых странах, сложности в диагностике, несвоевременное начало терапии и другие факторы приводят к тому, что даже в западных клиниках выживаемость пациентов остается неудовлетворительной. Несмотря на значительный прогресс в лечении ИМ, отсутствует адекватное количество крупных рандомизированных исследований, особенно с участием пациентов с инфекциями, вызванными плесневыми грибами, не получены точные ответы о наиболее эффективных схемах лечения ИМ. Изменение удельного веса различных возбудителей в структуре заболеваемости ИМ, увеличение количества ИМ, вызванных «редкими» видами микозов, также требуют проведения новых исследований с включением таких пациентов. На данный момент общепринятой является концепция начала эмпирической противогрибковой терапии при подозрении на развитие ИМ, в том числе у пациентов с ФН, не ответивших на адекватную антибактериальную терапию. Активно обсуждается концепция превентивной терапии, однако на данный момент не получено результатов, убедительно указывающих на преимущества такого подхода. Существующие стандарты таргетной терапии свидетельствуют в пользу применения эхинокандинов в лечении ИК и вориконазола — в лечении ИА. Дальнейшие исследования имеющихся, а также поиск новых препаратов и концепций терапии приведут к улучшению результатов лечения больных ИМ. Ситуация в Украине является еще более сложной, что обусловлено в основном низким материально-техническим и образовательным уровнем в медицине в отношении ИМ. Впрочем, мы надеемся, что привлечение внимания к этой проблеме может улучшить ситуацию.
Список использованной литературы находится в редакции
Данная информация предоставлена в качестве информационной поддержки врачам. Мнения, изложенные в материале, отображают точку зрения авторов и не обязательно совпадают с точкой зрения компании MSDAINF-1170178-0000
Адрес:
Филоненко Екатерина Сергеевна
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
Тел.: (050) 816-67-60
E-mail: ksfilonenko@yahoo.com














Leave a comment