Псевдоміксома очеревини: інкурабельна казуїстична патологія чи необхідність проактивної тактики комбінованого лікування?
Ярема Р.Р.1, Моран Б.2, Сесіл Т.2, Фецич Т.Г.1, Огорчак М.А.3
- 1Львівський національний медичний університет імені Данила Галицького
- 2Інститут перитонеального канцероматозу, госпіталь Бейзінгстоука та Північного Гемпшира, Бейзінгстоук, Велика Британія
- 3Львівський державний онкологічний регіональний лікувально-діагностичний центр, Львів
Резюме. Псевдоміксома очеревини — це рідкісна комплексна патологія з унікальною біологічною поведінкою, яка, як правило, пов’язана із прогресуванням муцинозних неоплазій апендикса та імплантаційним поширенням в черевній порожнині. На зміну старим підходам до паліативного лікування таких пацієнтів сьогодні приходить проактивний спосіб комбінованої терапії з використанням циторедуктивної хірургії та періопераційної внутрішньочеревної хіміотерапії, що забезпечує прогноз для хворих на якісно новому рівні.
 Псевдоміксома очеревини (ПМО) — це рідкісна патологія, що характеризується синдромом інтраперитонеального акумулювання муцину внаслідок імплантаційного поширення муцинпродукуючих пухлин та супроводжується розвитком перитонеальних імплантів, масивного метастатичного потовщення великого сальника (рис. 1) та метастатичного ураження яєчників. Найчастіше розвиток синдрому ПМО пов’язаний із прогресуванням муцинозних неоплазій апендикса низького злоякісного потенціалу [1, 2]. ПМО вперше описана Rokitansky у 1842 р. у хворого з муциновою кістою апендикса [3] та до сьогодні залишається однією із найбільш вражаючих пухлин черевної порожнини та одним із серйозніших викликів у практиці абдомінальної онкохірургії.
Псевдоміксома очеревини (ПМО) — це рідкісна патологія, що характеризується синдромом інтраперитонеального акумулювання муцину внаслідок імплантаційного поширення муцинпродукуючих пухлин та супроводжується розвитком перитонеальних імплантів, масивного метастатичного потовщення великого сальника (рис. 1) та метастатичного ураження яєчників. Найчастіше розвиток синдрому ПМО пов’язаний із прогресуванням муцинозних неоплазій апендикса низького злоякісного потенціалу [1, 2]. ПМО вперше описана Rokitansky у 1842 р. у хворого з муциновою кістою апендикса [3] та до сьогодні залишається однією із найбільш вражаючих пухлин черевної порожнини та одним із серйозніших викликів у практиці абдомінальної онкохірургії.
Пухлини апендикса є рідкісними неоплазіями, що становлять усього 1% в структурі злоякісних пухлин товстої кишки. Більшість пухлин червоподібного відростка за своєю морфологічною структурою є нейроендокринними, епітеліальні неоплазії обіймають друге місце [2].
Не більше 10% раку ободової кишки характеризується муцинозним гістологічним типом аденокарциноми. На противагу цьому, близько 90% епітеліальних пухлин апендикса мають муцинозний гістотип, а інтестинальний (кишковий) тип патології трапляється набагато рідше [4].
Захворюваність на муцинозні пухлини апендикса, а відтак і частота синдрому ПМО залишається казуїстично низькою — становить всього 1–3 випадки на 1 млн/рік [5, 6].
Муцинозні пухлини апендикса представлені широким гістологічним спектром новоутворень: від індолентних пухлин із низьким злоякісним потенціалом до утворень із більш агресивною поведінкою. В.М. Ronnett та співавтори відповідно до вираженості клітинної атипії та порушення гістологічної архітектури у зразках імплантаційних метастазів з очеревини визначили 3 гістологічні типи муцинозних неоплазій апендикса [7].
Найменш агресивні муцинозні пухлини гістологічно характеризуються зразками, бідними на клітинні елементи, з невеликою кількістю простих шарів муцинового епітелію без атипії та мітозів та зі значним накопиченням «озер» екстрацелюлярного муцину. Мультифокальні вогнища такої пухлини демонструють тісне прилягання, але не інвазію у структури вісцеральної чи парієтальної очеревини. Такий гістологічний варіант названо «дифузний перитонеальний аденомуциноз» (diffuse peritoneal adenomucinosis — DPAM) [7]. J. Misdraji зі співавторами пізніше класифікували цей тип як «low-grade» (низького ступеня злоякісності) муцинозні неоплазми апендикса [8].
Другий гістологічний тип, що походить від інвазивних первинних пухлин апендикса, отримав назву «перитонеальна муцинозна аденокарцинома» (peritoneal mucinous adenocarcinoma — PMAC). Гістологічно характеризується рясним епітелієм із кишковою чи перснеподібно-клітинною морфологією, достатньо збереженою залозистою архітектонікою, клітинною атипією та інвазивним компонентом [7]. J. Misdraji та співавтори віднесли цей тип до «high-grade» (високого ступеня злоякісності) муцинозних пухлин апендикса [8].
Також виділено проміжний, або гібридний, гістологічний варіант муцинозних пухлин апендикса, що характеризується домінуванням аденомуцинозу, проте з наявністю (менше 5% полів зору) вогнищ муцинозної аденокарциноми [7].
У 2010 р. професор N. Carr з колегами з медичного центру у місті Бейзінгстоук (Велика Британія) на основі морфологічних досліджень запропонували врешті затвердити бінарну систему класифікації таких пухлин — low-grade та high-grade (до якої увійшов проміжний тип) ПМО [9]. Така бінарна класифікація отримала підтвердження як щодо кореляції з клінічним прогнозом хворих [10], так і підтримки в рамках міжнародного консенсусу експертів [11] та використовується сьогодні в більшості спеціалізованих центрів.
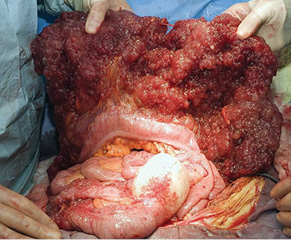
Попередні патоморфологічні [12], молекулярно-генетичні [13] та імуногістохімічні [14] дослідження підтвердили чіткий зв’язок розвитку ПМО у більшості хворих з муцинозними пухлинами червоподібного відростка (рис. 2). Проте в невеликій кількості випадків ПМО може бути результатом маніфестації муцинозних цистаденокарцином чи пограничних муцинозних цистаденом яєчника, аденокарциноми апендикса, муцинозних аденокарцином товстого кишечнику чи інших інтраабдомінальних органів [15, 16]. Необхідно зазначити, що первинні муцинозні цистаденокарциноми яєчника виникають доволі рідко, відтак, проблема їх диференціації з метастазами Крукенберга муцинозних неоплазій апендикса до сьогодні залишається актуальною. Наголошується, що в гінекологічній клінічній практиці при діагностиці та хірургічному лікуванні пухлин яєчника необхідно застосовувати онкологічні серологічні маркери — РЕА (раково-ембріональний антиген) та СА 19-9, а також завжди проводити радіологічну діагностику та хірургічну ревізію стану червоподібного відростка [17]. Онкологічні маркери РЕА та СА 19-9 є підвищеними у 59,6% хворих на ПМО апендикулярного генезу [19].
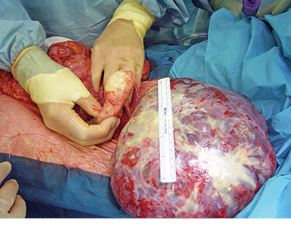
Муцинпродукуючі клітини, що потрапили у вільну черевну порожнину, в більшості випадків є мінімально агресивними, тому практично завжди стають джерелом виключно імплантаційного розповсюдження процесу в межах порожнини очеревини. Тому ПМО часто прирівнюють до пограничної пухлини [18, 19]. Гематогенні та лімфогенні метастази муцинозних пухлин апендикса розвиваються вкрай рідко [1, 18, 20]. Так, метастази у регіонарні лімфатичні вузли відзначено тільки у 5% хворих з high-grade муцинозними пухлинами апендикса, для low-grade пухлин лімфогенне метастазування є рідкістю [21]. Отже, клінічна проблема синдрому ПМО лежить виключно в площині порожнини перитонеума.
У клінічній маніфестації ПМО найчастішими симптомами є такі [22]: збільшення об’єму черева на фоні прогресування муцинозного асциту та перитонеального канцероматозу (рис. 3), періодичні епізоди апендициту, Крукенберг-синдром, нововиникла кила черевної стінки (пупкова, інгвінальна) та абдомінальний дискомфорт.
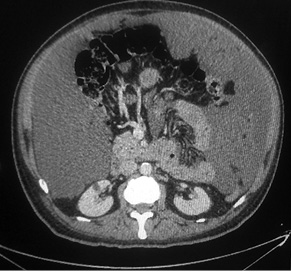
Беручи до уваги об’єм та характер інтраперитонеального розповсюдження ПМО, традиційно склалася симптоматична тактика хірургічного лікування при цій патології. Таким хворим з метою зменшення вираженості симптомів захворювання проводили, як правило, повторні паліативні операції, що передбачали лише часткове видалення муцинозних мас. Очікування тривалої виживаності хворих після таких втручань були обмеженими. Кожна наступна операція ставала менш ефективною та більш ризикованою щодо хірургічних ускладнень [1, 2]. Окрім того, з урахуванням гетерогенності клітинного складу ПМО у деяких хворих на фоні повторних паліативних операцій патологія може не залишатися торпідною протягом свого клінічного перебігу, а трансформуватися з менш агресивного low-grade в більш агресивний high-grade гістологічний тип [23].
Історичний контроль ефективності паліативного хірургічного лікування захворювання є доволі складним через малу кількість публікацій, зважаючи на рідкість цієї патології. T.J. Miner та співавтори повідомили про 21% 10-річної виживаності у 97 хворих на ПМО, яким проводили серії паліативних операцій та паліативну хіміотерапію, за 22-річний термін спостережень [24]. Системна паліативна хіміотерапія є неефективною у хворих на ПМО на фоні low-grade муцинозної пухлини апендикса [18].
На початку 90-х років минулого століття американський хірург Paul H. Sugarbaker, враховуючи вкрай рідке екстраперитонеальне розповсюдження ПМО, запропонував нову парадигму лікування цієї патології. Автор підійшов до проблеми ПМО не як до метастатичного процесу, а як до місцево-поширеного інтраперитонеального захворювання та розробив методику циторедуктивного втручання — субтотальної перитонектомії, після якої запропонував застосовувати внутрішньочеревну хіміотерапію [25, 26]. Термін «циторедуктивна хірургія» для лікування пацієнтів із дисемінованими пухлинами різних локалізацій вперше застосований американськими лікарями R.G. Wong та J.J. De Cosse у 1990 р. [27]. Згідно з визначенням авторів циторедуктивна операція — це максимальне видалення пухлини, регіонарних та віддалених метастазів з організму хворого до резидуального процесу, наближеного до мікрометастазів, у розрахунку на наступну дію на залишкові пухлинні елементи хіміотерапевтичних агентів. Термін «циторедуктивна хірургія» здобула сьогодні широке застосування в спеціалізованих хірургічних центрах і використовується як уніфікована англомовна абревіатура — CRS (cytoreductive surgery).
З метою досягнення повної циторедукції при хірургічному лікуванні ПМО операція P.Н. Sugarbaker [25, 26] передбачає проведення 6 класичних етапів процедури перитонектомії (в основному парієтальні перитонектомії) та за необхідності вісцеральної резекції (таблиця). Окремі етапи такої операції застосовуються тільки в ділянках ураження метастатичним процесом парієтальної чи вісцеральної очеревини. Проте у випадку ПМО нерідко необхідно проводити доволі екстенсивні втручання — практично весь комплекс процедури перитонектомії з окремими вісцеральними резекціями (субтотальна перитонектомія) (рис. 4, 5).
| Процедура перитонектомії | Вісцеральні резекції |
| Верхня квадрантна (піддіафрагмальна) перитонектомія зліва | Апендектомія +/− правобічна геміколектомія |
| Верхня квадрантна перитонектомія справа +/− «капсулектомія» печінки | Резекція шлунка |
| Супраколярна оментектомія великого сальника +/− спленектомія | Резекція тонкої кишки |
| Оментектомія малого сальника +/− холецистектомія | Резекція товстої кишки |
| Перитонектомія передньобокової черевної стінки | |
| Тазова перитонектомія +/− резекція ректосигмоїдного відділу +/− гістеректомія, двобічна сальпінго-оофоректомі</> |

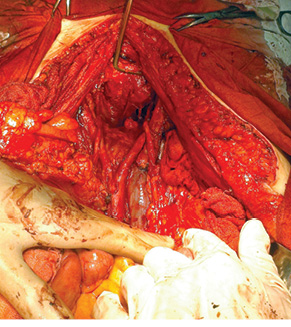
З метою елімінації резидуального інтраперитонеального пухлинного процесу після завершення циторедуктивної операції з приводу ПМО вже більше двох десятків років застосовують інтраопераційну гіпертермічну внутрішньочеревну хіміотерапію, що стала невід’ємним етапом комбінованого лікування таких хворих [1, 2, 18]. Англомовний варіант назви цього типу внутрішньочеревної хіміотерапії — hyperthermic intraperitoneal chemotherapy (HIPEC) — сьогодні є загальноприйнятим. Комбінацію внутрішньочеревного введення хіміопрепаратів та локальної гіпертермії вперше застосував американський хірург J.S. Spratt з колегами у 1980 р. для лікування хворого власне на ПМО [28]. Локальна гіпертермія при проведенні HIPEC чинить прямий цитотоксичний протипухлинний ефект, посилює пенетрацію хіміопрепаратів у тканини, дозволяє долати хіміорезистентність пухлинних клітин [29] та перебуває в синергічній взаємодії з цитостатичними препаратами [30]. Внаслідок існування очеревинно-плазматичного бар’єру градієнт концентрації хіміопрепаратів великої молекулярної маси (мітоміцин, цисплатин) залишається високим протягом тривалого часу, що дозволяє створювати високу концентрацію цитостатиків у черевній порожнині при низькій системній токсичності [31].
Принципова схема проведення НІРЕС (рис. 6) передбачає створення замкнутого стерильного контуру, який з’єднує черевну порожнину хворого зі спеціальним обладнанням, що дозволяє проводити інтраперитонеальну перфузію розчином цитостатиків у гіпертермічному режимі з перманентним термомоніторингом організму на різних рівнях.
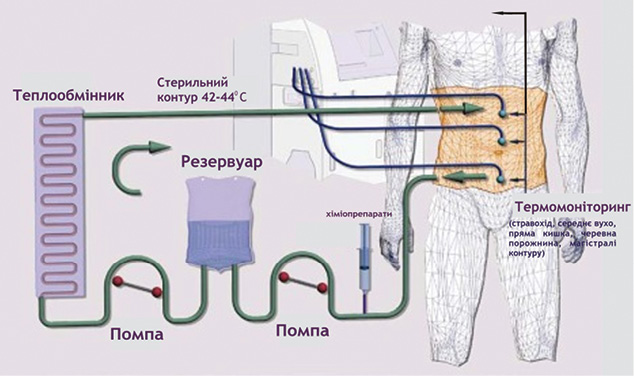
Основним обмежувальним фактором застосування НІРЕС є невелика глибина пенетрацї цитостатичних препаратів у тканини при їх внутрішньочеревному введенні — не більше 1–3 мм [32]. Відтак, це підтверджує принципову необхідність проведення адекватної хірургічної циторедукції на попередньому етапі. З метою оцінки резидуального інтраперитонеального метастатичного процесу після циторедуктивної операції використовують показник повноти циторедукції (completeness of cytoreduction score — CC) [26], що також є потужним прогностичним чинником виживаності хворих. Показник розраховується таким чином: СС-0 — макроскопічні резидуальні пухлинні вогнища на очеревині після циторедуктивного втручання відсутні; СС-1 — резидуальні вогнища діаметром не більше 2,5 мм (максимальна глибина пенетрації хіміопрепаратів при проведенні НІРЕС); СС-2 — розмір резидуальних вузликів від 2,5 мм до 2,5 см; та СС-3 — розмір резидуальних пухлинних вузлів більше 2,5 см.
Таким чином, «повною циторедукцією» після проведення хірургічного втручання з приводу ПМО можна вважати тільки СС-0 та СС-1. Адже при подальшому проведенні НІРЕС ефективна елімінація залишкового пухлинного процесу в черевній порожнині може відбутися тільки при його мікроскопічному характері або резидуальних муцинозних імплантах до 2,5 мм, що добре пенетруються хіміопрепаратами [18, 33, 34].
Іншим важливим прогностичним чинником та об’єктивним критерієм стадіювання перитонеального канцероматозу є запропонований P.Н. Sugarbaker перитонеальний раковий індекс (peritoneal cancer index — PCI), що використовується також як непрямий показник можливості досягнення повної циторедукції при різних локалізаціях пухлин. При обчисленні РСІ черевну порожнину розділяють на 13 умовних тазово-абдомінальних ділянок, у кожній з яких залежно від розмірів імплантів оцінюється ступінь канцероматозу (від 1 до 3 балів) з подальшим сумуванням балів всіх ділянок; таким чином, максимальне значення РСІ становить 39 [26].
Досвід комбінованого лікування хворих на ПМО з використанням CRS + HIPEC у клініці P.H. Sugarbaker Інституту раку у Вашингтоні (Washington Cancer Institute), США, становить сьогодні майже 1000 таких пацієнтів протягом останніх 20 років. Процедура НІРЕС проводиться протягом 90 хв із середньою інтраабдомінальною температурою 42,0 °С з введенням внутрішньочеревно мітоміцину 15 мг/м2 та доксорубіцину 15 мг/м2, а також додатково внутрішньовенно 5-флуороурацилу 400 мг/м2 (бідирекційна хіміотерапія). У перші 4 доби після операції проводиться рання післяопераційна внутрішньочеревна нормотермічна хіміотерапія 5-флуороурацилом через абдомінальні дренажі. Хворим з high-grade муцинозними пухлинами рекомендується проведення системної ад’ювантної хіміотерапії за схемою FOLFOX [4].
Про перші віддалені результати лікування 500 таких хворих у цій клініці повідомлено у 2004 р. [35]: медіана загальної виживаності становила 156 міс, 5- та 10-річна виживаність хворих загальної групи — 72 та 55% відповідно.
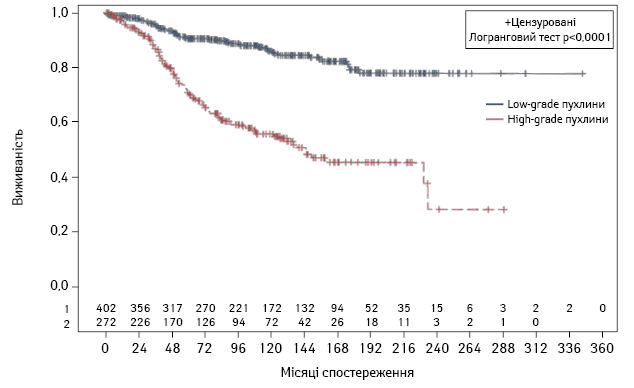
Сьогодні опубліковано результати 20-річного періоду роботи центру у Вашингтоні. Віддалені результати лікування очікувано вірогідно залежать від гістологічної будови ПМО [4]: за умови повної циторедукції (СС-0, СС-1) досягнуто 20-річної виживаності у 80% хворих з low-grade ПМО та з high-grade пухлинами — у близько 45% пацієнтів (p<0,0001) (рис. 7). Тридцятиденна післяопераційна летальність становила 2%, хірургічні ускладнення, що потребували релапаротомії, розвинулися у 11% хворих, ускладнення періопераційної внутрішньочеревної хіміотерапії ІV ступеня — у 19% пацієнтів [4].
Рівень РСІ вірогідно впливає на прогноз у хворих на ПМО обох гістологічних типів. Проте, якщо циторедукція була повною, навіть у групі пацієнтів із РСІ >20 балів рівень 20-річної виживаності зафіксовано на позначці 65% [4]. Таким чином, на відміну від інших інтраперитонеально дисемінованих пухлин (наприклад карцинома товстої кишки, яєчника, шлунка), при яких CRS + HIPEC застосовують виключно за умови рівня РСІ <20 балів [4, 36], ПМО — це чи не єдина патологія, при якій циторедуктивні операції показані пацієнтам з субмаксимальними значеннями РСІ [18].
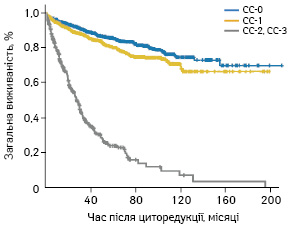
Показник CC є потужним прогностичним чинником виживаності хворих на ПМО при застосуванні комбінованого лікування. Так, у мультицентровому ретроспективному дослідженні ефективності CRS + HIPEC у майже 2300 хворих на ПМО із 16 спеціалізованих центрів зафіксовано вірогідну різницю виживаності після повної циторедукції проти паліативних операцій (СС-2, СС-3) (рис. 8). У цьому самому дослідженні у загальній групі хворих зафіксовано медіану загальної виживаності 196 міс (16,3 року), медіану безрецидивної виживаності 98 міс (8,2 року) з 10- та 15-річною виживаністю 63 та 59% відповідно [37].
Хірургічний центр в госпіталі Бейзінгстоука та Північного Гемпшира (Бейзінгстоук, Велика Британія) є сьогодні одним із найбільших в світі центрів комбінованого лікування ПМО, що за останні 22 роки накопичив досвід терапії більше тисячі хворих на ПМО із застосуванням CRS + HIPEC [38, 39]. У клініці НІРЕС проводиться протягом 60 хв із середньою інтраабдомінальною температурою 41–42,0 °С із внутрішньочеревним застосуванням мітоміцину 10 мг/м2. У перші 4 доби застосовують післяопераційну внутрішньочеревну хіміотерапію 5-флуороурацилом через абдомінальні дренажі. Системна ад’ювантна хіміотерапія рекомендується хворим з high-grade пухлинами.
Віддалені результати у центрі в Бейзінгстоуку базуються на аналізі ефективності лікування 1000 хворих на ПМО. Медіани виживаності в загальній групі пацієнтів на сьогодні не досягнуто. У хворих з повною циторедукцією (СС-0, СС-1) 3-, 5- та 10-річна виживаність становить 94,1; 87,4 та 70,3% відповідно. Десятирічна безрецидивна виживаність — 63,5%. За умови неповної циторедукції (СС-2, СС-3) 5- та 10-річна виживаність становить 39,2 та 8,1% відповідно. Багатофакторний аналіз підтвердив вірогідний вплив на виживаність морфологічного типу ПМО, показника СС, а також підвищення рівня онкомаркерів перед операцією [39]. Для досягнення повної циторедукції у 12% пацієнтів клініки необхідною була резекція шлунка чи гастректомія [40]. Тридцятиденна післяопераційна летальність становила 0,8%, післяопераційні ускладнення ІІІ–ІV ступеня згідно зі шкалою Claviene — Dindo [41] зафіксовано у 15,2% хворих [39].
Італійські онкологи з Національного інституту раку (National Cancer Institute) в Мілані, Італія, повідомляють про 5-річну загальну та безрецидивну виживаність на рівні 78,3 та 31,1% відповідно у загальній групі хворих на ПМО, яким проведено CRS + HIPEC [5].
Вірогідний вплив доопераційного рівня маркерів пухлинного росту (РЕА, СА 19-9 та СА 125) на ризик інтраперитонеального рецидиву, безрецидивну та загальну виживаність продемонстровано також в інших дослідженнях [19, 42]. Встановлено також, що у хворих з доопераційним статусом життєдіяльності ECOG 2/3 (Eastern Cooperative Oncology Group) вірогідно нижча виживаність, ніж у пацієнтів з ECOG 1 [43]. Хворі, яким проводять повторні CRS + HIPEC при прогресуванні захворювання, характеризуються вірогідно кращим прогнозом [44].
Таким чином, з огляду на результати попередніх проспективних досліджень [35, 37], систематичний огляд літератури [45] та консенсусне рішення експертів [18] проактивний підхід до комбінованого лікування ПМО з використанням CRS + НІРEC розглядається сьогодні як стандарт терапії. Ось як висловлюється з цього приводу P.H. Sugarbaker [4]: «На мою думку, результати попередніх досліджень творять новий стандарт лікування муцинозних неоплазій апендикса з перитонеальною дисемінацією. Традиційна вичікувальна тактика в комбінації з паліативними втручаннями повинна мати виключно історичне значення, оскільки застосування CRS з періопераційною хіміотерапією забезпечує високу вірогідність курації цієї складної патології».
В аспекті критеріїв доказової медицини результати проведених нерандомізованих з історичним контролем досліджень ефективності комбінованого лікування ПМО не можуть претендувати на найвищі рівні доказовості [46]. Проте проблеми з організацією рандомізованих контрольованих досліджень ефективності лікування цієї рідкісної патології є очевидними вже сьогодні: проведення прямого порівняння куративного лікування з групою контролю фактично симптоматичних операцій чи симптоматичного лікування є неетичним. Можливим дизайном потенційних досліджень ІІІ фази може бути дослідження CRS з або без окремих етапів періопераційної хіміотерапії чи окремих аспектів або режимів проведення внутрішньочеревної хіміотерапії [18, 45].
Сучасна стратегія комбінованого лікування ПМО — це комплекс екстенсивних хірургічних та хіміотерапевтичних процедур, асоційованих із підвищеним ризиком ускладнень та летальності, що істотно корелює з феноменом індивідуальної та інституційної «кривої навчання» [47, 48]. Так, у хірургічному центрі в Бейзінгстоуку, де сьогодні щороку виконують більше 200 втручань з приводу цієї рідкісної патології, протягом двох десятків років кількість повних циторедукцій зросла з 60,7 до 80,9%, кількість пробних лапаротомій зменшилася з 6,4 до 1,3% та 30-денна післяопераційна летальність знизилася з 3,0 до 0,7% [38]. Сьогодні існує рекомендація проводити циторедуктивні перитонектомії в команді, де принаймні двоє хірургів мають досвід виконання комбінованих втручань підвищеного ризику від діафрагми до порожнини малого таза [49]. Тому необхідність концентрації таких хворих у спеціалізованих центрах з досвідом виконання таких операцій є очевидною. Так, сьогодні в США функціонують 28 центрів комбінованого лікування ПМО, у Великій Британії в рамках державної програми охорони здоров’я — 2 центри в Бейзінгстоуку та Манчестері, в Європейському Союзі десятки таких центрів.
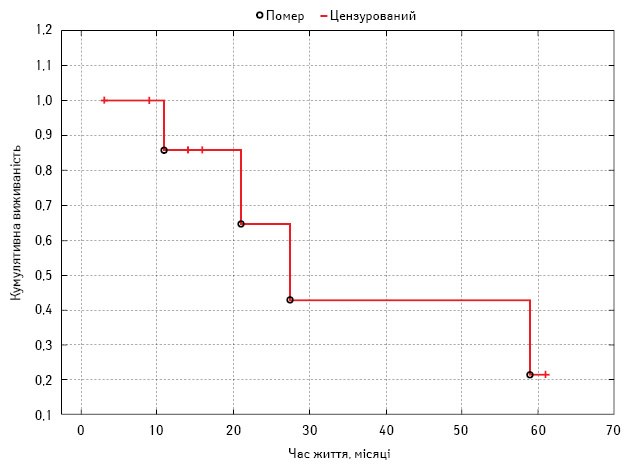
Комбіноване лікування інтраперитонеально дисемінованих пухлин шлунково-кишкового тракту та яєчника з використанням CRS + HIPEC у клініці онкології Львівського національного медичного університету ім. Данила Галицького на базі відділення абдомінальної хірургії Львівського державного онкологічного регіонального лікувально-діагностичного центру проводиться з 2007 р. Накопичено досвід терапії близько 150 хворих. Проведено лікування 9 хворих на ПМО (рис. 9).
Отже, створення і розвиток спеціалізованих хірургічних центрів із великим досвідом комбінованого лікування ПМО та інших інтраперитонеально дисемінованих пухлин та концентрація хворих в таких центрах дозволяють збільшувати частку пацієнтів з повною циторедукцією та знижувати рівень ускладнень та летальності. І загалом зміна поглядів онкологічної спільноти на парадигму лікування таких хворих дає можливість забезпечити тривалі терміни виживаності пацієнтів із цією рідкісною, складною, проте курабельною патологією.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Moran B.J., Cecil T.D. (2003) The ethiology, clinical presentation, and management of pseudomyxoma peritonei. Surg. Oncol. Clin. N. Am., 12: 585–603.
2. Sugarbaker P.H. (2006) New standard of care for appendiceal epithelial neoplasms and pseudomyxoma peritonei syndrome? Lancet Oncol., 7: 69–76.
3. Weaver C.H. (1937) Mucocele of the appendix with pseudomucinous degeneration. Am. J. Surg., 36: 523–526.
4. Sugarbaker P.H. (2013) Cytoreductive surgery and perioperative chemotherapy for peritoneal surface malignancy. Textbook and video atlas. Cine-Med Publishing, Inc. 214 p.
5. Baratti D., Kusamura S., Nonaka D. et al. (2007) Pseudomyxoma peritonei: clinical pathological and biological prognostic factors in patient treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Ann. Surg. Oncol., 15(2): 526–534.
6. Smeenk R.M., Velthuysen M.L., Verwaal V.J., Zoetmulder F.A. (2008) Appendiceal neoplasms and pseudomyxoma peritonei: a population based study. Eur. J. Surg. Oncol., 34(2):196–201.
7. Ronnett B.M., Shmookler B.M., Sugarbaker P.H., Kurman R.J. (1997) Pseudomyxoma peritonei: new concepts in diagnosis, origin, nomenclature, relationship to mucinous borderline (low malignant potential) tumors of the ovary. In: Fechner R.E., Rosen P.P., eds. Anatomic Pathology. Chicago: ASCP Press: 197–336.
8. Misdraji J., Yantiss R.K., Graeme-Cook F.M. et al. (2003) Appendiceal mucinous neoplasms: a clinicopathologic analysis of 107 cases. Am. J. Surg. Pathol., 27: 1089–1103.
9. Carr N.J., Sobin L.H. (2010) Adenocarcinoma of the appendix. In: Bosman F.T., Carneiro F., Hruban R.H., et. аl., eds. WHO classification of tumors of the digestive system. Lyon: IARC; p. 122–125.
10. Carr N.J., Finch J., Ilesley I.C. et. al. (2012) Pathology and prognosis in pseudomyxoma peritonei: a review of 274 cases. J. Clin. Pathol., 65(10): 919–923.
11. Carr N.J., Cecil T., Mohamed F. et al. (2016) A consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia. The results of the Peritoneal Surface Oncology Group International (PSOGI) modified Delphi process. Am. J. Surg. Pathol., 40(1): 14–26.
12. Ronnett B.M., Zahn C.M., Kurman R.J. et al. (1995) Disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis: a clinicopathologic analysis of 109 cases with emphasis on distinguishing pathologic features, site of origin, prognosis and relationship to «pseudomyxoma peritonei». Am. J. Surg. Pathol., 19: 1390–1408.
13. Szych C., Staebler A., Connoilly D.C. et al. (1999) Molecular genetic evidence supporting the clonality and appendiceal origin of pseudomyxoma peritonei in women. Am. J. Pathol., 154: 1849–1855.
14. Carr N.J., Emory T.S., Sobin L.H. (2002) Epithelial neoplasms of the appendix and colorectum: an analysis of cell proliferation, apoptosis and expression of p53, CD44, bcl-2. Arch. Pathol. Lab. Med., 126: 837–841.
15. Kann M.A., Demopoulous R.I. (1992) Mucinous ovarian tumors with pseudomyxoma peritonei: a clinicopathological study. Int. J. Gynecol. Pathol., 11: 15–23.
16. Cheijfec G., Rieker W.J., Jablokow V.R. et al. (1986) Pseudomyxoma peritonei associated with colloid carcinoma of the pancreas. Gastroenterology, 90: 202–205.
17. Ronnett B.M., Kurman R.J., Shmookler B.M. et al. (1997) The morphologic spectrum of ovarian metastases of appendiceal adenocarcinomas: a clinicopathologic and immunohistochemical analysis of tumors often misinterpreted as primary ovarian tumors or metastatic tumors from other gastrointestinal sites. Am. J. Surg. Pathol., 21: 1144–1155.
18. Moran B., Baratti D., Yan T.D. et al. (2008) Consensus statement on the loco-regional treatment of appendiceal mucinous neoplasms with peritoneal dissemination (pseudomyxoma peritonei). J. Surg. Oncol., 98: 277–282.
19. Tan G.H.C., Novo C.A., Dayal S. et al. (2017) The modified Glasgow prognosis score predicts for overall and disease-free survival following cytoreductive surgery and HIPEC in patients with pseudomyxoma peritonei of appendiceal origin. Eur. J. Surg. Oncol., 43: 388–394.
20. Carmignani P., Sugarbaker T.A., Bromley C.M. et al. (2003) Intraperitoneal cancer dissemination: mechanisms of the patterns of spread. Cancer Metastasis Rev., 22: 465–472.
21. Gonzalez-Moreno S., Brun E., Sugarbaker P.H. (2005) Lymph node metastasis in epithelial malignancies of the appendix with peritoneal dissemination does not reduce survival in patients treated by cytoreductive surgery and perioperative intraperitoneal chemotherapy. Ann. Surg. Oncol., 12: 72–80.
22. Esquivel J., Sugarbaker P.H. (2000) Clinical presentation of the pseudomyxoma perotonei syndrome. Br. J. Surg., 87: 1414–1418.
23. Yan H., Pestieau S.R., Shmookler B.M. et al. (2001) Histopathologic analysis in 46 patients with pseudomyxoma peritonei syndrome: failure versus success with a second-look operation. Mod. Pathol., 14: 164–171.
24. Miner T.J., Shia J., Jaques D.P. et al. (2005) Long-term survival following treatment of pseudomyxoma peritonei: an analysis of surgical therapy. Ann. Surg., 241: 300–308.
25. Sugarbaker P.H. (1995) Peritonectomy procedures. Ann. Surg., 221 (1): 29–42.
26. Sugarbaker P.H. (1999) Management of peritoneal-surface malignancy: the surgeon’s role. Langenbeck’s Arch. Surg., 384(6): 576–587.
27. Wong R.J., De Cosse J.J. (1990) Cytoreductive surgery. J. Surg. Gynecol. Obstet., 170(3): 276–281.
28. Spratt J.S., Adcock R.A., Muskovin M. et al. (1980) Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res. 40(2): 256–260.
29. Suit H.D., Gerweck L.E. (1979) Potential for hyperthermia and radiation therapy. Cancer Res., 39(60): 2290–2298.
30. Watanabe M., Tanaka R., Hondo H., Kuroki M. (1992) Effects of antineoplastic agents and hyperthermia on cytotoxicity toward chronically hypoxic glioma cells. Int. J. Hyperthermia., 8(1): 131–138.
31. Van der Speeten K., Stuart O.A., Chang D. et al. (2011) Changes induced by surgical and clinical factors in the pharmacology of intraperitoneal mitomycin C in 145 patients with peritoneal carcinomatosis. Cancer Chemother. Pharmacol., 68(1): 147–156.
32. Los G., Mutsaers P.H., Lenglet W.J. et al. (1990) Platinum distribution in intraperitoneal tumors after intraperitoneal cisplatin treatment. Cancer Chemother. Pharmacol., 25: 389–394.
33. Sugarbaker P.H. (1996) Peritoneal carcinomatosis: natural history and rational therapeutic interventions using intraperitoneal chemotherapy. Cancer Treat. Res., 81: 149–68.
34. Jacquet P., Sugarbaker P.H. (1996) Current methodologies for clinical assessment of patients with peritoneal carcinomatosis. J. Exp. Clin. Cancer Res., 15: 49–58.
35. Gonzalez-Moreno S., Sugarbaker P.H. (2004) Right hemicolectomy does not confer a survival advantage in patients with mucinous carcinoma of the appendix and peritoneal seeding. Br. J. Surg., 91: 304–311.
36. Elias D., Lefevre J.H., Chevalier J. et al. (2009) Сomplete cytoreductive surgery plus intraperitoneal chemohyperthermia with oxaliplatin for peritoneal carcinomatosis of colorectal origin. J. Clin. Oncol., 27: 681–685.
37. Chua T.C., Moran B.J., Sugarbaker P.H. et al. (2012) Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J. Clin. Oncol., 30(20): 2449–2456.
38. Moran B., Cecil T., Chandrakumaran K. et al. (2015) The results of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1200 patients with peritoneal malignancy. Colorectal Dis., 17: 772–778.
39. Ansari N., Chandrakumaran K., Dayal S. et al. (2016) Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1000 patients with perforated appendiceal epithelial tumours. Eur. J. Surg. Oncol., 42(7): 1035–1041.
40. Di Fabio F., Mehta A., Chandrakumaran K. et al. (2016) Advanced pseudomyxoma peritonei requiring gastrectomy to achieve complete cytoreduction results in good long-term oncologic outcomes. Ann. Surg. Oncol., 23: 4316–4321.
41. Clavien P.A., Barkun J., de Oliveira M.L. et al. (2009) The Clavien-Dindo classification of surgical complications: five-year experience. Ann. Surg., 250(2): 187–196.
42. Taflampas P., Dayal S., Chandrakumaran K. et al. (2014) Pre-operative tumour marker status predicts recurrence and survival after complete cytoreduction and hyperthermic intraperitoneal chemotherapy for appendiceal Pseudomyxoma Peritonei: Analysis of 519 patients. Eur. J. Surg. Oncol., 40(5): 515–520.
43. Stewart J.H., Perry S., Levine E.A. (2005) Intraperitoneal hyperthermic chemotherapy for peritoneal surface malignancy: current status and future directions. Ann. Surg. Oncol., 12: 765–777.
44. Yan T.D., Bijelic L., Sugarbaker P.H. (2007) Critical analysis of treatment failure after complete cytoreductive surgery and perioperative intraperitoneal chemotherapy for peritoneal dissemination from appendiceal mucinous neoplasms. Ann. Surg. Oncol., 14: 2289–2299.
45. Yan T.D., Black D., Savady R., Sugarbaker P.H. (2007) A systematic review on the efficacy of cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxoma peritonei. Ann. Surg. Oncol., 14(2): 484–492.
46. Casali P., Licitra L., Tondini C. et al. (1999) START: a European state-of-the-art on-line instrument for clinical oncologist. Ann. Oncol., 10: 769–773.
47. Moran B.J. (2006) Establishment of a peritoneal malignancy treatment centre in the United Kingdom. Eur. J. Surg. Oncol., 32: 614–618.
48. Smeenk R.M., Verwaal V.J., Zoetmulder F.A. (2007) Learning curve of combined modality treatment in peritoneal surface disease. Br. J. Surg., 94: 1408–1414.
49. Moran B.J. (2006) Decision-making and technical factors account for the learning curve in complex surgery. J. Public Health (Oxf.), 28(4): 375–378.
Псевдомиксома брюшины: инкурабельная казуистическая патология или необходимость проактивной тактики комбинированного лечения?
Львовский национальный медицинский университет
им. Данила Галицкого, кафедра онкологии и медицинской радиологии
Институт перитонеального канцероматоза,
госпиталь Бейзингстоука и Северного Гемпшира,
Бейзингстоук, Великобритания
Львовский государственный онкологический
региональный лечебно-диагностический центр
Резюме. Псевдомиксома брюшины — это редкая комплексная патология с уникальным биологическим поведением, которая, как правило, связана с прогрессированием муцинозных неоплазий аппендикса и имплантационным распространением в брюшной полости. На смену старым подходам к паллиативному лечению таких пациентов сегодня приходит проактивный способ комбинированной терапии с использованием циторедуктивной хирургии и периоперационной внутрибрюшной химиотерапии, что обеспечивает прогноз для больных на качественно новом уровне.
муцинозные неоплазии аппендикса, канцероматоз брюшины, псевдомиксома брюшины, циторедуктивная хирургия, гипертермическая внутрибрюшная химиотерапия.
Адреса:
Ярема Роман Романович
79000, Львів, вул. Пекарська, 69
Львівський національний медичний університет ім. Данила Галицького
Тел.: +380679406933, (032) 295-37-61
E-mail: roman.yarema@ukr.net














Leave a comment