Безпосередні результати комбінації системно-селективної неоад’ювантної поліхіміотерапії та магнітотермії у комплексному лікуванні хворих на місцево-поширений рак грудної залози
Смоланка І.І. (старший), Орел В.Е., Досенко І.В., Лобода А.Д., Риспаєва Д.Є., Супруненко О.А., Тарасова Т.О., Ляшенко А.О., Іванкова О.М., Родзаєвський С.О., Молід С.О., Смоланка І.І. (молодший)
Резюме. У дослідженні проаналізовано безпосередні результати лікування 92 хворих на місцево-поширений рак грудної залози із застосуванням стандартних та нових методик неоад’ювантної поліхіміотерапії. Розроблена методика лікування хворих на місцево-поширений рак грудної залози із застосуванням системно-селективної неоад’ювантної поліхіміотерапії з використанням магнітотермії сприяє вірогідному підвищенню об’єктивної відповіді пухлини на лікування — дозволяє збільшити на 15,34% кількість випадків повної та часткової регресії первинної пухлини за критеріями RECIST. Метод дозволяє на 11,74% збільшити відсоток проведення органозберігаючих та на 11,55% — реконструктивно-відновних оперативних втручань.

Вступ
Рак грудної залози (РГЗ) займає перше місце в структурі онкологічної патології серед жіночого населення у всьому світі. Рівень захворюваності на РГЗ невпинно зростає. За даними Всесвітньої організації охорони здоров’я, у 2012 р. в світі зареєстровано 1,67 млн нових випадків цієї хвороби. За даними Національного канцер-реєстру, протягом 2015 р. в Україні на РГЗ захворіли 14 332 жінки, що становило 73,8 на 100 тис. жіночого населення, а смертність відповідно сягнула 24,6 випадків [1].
Лікування при РГЗ на сьогодні лишається етапним, багатокомпонентним процесом, передбачає індивідуальний підхід. При місцево-поширеному РГЗ (МП РГЗ) основним стандартом є неоад’ювантна терапія [2].
Пильну увагу викликають занедбані форми РГЗ, що мають стрімкий перебіг, несприятливий прогноз та асоційовані з пухлинами великого розміру, поширенням процесу в регіонарні лімфатичні колектори, ураженням парастернальних та надключичних лімфатичних вузлів (ЛВ) [3].
Нині наявність у тканинах пухлини рецепторів стероїдних гормонів служить критерієм її гормональної чутливості і є показанням до призначення гормонотерапії. Відсутність рецепторів супроводжується гормонорезистентністю пухлини, за винятком 8–10%, коли пухлина все ж виявляється гормоночутливою [4].
Оптимізація протипухлинної терапії є одним із перспективних напрямків покращення результатів лікування хворих на РГЗ [5]. Розробки, що ведуться у цій галузі, дають можливість потенціювати ефективність поліхіміотерапії (ПХТ) за рахунок: по-перше, створення нових хіміопрепаратів; по-друге, удосконалення методів транспортування препаратів до пухлини; по-третє, використання модифікаторів хіміопроменевої терапії та, по-четверте, призначення індивідуалізованих хіміотерапевтичних режимів. Дуже важливим після застосування неоад’ювантної поліхіміотерапії (НПХТ) є можливість створення умов для проведення радикальних, реконструктивних та відновних операцій у цієї категорії хворих [6].
Зацікавленість проблемою передопераційної протипухлинної терапії постійно зростає, тому що неоад’ювантне лікування при РГЗ дозволяє зменшити обсяг хірургічного втручання та у частини хворих створює сприятливі умови для виконання органозберігаючих або відновних операцій [7].
Починаючи з 1990 р., у Національному інституті раку ми проводимо аналіз результатів неоад’ювантного антибластомного впливу на пухлину грудної залози (ГЗ) з ретельним дослідженням лікувального патоморфозу [8].
Відомо, що РГЗ характеризується значною внутрішньопухлинною морфологічною гетерогенністю та ризиком метастазування [9]. Тому актуальною проблемою клінічної онкології стає морфологічна оцінка чутливості пухлини до неоад’ювантної терапії, яка визначається при аналізі операційного матеріалу видалених пухлин та відображається у зміні об’ємної частки життєздатної пухлинної тканини (ОЧЖПТ) при лікувальному патоморфозі. З погляду морфологічної онкології доцільність передопераційної терапії полягає в досягненні структурних пошкоджень пухлинних клітин, завдяки чому гальмується пухлинний ріст і зменшується проліферативний та інвазивний потенціал агресивного пулу пухлин, що сприяє зниженню рецидивного та метастатичного ризику в післяопераційний період [10].
Ці структурні зміни відповідають клінічній стратегії, оскільки головним призначенням передопераційної терапії є девіталізація морфологічного субстрату злоякісної пухлини, життєздатність якого втрачається внаслідок деструкції та загибелі неопластичних клітин, пригнічення мітотичної активності проліферуючого пулу з появою патологічних мітозів, збільшення яких під впливом неоад’ювантної хіміотерапії свідчить про ефективність лікування.
Важливими прогностичними факторами вважають: вік, різні варіанти будови, клітинного диференціювання, ступінь злоякісності, розміри, локалізацію, наявність чіткої границі пухлини, інфільтративність росту, радикальність операції, ОЧЖПТ, наявність метастазів в ЛВ, стан мікроциркуляторного русла, лімфоїдноклітинну реакцію [11].
У Національному інституті раку також проводяться багаторічні дослідження з оцінки ефективності комбінованих методів лікування хворих на МП РГЗ з використанням магнітотермії (МТ) [12, 13].
Об’єкт і методи дослідження
У дослідженні оцінено безпосередні результати лікування 92 хворих на МП РГЗ ІІБ–ІІІА стадії. Усім пацієнткам проведено стандартне обстеження, що включало: мамографію, ультразвукове дослідження (УЗД) ГЗ та аксилярної зони на боці ураження, гістологічну верифікацію діагнозу з імуногістохімічним дослідженням.
Критеріями залучення пацієнтів у дослідження були:
- жіноча стать, вік від 18 до 65 років;
- наявність у пацієнта цитологічно або гістологічно підтвердженого діагнозу РГЗ;
- інформована письмова згода пацієнтки на участь у дослідженні;
- здатність пацієнтки до адекватного співробітництва в процесі дослідження;
- стан хворого за ЕСОG — 0–2.
Критерії виключення пацієнтів із дослідження:
- вагітність, лактація;
- гострі запальні та інфекційні процеси;
- системні захворювання крові;
- супутні захворювання, наявність яких здатна істотно вплинути на результати дослідження (серцева недостатність III ступеня, хронічна ниркова недостатність ІІІ–IV ступеня, печінкова недостатність, некомпенсовані порушення функції нирок, підшлункової залози, зовнішнього дихання та ін.);
- наявність окремої пухлини (інше злоякісне новоутворення).
Після встановлення та верифікації діагнозу всі хворі були рандомізовані на дві групи. Основну групу становили 48 хворих на МП РГЗ ІІБ–ІІІА стадії, яким проводилася НПХТ за схемою CАР з внутрішньоартеріальним введенням карбоплатину та циклофосфаміду і системним введенням антрациклінів з використанням МТ з інтервалом 3 тиж; 44 хворі на МП РГЗ ІІБ—ІІІА стадії увійшли до контрольної групи, в якій НПХТ проведено за такою самої схемою без використання МТ з інтервалом 3 тиж.
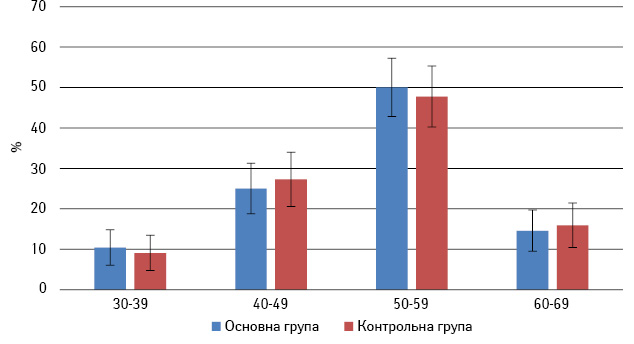
Розподіл пацієнток із МП РГЗ проводили залежно від віку та стадії захворювання, за цими параметрами обидві групи були однорідними (рис. 1, табл. 1).
Таблиця 1. Розподіл хворих на МП РГЗ залежно від стадії захворювання
| Стадія захворювання | Основна група, n (%) | Контрольна група, n (%) |
| IІБ (T2–3N0–1M0) | 27 (56,25±7,16) | 25 (56,82±7,47) |
| IIIА (T2–3N1–2M0) | 21 (43,75±7,16) | 19 (43,18±7,47) |
| Усього | 48 (100,0) | 44 (100,0) |
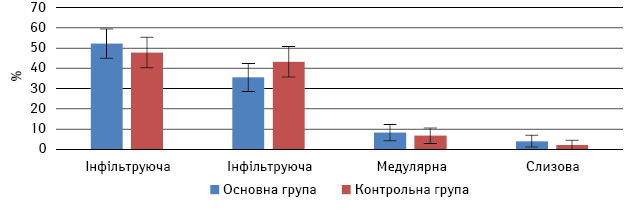
У всіх хворих діагноз був верифікований методом трепан-біопсії. За гістологічною структурою найбільш часто траплялася інфільтруюча часточкова карцинома: в основній групі — у 25 пацієнток (52,08±7,21%), в контрольній — у 21 (47,73±7,53%) (р>0,05). Інфільтруючу протокову карциному в основній групі діагностовано у 17 пацієнток (35,42±6,90%), у контрольній — у 19 (43,18±7,47%) (р>0,05); медулярну карциному — у 4 (8,33±3,99%) хворих основної та у 3 (6,8±3,80%) контрольної групи (р>0,05); слизову карциному — у 2 (4,17±2,88%) хворих основної та 1 (2,27±2,25%) пацієнтки контрольної групи (р>0,05). Різниця відсотків хворих за різними морфологічними типами пухлин в обох досліджуваних групах не була достовірною (рис. 2).
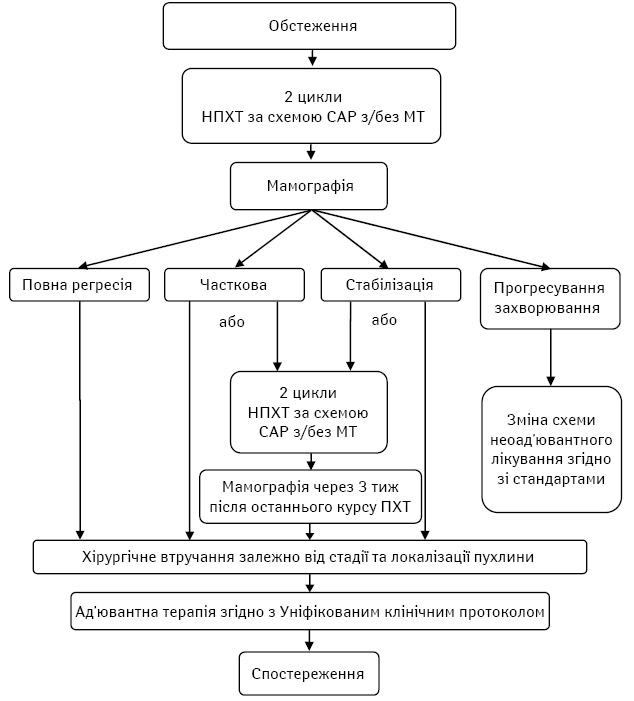
Дизайн дослідження комплексного лікування хворих на МП РГЗ з використанням системно-селективної неоад’ювантної поліхіміотерапії (ССНПХТ) та МТ наведено на рис. 3.
ССНПХТ проводиться селективно після попереднього виконання діагностичної ангіографії.
Внутрішньоартеріальна хіміотерапія призначена для селективного руйнування тканин пухлини, індукування стану клінічної ремісії у вигляді зменшення маси та об’єму новоутворень та регіонарних ЛВ, зниження стадії захворювання, конвертування нерезектабельних пухлин у резектабельні [8].
Кровопостачання РГЗ виникає з ряду джерел, які належать до систем підключичної та пахвової артерій. В умовах експансивного росту пухлини кровообіг в регіоні зазнає суттєвих змін. Для забезпечення зростаючих потреб у кровопостачанні пухлини-мішені домінуючого розвитку набувають судини, територіально розташовані ближче до вогнища ураження.
При серійному ангіографічному дослідженні аферентні судини пухлини ГЗ виділяються за рахунок значної гіпертрофії і деформації своїх порядкових гілок, територія їх розподілу розширюється не тільки за рахунок росту новоутворення, але й збільшення зони перифокальної інфільтрації суміжних м’яких тканин (рис. 4, 5). Об’ємний кровотік у пухлині помітно зростає, лінійна швидкість його знижується. Усе це сприяє успіху проведення селективної катетеризації привідних артерій і забезпечує адресне та пролонговане направлення хіміопрепаратів у пухлину-мішень.
Під час селективного введення цитостатиків у пухлинне русло тік крові витісняється та заміщується інфузійною рідиною. Завдяки цьому виключається процес контакту та зв’язку цитостатиків з білками плазми крові, що зумовлює ексклюзивний хіміотерапевтичний ефект першого проходження препаратів через пухлину.
Алгоритм селективної катетеризації судин, які кровопостачають пухлину ГЗ
Для вирішення конкретного терапевтичного завдання виконували вибірковий пошук домінантної судини, яка бере участь у кровопостачанні новоутворення ГЗ. Безпосередньо для пухлин, які локалізуються в медіальних квадрантах або в центральній частині органа, була показана катетеризація внутрішньої грудної артерії.
Вибіркову катетерну хіміотерапію пухлин, локалізованих у зовнішніх квадрантах ГЗ, проводили шляхом зондування бокової грудної або підлопаткової артерії.
Якщо при пошуковій ангіографії контрастували додаткові, нетипові джерела кровопостачання пухлини або регіонарних метастазів, тоді прицільну ССНПХТ виконували на основі використання техніки катетеризації реберно-шийного або щито-шийного стовбура чи інших аферентних судин системи підключичної та пахвової артерій. Пункцію пахвової артерії з відповідного боку застосовували головним чином у разі невдалого пошуку обраних артерій шляхом пункції загальної стегнової артерії.
Селективне ангіографічне дослідження хворих на МП РГЗ здійснювали в спеціальній рентгеноопераційній, оснащеній телемоніторами і пристроєм для реєстрації цифрового зображення, автоматичним інжектором рентгеноконтрастної речовини.
Ангіографічне дослідження проводили в умовах автоматичного введення рентгеноконтрастної рідини із реєстрацією зображення артеріальної, пізньої капілярної та паренхіматозної фаз контрастування пухлини. Застосовували неіонні низькоосмолярні водорозчинні препарати. Кількість препарату на одне введення залежала від діаметра катетеризованої судини і становила 20–30 мл. Для суперселективної ангіографії використовували 7–10 мл рентгеноконтрастної рідини. Швидкість зйомки — 2 кадри за секунду, тривалість ін’єкції контрасту була обмежена 3 с. Після динамічної ангіографії застосовували програму дигітальної субтракційної ангіографії. При цьому більше уваги приділяли контрастуванню артеріо-артеріальних анастамозів у системах підключичної та пахвової артерій, враховуючи наявність нетипових джерел кровопостачання МП РГЗ.
Катетери, які використовують для проведення ССНПХТ, армовані на всій протяжності, різних типів та калібру, спеціально модельовані для катетеризації судин ГЗ. Отже, завжди є можливість заміни катетера для вирішення терапевтичного завдання.
Після місцевого знеболення у пахвовій ділянці під контролем ангіографічного апарата через аксилярну артерію катетер F-5 встановлювали у внутрішню або бокову грудну артерію, залежно від кровопостачання пухлини.
Ангіографію та встановлення внутрішньоартеріального катетера виконували за допомогою ангіографічної установки Philips BV Pulsera.
Хворим на МП РГЗ ІІБ–ІІІА стадії проводили ССНПХТ за схемою CАР. Курс хіміотерапії розпочинали з премедикації з дексаметазоном 8,0 мг, ондансетроном 8,0 мг у розчині NaCl 0,9% 400,0 мл, у подальшому — внутрішньовенно крапельно вводили хіміопрепарат доксорубіцин з розрахунку на площу поверхні тіла — 50 мг/м2; внутрішньоартеріально циклофосфамід — 600 мг/м2; на наступний день — премедикація у тому самому об’ємі, після чого внутрішньоартеріально вводили карбоплатин — 300 мг/м2.
Не пізніше як за 30 хв після закінчення інфузії хіміопрепаратів щоденно проводили сеанс МТ упродовж 30 хв на апараті «Магнітерм» за вихідної потужності 50 Вт.
Під час сеансу МТ хвора перебуває в горизонтальному положенні на спині з оголеною верхньою частиною тіла. Основний аплікатор (еліпсоїдної форми з великою віссю 23 см, з рівним профілем) апарата «Магнітерм» встановлюють навколо ураженої ГЗ, допоміжний аплікатор (формою, наближеною до трикутної, розмірами 5×5,5 см з профілем у формі дуги кола з радіусом 2,3 см, який знаходиться над площиною основного аплікатора на відстані 2 см) розміщують у проекції пухлини. Максимальна напруженість магнітного поля на поверхні ГЗ у зоні пухлини становила Н=22 А/м. При цьому температура на поверхні ГЗ у зоні пухлини не перевищувала 4 °С.
Приклад укладки хворої на МП РГЗ під час МТ наведено на рис. 6.
Через 3 тиж після останнього курсу ПХТ проводили мамографію з метою аналізу результатів лікування хворих обох груп, після чого виконували радикальне оперативне втручання і подальшу ад’ювантну терапію відповідно до стандартів лікування онкологічних хворих Міністерства охорони здоров’я України. Оцінку ефективності НПХТ проводили за критеріями RECIST з використанням мамографії та УЗД. Обсяг оперативного втручання обирали на підставі отриманих даних клінічної ефективності передопераційної терапії з урахуванням результатів інтраопераційного визначення меж резекції (проведення експрес-біопсії країв резекції під час операції).
Через 3 тиж після 2-го та 4-го курсів НПХТ з або без використання МТ проводили повторне обстеження пацієнток (мамографія з аксилографією та УЗД пахвових ЛВ) для оцінки ефективності лікування за критеріями RECIST v 1.0 (табл. 2) та планування подальшої терапії.
Таблиця 2. Відповідь на терапію у хворих на МП РГЗ за критеріями RECIST
| Оцінка відповіді на терапію | RECIST-критерії оцінки відповіді солідних пухлин |
| Повна регресія | Повне зникнення всіх ознак та симптомів захворювання |
| Часткова регресія | Зменшення загального розміру пухлини ≥30% за найдовшим поперечним діаметром ділянок ураження, що визначалося для оцінки ефективності терапії |
| Стабілізація захворювання | Розмір пухлини без змін або зменшення загального розміру пухлини <30% чи збільшення ≤20% найдовшого поперечного діаметра ділянок ураження |
| Прогресування захворювання | Поява нових або збільшення більше ніж на 20% старих вогнищ ураження |
При досягненні повної, часткової регресії пухлини, а інколи і при стабілізації процесу після 4 курсів НПХТ за схемою CАР з або без МТ виконували радикальне оперативне втручання. При прогресуванні захворювання змінювали схему НПХТ.
Після проведення повного комплексу неоад’ювантного лікування та виконання оперативного втручання проводили повне морфологічне дослідження післяопераційного матеріалу з оцінкою лікувального патоморфозу та ОЧЖПТ.
Результати
Оцінку токсичності лікування проводили згідно з Common Toxicity Criteria NCIC. При аналізі змін показників гемопоезу та функціональних змін слід відмітити, що:
- анемію І ступеня тяжкості виявляли у 11,1% хворих основної та 15,6% контрольної групи, анемія ІІ ступеня розвинулася у 16,7% хворих основної групи та у 9,9% — в контролі, анемія ІІІ ступеня визначалася у 2,8% пацієнток в контролі;
- лейкопенію І ступеня тяжкості спостерігали в основній групі в 16,7% пацієнток, у хворих контрольної групи — у 37,5%, лейкопенію ІІ ступеня відмічали у 8,3% хворих основної групи та у 9,4% — в контролі.
Дослідження змін показників гемопоезу, функції печінки та нирок виявило можливість проведення курсів ПХТ з використанням схеми CАР без значних порушень лабораторних показників.
Нудота, блювання І–ІІ ступеня виникали у 47,2% пацієнток основної та у 75% — контрольної групи на 1–3-тю добу після курсу ПХТ. Усім пацієнткам як препарати супроводу доводилося застосовувати антиеметичні засоби. Діарея І–ІІ ступеня відмічена у 16,7% хворих в основній групі та у 46,9% — у контролі. Алопеція ІІ–IV ступеня розвинулася у 93,5% основної групи та у 93,8% пацієнток в контролі.
Усі пацієнтки основної групи приймали курси НПХТ в означений строк, перерв в лікуванні не зафіксовано, у 2 пацієнток у контролі НПХТ відстрочено на 2 тиж.
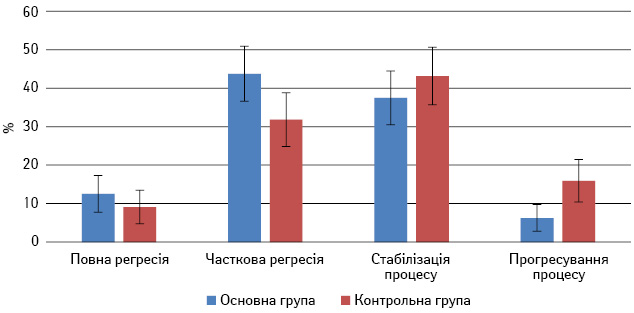
За даними клініко-рентгенологічного дослідження у хворих на МП РГЗ, які отримали ССНПХТ з використанням МТ, повної регресії пухлин досягнуто у 6 (12,50±4,77%) хворих основної та у 4 (9,09±4,33%) — контрольної групи (р>0,05). Часткова регресія пухлини виявлена у 21 (43,75±7,16%) хворої основної та 14 (31,81±7,02%) — контрольної групи (р>0,05). Стабілізацію процесу відмічено у 18 (37,50±8,99%) пацієнток основної групи та 19 (43,18±7,47%) контрольної (р>0,05). Прогресування пухлинного процесу відбулося у 3 (6,25±3,49%) пацієнток основної та у 7 (15,91±5,51%) — контрольної групи (р>0,05) (рис. 7).
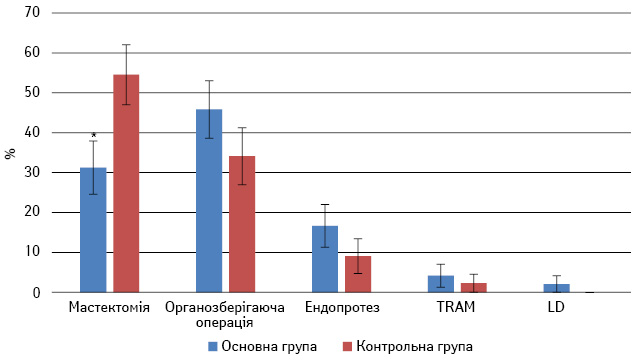
Після аналізу відповіді на неоад’ювантне лікування проводили оперативне втручання. В основній групі мастектомію виконано у 15 (31,25±6,69%) пацієнток, що значно менше, ніж у контрольній — 24 (54,55±7,51%) (р<0,05). Органозберігаючі операції проведено у 22 (45,83±7,19%) хворих основної групи, у контрольній групі — у 15 (34,09±7,15%) (р>0,05). Підшкірна мастектомія з одночасним ендопротезуванням застосована у 8 (16,67±5,38%) хворих основної та у 4 (9,09±4,33%) пацієнток контрольної групи (р>0,05). Реконструкцію TRAM-клаптем виконано у 2 (4,17±2,88%) хворих основної групи та в 1 (2,27±2,25%) пацієнтки в контролі (p>0,05), LD-клаптем — в 1 (2,08±2,06%) пацієнтки основної групи (рис. 8).
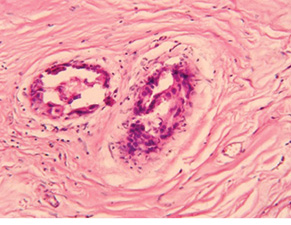
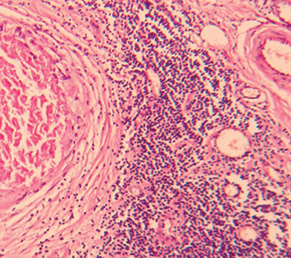
Клінічним прикладом морфологічного дослідження післяопераційного матеріалу з оцінкою лікувального патоморфозу та ОЧЖПТ може бути хвора В., 1972 р.н. з діагнозом: рак правої ГЗ, рT2рN1M0, стан після комбінованого лікування, стадія ІІБ, клінічна група ІІ. Остаточний гістологічний висновок: інфільтруюча карцинома ГЗ з вираженим склерозом (рис. 9), лімфоїдноклітинною інфільтрацією (рис. 10), хронічним гранулематозним запальним процесом, ксантоматозом. ОЧЖПТ 2,1±0,1%. У ЛВ метастази не виявлені. Виражений лікувальний патоморфоз.
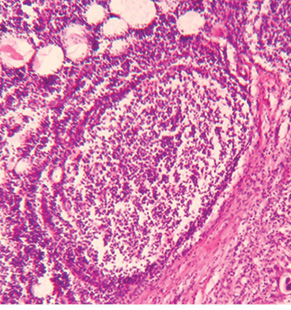
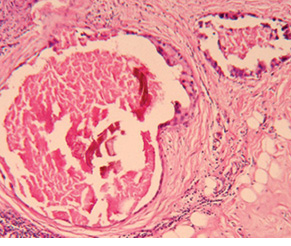
Хвора М., 1969 р.н. Діагноз: рак правої ГЗ, стан після ССНПХТ. Інфільтруюча карцинома ГЗ з вираженим склерозом, лімфоїдноклітинною інфільтрацією, некрозами, крововиливами. ОЧЖПТ 5,3±0,8%. В 1 з 9 ЛВ метастаз карциноми (рис. 11). Виражений лікувальний патоморфоз (рис. 12).
Висновки
1. Визначено, що використання МТ із ССНПХТ при лікуванні хворих на МП РГЗ дозволяє збільшити кількість випадків повної та часткової регресії пухлини на 15,34%.
2. Доповнення ССНПХТ сеансами МТ дає можливість на 23,3% зменшити кількість мастектомій за рахунок збільшення на 11,74% органозберігаючих хірургічних втручань та на 11,55% — реконструктивно-відновних операцій.
3. Застосування неоад’ювантної терапії за розробленою технологією при комплексному лікуванні хворих на МП РГЗ не супроводжується збільшенням кількості побічних явищ після НПХТ та післяопераційних ускладнень.
4. Отримані результати свідчать про ефективність та перспективність розробленого методу ССНПХТ при комплексному лікуванні хворих на МП РГЗ та доцільність його використання із застосуванням МТ.
Список використаної літератури
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2017) Рак в Україні, 2015–2016. Захворюваність, смертність, виживаність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 18. С. 123.
2. ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up Primary breast cancer August 2013, ESO-ESMO 2nd International Consensus Guidelines for advanced breast cancer (ABC2). Aug. 2014.
3. Семиглазов В.Ф. (2008) Неоадъювантное и адъювантное лечение рака молочной железы. М.: 288 с.
4. American Joint Committee on Cancer (2002) AJCC Cancer Staging Manual. 6th ed. Chicago, Ill: Springer-Verlag: 257–280.
5. Гарбуков Е.Ю., Слонимская Е.М., Красулина И.А. (2005) Неоадъювантная химиотерапия при раке молочной железы. Сиб. онкол. журн., 2: 14.
6. Донских Р.В., Семиглазов В.Ф., Семиглазов В.В. и др. (2007) Неоадъювантное лечение рака молочной железы. Маммология, 1: 34–38.
7. Возный Э.К., Добровольская Н.Ю. (2006) 15-летний опыт комплексного лечения больных местно-распространенным раком молочной железы с использованием неоадъювантной химиотерапии. Х Российский онкологический конгресс: материалы конгресса. 21–23 ноября 2006 г., Москва: 64–66.
8. Бондар Г.В., Сєдаков І.Є., Шлопов В.Г. (2005) Первинно-неоперабельний рак молочної залози. Д.: Каштан. 347 с.
9. Rakha E.A., Reis-Filho J.S., Baehner F. et al. (2010) Breast cancer prognostic classification in the molecular era: the role of histological grade. Breast Cancer Res., 12(4): 207.
10. Смоланка И.И., Скляр С.Ю., Иванкова О.Н. та ін. (2013) Ефективність неоад’ювантної поліхіміотерапії у хворих на рак грудної залози. Лікувальний патоморфоз, 2(10): 545.
11. Смоланка І.І., Скляр С.Ю., Досенко І.В. та ін. (2012) Безпосередні результати комплексного лікування хворих на місцево поширений рак грудної залози при використанні радіочастотної гіпертермії. Науковий вісник Ужгородського університету, 1(43): 111–117.
12. Смоланка И.И., Югринов О.Г., Досенко И.В., Ляшенко А.А. (2013) Безпосередні результати комплексного лікування хворих на місцево-поширений рак грудної залози із застосуванням системно-селективної неоад’ювантної поліхіміотерапії. Клин. онкол., 1(9): 44–48.
13. Сивак Л.А., Смоланка І.І., Орел В.Е. та ін. (2017) Магнітотермія злоякісних новоутворень. Клин. онкол., 2(26): 66–70.
Непосредственные результаты комбинации системно-селективной неоадъювантной полихимиотерапии и магнитотермии в комплексном лечении больных местно-распространенным раком грудной железы
Национальный институт рака, Киев
Резюме. В исследовании проанализированы результаты лечения 92 больных местно-распространенным раком грудной железы с применением стандартных и разрабатываемых методик неоадъювантной полихимиотерапии. Разработанная методика лечения больных местно-распространенным раком грудной железы с применением системно-селективной неоадъювантной полихимиотерапии с использованием магнитотермии способствует достоверному увеличению объективного ответа опухоли на лечение — позволяет увеличить на 15,34% количество случаев полной и частичной регрессии первичной опухоли по критериям RECIST. Разработанный метод позволяет на 11,74% увеличить процент проведения органосохраняющих и на 11,55% — реконструктивно-восстановительных оперативных вмешательств.
рак грудной железы, комплексное лечение, неоадъювантная полихимиотерапия, внутриартериальная полихимиотерапия, магнитотермия, органосохраняющие операции, непосредственные результаты лечения, качество жизни больных.














Leave a comment