Оцінка результатів неоад’ювантного лікування хворих на місцево-поширений рак грудної залози при використанні радіочастотної гіпертермії
Досенко І.В., Лобода А.Д., Тарасова Т.О., Смоланка І.І., Скляр С.Ю.
Резюме. Проведено дослідження ефективності використання радіочастотної гіпертермії в неоад’ювантному режимі при лікуванні хворих на місцево-поширені форми раку грудної залози. Результати дослідження оцінювали за критеріями RECIST та при вивченні лікувального патоморфозу. Визначено, що додавання радіочастотної гіпертермії до стандартних методів неоад’ювантного лікування хворих на рак грудної залози дозволило на 13,4% збільшити відсоток проведення органозберігаючих операцій та 14,5% хворих провести відновні операції завдяки збільшенню кількості випадків часткової регресії пухлини на 13,3% та регресії метастатичних лімфовузлів на 14,9%.
ВСТУП
 Останнім часом у клінічній онкології велике значення надають якості життя пацієнток після проведеного комплексного лікування, яке напряму залежить від ефективності останнього. Особливу увагу приділяють комплексу протипухлинних системних заходів із застосуванням неоад’ювантної поліхіміотерапії (НПХТ) для покращення результатів лікування, збільшення кількості радикальних органозберігаючих операцій (ОЗО) та можливості проведення реконструктивних операцій [3]. Усе більшого розповсюдження набувають фактори, що модифікують ПХТ, чим посилюють цитостатичну дію хіміопрепаратів та сприяють подоланню резистентності до них [6, 7, 11].
Останнім часом у клінічній онкології велике значення надають якості життя пацієнток після проведеного комплексного лікування, яке напряму залежить від ефективності останнього. Особливу увагу приділяють комплексу протипухлинних системних заходів із застосуванням неоад’ювантної поліхіміотерапії (НПХТ) для покращення результатів лікування, збільшення кількості радикальних органозберігаючих операцій (ОЗО) та можливості проведення реконструктивних операцій [3]. Усе більшого розповсюдження набувають фактори, що модифікують ПХТ, чим посилюють цитостатичну дію хіміопрепаратів та сприяють подоланню резистентності до них [6, 7, 11].
Історія використання гіпертермії в онкології становить більше 40 років, але систематизованого характеру вона набула у 90-х роках XX століття. Так, у 1999 р. на Європейській конференції з гіпертермічної онкології в Роттердамі (Голландія) було представлено результати 10 досліджень з ефективності комбінованого гіпертермічного та хіміотерапевтичного лікування ряду пухлин, включаючи рак грудної залози (РГЗ). Останніми роками радіочастотна гіпертермія (РГТ) стала загальновизнаним і досить широко розповсюдженим методом підвищення ефективності лікування пухлин. РГТ застосовують безпосередньо під час або після проведення хіміо- та променевого лікування при резистентних формах злоякісних новоутворень [5, 8]. Не є винятком і застосування РГТ як компонента неоад’ювантного методу лікування хворих на місцево-поширений (МП) РГЗ [5, 10].
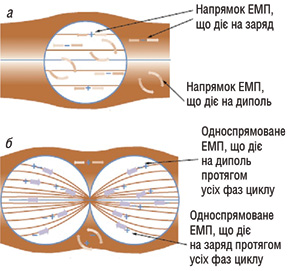
Відомо, що при температурах 38–42°С в тканинах організму підвищується мікроциркуляція біологічних рідин, тому поряд із достатньо широким використанням класичної РГТ (температура підвищується до 42–46°С) в якості синергетичного гіпертермічного фактора нагріву пухлин зараз почали застосовувати і помірну фізіологічну РГТ — магнітотермію (індуктотермію). В останньому випадку внаслідок дії електричної компоненти електромагнітного поля (ЕМП) ініціюється не лише помірний тепловий фактор впливу, а й дія магнітної компоненти. Також використовують просторово неоднорідне магнітне поле, яке ініціює орієнтацію іонів та диполів біологічних тканин переважно у напрямку градієнтів ізоліній вздовж електрично поляризованих міжклітинних місточків та тубулінових мікротрубочок злоякісних клітин на стадії поділу. Усередині клітин у стані спокою поле однорідне, і дія електромагнітних сил полягає тільки у «вібрації» іонів і диполів (сили, пов’язані з кожною фазою циклу, позначені стрілками) (рис. 1). На відміну від клітин, що діляться (б), в яких неоднорідне поле індукує сили, що спрямовують усі диполі до місця поділу, цей ефект селективно пришвидшує активний транспорт препаратів через мембрану усередину злоякісної клітини (див. рис. 1). Внаслідок чого підсилюється руйнування цитоскелету та органоїдів, зростає вірогідність селективної загибелі злоякісних клітин [6, 8, 12].
Раніше проведені дослідження на резистентних експериментальних моделях пухлин до препаратів доксорубіцину та цисплатину показали, що РГТ внаслідок опромінення неоднорідним ЕМП більш суттєво знижує резистентність пухлин [9]. Проте клінічні аспекти РГТ при лікуванні хворих на РГЗ ще не були вивчені, ефективність гіпертермії в онкології досліджена недостатньо. Враховуючи значну розповсюдженість хіміорезистентних форм пухлин та обмежену кількість робіт, присвячених застосуванню РГТ при лікуванні РГЗ, було проведено дослідження із визначення доцільності її застосування в якості модифікатора цитостатичної дії ПХТ.
Метою дослідження було підвищити ефективність лікування та покращити якість життя хворих на РГЗ шляхом розробки та оптимізації методик лікування, спрямованих на збереження органа.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
У роботі проаналізовано безпосередні результати комплексного лікування 127 хворих на МП РГЗ IIБ–IIIА стадії. Вік хворих, що були включені у дослідження, коливався від 29 до 65 років. Основна група досліджених (63 пацієнтки) складалася з хворих на МП РГЗ, при комплексному лікуванні яких в неоад’ювантному режимі застосовували ПХТ на фоні РГТ. Контрольна група (64 пацієнтки) отримувала комплексне лікування з НПХТ у стандартному режимі. У всіх хворих діагноз був верифікований методом тонкоголкової біопсії або трепан-біопсії.
Кожній хворій проводили стандартне клініко-лабораторне обстеження, рентгенологічні дослідження: мамографію в прямій та боковій проекціях, аксилографію, комплексне ультразвукове дослідження (УЗД) грудної залози (ГЗ) та регіонарних лімфатичних вузлів (ЛВ), комп’ютерну томографію органів грудної та черевної порожнини, малого тазу, електрокардіограму. Розподіл хворих на РГЗ залежно від стадії захворювання був однорідним в обох групах (табл. 1).
Таблиця 1 Розподіл хворих на РГЗ залежно від стадії захворювання
| Стадія захворювання | Основна група n, (%) | Контрольна група n, (%) | р |
|---|---|---|---|
| IІВ (T2-3N0-1M0) | 40 (63,5±6,1) | 43 (67,2±5,9) | р>0,05 |
| IIIА (T2-3N1-2M0) | 23 (36,5±6,1) | 21 (32,8±5,9) | р>0,05 |
| Всього | 63 (100,0) | 64 (100,0) |
У дослідження включали хворих на РГЗ IІВ (T2-3N0-1M0) та IIIА (T2-3N1-2M0) стадії захворювання, що належать до МП форм захворювання, при яких раніше органозберігаючі та реконструктивно-відновні операції не проводили, а виконували розширені мастектомії, що значно погіршувало якість життя пацієнтів.
За гістологічною структурою найбільш часто мала місце інфільтруюча часточково-протокова карцинома: в основній групі — у 35 хворих (55,6±6,3%), у контрольній — у 37 (57,8±6,2%) (p>0,05). Інфільтруючу протокову карциному в основній групі діагностовано у 15 (23,8±5,4%) пацієнток, у контрольній — у 16 (25,0±5,4%) (p>0,05). Медулярну карциному відзначають у 5 (7,9±3,4%) хворих основної та у 5 (7,8±3,4 %) хворих контрольної групи (p>0,05), слизову карциному — у 4 (6,3±3,1%) хворих основної та у 6 (9,4±3,6%) хворих контрольної групи (p>0,05). У 4 (6,3±3,1%) хворих основної групи гістологічна структура пухлини в ГЗ залишилася невизначеною у зв’язку з майже повною регресією (ПР) після проведеного до операції лікування. Різниця відсотків хворих за різними морфологічними типами пухлин в обох досліджуваних групах була недостовірною.
Після встановлення та верифікації діагнозу всіх хворих було рандомізовано на 2 групи: хворі контрольної групи отримали 4 курси НПХТ за схемою FAC з інтервалом 3 тиж. Хворим основної групи проводили 4 курси НПХТ за схемою FAC, але на фоні РГТ, за допомогою апарата «Магнітерм». Опис та рисунки проведення НПХТ за зазначеним методом наведено в попередніх публікаціях [4].
На термограмах показано результати підвищення температури на поверхні тіла при проведенні гіпертермії (рис. 2)
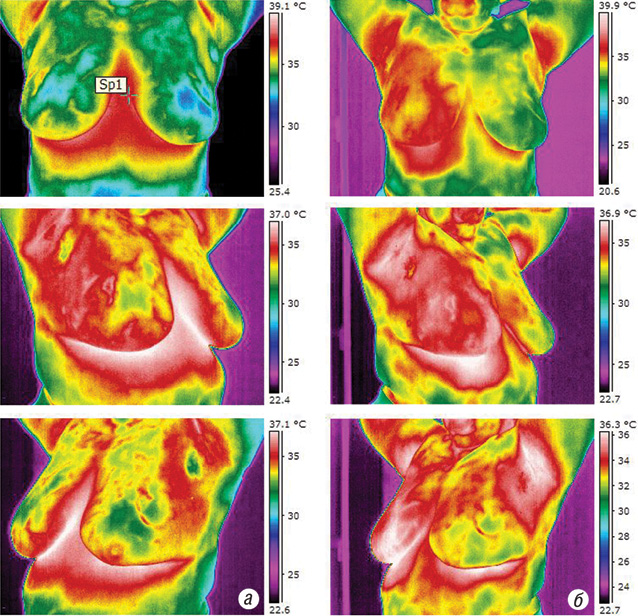
З метою оцінки ефективності НПХТ усім хворим проводили комплексне УЗД ГЗ і регіонарних ЛВ. УЗД проводили на цифровому допплерівському ультразвуковому діагностичному комплексі «ULTIMA» у масштабі реального часу. Перший етап обстеження включав безпосередні дослідження до початку проведення лікування, другий проводили після закінчення сеансу РГТ.
Через 3 тиж після останнього курсу ПХТ проводили мамографічне та ультразвукове дослідження ГЗ та регіонарних ЛВ з метою аналізу результатів лікування хворих обох груп, після чого проводили радикальне оперативне втручання та подальше ад’ювантне лікування згідно з рекомендаціями стандартів лікування МОЗ України. Оцінку ефективності НПХТ проводили за критеріями RECIST з використанням мамографії у фронтальній та сагітальній проекціях та УЗД. Залежно від відсотка регресії пухлини оцінювали такі параметри: ПР, часткову регресію (ЧР), стабілізацію процесу або прогресування. Обсяг оперативного втручання обирали на підставі отриманих даних клінічної ефективності передопераційної терапії з урахуванням результатів інтраопераційного визначення меж резекції (проведення експрес-біопсії країв резекції під час операції). У випадках стабілізації чи прогресування хвороби пацієнткам було проведено мастектомію за Маденом з або без одномоментної реконструкції ГЗ. У випадках ПР чи ЧР пухлини та досягненні чистоти меж резекції пацієнткам було проведено ОЗО — квадрантектомію з регіонарною лімфодисекцією або (при розташуванні пухлини в центральному квадранті чи за наявності мультицентричних вогнищ мікрокальцинатів) підшкірну мастектомію з одномоментним ендопротезуванням. Хворим, у яких інтраопераційно не було досягнуто чистоти меж резекції, проводили мастектомію за Маденом або підшкірну мастектомію з одномоментним ендопротезуванням.
Після операції з метою оцінки проведеного передопераційного лікування в обох досліджених групах вивчали лікувальний патоморфоз (комплекс альтернативно-деструктивних порушень паренхіми та строми пухлини під дією передопераційної протипухлинної терапії), який визначають для оцінки ефективності певного виду неоад’ювантної терапії. Така оцінка має суттєве значення для оптимізації схем подальшого ад’ювантного лікування. Вивчення лікувального патоморфозу дає об’єктивну оцінку пошкодження пухлини, видаленої після специфічного протипухлинного лікування, що відображається достовірно-кількісними ознаками, а саме: зростанням об’єму девіталізованої пухлинної паренхіми, збільшенням об’ємної частки строми та некрозів як за глибиною, так і за довжиною.
Особливо актуальною проблемою клінічної онкології стає морфологічна оцінка чутливості пухлини до неоад’ювантної терапії, яка визначається при аналізі операційного матеріалу видалених пухлин та відображається у зміні об’ємної частки життєздатної пухлинної тканини (ОЧЖПТ) при лікувальному патоморфозі. З точки зору морфологічної онкології доцільність передопераційної терапії полягає в досягненні структурних пошкоджень пухлинних клітин, завдяки чому гальмується пухлинний ріст і зменшується проліферативний та інвазивний потенціал агресивного пула пухлин, що сприяє зниженню рецидивного та метастатичного ризику в післяопераційний період.
У нашому дослідженні оцінку терапевтичного патоморфозу проводили за допомогою методу гістостереометрії з використанням окулярної тест-сітки Автанділова [1]. Після операції у кожної хворої в обох групах проводили кількісно-якісну оцінку терапевтичного патоморфозу пухлин, індукованих передопераційною протипухлинною терапією, з метою оцінки проведеного лікування та корекції подальшого протипухлинного лікування. Гістологічні препарати виготовляли з тканин центральної, проміжної та периферійної зон пухлини після дії на неї ПХТ. При підрахунках визначали ОЧЖПТ в серійних зрізах. Вивчення мікропрепаратів здійснювали на мікроскопі виробництва Zeiss «Axiostar (Plus)» під малим (об’єктив ×10, окуляр ×10), а потім під великим (об’єктив ×40, окуляр ×7) збільшенням. У кожному зрізі під мікроскопом вивчали 11 полів зору (стандартне збільшення 280). Для кількісних критеріїв обліку загибелі пухлинної паренхіми, індукованої протипухлинною терапією, використовували схему-шкалу оцінки лікувального патоморфозу за операційним матеріалом [2].
Аналіз безпосередніх результатів проведеного лікування базувався на клінічних, рентгенологічних RECIST-критеріях (Response evaluation criteria in solid tumor) та морфологічних даних. Статистичний аналіз вірогідності отриманих даних проводили за допомогою t-критерію Стьюдента, використовуючи комп’ютерну програму Statistica 6.0 з попередньою перевіркою гіпотези про нормальний закон розподілу випадкової величини за критерієм Колмогорова — Смірнова. Статистичну обробку даних також проводили в MS Excel 7.0, використовуючи функції описової статистики та двовибірковий t-тест з різними дисперсіями для визначення вірогідності випадкових розбіжностей (р).
РЕЗУЛЬТАТИ
Безпосередні результати лікування оцінювали у 127 хворих на МП РГЗ через 3 тиж після закінчення НПХТ. Усі пацієнтки дослідної групи приймали курси НПХТ у визначений строк, перерв у лікуванні не відмічено. При аналізі показників гематологічної токсичності та зміни функції печінки та нирок у досліджуваних не було виявлено достовірних відмінностей між основною та контрольною групами хворих. Виявлені зміни показників гемопоезу, функції печінки не були лімітуючими факторами для застосування поряд із класичною схемою FAC схеми FAC із сеансами РГТ при проведенні неоад’ювантної терапії в комплексному лікуванні хворих на МП РГЗ.
За даними клініко-рентгенологічного дослідження, ПР пухлин характеризувалася зменшенням її розмірів до встановлення нормальної зональної анатомії, однорідністю ультразвукового сигналу. Набряк та інфільтрація шкіри, кровоносна мережа пухлин протягом лікування повністю зникали. ПР пухлин виявлено у 4 (6,3±3,1%) пацієнток основної групи та у 2 (3,1±2,2%) хворих контрольної групи (p>0,05).
При ЧР відзначали зменшення пухлини більше ніж на 30% порівняно з початковими даними, відбувалася її структурна перебудова, але ще залишалися гіпоехогенні ділянки, зменшувалися розміри ЛВ. ЧР пухлини виявлено у 31 (49,2±6,3%) хворого основної групи та у 23 (35,9±6,0%) пацієнтів контрольної (р<0,05). Стабілізацію процесу виявлено у 24 (38,1±6,1%) пацієнток основної групи та у 35 (54,7±6,2%) контрольної (р<0,05). Прогресування пухлинного процесу виявлено у 4 (6,3±3,1 %) основної та у 5 (7,8±3,4 %) пацієнток контрольної групи (табл. 2).
Таблиця 2 Безпосередні результати лікування хворих на РГЗ за критеріями RECIST
| Відповідь пухлини на лікування (за критеріями RECIST) | Основна група n (%) | Контрольна група n (%) | р |
|---|---|---|---|
| ПР | 4 (6,3±3,1) | 2 (3,1±2,2) | р>0,05 |
| ЧР | 31 (49,2±6,3) | 23 (35,9±6,0) | р<0,05 |
| Стабілізація процесу | 24 (38,1±6,1) | 35 (54,7±6,2) | р<0,05 |
| Прогресування процесу | 4 (6,3±3,1) | 5 (7,8±3,4) | р>0,05 |
| Всього | 63 (100%) | 64 (100%) |
Регресію метастатично уражених регіонарних ЛВ відзначали у 35 (55,6±6,3%) пацієнток основної групи та у 26 (40,6±6,1 %) хворих контрольної групи (p<0,05). Результати оцінки ефективності НПХТ наведено на рис. 3.

Після аналізу відповіді на неоад′ювантне лікування проводили оперативне втручання. При позитивному ефекті лікування можливим було проведення органозберігаючого лікування, при стабілізації процесу переважно проводили мастектомію за Маденом, при прогресуванні — більш розширені операції.
ОЗО було проведено 37 (58,7±6,2%) хворим основної групи та 29 (45,3±6,2%) контрольної (р<0,05). Реконструкція TRAM-клаптем виконана у 5 (7,9±3,4%) хворих основної групи та у 3 (4,7±2,6%) пацієнток в контрольній (p>0,05). Підшкірну мастектомію з одночасним ендопротезуванням проведено 12 (19,0±4,9%) хворим основної групи та 5 (7,8±3,4%) пацієнткам контрольної групи (р<0,05).
Вивчення особливостей патоморфозу дозволило визначити глибину та характер змін у новоутворенні під впливом різних схем НПХТ, оцінити її спрямованість. Отримані усереднені статистичні дані вивчення показників, які характеризують патоморфоз у 29 хворих на МП РГЗ в основній групі, у якій проводили НПХТ за традиційними схемами із застосуванням РГТ, свідчать про значення ОЧЖПТ у межах 24,4±0,2%. У контрольній групі хворих, які отримували НПХТ тільки за традиційними схемами, значення ОЧЖПТ становило 35,4±0,25%.
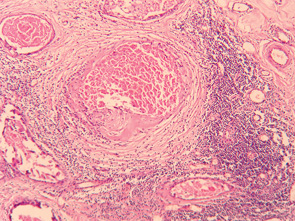
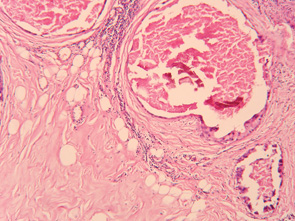
Результати проведених спостережень свідчать про наявність значного пошкоджуючого ефекту (достовірне зменшення об’ємної частки пухлинного компонента НПХТ) при застосуванні РГТ та про доцільність використання даного методу лікування. Морфологічний аналіз гістопрепаратів операційного матеріалу хворих на МП РГЗ в основній групі показав, що для клітинних елементів пухлин були характерними різко виражений поліморфізм, гіперхроматоз ядер, пошкодження внутрішньоядерних субстанцій, зернистість цитоплазми. При дослідженні післяопераційного препарату спостерігали різні розмір та форму пухлинних клітин, набряк цитоплазми, стирання меж між пухлинними клітинами, збільшення ядерно-цитоплазматичного співвідношення, порушення клітинної полярності, розростання зрілої грубоволокнистої фіброзної тканини, яка заміщала некротизовану пухлину, круглоклітинну інфільтрацію строми, осередки гемосидерозу, грануляційну тканину та зони звапніння. Виявлено різке потовщення та склероз стінок судин різного калібру з явищами гіалінозу, а також повну облітерацію їх просвіту, виникнення судин синусоїдного типу. У жировій клітковині зустрічалися крововиливи, незначні за площею та об’ємом, і повнокров’я судин. Суттєвих відмінностей лікувального патоморфозу пухлин ГЗ з різними варіантами та різним клітинним диференціюванням після використання НПХТ та РГТ не було виявлено.
Після проведення НПХТ із застосуванням РГТ чітко виявлявся взаємозв’язок між порушенням мікроциркуляції в тканині пухлини та її пошкодженням, мали місце стаз, садж-синдром, мікротромбози та спонтанні деструктивні зміни в пухлинах, які займали до 30% площі неоплазми, збільшувалася чисельність патологічних мітозів та фігур апоптозу. Ступінь розповсюдження некрозу не змінювався залежно від розмірів пухлини та мітотичної активності пухлинних клітин.
Враховуючи отримані усередненні статистичні дані, можна констатувати, що у хворих після модифікованої ПХТ (НПХТ за традиційними схемами із застосуванням РГТ) спостерігався більш виражений патоморфоз та найменший ОЧЖПТ, а також суттєва клітинна інфільтрація строми, яка є сприятливим прогностичним фактором (рис. 4). Параметри оцінки характеру та ступеня запальної реакції в залишковій пухлині (осередкова або дифузна) дозволяли чітко відобразити стан захисних сил організму. Також мало місце відокремлення агресивного пула зі зниженням його проліферативного, інвазивного та метастатичного потенціалу, що є важливим для зниження частоти виникнення та розповсюдження післяопераційної пухлинної дисемінації клітин імплантаційним, гематогенним та лімфогенним шляхом. У пухлині відбувалися зміни паренхіматозно-стромального співвідношення у бік строми (рис. 5); тромбування судинного русла запобігало дисемінації пухлинних клітин та знижувало ризик метастазування в післяопераційний період, а також у віддалені строки після лікування (рис. 6).
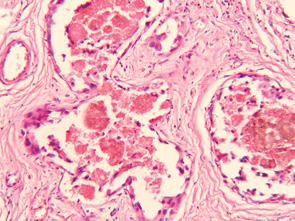
Ці результати свідчать про ефективність та перспективність даного методу лікування для хворих МП РГЗ.
Вираженість лікувального патоморфозу в пухлині, що був індукований неоад’ювантною терапією, є важливим прогностичним фактором рецидивування. Відомо, що хворі з незначним лікувальним патоморфозом пухлини мають поганий прогноз, після лікування виникає велика ймовірність розвитку віддалених метастазів.
На виникнення рецидиву значно впливає відстань від краю пухлини до місця резекції та ОЧЖПТ. При вивченні лікувального патоморфозу хворі з високим ризиком рецидиву та метастазування можуть бути ідентифіковані на ранніх етапах лікування (при визначенні його низької ефективності), що дозволить планувати адекватне ад’ювантне лікування. Проводячи верифікацію та оцінюючи ступінь патоморфозу, онкоморфолог може впливати на корекцію подальшого індивідуального лікування у конкретного хворого, внаслідок чого можуть підвищитися ефективність лікування та збільшитися строки виживаності.
Таким чином, результати проведеного дослідження свідчать про ефективність, перспективність та доцільність використання методу модифікованої НПХТ із застосуванням РГТ при комплексному лікуванні хворих на МП РГЗ.
ВИСНОВКИ
1. Проведення НПХТ з використанням РГТ при комплексному лікуванні хворих на МП РГЗ сприяє вірогідному збільшенню об’єктивної відповіді пухлини на лікування (дозволяє збільшити на 13,3% кількість випадків ЧР первинної пухлини та на 14,9% регресію метастатичних ЛВ).
2. Застосування неоад’ювантної терапії з використанням НПХТ на фоні РГТ дозволяє на 13,4% збільшити відсоток проведення ОЗО та на 14,5% реконструктивно-відновних операцій.
3. Вивчення лікувального патоморфозу у хворих, які отримують індуковану неоад’ювантну протипухлинну терапію, є необхідним критерієм оцінки ефективності лікування та прогнозування перебігу захворювання та ймовірності рецидивування.
ЛІТЕРАТУРА
1. Автандилов Г.Г. (1990) Медицинская морфометрия. М., Медицина, 383 с.
2. Галахин К.А., Курик Е.Г. (2000) Лечебный патоморфоз злокачественных опухолей пищеварительного тракта. К. Книга плюс, 176 с.
3. Семиглазов В.Ф., Семиглазов В.В., Клетсель А.Е. (2008) Неоадъювантное и адъювантное лечение рака молочной железы. М., МИА, 287 с.
4. Смоланка І.І., Орел В.Е., Скляр С.Ю. та ін. (2011) Використання радіочастотної гіпертермії для підвищення ефективності комплексного лікування хворих на місцево-поширений рак грудної залози. Клиническая онкология, 2(2) / ООО «Морион»: 42–46.
5. Щепотін І.Б., Чешук В.Є., Мотузюк І.М. та ін. (2005) Результати застосування неоад’ювантної поліхіміотерапії в комбінації з локальною гіпертермією при лікуванні хворих на рак молочної залози. Науковий вісник Національного медичного університету ім. О.О. Богомольця, 3–4: 73–78.
6. Ellegala D.B., Leong-Poi H., Carpenter J. E. et al. (2003) Imaging Tumor Angiogenesis With Contrast Ultrasound and Microbubbles Targeted to αvß3Circulation,108: 336.
7. Baish JW, Stylianopoulos T, Lanning RM, Kamoun WS, Fukumura D, Munn LL, Jain RK. Scaling rules for diffusive drug delivery in tumor and normal tissues.Proc Natl Acad Sci U S A. 2011,1;108(5):1799–803.
8. Kirson E.D., Dbaly D., Tovarys F. et al. (2007) Alternating electric fields arrest cell proliferation in animal tumor models and human brain tumors, Proc Natl Acad Sci U S A, 104: 10152–7.
9. Long G.G., Kimmick B.J., Shelton L.D. et al. (2002)Long-term follow-up of a phase II trial studying a weekly doxorubicin-based multiple drug adjuvant therapy for stage II node-positive carcinoma of the breast. Breast Cancer Res. Treat., 72: 233–243.
10. Orel V.E., Romanov A.V. (2010) The Effect of Spatially Inhomogeneous Electromagnetic Field and Local Inductive Hyperthermia on Nonlinear Dynamics of the Growth for Transplanted Animal Tumors, In T. Evans (Ed), Nonlinear Dynamics, INTECH, Сhroatia, 285–308.
11. Song C.W., Park H.J., Lee C.K., Griffin R. (2005) Implications of increased tumor flow and oxygenation caused by mild tempreture hyperthermia in tumor treatment. International Journal of Hyperthermia, 8(21): 761–767.
12. Palti Y. (2007) Management of Recurrent or Progressive Glioblastoma Multiforme with Low-intensity, Medium-frequency Alternating Electric Fields. Touch briefings 2007, European oncological disease, 88–89.
Оценка результатов неоадъювантного лечения больных местно-распространенным раком грудной железы при использовании радиочастотной гипертермии
Национальный институт рака, Киев
Резюме. Изучена эффективность использования радиочастотной гипертермии в неоадъювантном режиме при лечении больных местно-распространенными формами рака грудной железы. Результаты исследования оценивали по критериям RECIST. Определено, что добавление радиочастотной гипертермии к стандартным методам неоадъювантной терапии больных раком грудной железы позволило на 13,4% увеличить процент проведения органосохраняющих операций и у 14,5% больных провести восстановительные операции благодаря увеличению количества случаев частичной регрессии опухоли на 13,3% и регрессии метастатических лимфоузлов на 14,9%.
Ключевые слова: рак грудной железы, магнитотермия, термохимиотерапия, комплексное лечение, неоадъювантная полихимиотерапия, органосохраняющие операции, качество жизни больных, радиочастотная гипертермия.
Evaluation of results neoadjuvant treatment of patients with locally advanced breast cancer using radiofrequency zhilizy hyperthermia
National Cancer institute, Kyiv
Summary. The method of neoadjuvant chemotherapy supplemented with local radio-frequency hyperthermia in the treatment of patients with locally advanced breast cancer. Using this method in complex therapy of patients with breast cancer increase to 13,3%, partial regression of primary tumor and to 14,9% regression of metastatic lymph nodes. Increase on 13,4% of conserved surgery, and in 14,5% of patients to restorative surgery.
Key words: breast cancer, local hyperthermia, thermоchemotherapy, combined treatment, neoadjuvant chemotherapy, conserved surgery, quality of life of patients.














Leave a comment