Клінічний випадок лікування пацієнта з меланомою з використанням чекпойнт-інгібітора пембролізумабу (анти-PD-1 моноклональних антитіл)
Резюме. У статті ми представляємо клінічний випадок пацієнта з метастатичною меланомою. Пацієнт отримував лікування імунним чекпойнт-інгібітором пембролізумабом. Доза препарату Кітруда становила 2 мг/кг (загальна доза 200 мг) кожні 3 тиж. У публікації ми обговорюємо тактику спостереження і лікування цього пацієнта. Ми продовжуємо лікування пембролізумабом і пропонуємо стереотаксичну променеву терапію одиночних метастазів в лопатці.
Резюме. В статье мы представляем клинический случай пациента с метастатической меланомой. Пациент получал лечение иммунным чекпойнт-ингибитором пембролизумабом. Доза препарата Китруда® составляла 2 мг/кг (общая доза 200 мг) каждые 3 нед. В публикации мы обсуждаем тактику наблюдения и лечения этого пациента. Мы продолжаем лечение пембролизумабом и предлагаем стереотаксическую лучевую терапию единичных метастазов в лопатке.
 Две терапевтические стратегии значительно улучшили показатели выживаемости пациентов с прогрессирующей меланомой за последние годы: иммунотерапия ингибиторами чекпойнтов и таргетная терапия, блокирующая BRAF и MEK. BRAF- и MEK-ингибиторы показаны 40–50% пациентов, у которых выявляют BRAF V600 мутацию, в то время как иммунотерапия эффективна независимо от BRAF-статуса [1].
Две терапевтические стратегии значительно улучшили показатели выживаемости пациентов с прогрессирующей меланомой за последние годы: иммунотерапия ингибиторами чекпойнтов и таргетная терапия, блокирующая BRAF и MEK. BRAF- и MEK-ингибиторы показаны 40–50% пациентов, у которых выявляют BRAF V600 мутацию, в то время как иммунотерапия эффективна независимо от BRAF-статуса [1].
Иммунотерапевтические препараты, а именно ингибиторы чекпойнтов, стали революционными в лечении многих видов рака, но первый прорыв был достигнут у пациентов с меланомой. Речь идет о так называемых ингибиторах чекпойнтов. Чекпойнт-механизмы, включая CTLA-4 (cytotoxic T-lymphocyte-associated antigen 4 — цитотоксический Т-лимфоцит-ассоциированный антиген 4), подавляющий раннюю Т-клеточную функцию, и механизм PD-1 (programmed death-1 — программированной смерти-1), регулирующий Т-клеточную активность в эффекторную фазу, могут использоваться опухолями для уклонения от иммунного ответа [2].
Ингибиторы чекпойнтов восстанавливают антиопухолевый иммунный ответ и стали основой в лечении рака. Несколько ингибиторов чекпойнтов широко исследуются, включая анти-CTLA-4 моноклональное антитело ипилимумаб и анти-PD-1 моноклональные антитела пембролизумаб и ниволумаб; все они одобрены для лечения прогрессирующей меланомы, демонстрируют клиническую активность и открывают новые возможности лечения [3].
Ипилимумаб — первый одобренный FDA в 2011 г. чекпойнт-ингибитор. С того времени клинический опыт показал, что только у около 20% пациентов с поздними стадиями меланомы наблюдается длительный ответ на ипилимумаб и за это можно заплатить высокой ценой с точки зрения побочных эффектов, потому что ипилимумаб ассоциируется с такими побочными явлениями, как колиты, требующие отмены препарата [4].
В 2014 г. FDA одобрен первый препарат из группы ингибиторов чекпойнтов анти-PD-1 для лечения нерезектабельной и метастатической меланомы — пембролизумаб — высокоселективное гуманизированное моноклональное IgG 4 антитело против PD-1. Блокада PD-1 рецептора препятствует связыванию с лигандами PD-L1/PD-L2 и позволяет сохранить эффекторные функции Т-клеток [5].
В исследовании III фазы KEYNOTE-006 пембролизумаб продемонстрировал значительное превосходство в общей выживаемости, выживаемости без прогрессирования и объективных ответах по сравнению с ипилимумабом (рис. 1) [3].
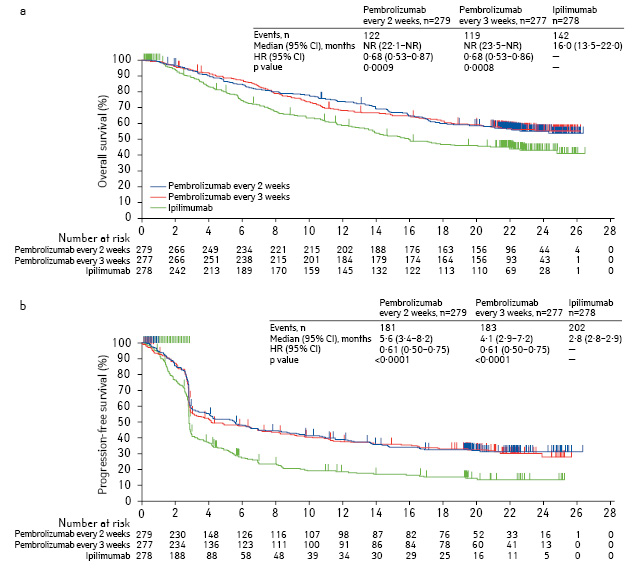
Обновленные данные KEYNOTE-006 представлены Каролин Роберт на ASCO 2017 [6]. В целом, в исследовании приняли участие 834 пациента из 16 стран; 279 из них получали пембролизумаб каждые 2 нед, 277 — пембролизумаб каждые 3 нед, a 278 — ипилимумаб, 80,5% пациентов имели PD-L1-позитивный статус.
Медиана наблюдения на момент анализа составила 33,9 мес.
Медиана общей выживаемости в группе пембролизумаба была в 2 раза выше по сравнению с ипилимумабом, составив 32,3 vs 15,9 мес, медиана без прогрессирования — 8,3 vs 3,3 мес соответственно.
Отдельно стоит отметить, что у 91% пациентов, прекративших лечение пембролизумабом по истечении 2 лет, в рамках дизайна протокола достигнутый частичный или полный ответ сохранялся после прекращения приема пембролизумаба. На момент анализа медиана наблюдения этой когорты пациентов составила 9,7 мес.
Безусловно, большой интерес для клинического онколога с практической точки зрения представляют данные выживаемости пациентов в долгосрочной перспективе.
На EADO 2017 К. Роберт представила данные исследования KEYNOTE-001, I фазы мультикогортного открытого исследования пембролизумаба, в которое были включены 655 пациентов. Целью представленного анализа была оценка выживаемости через 4 года у пациентов, получавших пембролизумаб. Медиана наблюдения на момент анализа составила 43 мес.
4-летняя общая выживаетесь составила 37%, а у пациентов, получавших пембролизумаб в первой линии, — 48% [7]. Можно сделать вывод, что почти половина пациентов, лечившихся пембролизумабом, живы через 4 года. Отдельно была проанализирована когорта пациентов (67 человек), достигших полного ответа и прекративших прием пембролизумаба. Медиана достижения полного ответа — 13 мес (от 3 до 36 мес), медиана времени после прекращения приема пембролизумаба — 16 мес. У 91% пациентов ответ сохранился [7].
Пристальное внимание во всех исследованиях, посвященных эффективности ингибиторов чекпойнтов, уделялось побочным эффектам данных препаратов, так как их воздействие на все системы организма коренным образом отличается от известных побочных эффектов традиционных цитостатических препаратов.
Наиболее часто возникающими побочными эффектами любой степени тяжести у пациентов, принимавших пембролизумаб, были усталость, зуд и сыпь. Побочные эффекты III–IV степени отмечали у 14% пациентов, наиболее частым нежелательным явлением была усталость (1,8% пациентов). Другие побочные эффекты серьезной степени тяжести наблюдались в менее 1% случаев: колиты (n=9; 1%), гипертермия (n=6; 1%) и пневмониты (n=5; 1%). Прекращение лечения в связи с побочными явлениями случилось у 27 пациентов (4%). Иммуноопосредованные побочные эффекты любой степени тяжести: гипотиреоидит (n=49; 7%), пневмонит (n=18; 3%), гипертиреоидит (n=15; 2%), колит (n=11; 2%), тяжелые кожные реакции (n=11; 2%), тиреоидит (n=8; 1%), увеит (n=6; 1%), гепатит (n=4; 1%), гипофизит (n=3; 0,5%), гипопитуитаризм (n=3; 0,5%), нефрит (n=3; 0,5%) и миозит (n=2; 0,3%). Все эти побочные эффекты были I или II степени тяжести, кроме 23 случаев III степени (у 9 пациентов — тяжелые кожные реакции, 7 — колит, 2 — гипертиреоидит и пневмонит, у 1 — гепатит, гипотиреоидит и нефрит) и 3 нежелательных явления IV степени (у 1 пациента — гепатит, гипофизит, нефрит) [5].
По результатам опубликованных данных, монотерапия пембролизумабом является стандартом выбора терапии для пациентов с нерезектабельной и метастатической меланомой [6, 8].
В свете изложенных данных мы хотим представить клинический случай лечения метастатической меланомы с использованием пембролизумаба.
Пациент Ш., 33 года, обратился в нашу клинику в хорошем состоянии, без активных жалоб на момент осмотра. В объективном статусе не отмечалось отклонений: кожные покровы пациента без видимых изменений, периферические лимфоузлы не увеличены ни в одной из групп. В области правой ушной раковины послеоперационный шов. Дыхание везикулярное, определяется над всей поверхностью легких, хрипы не выслушиваются. Живот обычной формы, мягкий, при пальпации безболезненный, увеличения печени или селезенки не отмечается. Периферических отеков нет. Физиологические показатели в норме.
Из анамнеза известно, что в октябре 2015 г. у пациента было удалено 2 образования кожи в области правой ушной раковины. В патогистологической лаборатории по месту жительства одно из образований было диагностировано как эпителиоидный невус, а второе — папилломатозный эндодермальный невус.
До февраля 2017 г. пациент находился в удовлетворительном состоянии, пока на компьютерной томограмме, выполненной по месту жительства, не была диагностирована и подтверждена правосторонняя шейная лимфаденопатия. В марте 2017 г. пациенту произведена эксцизионная биопсия лимфоузла из данного конгломерата. Гистологическое заключение, полученное в одной из лабораторий, свидетельствовало в пользу метастаза светлоклеточной опухоли.
Пациент обратился в нашу клинику для пересмотра гистологических препаратов и уточнения диагноза. Ревизия препаратов в референтной патогистологической лаборатории подтвердила следующий диагноз: первое образование представляло собой полипоидный дермальный невус, а второе — полипоидную злокачественную меланому с инвазией более 1 мм. В удаленном лимфоузле (март 2017 г.) также выявлен метастаз эпителиоидной злокачественной меланомы.
После подтверждения гистологического диагноза у пациента выполнено базовое ПЭТ-КТ-исследование.
При метаболической ПЭТ-КТ, произведенной для оценки распространенности поражения известной злокачественной меланомой, выявлено единичное поражение правой лопатки в виде метаболически активного литического очага (рис. 2). Других патологических изменений, которые бы свидетельствовали в пользу метаболически активного неопластического поражения, на момент базового сканирования не отмечено.
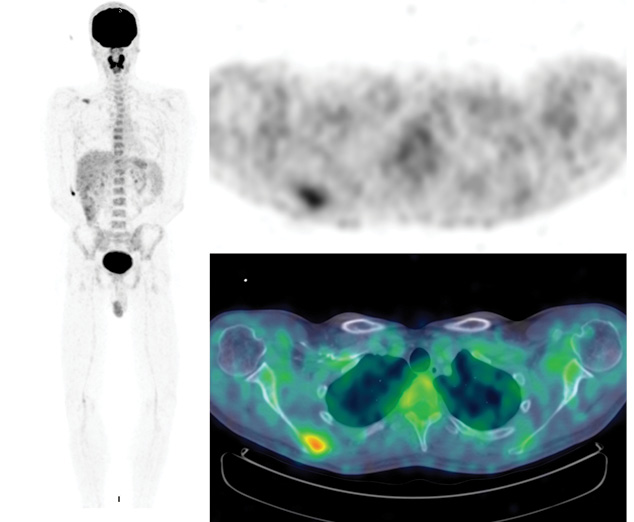
Согласно полученным данным гистологического исследования и данным ПЭТ-КТ-исследования установлен диагноз: меланома правой ушной раковины T3N1M1 с метастазами в шейные лимфоузлы и в правую лопатку.
После исследования BRAF статуса у пациента выявлена BRAF-мутация экзона 15: p.V600E; c.1799T>A.
В соответствии с рекомендациями NCCN (NCCN Guidelines Melanoma Version 1.2017), для пациента в первую очередь рассматривали 2 варианта лечения: комбинация BRAF + МЕК ингибиторов вемурафениба + кобиметиниба либо пембролизумаб в монотерапии (рис. 3).
 Рис. 3. NCCN Guidelines Melanoma Version 1.2017. Системная терапия при нерезектабельной либо метастатической меланоме [8]
Рис. 3. NCCN Guidelines Melanoma Version 1.2017. Системная терапия при нерезектабельной либо метастатической меланоме [8]Пациенту было предложено начать лечение пембролизумабом 200 мг внутривенной инфузией в течение 30 мин каждые 3 нед.
Таким образом, в апреле 2017 г. пациент получил 1-й цикл лечения пембролизумабом в суммарной дозе 200 мг, а также первую инфузию ибандроновой кислоты в связи с установленным метастатическим поражением лопатки. Лечение продолжалось до 4 введений пембролизумаба на фоне хорошего самочувствия пациента и отсутствия каких-либо отклонений в лабораторных показателях, включая уровень гормонов щитовидной железы (TSH, free T3, free T4).
После 4 циклов лечения пациенту проведено промежуточное ПЭТ-КТ-исследование: сохраняющийся единичный очаг метастатического поражения в правой лопатке, без существенной метаболической динамики, с частичной склеротизацией очага. Появления новых гиперметаболических очагов, которые бы свидетельствовали в пользу новых метастатических поражений или прогрессии заболевания, не выявлено.
Лечение пембролизумабом было продолжено до 8 циклов. При этом у пациента не отмечалось никаких побочных явлений на фоне лечения. В объективном статусе пациента также не зафиксировано изменений. По-прежнему не наблюдалось отклонений от референтных значений гормонов щитовидной железы (TSH, free T3, free T4).
После 8 циклов лечения пациенту проведено второе промежуточное ПЭТ-КТ-исследование, на котором не выявлено изменений по сравнению с предыдущим.
На сегодня пациент получил 12 циклов лечения пембролизумабом. Отмечается минимальная кожная токсичность (I степень) в виде уртикарных высыпаний на коже левого плеча, не требующая применения дополнительных лекарственных препаратов, включая средства, содержащие кортикостероиды. Также пациент продолжает получать бисфосфонаты.
После 12 циклов лечения пембролизумабом пациенту проведено финальное ПЭТ-КТ-исследование: выявлено единичное поражение лопатки без выраженной динамики, по сравнению с базовым сканированием отсутствие новых очаговых изменений, характерных для развития метастатической болезни.
Учитывая сохраняющийся солитарный метастаз в правой лопатке, пациенту было предложено провести стереотаксическое гипофракционное облучение данного очага на фоне продолжения лечения пембролизумабом.
На наш взгляд, результат лечения стоит расценивать как стабилизацию заболевания.
Список использованной литературы
1. McArthur G.A., Ribas A. (2013) Targeting oncogenic drivers and the immune system in melanoma. J. Clin. Oncol., 31(4): 499–506.
2. Pardoll D.M. (2012) The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer, 12: 252–264.
3. Schachter J., Ribas A., Long G.V. et al. (2017) Pembrolizumab versus Ipilimumab for Advanced Melanoma: final overall survival results of a multicenter, randomized, open-label phase 3 study (KEYNOTE-006). The Lancet, 390(10105): 1853–1862.
4. Schadendorf D., Hodi F.S., Robert C. et al. (2015) Pooled analysis of long-term survival data from phase II and phase III trials of ipilimumab in unresectable or metastatic melanoma. J. Clin. Oncol., 33: 1889–1894.
5. Ribas A., Hamid O., Daud A. et al. (2016) Association of Pembrolizumab With Tumor Response and Survival Among Patients With Advanced Melanoma. JAMA, 315(15): 1600–1609.
6. Robert C. ASCO June 2017.
7. Robert C. EADO June 2017.
8. NCCN Guidelines Melanoma Version 1.2017.
Адрес:
Киевская обл., Обуховский р-н, с. Плюты
Больница израильской онкологии LISOD
Настоящая информация предоставлена компанией MSD в качестве профессиональной поддержки специалистам здравоохранения. Информация, относящаяся к любому продукту(-ам), может не совпадать с инструкцией по применению препарата. Пожалуйста, ознакомьтесь с полным текстом инструкции для получения точной информации или данных по продуктам, рассматриваемым в настоящей публикации, до назначения.
ONCO-1242906-0000














Leave a comment