Циторедуктивна хірургія та HIPEC (hyperthermic intraperitoneal chemotherapy) у комбінованому лікуванні при раку яєчника
Ярема Р.Р.1, Фецич Т.Г.1, Володько Н.А. 1, Огорчак М.А.2, Милян Ю.П. 2, Фецич М.Т.1
- 1Львівський національний медичний університет імені Данила Галицького
- 2Львівський державний онкологічний регіональний лікувально-діагностичний центр, Львів
Резюме. Проведено дослідження клінічної ефективності застосування циторедуктивних втручань та гіпертермічної внутрішньочеревної хіміотерапії (hyperthermic intraperitoneal chemotherapy — HIPEC) у комбінованій терапії хворих на рак яєчників (РЯ) з імплантаційними метастазами, а також вивчення факторів прогнозу у таких пацієнтів. Проведено аналіз ефективності застосування циторедуктивних втручань, НІРЕС та системної хіміотерапії в комбінованому лікуванні 59 хворих на РЯ, що супроводжувався перитонеальним карциноматозом (49 хворих на рецидивний РЯ та 10 пацієнтів із первинним РЯ). HIPEC проводили за «закритою» методикою з використанням цисплатину чи цисплатину в комбінації з доксорубіцином. Післяопераційні хірургічні ускладнення розвинулися у 22% хворих, 60-денна післяопераційна летальність становила 6,8%. Медіана безрецидивної та загальної виживаності хворих сягала 13,9 та 30,2 міс відповідно. У рамках монофакторного аналізу вірогідним впливом на виживаність характеризувалися такі чинники: наявність асциту, хіміочутливість та тривалість безрецидивного періоду у хворих на рецидивний РЯ, перитонеальний раковий індекс, ступінь повноти циторедукції та наявність екстраперитонеальних метастазів. Застосування тактики агресивного комбінованого лікування хворих на РЯ з перитонеальним карциноматозом із використанням циторедуктивних операцій та НІРЕС демонструє прийнятні безпосередні результати й оптимістичні показники виживаності пацієнтів.

ВСТУП
Рак яєчника (РЯ) залишається однією із найчастіших гінекологічних неоплазій, що посідає сьогодні 7-ме місце в структурі онкологічної захворюваності та 5-те місце серед причин смертності від злоякісних пухлин жінок у глобальному масштабі [1]. У більшості випадків РЯ діагностують на стадії місцево-поширеного процесу з маніфестованою перитонеальною дисемінацією, однак, незважаючи на 60–80% рівень [2] об’єктивних відповідей на фоні платиновмісної системної хіміотерапії, прогноз для хворих залишається незадовільним з урахуванням великої частки рецидивів захворювання [3].
Протягом останніх двох десятків років спостерігається зміна парадигми лікування інтраперитонеально дисемінованих пухлин, що супроводжується впровадженням нових активних способів комбінованого лікування таких хворих із використанням циторедуктивних перитонектомій та гіпертермічної внутрішньочеревної хіміотерапії (в англомовній літературі — hyperthermic intraperitoneal chemotherapy — HIPEC).
Такий терапевтичний підхід вже сьогодні стандартизовано для лікування хворих на колоректальний рак з імплантаційними метастазами, псевдоміксому та мезотеліому очеревини в багатьох країнах Європейського Союзу [4, 5]. Однак щодо РЯ результати застосування комбінованої терапії з використанням HIPEC донині залишаються обмеженими низкою ретроспективних робіт та невеликою кількістю проспективних рандомізованих досліджень [6, 7]. Відтак, питання ефективності застосування HIPEC у хворих на первинний і рецидивний РЯ не втрачає сьогодні своєї актуальності та інтенсивно досліджується у близько 20 рандомізованих досліджень у різних кутках світу [8].
В основу циторедуктивного втручання — субтотальної перитонектомії (запропонованої Paul H. Sugarbaker) — покладено принцип максимального видалення макроскопічних імплантаційних метастазів із черевної порожнини шляхом проведення різного характеру перитонектомій з метою досягнення мінімального мікроскопічного рівня резидуального інтраперитонеального пулу пухлинних клітин, з подальшою елімінацією останнього під час інтраперитонеальної хіміогіпертермії [9]. Термін «циторедуктивна хірургія» (cytoreductive surgery — CRS) на сьогодні здобув широке застосування в спеціалізованих центрах та використовується уніфіковано.
Важливим прогностичним чинником та об’єктивним критерієм стадіювання перитонеального карциноматозу є перитонеальний раковий індекс (peritoneal cancer index), що використовується як непрямий показник можливості досягнення повної циторедукції. При обчисленні перитонеального ракового індексу черевну порожнину розділяють на 13 умовних тазово-абдомінальних ділянок, у кожній з яких залежно від розмірів імплантів оцінюється ступінь карциноматозу (від 1 до 3 балів) з подальшим сумуванням балів усіх ділянок [9].
Вагомим прогностичним критерієм ефективності CRS є показник повноти циторедукції (completeness of cytoreduction score — CC) [9]:
- СС-0 — макроскопічні резидуальні пухлинні вогнища на очеревині після CRS відсутні;
- СС-1 — резидуальні вогнища діаметром не більше 2,5 мм;
- СС-2 — розмір резидуальних вузликів від 2,5 мм до 2,5 см;
- та СС-3 — розмір резидуальних пухлинних вузлів більший за 2,5 см.
Метою нашого дослідження було вивчення клінічної ефективності застосування комбінованої терапії з використанням CRS + HIPEC у хворих на рецидивний та первинний РЯ з імплантаційними метастазами, а також визначення факторів прогнозу у таких пацієнтів після проведеного комбінованого лікування.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено аналіз ефективності застосування CRS та НІРЕС у комбінованому лікуванні 59 хворих на РЯ, що супроводжувався перитонеальним карциноматозом (49 хворих на рецидивний РЯ та 10 пацієнтів із первинним РЯ). Хворі перебували на стаціонарному лікуванні у Клініці онкології та медичної радіології Львівського національного медичного університету ім. Данила Галицького на базі відділення абдомінальної хірургії Львівського державного онкологічного регіонального лікувально-діагностичного центру у 2008–2017 рр. (проспективне нерандомізоване клінічне дослідження). Вік хворих становив від 28 до 76 років, середній вік — 54,2±7,9 року.
Діагноз РЯ у всіх хворих верифіковано морфологічно до початку лікування, а також отримано інформовану згоду на участь у клінічному дослідженні. Стадіювання РЯ проводили на основі критеріїв класифікації TNM 7-го видання (2009).
Основні клініко-патологічні характеристики хворих, які взяли участь у дослідженні, представлено у табл. 1.
Таблиця 1. Клініко-патологічні характеристики 59 хворих на РЯ
| Характеристики | Кількість, n (%) | |
| РЯ | Первинний Рецидивний |
10 (17) 49 (83) |
| Хіміочутливість рецидиву (епітеліальний рецидивний РЯ, n=46) | Хіміочутливий рецидив (>6 міс) Хіміорезистентний рецидив (<6 міс) |
29 (63) 17 (37) |
| Первинна стадія | ІВІСІІАІІВІІСІІІВІІІСІV | 2 (3,4)7 (11,8)2 (3,4)
3 (5,1) 4 (6,8) 2 (3,4) 38 (64,4) 1 (1,7) |
Гістологічна структура
|
Серозно-папілярна карциномаhigh-gradeСерозно-папілярна карциномаlow-gradeМуцинозна карцинома
Мезонефроїдна карцинома Ендометріоїдна карцинома Повний патоморфологічний регрес після неоад’ювантної хіміотерапії Гранульозоклітинна карцинома |
35 (59,3)9 (15,3)6 (10,1)
3 (5,1) 2 (3,4) 1 (1,7
3 (5,1) |
| Асцит | Наявний Відсутній |
9 (15,3) 50 (84,7) |
| Ускладнення РЯ | Без ускладнень Часткова кишкова непрохідність Больовий синдром |
50 (84,7) 7 (11,9) 2 (3,4) |
| Супутня патологія (кардіоваскулярна, ендокринна, респіраторна та ін.) | Наявна Відсутня |
33 (56,0) 26 (44,0) |
До моменту розвитку та комбінованого лікування з приводу прогресування захворювання пацієнти із рецидивним РЯ на попередніх етапах патологічного процесу отримували від 0 до 3 ліній хіміотерапії (1,3±0,7), від 0 до 4 курсів (1,6±0,9) та сумарно від 0 до 24 циклів хіміотерапії (8,4±4,6).
Середня тривалість останнього безрецидивного періоду до початку комбінованого лікування у хворих на рецидивний РЯ становила 16,2±24 міс (0,5–144 міс).
З метою регресу інтраперитонеального рецидиву перед початком комбінованого лікування у 22 (37,3%) хворих проводили неоад’ювантну хіміотерапію, в середньому — 4±1,8 (від 2 до 8) циклу хіміотерапії.
Комбіноване лікування хворих на рецидивний РЯ проводили із застосуванням циторедуктивних операцій в комбінації з НІРЕС з наступною системною хіміотерапією відповідної лінії. Серед 10 пацієнтів із первинним РЯ у 7 хворих виконано первинне циторедуктивне хірургічне втручання, у 3 — циторедукцію після нерадикального первинного хірургічного лікування в комбінації з НІРЕС та з подальшою системною хіміотерапією.
З метою досягнення повного характеру циторедукції у хворих виконували циторедуктивні хірургічні втручання із застосуванням різних етапів операції перитонектомії за P. Sugarbaker (табл. 2).
Таблиця 2. Кількість етапів циторедуктивної перитонектомії, виконаних у 59 хворих на РЯ
| Етап CRS | Кількість | |
| Парієтальні перитонектомії | Правобічна піддіафрагмальна перитонектомія Резекція правого купола діафрагми Лівобічна піддіафрагмальна перитонектомія Резекція лівого купола діафрагми Перитонектомія правого бокового каналу Перитонектомія лівого бокового каналу Тазова перитонектомія Передня тазова перитонектомія Парціальна парієтальна перитонектомія |
16 6 4 2 24 7 21 10 14 |
| Вісцеральні резекції | Спленектомія Резекція печінки «Капсулектомія» печінки Холецистектомія Парціальна резекція шлунка Резекція хвоста підшлункової залози Резекція надниркової залози Супраколярна оментектомія Оментектомія малого сальника Резекція тонкої кишки Геміколектомія справа/зліва Апендектомія Резекція сигмовидної кишки Резекція прямої кишки Перитонектомія брижі тонкої/товстої кишки Видалення імплантів тонкої/товстої кишки Пангістеректомія Резекція кукси піхви/екстирпація шийки матки Резекція сечового міхура |
11 5 4 2 1 3 3 41 5 7 9 5 10 11 19 23 7 8 4 |
У 23 (39%) хворих виконано одночасно більше 6 етапів циторедуктивного втручання (від 6 до 12 етапів).
Середній рівень показника хірургічного перитонеального ракового індексу, що визначався інтраопераційно, становив 15,9±10,5 бала (0–36 балів). Середній рівень показника Fagotti, який обчислювали інтраопераційно, дорівнював 6,5±3,2 бала (0–12 балів).
Показник повноти циторедукції після завершення хірургічного етапу втручання оцінено наступним чином: СС-0 циторедукцію виконано у 32 (54,2%) хворих, СС-1 — 12 (20,3%), СС-2 — 11 (18,7%) та СС-3 — у 4 (6,8%) пацієнтів.
У 12 (20,3%) пацієнтів гістологічно підтверджено наявність лімфогенних метастазів у видалених клубових, парааортальних чи інгвінальних лімфатичних вузлах. У 4 (6,8%) хворих після резекції печінки морфологічно підтверджено гематогенні метастази у печінці. Отже, екстраперитонеальні метастази сумарно виявлено у 16 (27,1%) хворих.
Процедуру HIPEC проводили за «закритою» методикою протягом 90 хв із середньою інтраабдомінальною температурою 43,3±1,4 °С (39–44,5 °С) з використанням у пацієнтів із платиночутливими пухлинами інтраперитонеально цисплатину в дозі 100 мг/м2, у разі платинорезистентних рецидивів — цисплатину в дозі 75 мг/м2 та доксорубіцину 15 мг/м2.
Середня тривалість операції, враховуючи процедуру НІРЕС, становила 368,3±68,1 хв (270–550 хв).
Системну ад’ювантну хіміотерапію після операції отримали 44 хворих із 59 (74,6%) учасників дослідження. Середня кількість циклів сягала 4,7±1,6 (від 1 до 8 циклів хіміотерапії). Схеми застосованої хіміотерапії залежали від лінійності попереднього лікування: цисплатин/карбоплатин + циклофосфамід застосовано у 18 (40,9%) хворих, паклітаксел ± карбоплатин — у 21 (47,8%), доксорубіцин — у 2 (4,5%), гемцитабін — у 2 (4,5%) та топотекан — в 1 (2,3%).
На подальших етапах перебігу РЯ хворі отримували від 0 до 4 ліній хіміотерапії (1,3±1,1), від 0 до 5 курсів (1,4±1,2) та сумарно від 0 до 21 циклів хіміотерапії (8,1±5,1). Повторні циторедуктивні операції виконано у 9 (15,3%) пацієнтів.
Статистичну обробку первинних даних проводили з використанням програм SPSS 22 та Statistica 6. Для дослідження кумулятивної виживаності хворих використовували цензурований метод Каплана — Мейєра, значущість у різниці рівнів виживаності в окремих групах визначали за допомогою логарифмічного рангового коефіцієнта. З метою встановлення корелятивних зв’язків застосовано ранговий коефіцієнт кореляції Спірмена.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
Середній термін післяопераційного перебування хворих у стаціонарі, у яких застосовували CRS + HIPEC, становив 18,3 ± 6,8 доби (від 9 до 40 діб).
Після проведеного циторедуктивного хірургічного втручання та використання HIPEC післяопераційні ускладнення розвинулися у 26 (44,1%) хворих (табл. 3). У 9 (15,2%) пацієнтів хірургічні ускладнення потребували проведення релапаротомії. 60-денна післяопераційна летальність становила 6,8% (4 хворих). Із них три випадки характеризувалися перитонеальним раковим індексом >21 бала.
Таблиця 3. Структура ускладнень після виконання CRS + HIPEC у 59 хворих на РЯ
| Ускладнення | Кількість, n (%) | |
| Хірургічні | Перфорація тонкої/товстої кишки Недостатність дигестивних анастомозів Внутрішньочеревна кровотеча Інтраопераційна травма сечоводу Нагноєння післяопераційної рани |
13 (22,0) 4 3 1 1 4 |
| Ускладнення НІРЕС (ІІІ–ІV ступеня) | Лейкопенія ІІІ ступеня Лейкопенія ІV ступеня Нефротоксичність ІІІ ступеня Нефротоксичність ІV ступеня |
6 (10,2) 1 1 3 1 |
| Соматичні | Флеботромбоз глибоких вен нижніх кінцівок Антибіотикоасоційований коліт Госпітальна пневмонія |
7 (11,9) 2 4 1 |
Визначено статистично достовірний обернено пропорційний кореляційний зв’язок між ризиком розвитку нефротоксичності ІІІ–IV ступеня (згідно з критеріями Clinical Toxicity Criteria National Cancer Institut Canada — CTC NCIC) та темпом діурезу під час процедури НІРЕС (r=–0,43; p=0,0006).
Мінімальний термін диспансерного спостереження за пацієнтами після комбінованого лікування становив 10 міс, максимальний — 84 міс.
Медіана безрецидивної та загальної виживаності 59 хворих на РЯ, яким проводили CRS + HIPEC та системну хіміотерапію, сягали 13,9 та 30,2 міс відповідно (рис. 1).
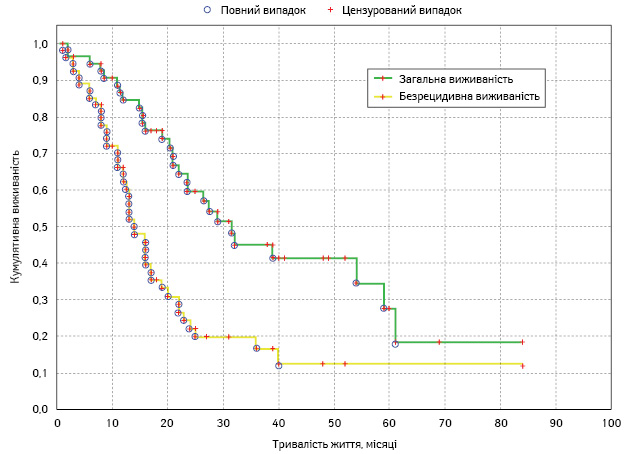
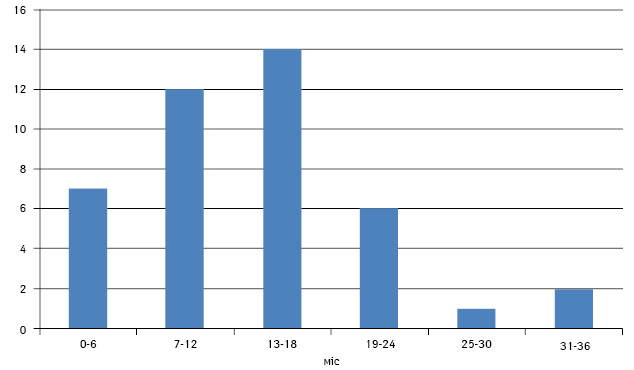
Серед 54 нецензурованих (5 хворих цензуровано в зв’язку зі смертю внаслідок хірургічних ускладнень чи інтеркурентної патології) прогресування захворювання розвинулося у 42 (77,8%) пацієнтів. Серед них найчастішим був інтраперитонеальний рецидив — виник у 35 (83,3%) осіб. У 16,7% хворих розвинулися метастази іншого характеру. Зокрема, метастази в печінку (самостійно чи в комбінації з лімфогенними метастазами або інтраперитонеальним рецидивом) — у 10 (23,8%) хворих, лімфогенні метастази (в заочеревині, середостінні, надключичні чи інгвінальні лімфовузли) — у 12 (28,6%), випітний плеврит — у 9 (21,4%) та метастази в легені — в 1 (2,3%) хворої. Пік частоти прогресування РЯ припадає на третє півріччя після закінчення комбінованого лікування (рис. 2).
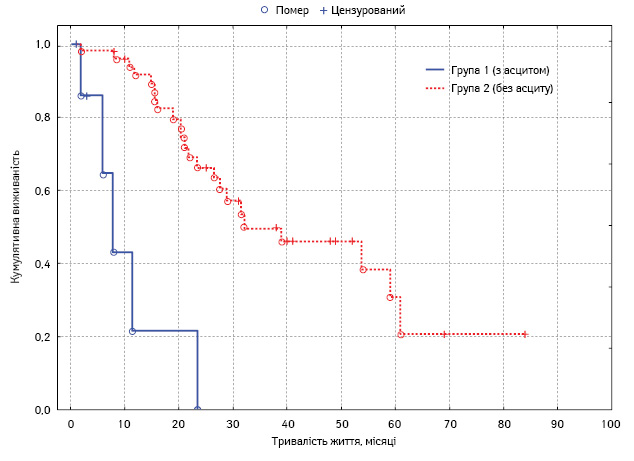
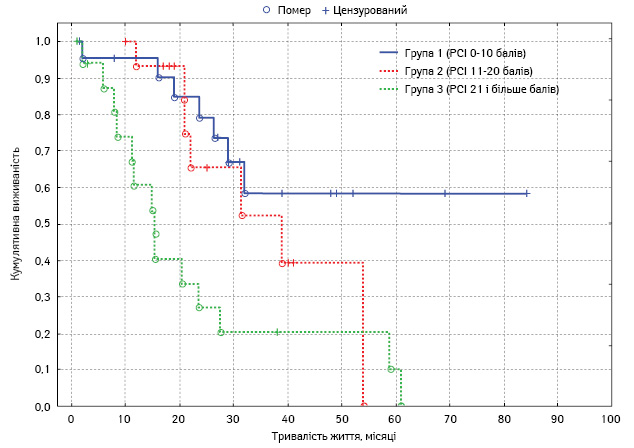
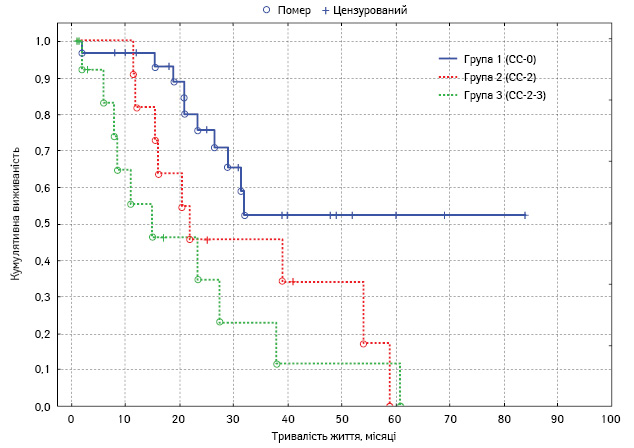
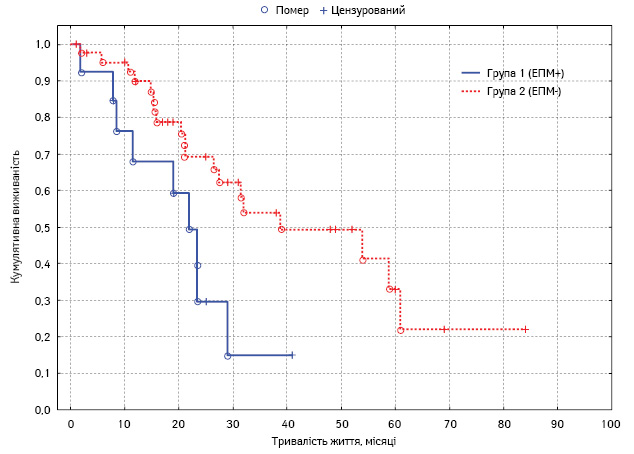
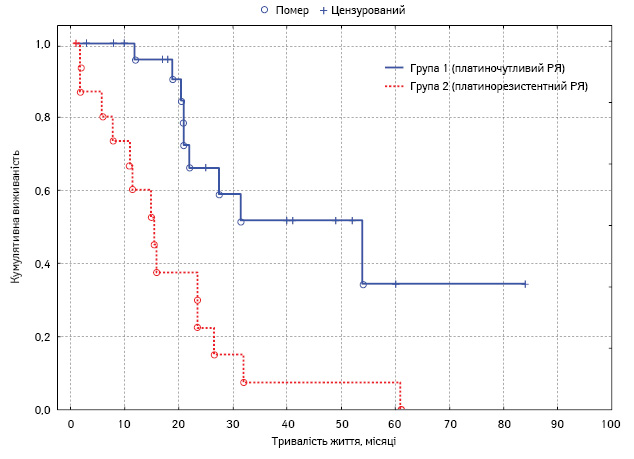
Проведено монофакторний аналіз потенційних чинників прогнозу. Статистично вірогідним впливом на виживаність характеризувалися такі фактори: наявність асциту, хіміочутливість та тривалість безрецидивного періоду у хворих на рецидивний РЯ, перитонеальний раковий індекс, ступінь повноти циторедукції, а також наявність екстраперитонеальних метастазів (табл. 4, рис. 3–7).
Таблиця 4. Результати монофакторного аналізу чинників прогнозу у хворих на РЯ після проведення CRS + HIPEC
| Показник | Медіана виживаності, міс | 95% CI | р |
| РЯ первинний РЯ рецидивний |
29±1,6 19±2,4 |
25,9–32,03 14,2–23,8 |
0,12 |
| Асцит наявний Асцит відсутній |
3±0,8 23,5±3,0 |
1,5–4,5 17,6–29,4 |
0,03 |
| Рецидив хіміочутливий (>6 міс) Рецидив хіміорезистентний (<6 міс) |
21±1,7 12±2,7 |
17,6–24,4 6,6–17,4 |
0,001 |
Безрецидивний період до CRS + HIPEC:
|
12±2,7 21±4,5 25±2,8 |
6,8–17,2 12,2–29,8 19,4–30,6 |
0,002 |
Перитонеальний раковий індекс:
|
27±1,5 21±2,0 11±3,4 |
24,1–29,9 17,1–24,9 4,4–17,6 |
0,002 |
Ступінь повноти циторедукції:
|
25±3,4 20,5±5,28,5±3,2 |
18,4–31,610,3–30,74,3–15,6 | 0,008 |
Лімфогенні метастази:
|
19±6,421±4,1 | 6,5–31,612,9–29,1 | 0,05 |
| Екстраперитонеальні метастази (лімфогенні, метастази в печінку):
|
19±6,921±5,0 | 5,4–32,611,1–30,9 | 0,04 |
ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ
Результати нашого дослідження засвідчили, що застосування агресивної тактики комбінованого лікування РЯ з використанням CRS та НІРЕС є безпечним методом, що супроводжується допустимими рівнями післяопераційних ускладнень і летальності.
Більшість випадків післяопераційних ускладнень були хірургічного характеру (хірургічні ускладнення розвинулися у 22% хворих), що пов’язано з екстенсивним обсягом циторедуктивних втручань. Найчастішим небажаним наслідком процедури НІРЕС була нефротоксичність. Проте тяжка нефротоксичність (ІІІ–IV ступеня) виникла лише у 6,8% пацієнтів. Визначено достовірний вплив на ризик розвитку нефротоксичності рівня діурезу під час проведення НІРЕС, що підтверджує необхідність підтримання високого темпу діурезу вже від початку процедури НІРЕС.
Абсолютну більшість хворих нашого дослідження становили пацієнтки із рецидивним РЯ.
M. Deraco та співавтори [6] представили результати італійського мультицентрового дослідження ефективності CRS + HIPEC у комбінованому лікуванні 56 хворих на рецидивний РЯ, що отримували терапію у 4 спеціалізованих центрах. Середнє значення показника перитонеального ракового індексу у хворих, які взяли участь у цьому дослідженні, сягало 15,2 бала. Післяопераційні ускладнення та летальність розвинулися у 26,3 та 5,3% хворих відповідно. Медіана безрецидивної та загальної виживаності пацієнтів становила 10,8 та 25,7 міс відповідно. Безпосередні та віддалені результати нашого дослідження відповідають результатам описаної роботи та повідомлень низки інших авторів [10–12].
Перитонеальний раковий індекс та ступінь повноти циторедукції є традиційними прогностичними факторами при проведенні CRS та НІРЕС, що широко висвітлені в літературі, в тому числі для хворих на РЯ [6, 13, 14]. Результати нашого дослідження також підтвердили прогностичну цінність цих критеріїв у рамках монофакторного аналізу.
Відповідно до результатів міланського консенсусу щодо лікування пацієнтів з інтраперитонеально дисемінованими пухлинами (Мілан, 2006), НІРЕС як інтегральна частина комбінованої терапії може бути застосована на різних етапах перебігу РЯ (первинна операція, інтервальна та вторинна циторедукція), проте не у випадках платинорезистентних рецидивів захворювання [15].
Незважаючи на це, результати досліджень наступних років довели перевагу виживаності хворих на рецидивний платинорезистентний РЯ за умови комбінованого лікування порівняно із системною хіміотерапією. Хоча медіана виживаності таких хворих була меншою при зіставленні цього показника з ефективністю застосування CRS + HIPEC у випадках платиночутливих рецидивів [3].
Результати нашого дослідження також підтвердили вірогідну різницю виживаності хворих із хіміочутливими та резистентними рецидивами РЯ при застосуванні CRS + HIPEC. В літературі знайдено тільки одне дослідження, що засвідчило відсутність різниці виживаності хворих з платиночутливими та платинорезистентними рецидивами РЯ при застосуванні CRS + HIPEC. Це французьке дослідження, що базувалося на аналізі ефективності вторинної циторедукції та НІРЕС у 246 хворих на рецидивний РЯ [16], що, очевидно, має стати предметом для подальших дискусій та досліджень.
Іншим несподіваним висновком нашого дослідження, що заслуговує на обговорення, було встановлення статистично вірогідної різниці виживаності у хворих із різною тривалістю останнього безрецидивного періоду перед застосуванням CRS та НІРЕС (у групах до 6 міс, до 12 міс та >12 міс). У хворих із більшими термінами безрецидивного періоду прямо пропорційно покращується прогноз, що, очевидно, може бути предметом подальших обговорень щодо розгляду цього критерію як фактора прогнозу.
ВИСНОВКИ
1. Застосування комбінованої терапії з використанням циторедуктивних втручань та HIPEC у хворих на РЯ є безпечним методом лікування з допустимими рівнями післяопераційних ускладнень та летальності. Більшість випадків післяопераційної летальності асоційовані з субмаксимальними показниками перитонеального ракового індексу.
2. Більшість випадків післяопераційних ускладнень були хірургічними (розвинулися у 22% хворих), пов’язаними з характером та обсягом циторедуктивних втручань. Характерним та найчастішим небажаним явищем внаслідок проведення НІРЕС була нефротоксичність (нефротоксичність ІІІ–IV ступеня розвинулася у 6,8% хворих). Визначено достовірний обернено пропорційний кореляційний зв’язок між ризиком розвитку нефротоксичності та темпом діурезу під час процедури НІРЕС (r=–0,43; p=0,0006).
3. Застосування циторедуктивних втручань, НІРЕС та системної хіміотерапії у хворих на РЯ з перитонеальним карциноматозом забезпечує безрецидивну та загальну виживаність на рівні 13,9 та 30,2 міс відповідно.
4. Найчастішим шляхом прогресування РЯ після проведення комбінованого лікування з використанням циторедуктивних втручань та НІРЕС є інтраперитонеальний рецидив, що виник у 83,3% хворих. Пік частоти прогресування РЯ припадає на третє півріччя після закінчення комбінованого лікування.
5. Шляхом монофакторного аналізу встановлено чинники, що вірогідно впливають на виживаність таких хворих: наявність асциту, хіміочутливість та тривалість безрецидивного періоду у хворих на рецидивний РЯ, перитонеальний раковий індекс, ступінь повноти циторедукції та наявність екстраперитонеальних метастазів.
Список використаної літератури
1. Reid B.M., Permuth J.B., Sellers T.A. (2017) Epidemiology of ovarian cancer: a review. Cancer Biol. Med., 14(1): 9–32.
2. McGuire W.P., Hoskins W.J., Brady M.F. et al. (1996) Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and IV ovarian cancer. N. Engl. J. Med., 334(1): 1–6.
3. Bijelic L., Jonson A., Sugarbaker P.H. (2007) Systematic review of cytoreductive surgery and heated intraoperative intraperitoneal chemotherapy for treatment of peritoneal carcinomatosis in primary and recurrent ovarian cancer. Ann. Oncol., 18(12): 1943–1950.
4. Elias D., Gilly F., Quenet F. et al. (2010) Pseudomyxoma peritonei: a French multicentric study of 301 patients treated with cytoreductive surgery and intraperitoneal chemotherapy. Eur. J. Surg. Oncol., 36(5): 456–462.
5. Baratti D., Scivales A., Balestra M.R. et al. (2010) Cost analysis of the combined procedure of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Eur. J. Surg. Oncol., 36(5): 463–469.
6. Deraco M., Virzı S., Iusco D.R. et al. (2012) Secondary cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for recurrent epithelial ovarian cancer: a multi-institutional study. B. J. O. G., 119: 800–809.
7. Spiliotis J., Halkia E., Lianos E. et al. (2015) Cytoreductive surgery and HIPEC in recurrent epithelial ovarian cancer: a prospective randomized phase III study. Ann. Surg. Oncol., 22(5): 1570–1575.
8. van Driel W.J., Lok C.A., Verwaal V., Sonke G.S. (2015) The role of hyperthermic intraperitoneal intraoperative chemotherapy in ovarian cancer. Curr. Treat. Options. Oncol., 16(4): 14.
9. Sugarbaker P.H. (1999) Management of peritoneal-surface malignancy: the surgeon’s role. Langenbeck’s Arch. Surg., 384(6): 576–587.
10. Di Giorgio A., Naticchioni E., Biacchi D. et al. (2008) Cytoreductive surgery (peritonectomy procedures) combined with hyperthermic intraperitoneal chemotherapy (HIPEC) in the treatment of diffuse peritoneal carcinomatosis from ovarian cancer. Cancer, 113: 315–325.
11. Helm C.W., Randall-Whitis L., Martin R.S. et al. (2007) Hyperthermic intraperitoneal chemotherapy in conjunction with surgery for the treatment of recurrent ovarian carcinoma. Gynecol. Oncol., 105: 90–96.
12. Fagotti A., Paris I., Grimolizzi F. et al. (2009) Secondary cytoreduction plus oxaliplatin-based HIPEC in platinumsensitive recurrent ovarian cancer patients: a pilot study. Gynecol. Oncol., 113: 335–340.
13. Huo Y.R., Richards A., Liauw W., Morris D.L. (2015) Hyperthermic intraperitoneal chemotherapy (HIPEC) and cytoreductive surgery (CRS) in ovarian cancer: a systematic review and meta-analysis. Eur. J. Surg. Oncol., 41: 1578–1589.
14. Cavaliere D., Cirocchi R., Coccolini F. et al. (2017) 1st Evidence-based Italian consensus conference on cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal carcinosis from ovarian cancer. Tumori., 20:0. doi: 10.5301/tj.5000623.
15. Helm C.W., Bristow R.E., Kusamura S. et al. (2008) Hyperthermic intraperitoneal chemotherapy with and without cytoreductive surgery for epithelial ovarian cancer. J. Surg. Oncol., 98: 283–290.
16. Bakrin N., Cotte E., Golfier F. et al. (2012) Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC) for persistent and recurrent advanced ovarian carcinoma: a multicenter, prospective study of 246 patients. Ann. Surg. Oncol., 19(13): 4052–4058.
Циторедуктивная хирургия и HIPEC (hyperthermic intraperitoneal chemotherapy) в комбинированном лечении при раке яичника
Львовский национальный медицинский университет им. Данила Галицкого, кафедра онкологии и медицинской радиологии
Львовский государственный онкологический региональный лечебно-диагностический центр
Резюме. Проведено исследование клинической эфективности применения циторедуктивных вмешательств и гипертермической внутрибрюшинной химиотерапии (hyperthermic intraperitoneal chemotherapy — HIPEC) в комбинированном лечении больных раком яичника (РЯ) с имплантационными метастазами, а также изучение факторов прогноза у таких пациентов. Проведен анализ эфективности применения циторедуктивних вмешательств, НІРЕС и системной химиотерапии в комбинированном лечении 59 больных РЯ, что сопровождался перитонеальным карциноматозом (49 больных рецидивным РЯ и 10 пациентов с первичным РЯ). HIPEC проводили по «закрытой» методике с использованием цисплатина или цисплатина в комбинации с доксорубицином. Послеоперационные хирургические осложнения зафиксированы у 22% больных, 60-суточная послеоперационная летальность составила 6,8%. Медиана безрецидивной и общей выживаемости пациентов составила 13,9 и 30,2 мес соответственно. В рамках монофакторного анализа вероятным влиянием на выживаемость характеризовались следующие факторы: наличие асцита, химиочувствительность и длительность безрецидивного периода у больных рецидивным РЯ, перитонеальный раковый индекс, степень полноты циторедукции и наличие экстраперитонеальных метастазов. Применение тактики агрессивного комбинированного лечения больных РЯ с перитонеальным карциноматозом с использованием циторедуктивных вмешательств и НІРЕС демонстрирует приемлемые непосредственные результаты и оптимистические показатели выживаемости пациентов.
рак яичника, карциноматоз брюшины, циторедуктивная операция, гипертермическая внутрибрюшинная химиотерапия.
Адреса:
Ярема Роман Романович
79000, Львів, вул. Пекарська, 69
Львівський національний медичний університет ім. Данила Галицького,
кафедра онкології та медичної радіології
Тел.: (032) 295-37-61
E-mail: roman.yarema@ukr.net














Leave a comment