Клінічні рекомендації з діагностики та лікування нейроендокринних пухлин тонкої кишки
Зубарєв М.Г., Колеснік О.О., Лукашенко А.В., Остапенко Ю.В., Бойко А.В.
Резюме. Нейроендокринні пухлини (НЕП) об’єднують доволі велику групу новоутворень, які характеризуються біологічною різноманітністю та гетерогенністю. За даними Всесвітньої організації охорони здоров’я, за останні роки відмічається підвищення частоти виявлення НЕП до 3,65 випадку на 100 тис. населення. Стадія та диференціювання НЕП є основними факторами прогнозу у пацієнтів із НЕП шлунково-кишкового тракту (ШКТ). Застосування сучасних методів діагностики — комп’ютерної томографії, магнітно-резонансної томографії, сцинтиграфії, позитронно-емісійної томографії, поєднаної з комп’ютерною томографією, та імуногістохімічного дослідження біологічного матеріалу — відіграє ключову роль у виявленні НЕП ШКТ. Основні принципи хірургічного лікування полягають у адекватному обсязі лімфодисекції, видаленні всіх видимих первинних пальпабельних пухлин, усуненні рецидиву та метастазів. Медикаментозне лікування пацієнтів із НЕП ШКТ IV стадії залежить від ступеня градації (G), індекcу проліферації (Ki-67) та мітотичної активності і полягає у застосуванні пролонгованих октреотидів, імунотерапії, системної хіміотерапії та локорегіонарної терапії. Медіана загальної виживаності пацієнтів із НЕП ШКТ І–ІІ стадії, які отримали лікування, становить 112–170 міс, ІІІ — 70–105 міс та ІV — 13–60 міс відповідно. Представлені рекомендації з діагностики та лікування пацієнтів із НЕП ШКТ базуються на рекомендаціях ENETS 2016 р., NCCN 03/2017, дані яких оновлювалися на основі перегляду літератури на базі пошукового ресурсу PubMed за 2015–2016 рр.
Одержано 13.11.2017
Прийнято до друку 20.11.2017
Вступ
Нейроендокринні пухлини тонкої кишки (Т-НЕП), а саме порожньої та клубової кишки (в англомовній літературі — SI-NETs), становлять щонайменше одну з трьох найбільших груп нейроендокринних пухлин (НЕП) верхнього відділу шлунково-кишкового тракту (ШКТ) (шлунок, підшлункова залоза, дванадцятипала кишка, тонка кишка) [84, 96].
Завдяки розширенню знань у молекулярній біології про ці пухлини, а також доволі чітку патогістологічну їх характеристику сьогодні, за статистичними даними, у світі реєструють суттєве підвищення захворюваності на Т-НЕП.
У попередніх рекомендаціях Європейського товариства з вивчення нейроендокринних пухлин (European Neuroendocrine Tumor Society — ENETS) [29, 96, 101] детально розглядалися клінічні симптоми, діагностика та лікування локалізованих, місцево-поширених, а також метастатичних Т-НЕП. Четверте видання ENETS з’явилося у 2016 р. як доповнення до третьої версії, опублікованої у 2012 р., та включає у себе оновлення у стандартизації та вдосконаленні ранньої діагностики і лікування [96].
Епідеміологія та прогноз
За деякими даними, захворюваність на Т-НЕП досягає найвищих показників серед інших локалізацій [78, 108, 116, 133]. Наприклад, за інформацією, у США захворюваність на Т-НЕП зросла на 300–500% за останні 35 років (рис. 1) [84, 96]. Подібні дані отримано у Швеції та Норвегії. Причина такого стрімкого підвищення захворюваності на Т-НЕП невідома, але можна стверджувати, що це частково пов’язано з покращенням ендоскопічної та молекулярно-біологічної діагностики. Незважаючи на стрімке зростання захворюваності на Т-НЕП, ці пухлини залишаються доволі рідкісним онкологічним захворюванням. За даними світової статистики, частота захворюваності на Т-НЕП становить 0,32 на 100 тис. населення у Великобританії, 0,33 — у Японії, 0,67 — у США, 0,81 — у Норвегії та 1,12 — у Швеції [28, 49, 53, 64].
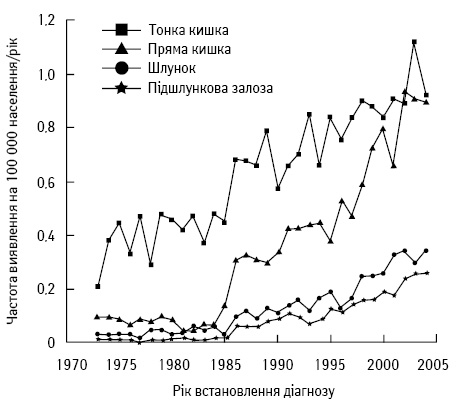
Також досліджено деякі особливості Т-НЕП, наприклад, вони найчастіше виникають у пацієнтів віком >60 років, практично немає різниці між показниками захворюваності чоловіків та жінок (незначне переважання чоловічої статі). Виявлено певну етнічну різницю — азійці хворію менше, ніж африканці та європейці. Ці пухлини, на жаль, дуже рідко проявляються симптомами у ранніх стадіях, що призводить до підвищення частоти їх виявлення у пізніх стадіях. Власне, це пояснює дані одного з досліджень, в якому встановлено, що Т-НЕП діагностували посмертно з частотою 1,22 на 100 тис. населення, що становить більше, ніж за життя — 0,67 (дані SEER) [12, 13, 37, 53, 67, 102].
Прогноз Т-НЕП залежить від двох показників, таких як стадія та градація пухлини, що відображено у класифікації ВООЗ 2010 р. [60]. Так, 5-річна виживаність пацієнтів із Т-НЕП І та ІІ стадії (TNM) становить 100%, 97,1% — ІІІ стадії та 84,8% — IV стадії, тоді як у випадку G1 — 93,8%, G2 — 83%, G3 — 50% [55]. За даними SEER, 5-річна виживаність сягає близько 72% у пацієнтів із місцево-поширеними пухлинами, 55% — при наявності відділених метастазів (Мтс). Також встановлено, що прогноз у пацієнтів віком понад 60 років є гіршим, ніж у молодших. Такі показники, як Мтс у регіонарних мезентеріальних лімфатичних вузлах, віддалених черевних лімфатичних вузлах, печінці та позапечінкові Мтс, є окремими незалежними прогностичними факторами, що виявлено при мультиваріантному аналізі [87].
Резюме згідно з останнім консенсусом з НЕП (ENETS 2016). Більше не використовується поділ НЕП ШКТ на пухлини середньої та задньої кишки, які об’єднують НЕП порожньої та клубової кишки, апендикса, сліпої, ободової та прямої кишки. Рівень Ki-67 — важливий прогностичний фактор, тому обов’язково визначається при дослідженні НЕП та зазначається у патогістологічному висновку. Показники виживаності строго залежать від гістопатологічної класифікації ВООЗ та стадії за класифікацією TNM.
Клінічні прояви Т-НЕП
Неспецифічні симптоми, такі як незначний біль у черевній порожнині, втрата маси тіла, трапляються у 37% випадків Т-НЕП. Специфічні симптоми пов’язані з самою пухлиною — локальні (наприклад стеноз та непрохідність, кровотеча, мелена) або системні (діарея та припливи) виникають у 21,5% пацієнтів [83]. На жаль, нерідко можуть бути відсутні будь-які симптоми навіть при наявності вже розповсюдженої хвороби з віддаленими Мтс [64]. За допомогою комп’ютерної томографії (КТ), ультразвукового дослідження (УЗД) або магнітно-резонансної томографії (МРТ) черевної порожнини випадково виявити первинну Т-НЕП відносно складно через незначні патогномонічні ознаки малих за розміром утворень. Тому при зверненні пацієнта слід взяти до уваги наявність неспецифічних симптомів [1]. Біль у черевній порожнині — одна із найчастіших скарг пацієнтів, може виникати з декількох причин: через порушення моторики стінки кишки, обструкцію її просвіту, інтермітуючу мезентеріальну ішемію, спричинену фіброзом кореня брижі, а також функціональні порушення, такі як діарея та дисбактеріоз. Зменшення маси тіла, загальна слабкість та гарячка без відомих причин нерідко теж можуть бути наявними. У незначної кількості пацієнтів Т-НЕП можуть проявлятися гострою непрохідністю, жовтяницею внаслідок обструкції холедоху або множинних печінкових Мтс та гострою кровотечею [3, 50, 64, 83, 93, 94].
Карциноїдний синдром трапляється у 6–30% пацієнтів із Т-НЕП та супроводжується секреторною діареєю — 60–80%, припливами — 60–85%, інтермітуючими бронхіальними хрипами — 10% та пристінковим і клапанним фіброзом ендокарда правої половини серця (синдром Гедінгера (Hedinger) — Carcinoid Heart Disease (CHD) — 20% [13, 50, 93, 94]. Карциноїдний синдром найчастіше асоціюється з метастазуванням у печінку і пояснюється тим, що надлишок продукуючого НЕП серотоніну оминає уражену Мтс печінку і потрапляє у кров’яне русло у високій концентрації [3, 27, 94].
При Т-НЕП розвивається тяжке, нерідко смертельне ускладнення карциноїдного синдрому, яке називається «карциноїдний криз». Причиною цього фатального ускладнення є гіперсекреція гормонів та пептидів, вплив яких посилюється провокуючими факторами, а саме анестезією або інвазивними маніпуляціями та хірургічним втручанням. Клінічна картина проявляється припливами та почервонінням шкіри обличчя, гіпо- або гіпертензією, тяжким бронхоспазмом, серцевою аритмією [22].
Резюме згідно з останнім консенсусом з НЕП (ENETS 2016). Біль у черевній порожнині — найчастіший клінічний симптом Т-НЕП. Карциноїдний синдром відмічають у 20–30% пацієнтів з Мтс Т-НЕП, цей показник є вищим, ніж у попередніх рекомендаціях. У 80% пацієнтів синдром проявляється припливами, діареєю та кардіальними симптомами. Карциноїдний синдром у 95% випадків виникає у пацієнтів з Мтс Т-НЕП у печінці.
Методи діагностики Т-НЕП
Візуалізація. На сьогодні КТ та МРТ з контрастуванням залишаються найбільш інформативними методами діагностування Т-НЕП [57, 107]. За допомогою цих методів не завжди вдається виявити первинну пухлину тонкої кишки, але можливо оцінити локальну розповсюдженість та віддалене метастазування Т-НЕП. Також за допомогою КТ можна діагностувати первинну НЕП бронхів при вже виявлених Мтс в печінці, які також можуть бути при Т-НЕП. Таким чином, ці два методи дозволяють певною мірою провести диференційну діагностику та визначити локалізацію первинної пухлини [58, 73]. Трансабдомінальне УЗД також дозволяє у певних випадках зібрати цінну інформацію про наявність регіонарних або віддалених Мтс та іноді — про первинну пухлину тонкої кишки (з частотою 10–12 МГц), але цей метод вимагає подальших досліджень для визначення його цінності в обстеженні пацієнтів з Т-НЕП [25].
З відносним успіхом застосовується пряма візуалізація Т-НЕП за допомогою ендоскопії. Хоча можливості колоноскопії обмежені, цим методом можна діагностувати, пролабуючи пухлини клубової кишки у просвіт сліпої кишки, а також за допомогою інтубації клубової кишки проводити огляд її термінального відділу. Огляд тонкої кишки за межами дванадцятипалої кишки можливий при використанні балонної ендоскопії, яка, однак, вимагає володіння технікою виконання і є непопулярною. Капсульна ендоскопія відіграє ключову роль у виявленні Т-НЕП, наприклад у пацієнтів з верифікованими віддаленими Мтс НЕП (рис. 2) [9]. Але, на жаль, метод є дороговартісним та далеко не завжди дозволяє візуалізувати малі за розміром Т-НЕП. Крім того, протипоказанням до проведення капсульної ендоскопії є наявність у пацієнтів на фоні Т-НЕП обструкції тонкої кишки [35].
Для виявлення Т-НЕП з успіхом застосовується метод сцинтиграфії соматостатинових рецепторів (октреоскан). Цей метод спрацьовує у випадку наявності позитивних соматостатинових рецепторів у Т-НЕП. У цьому разі він інформативний у виявленні первинних пухлин, метастазів у регіонарних лімфатичних вузлах (90%), інших органах (печінка >95%) та кістках. Виявлення соматостатинових рецепторів Т-НЕП можливе також за допомогою ПЕТ-КТ з використанням Ga [5, 19, 32, 36, 48, 62, 82, 92, 103, 104, 111–113]. Ga-DOTATOC ПЕТ-КТ ефективно застосовується для виявлення первинної пухлини при підозрі на Т-НЕП або при вже наявних підтверджених віддалених Мтс Т-НЕП, але коли первинне вогнище не визначене [119]. Також цей метод є ефективним для візуалізації дрібних Т-НЕП. ПЕТ-КТ з використанням 18-фтордезоксиглюкози (18-fluorodeoxyglucose) виявилася неефективною у діагностиці високодиференційованих Т-НЕП G1, які становлять більшість серед Т-НЕП, проте, навпаки, дієвою при Т-НЕП G3 та рекомендована при цьому типі пухлин [61, 92].
Патоморфологія Т-НЕП. Патоморфологічне та імуногістохімічне (ІГХ) дослідження біоптату, отриманого шляхом біопсії первинної пухлини або Мтс, є обов’язковим. Важливими показниками у діагностиці Т-НЕП вважаються експресія рецепторів хромограніну А та синаптофізину [45, 60, 108, 121]. Також за допомогою встановлення різниці між показниками ІГХ дослідження та аналізу крові можна визначати прогноз Т-НЕП. Наприклад, якщо серологічний показник рівня хромограніну А є вищим за той, який визначається ІГХ дослідженням, то це вважається поганою прогностичною ознакою [93, 131].
Визначення рівня мітотичної активності та індексу проліферації Ki-67 також є обов’язковим у діагностиці Т-НЕП [55, 108]. Класифікація Т-НЕП має враховувати класифікацію ВООЗ, TNM та ступінь градації НЕП (G) (табл. 1–3) [60, 108, 121]. Визначення за допомогою ІГХ дослідження соматостатинових рецепторів 2 (SSR-2) є необхідним для планування медикаментозного лікування пролонгованим октреотидом (аналоги соматостатину — somatostatin analogues (SSA)). Хоча, за останніми даними, лікування SSA показане навіть при відсутності позитивних рецепторів до октреотиду.
| Первинна пухлина (Т) | |
| TX | Первинна пухлина не може бути оцінена |
| T0 | Немає даних про первинну пухлину |
| Тіs | Карцинома in situ/дисплазія (розмір пухлини <0,5 мм), не пов’язана зі слизовою оболонкою |
| T1 | Пухлина поширюється на слизову або у підслизову оболонку, розміром <1 см |
| T2 | Пухлина поширюється у м’язову оболонку або розміром >1 см |
| T3 | Пухлина поширюється субсерозно |
| T4 | Пухлина поширюється на вісцеральну очеревину/серозну оболонку або інші органи/сусідні структури/множинні пухлини |
| При наявності декількох пухлин до T слід додати (m) | |
| Регіональні лімфатичні вузли (N) | |
| NX | Регіонарні лімфатичні вузли не можливо оцінити |
| N0 | Метастази у регіонарних лімфатичних вузлах не виявляються |
| N1 | Метастази у регіонарних лімфатичних вузлах |
| Віддалені метастази (М) | |
| M0 | Відсутні віддалені Мтс |
| М1 | Віддалені метастази |
| Стадія | T | N | M | Поширеність |
| 0 (ENETS) | is | 0 | 0 | Локалізована |
| І | 1 | 0 | 0 | |
| ІІА | 2 | 0 | 0 | |
| ІІВ | 3 | 0 | 0 | |
| ІІІА | 4 | 0 | 0 | |
| ІІІВ | 1–4 | 1 | 0 | Регіонарна |
| IV | 1–4 | 0–1 | 1 | Метастатична |
| ENETS градація | Мітотичний індекс | Ki-67 індекс проліферації |
| G1 | <2 | <2% |
| G2 | 2–20 | 3–20% |
| G3 | >20 | >20% |
Визначення позитивних cdx-2 та серотоніну разом з негативними TTF-1 та ISL-1 за даними ІГХ дослідження ІГХ у пацієнтів з Мтс НЕП у печінці без встановленого первинного вогнища свідчить про походження з тонкої кишки [118].
Сімейна або генетична схильність до Т-НЕП не доведена, хоча декілька досліджень представили дані, які підтверджують її наявність [47, 52, 56]. Мутації у 18-й хромосомі асоціюються з поганим прогнозом [123, 127].
У табл. 4 наведено схему покрокової діагностики Т-НЕП, при дотриманні якої можна швидко та ефективно виявляти ці пухлини і, відповідно, проводити необхідне лікування.
| Первинна діагностика Т-НЕП: випадково/симптоматино | |||||||
| Абдомінальна хірургія (ургентна — випадково) | УЗД черевної порожнини | Ендоскопія | |||||
| Первинна пухлина/метастази | Біопсія вогнищ в печінці | НЕП порожньої та клубової кишки | |||||
| Гістопатологічний діагноз НЕП | |||||||
| Забарвлення гематоксиліном та еозиномІГХ метод (хромогранін А, синаптофізин — позитивний для Т-НЕП, серотонін, cdx-2)Індекс Ki-67 та мітотичний індекс | |||||||
| КТ та МРТ, G1–2 — октреоскан, ПЕТ-КТ DOTATOC, для G3 — FDG — ПЕТ-КТ | Визначення в крові рівня хромограніну А та 5-HIAA | ||||||
| Первинна пухлина з Мтс або без них | Первинна пухлина не виявлена |
Норма | Підвищені | ||||
| Тільки первинна пухлина | Мтс у регіонарних лімфатичних вузлах | Віддалені Мтс | Капсульна ендоскопіяПодвійна балонна ендоскопія тонкої кишкиКолоноскопія | Без симптомів | Симптоматичні | ||
| Нефункціонуюча НЕП | Функціонуюча НЕП | ||||||
| Кардіографія NT-pro-BNP для виявлення синдрому Гедінгера | |||||||
FDG — фтордезоксиглюкоза; 5-HIAA — 5-оксііндолоцтова кислота — метаболіт серотоніну та специфічний медіатор карциноїдного синдрому; NT-pro-BNP — В тип натрійуретичного пептиду.
Лікування Т-НЕП
Резекція Т-НЕП І–ІІІ стадії. Усі пацієнти з Т-НЕП мають розглядатися як кандидати на радикальне хірургічне лікування з видаленням первинної пухлини та регіонарних лімфатичних вузлів [14, 42, 47, 52, 56, 127, 129]. Важливу роль у хірургії НЕП має досвід оперуючого хірурга [2, 4, 41, 46, 68, 83, 88, 93, 94, 110, 125, 126]. Під час операції необхідно ретельно пальпаторно обстежити тонку кишку на всій протяжності, враховуючи той факт, що Т-НЕП часто мають мультифокальний ріст. Резекція первинної пухлини разом з регіонарними лімфатичними вузлами вздовж кореня брижі (верхньої мезентеріальної вени) з метою збереження кровопостачання кишки [91] покращує віддалені результати лікування та, відповідно, проявляється у доволі позитивних показниках 5- та 10-річної виживаності, яка становить 100% у пацієнтів із І та ІІ стадією, >95 та >80% — із ІІІ стадією Т-НЕП [55]. Також на великій кількості хірургічних втручань у пацієнтів з Т-НЕП виявлено, що радикальна регіонарна лімфодисекція покращує віддалені результати [66]. Хірургічні втручання на тонкій кишці у пацієнтів з Т-НЕП мають бути виконані з урахуванням онкологічних принципів. При локалізації пухлини у термінальному відділі клубової кишки проводиться правобічна геміколонектомія [2, 4, 41, 46, 68, 88, 83, 93, 94, 110, 125, 126]. Вік, стадія хвороби та застосоване радикальне хірургічне лікування вважаються незалежними факторами прогнозу виживання пацієнтів із Т-НЕП. Відтак, пацієнти з локальними та місцево-поширеними Т-НЕП (І–ІІІ стадія) після радикальної операції мають відмінний прогноз, тому наголошується на важливості власне R0 резекції [44, 65]. Лапароскопічна хірургія у лікуванні Т-НЕП може розглядатися як ефективний метод лікування, але за умови технічного виконання за онкологічними принципами. Слід проводити відбір пацієнтів для проведення лапароскопічної хірургії, враховуючи схильність до мультифокального росту Т-НЕП. На жаль, на сьогодні обмаль даних рандомізованих досліджень, в яких порівнювали б ефективність лапароскопічної хірургії при Т-НЕП. Синдром мальабсорбції та діарея є найчастішими післяопераційними ускладненнями, які виникали внаслідок резекції більшої частини тонкої кишки, а особливо термінального відділу клубової кишки, і потребують консервативного лікування. За даними літератури, частота післяопераційних ускладнень коливається в межах 20%, тоді як смертність — близько 2% [1, 3].
Супутня холецистектомія. Відомо, що у пацієнтів з Т-НЕП на фоні лікування пролонгованими октреотидами нерідко виникає калькульозний холецистит, тому раніше проводилося планове видалення жовчного міхура з метою профілактики, навіть за відсутності симптомів калькульозного холециститу [31]. Але не існує жодного проспективного дослідження, в якому було б підтверджено необхідність та ефективність такого підходу. Рішення повинен приймати оперуючий хірург, наприклад, якщо у пацієнта з Т-НЕП наявні симптоми гострого калькульозного холециститу, якщо запланована внутрішньоартеріальна хіміотерапія та селективна внутрішня променева терапія. Все ж таки рекомендовано проводити профілактичну холецистектомію у пацієнтів, яким планується лікування пролонгованими октреотидами [86]. У табл. 5 наведено алгоритм лікування хворих на Т-НЕП.
| Пухлина | Локалізована | Місцево-поширена | Метастатична | ||
| Стадія | І/ІІ | ІІІ | IV | ||
| TNM | T1–3N0M0 | T4N0M0T1–4N1M0 | TxNxM1 | ||
| Хірургічне лікування | Резекція | Резекція з метою радикалізації | Паліативна резекція | Нерезектабельна пухлина | |
| Обсяг | Відкрито/лапароскопічно (селекція пацієнтів)+ лімфодисекція (вздовж верхньої мезентеріальної вени) | Відкрита локальна радикальна резекція:
|
Відкрито/лапароскопічно (селекція пацієнтів)+ лімфодисекція (вздовж верхньої мезентеріальної вени) | Внаслідок:
|
|
| Мета | Виліковування | Виліковування | Уникнути локальних ускладнень (непрохідність, кровотеча) Покращити прогноз |
||
Резюме до хірургічного лікування Т-НЕП згідно з останнім консенсусом НЕП (ENETS 2016). Хірургічне лікування є основним методом терапії пацієнтів з Т-НЕП. Резекція супроводжується розширеною лімфаденектомією вздовж мезентеріальних судин до кореня брижі. Також видаляються лімфатичні вузли, розташовані вздовж верхньої мезентеріальної артерії, якщо є дані про їх ураження. Резекцію не слід виконувати, якщо пухлина поширюється на мезентеріальні судини. Мультифокальність Т-НЕП, яка може бути виявлена на доопераційному етапі за допомогою КТ, МРТ, ендоскопічно або при октреоскануванні, не є протипоказанням до хірургічного лікування. Але такі пацієнти не можуть бути кандидатами на лапароскопічну резекцію. Інфільтрація брижі пухлиною також є протипоказанням до лапароскопії. Прогноз хірургічного лікування гірший у разі карциноматозу очеревини та за наявності Мтс в інших органах.
Немає даних про необхідність та ефективність нео- та ад’ювантного медикаментозного лікування пацієнтів з Т-НЕП.
Паліативне хірургічне лікування пацієнтів з Мтс Т-НЕП. Видалення первинної пухлини при Мтс є виправданим за наявності таких факторів:
- резектабельні Мтс (переважно в печінці) [97];
- обструкція тонкої кишки НЕП, яка спричиняє непрохідність;
- кровотеча з первинної пухлини;
- кращий прогноз після видалення первинної пухлини [3, 40].
На основі даних декількох сучасних досліджень встановлено, що резекція первинної пухлини з лімфаденектомією виправдана при наявності нерезектабельних Мтс в печінці [21]. Циторедуктивна хірургія також може розглядатися як метод, який покращує віддалені результати у пацієнтів з IV стадією захворювання [97, 124].
Резюме до хірургічного лікування метастатичних Т-НЕП згідно з останнім консенсусом з НЕП (ENETS 2016). Паліативне хірургічне лікування пацієнтів з метастатичними Т-НЕП є виправданим, оскільки, по-перше, Мтс найчастіше присутні у печінці, по-друге, ці Мтс переважно резектабельні, по-третє, навіть якщо Мтс в печінці чи інших органах нерезектабельні, все одно є дані про покращення прогнозу завдяки резекції первинної пухлини. Паліативне хірургічне лікування має виконуватися переважно із симптоматичною метою. Не існує єдиних рекомендацій паліативної хірургії пацієнтів з Т-НЕП. Паліативне втручання при Т-НЕП потребує періопераційної медикаментозної терапії [97].
Синдром пристінкового та клапанного фіброзу ендокарда правої половини серця (синдром Гедінгера) CHD. CHD виявляють у 25–50% пацієнтів з карциноїдним синдромом Т-НЕП [3, 15, 23, 43, 70, 80, 81, 85, 93, 134]. Нещодавно S. Grozinsky-Glasberg та співавтори [43] підсумували патофізіологічні та лікувальні аспекти CHD. CHD аcоціюється з поганим прогнозом і проявляється клінічними симптомами дилатації правого передсердя або трикуспідальною недостатністю. Прогноз дещо покращився протягом останніх 20 років — із 30% 5-річної виживаності (1980) до близько 55%. Основною причиною підвищення виживаності є вдосконалення кардіальної хірургії з імплантацією штучних клапанів [23, 70, 81, 16]. Синдром виникає на фоні значного підвищення концентрації серотоніну та 5-HІАА, а також інших фіброзопровокуючих факторів — тахікінів, фактора росту сполучної тканини, трансформуючого фактора росту та ін. — у крові пацієнтів з карциноїдним синдромом Т-НЕП [16, 26, 134].
Трансторакальна ехокардіографія — найбільш ефективний метод діагностики CHD [15, 80, 81]. МРТ серця та допплерографія — також інформативні методи діагностування цієї патології. Регулярний скринінг CHD має бути обов’язковим. Лікування серцевої недостатності, спричиненої CHD, проводиться, коли в цьому є потреба. Пролонговані октреотиди (ланреотид або октреотид) обов’язково застосовуються як основні медикаментозні препарати, які збільшують кардіальний резерв та відносно усувають симптоми CHD, але не покращують прогноз та не запобігають прогресуванню CHD. Пацієнтам, у яких шляхом медикаментозного лікування SSA вдалося купірувати карциноїдний синдром та стабілізувати розвиток Т-НЕП, показано трансплантацію штучних клапанів. Кардіальне хірургічне лікування проводиться перед плануванням резекції Мтс Т-НЕП, хоча видалення метастазів покращує перебіг CHD. Нещодавно встановлено наявність функціонуючого овального вікна при CНD, хірургічне лікування якого покращує прогноз терапії та проводиться перед трансплантацією штучних клапанів (табл. 6).
| Нерезектабельні НЕП шлунка та дванадцятипалої кишки | 1) (G1-2):
2) G3/прогресування:
3) Пептидна рецепторна цільова радіонуклідна терапія (PRRT) з використанням аналогів октреотиду з Лютецієм-177 4) MIBG — внутрішня радіотерапія з метайодбензилгуанідином |
| Карциноїдний синдром | Ланреотид 120 мг кожні 28 діб Октреотид LAR 2–30 мг кожні 28 діб Звичайний октреотид 200 мг 3 рази на добу щодня |
*Рекомендації щодо лікування пацієнтів з метастатичними та рецидивними НЕП ШКТ засновані на двох плацебо-контрольованих дослідженнях PROMID та CLARINET. У дослідження CLARINET було рандомізовано 204 пацієнти з місцево-поширеними та метастатичними НЕП підшлункової залози та ШКТ, яким проводилося лікування із застосуванням ланреотиду або плацебо. Результати, представлені у цьому дослідженні, свідчать про значне збільшення медіани безрецидивної виживаності протягом 24 міс до 65,1% у групі ланреотиду та 33,0% — у групі плацебо відповідно. У плацебо-контрольованому дослідженні PROMID виявлено, що у пацієнтів з місцево-поширеними та метастатичними Т-НЕП на фоні лікування октреотидом медіана безрецидивної виживаності досягала 14,3 міс порівняно з 6 міс у групі плацебо. Після 6 міс терапії октреотидом у 66,7% пацієнтів виявлено стабілізацію хвороби. У двох представлених дослідженнях не відмічено значного покращення медіани загальної виживаності пацієнтів з місцево-поширеними, рецидивуючими та метастатичними Т-НЕП. Так, медіана загальної виживаності становила 84,7 та 83,7 міс у групі октреотиду і плацебо відповідно [20, 109].
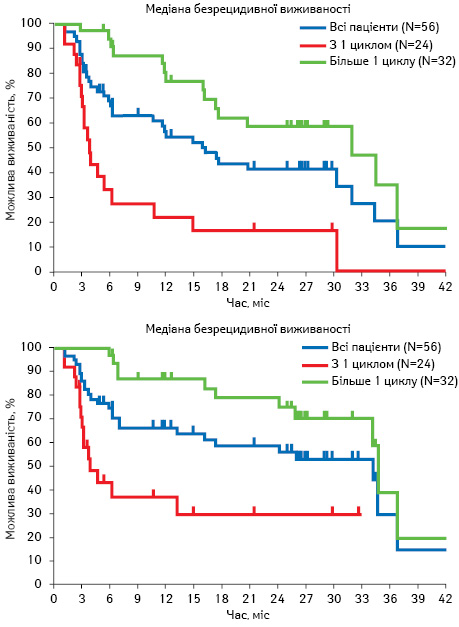
Пептидна рецепторна цільова радіонуклідна терапія (PRRT) вважається однією з найсучасніших методик лікування пацієнтів із прогресуючими НЕП. За допомогою PRRT у пацієнтів з метастатичними НЕП вдається стабілізувати хворобу та досягти регресу як первинної пухлини, так і Мтс. Лікування базується на біологічних аспектах НЕП. PRRT ефективна у випадку наявності позитивних рецепторів до октреотиду у клітинах НЕП. Октреотид зв’язаний з радіоактивним ізотопом Лютецієм-177, який при внутрішньовенному введенні пацієнтам з Мтс НЕП активно накопичується у НЕП, таким чином відбувається локальна променева терапія бета-частинками протягом декількох тижнів до періоду напіврозпаду радіофармпрепарату. ПЕТ-КТ, яка проводиться після введення цього комплексу, визначає накопичення радіофармпрепарату у зонах інтересу. Показники виживаності пацієнтів з метастатичними T-НЕП після застосування PRRT є значно кращими порівняно з плацебо та залежать від кількості циклів. Медіана загальної виживаності становила 4,7 та 34,7 міс у пацієнтів, яким було проведено один або більше одного циклу PRRT відповідно. Медіана безрецидивної виживаності сягала 4,7 та 34,5 міс у пацієнтів, яким було проведено один або більше одного циклу PRRT відповідно (рис. 3) [10].
Спостереження. Пацієнти з Т-НЕП, які отримали хірургічне лікування, мають проходити контрольні обстеження кожні 6–12 міс, за винятком хворих із Т-НЕП G3, які підлягають контролю кожні 3 міс. Пацієнти, у яких не проводилося спеціального лікування, спостерігаються кожні 3–6 міс у випадку G1/G2 та кожні 3 міс — при G3. У контрольні обстеження входять такі методи та показники: визначення хромограніну А, 5-HIAA, тризонна КТ (при підозрі на рецидив — октреоскан/ПЕТ-КТ).
Спостереження проводиться протягом усього життя пацієнтів із Т-НЕП, враховуючи той факт, що тільки 20% із них досягають 25-річної виживаності без прогресування хвороби [79, 93].
Список використаної та рекомендованої літератури
1. Aggarwal G., Obideen K., Wehbi M. (2008) Carcinoid tumors: what should increase our suspicion? Cleve Clin. J. Med., 75: 849–855.
2. Ahlman H., Wangberg B., Jansson S. et al. (2000) Interventional treatment of gastrointestinal neuroendocrine tumours. Digestion, 62(suppl. 1): 59–68.
3. Ahmed A., Turner G., King B. et al. (2009) Midgut neuroendocrine tumours with liver metastases: results of the UKINETS study. Endocr. Relat. Cancer, 16: 885–894.
4. Akerstrom G., Makridis C., Johansson H. (1991) Abdominal surgery in patients with midgut carcinoid tumors. Acta. Oncol., 30: 547–553.
5. Ambrosini V., Tomassetti P., Castellucci P. et al. (2008) Comparison between 68Ga-DOTA-NOC and 18F-DOPA PET for the detection of gastro-entero-pancreatic and lung neuro-endocrine tumours. Eur. J. Nucl. Med. Mol. Imaging, 35: 1431–1438.
6. Ardill J.E., Erikkson B. (2003) The importance of the measurement of circulating markers in patients with neuroendocrine tumours of the pancreas and gut. Endocr. Relat. Cancer, 10: 459–462.
7. Arnold R., Chen Y.J., Costa F. et al. (2009) ENETS consensus guidelines for the standards of care in neuroendocrine tumors: follow-up and documentation. Neuroendocrinology, 90: 227–233.
8. Arnold R., Wilke A., Rinke A. et al. (2008) Plasma chromogranin A as marker for survival in patients with metastatic endocrine gastroenteropancreatic tumors. Clin. Gastroenterol. Hepatol., 6: 820–827.
9. Bailey A.A., Debinski H.S., Appleyard M.N. et al. (2006) Diagnosis and outcome of small bowel tumors found by capsule endoscopy: a three-center Australian experience. Am. J. Gastroenterol., 101: 2237–2243.
10. Baum R.P., Kluge A.W., Kulkarni H. et al. (2016) [Lu177-DOTA]-D-Phe-Tyr-Octreotide (Lu 177-DOTA TOC) For Peptide Receptor Radiotherapy in Patients with Advanced Neuroendocrine Tumours: A Phase-II Study Theranostics, 6(Issue 4): 501–510.
11. Bellutti M., Fry L.C., Schmitt J. et al. (2009) Detection of neuroendocrine tumors of the small bowel by double balloon enteroscopy. Dig. Dis. Sci., 54: 1050–1058.
12. Berge T., Linell F. (1976) Carcinoid tumours. Frequency in a defined population during a 12-year period. Acta. Pathol. Microbiol. Scand. A., 84: 322–330.
13. Bergestuen D.S., Aabakken L., Holm K. et al. (2009) Small intestinal neuroendocrine tumors: prognostic factors and survival. Scand. J. Gastroenterol., 44: 1084–1091.
14. Besig S., Voland P., Baur D.M. et al. (2009) Vascular endothelial growth factors, angiogenesis, and survival in human ileal enterochromaffin cell carcinoids. Neuro-endocrinology, 90: 402–415.
15. Bhattacharyya S., Davar J., Dreyfus G., Caplin M.E. (2007) Carcinoid heart disease. Circulation, 116: 2860–2865.
16. Bhattacharyya S., Raja S.G., Toumpanakis C. et al. (2011) Outcomes, risks and complications of cardiac surgery for carcinoid heart disease. Eur. J. Cardiothorac. Surg., 40: 168–172.
17. Bhattacharyya S., Toumpanakis C., Chilkun- da D. et al. (2011) Risk factors for the development and progression of carcinoid heart disease. Am. J. Cardiol., 107: 1221–1226.
18. Boudreaux J.P., Klimstra D.S., Hassan M.M. et al. (2010) The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas, 39: 753–766.
19. Buchmann I., Henze M., Engelbrecht S. et al. (2007) Comparison of 68Ga-DOTATOC PET and 111In-DTPAOC (Octreoscan) SPECT in patients with neuro-endocrine tumours. Eur. J. Nucl. Med. Mol. Imaging, 34: 1617–1626.
20. Caplin M.E., Pavel M., Cwikla J.B. et al. (2014) Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N. Engl. J. Med., 371: 224–233.
21. Capurso G., Rinzivillo M., Bettini R. et al. (2012) Systematic review of resection of primary midgut carcinoid tumour in patients with unresectable liver metastases. Br. J. Surg., 99: 1480–1486.
22. Castillo J.G., Filsoufi F., Adams D.H. et al. (2008) Management of patients undergoing multivalvular surgery for carcinoid heart disease: the role of the anaesthetist. Br. J. Anaesth., 101: 618–626.
23. Castillo J.G., Filsoufi F., Rahmanian P.B. et al. (2008) Early and late results of valvular surgery for carcinoid heart disease. J. Am. Coll. Cardiol., 51: 1507–1509.
24. Delle Fave G., O’Toole D., Sundin A. et al. (2016) Vienna Consensus Conference participants: ENETS consensus guidelines update for gastroduodenal neuroendocrine neoplasms. Neuroendocrinology, 103: 119–124.
25. Dorffel Y., Wermke W. (2008) Neuroendocrine tumors: characterization with contrast-enhanced ultrasonography. Ultraschall. Med., 29: 506–514.
26. Druce M., Rockall A., Grossman A.B. (2009) Fibrosis and carcinoid syndrome: from causation to future therapy. Nat. Rev. Endocrinol., 5: 276–283.
27. Druce M.R., Bharwani N., Akker S.A. et al. (2010) Intra-abdominal fibrosis in a recent cohort of patients with neuroendocrine (‘carcinoid’) tumours of the small bowel. QJM, 103: 177–185.
28. Ellis L., Shale M.J., Coleman M.P. (2010) Carcinoid tumors of the gastrointestinal tract: trends in incidence in England since 1971. Am. J. Gastroenterol., 105: 2563–2569.
29. Eriksson B., Kloppel G., Krenning E. et al. (2008) Consensus guidelines for the management of patients with digestive neuroendocrine tumors — well-differentiated jejunal-ileal tumor/carcinoma. Neuroendocrinology, 87: 8–19.
30. Eriksson B., Oberg K. (1991) Peptide hormones as tu- mor markers in neuroendocrine gastrointestinal tumors. Acta. Oncol., 30: 477–483.
31. Eriksson J., Stalberg P., Nilsson A. et al. (2008) Surgery and radiofrequency ablation for treatment of liver metastases from midgut and foregut carcinoids and endocrine pancreatic tumors. World J. Surg., 32: 930–938.
32. Ezziddin S., Logvinski T., Yong-Hing C. et al. (2006) Factors predicting tracer uptake in somatostatin receptor and MIBG scintigraphy of metastatic gastroenteropancreatic neuroendocrine tumors. J. Nucl. Med., 47: 223–233.
33. Falconi M., Eriksson B., Kaltsas G. et al. (2016) Vienna Consensus Conference participants: ENETS consensus guidelines update for the management of functional pancreatic neuroendocrine tumors and non-functional pancreatic neuroendocrine tumors. Neuroendocrinology, 103: 153–171.
34. Feldman J.M., O’Dorisio T.M. (1986) Role of neuro-peptides and serotonin in the diagnosis of carcinoid tumors. Am. J. Med., 81: 41–48.
35. Frilling A., Smith G., Clift A.K., Martin J. (2014) Capsule endoscopy to detect primary tumour site in metastatic neuroendocrine tumours. Dig. Liver Dis., 46: 1038–1042.
36. Gabriel M., Decristoforo C., Kendler D. et al. (2007) 68Ga-DOTA-Tyr3-octreotide PET in neuroendocrine tumors: comparison with somatostatin receptor scintigraphy and CT. J. Nucl. Med., 48: 508–518.
37. Garcia-Carbonero R., Capdevila J., Crespo-Herrero G. et al. (2010) Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs): results from the National Cancer Registry of Spain (RGETNE). Ann. Oncol., 21: 1794–1803.
38. Garcia-Carbonero R., Sorbye H., Baudin E. et al. (2016) Vienna Consensus Conference participants: ENETS consensus guidelines for high-grade gastroenteropancreatic neuroendocrine tumors and neuroendocrine carcinomas. Neuroendocrinology, 103: 186–194.
39. Giusti M., Sidoti M., Augeri C. et al. (2004) Effect of short-term treatment with low dosages of the proton-pump inhibitor omeprazole on serum chromogranin A levels in man. Eur. J. Endocrinol., 150: 299–303.
40. Givi B., Pommier S.J., Thompson A.K. et al. (2006) Operative resection of primary carcinoid neoplasms in patients with liver metastases yields significantly better survival. Surgery, 140: 891–897; discussion 897–898.
41. Goede A.C., Winslet M.C. (2003) Surgery for carcinoid tumours of the lower gastrointestinal tract. Colorectal. Dis., 5: 123–128.
42. Grabowski P., Schrader J., Wagner J. et al. (2008) Loss of nuclear p27 expression and its prognostic role in relation to cyclin E and p53 mutation in gastroenteropancreatic neuroendocrine tumors. Clin. Cancer Res., 14: 7378–7384.
43. Grozinsky-Glasberg S., Grossman A.B., Gross D.J. (2015) Carcinoid heart disease: from pathophysiology to treatment — ‘Something in the way it moves’. Neuroendocrinology, 101: 263–273.
44. Habbe N., Fendrich V., Heverhagen A. et al. (2013) Outcome of surgery for ileojejunal neuroendocrine tumors. Surg. Today, 43: 1168–1174.
45. Hamilton S.R., Aaltonen L.A. (Eds.) (2000) Tumours of the Digestive System. Pathology and Genetics. WHO Classification of Tumours. Lyon, ARC.
46. Han S.L., Cheng J., Zhou H.Z. et al. (2010) Surgically treated primary malignant tumor of small bowel: a clinical analysis. World J. Gastroenterol.,16: 1527–1532.
47. Hassan M.M., Phan A., Li D. et al. (2008) Family history of cancer and associated risk of developing neuroendocrine tumors: a case-control study. Cancer Epidemiol. Biomarkers Prev., 17: 959–965.
48. Haug A., Auernhammer C.J., Wangler B. et al. (2009) Intraindividual comparison of 68Ga-DOTA-TATE and 18F-DOPA PET in patients with well-differentiated metastatic neuroendocrine tumours. Eur. J. Nucl. Med. Mol. Imaging, 36: 765–770.
49. Hauso O., Gustafsson B.I., Kidd M. et al. (2008)Neuroendocrine tumor epidemiology: contrasting Norway and North America. Cancer, 113: 2655–2664.
50. Helland S.K., Prosch A.M., Viste A. (2006) Carcinoid tumours in the gastrointestinal tract — a population-based study from Western Norway. Scand. J. Surg., 95: 158–161.
51. Hellman P., Lundstrom T., Ohrvall U. et al. (2002) Effect of surgery on the outcome of midgut carcinoid disease with lymph node and liver metastases. World J. Surg., 26: 991–997.
52. Hemminki K., Li X. (2001) Familial carcinoid tumors and subsequent cancers: a nation-wide epidemiologic study from Sweden. Int. J. Cancer, 94: 444–448.
53. Ito T., Sasano H., Tanaka M. et al. (2010) Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J. Gastroenterol., 45: 234–243.
54. Jacobsen M.B., Nitter-Hauge S., Bryde P.E., Hanssen L.E. (1995) Cardiac manifestations in midgut carcinoid disease. Eur. Heart J., 16: 263–268.
55. Jann H., Roll S., Couvelard A. et al. (2011) Neuroendocrine tumors of midgut and hindgut origin: tumor-node-metastasis classification determines clinical outcome. Cancer, 117: 3332–3341.
56. Jarhult J., Landerholm K., Falkmer S. et al. (2010) First report on metastasizing small bowel carcinoids in first-degree relatives in three generations. Neuroendocrinology, 91: 318–323.
57. Kaltsas G., Rockall A., Papadogias D. et al. (2004) Recent advances in radiological and radionuclide imaging and therapy of neuroendocrine tumours. Eur. J. Endocrinol., 151: 15–27.
58. Kamaoui I., De-Luca V., Ficarelli S. et al. (2010) Value of CT enteroclysis in suspected small-bowel carcinoid tumors. AJR Am. J. Roentgenol., 194: 629–633.
59. Kema I.P., Meijer W.G., Meiborg G. et al. (2001) Profiling of tryptophan-related plasma indoles in patients with carcinoid tumors by automated, on-line, solid-phase extraction and HPLC with fluorescence detection. Clin. Chem., 47:1811–1820.
60. Klimstra D.S., Arnold R., Capella C. et al. (2010) WHO Classification of Tumours of the Digestive System. Lyon, IACR.
61. Koopmans K.P., de Vries E.G., Kema I.P. et al. (2006) Staging of carcinoid tumours with 18F-DOPA PET: a prospective, diagnostic accuracy study. Lancet Oncol., 7: 728–734.
62. Koopmans K.P., Neels O.C., Kema I.P. et al. (2008) Improved staging of patients with carcinoid and islet cell tumors with 18F-dihydroxy-phenyl-alanine and 11C-5-hydroxy-tryptophan positron emission tomography. J. Clin. Oncol., 26: 1489–1495.
63. Korse C.M., Bonfrer J.M., Aaronson N.K. et al. (2009) Chromogranin A as an alternative to 5-hydroxyindoleacetic acid in the evaluation of symptoms during treatment of patients with neuroendocrine tumors. Neuroendocrinology, 89: 296–301.
64. Landerholm K., Falkmer S., Jarhult J. (2010) Epidemiology of small bowel carcinoids in a defined population. World J. Surg., 34: 1500–1505.
65. Landerholm K., Zar N., Andersson R.E. et al. (2011) Survival and prognostic factors in patients with small bowel carcinoid tumour. Br. J. Surg., 98: 1617–1624.
66. Landry C.S., Lin H.Y., Phan A. et al. (2013) Resection of at-risk mesenteric lymph nodes is associated with improved survival in patients with small bowel neuroendocrine tumors. World J. Surg., 37: 1695–1700.
67. Lepage C., Bouvier A.M., Manfredi S. et al. (2006) Incidence and management of primary malignant small bowel cancers: a well-defined French population study. Am. J. Gastroenterol., 101: 2826–2832.
68. Makridis C., Oberg K., Juhlin C. et al. (1990) Surgical treatment of mid-gut carcinoid tumors. World J. Surg., 14: 377–383; discussion 384–375.
69. Mansencal N., McKenna W.J., Mitry E. et al. (2010) Comparison of prognostic value of tissue Doppler imaging in carcinoid heart disease versus the value in patients with the carcinoid syndrome but without carcinoid heart disease. Am. J. Cardiol., 105: 527–531.
70. Mansencal N., Mitry E., Bachet J.B. et al. (2010) Echocardiographic follow-up of treated patients with carcinoid syndrome. Am. J. Cardiol., 105: 1588–1591.
71. Mansencal N., Mitry E., Forissier J.F. et al. (2006) Assessment of patent foramen ovale in carcinoid heart disease. Am. Heart J., 151: 1129.e1121–e1126.
72. Mansencal N., Mitry E., Pilliere R. et al. (2008) Prevalence of patent foramen ovale and usefulness of percutaneous closure device in carcinoid heart disease. Am. J. Cardiol., 101: 1035–1038.
73. Masselli G., Polettini E., Casciani E. et al. (2009) Small-bowel neoplasms: prospective evaluation of MR enteroclysis. Radiology, 251: 743–750.
74. Massironi S., Fraquelli M., Paggi S. et al. (2009) Chromogranin A levels in chronic liver disease and hepatocellular carcinoma. Dig. Liver Dis., 41: 31–35.
75. Meijer W.G., Kema I.P., Volmer M. et al. (2000) Discriminating capacity of indole markers in the diagnosis of carcinoid tumors. Clin. Chem., 46: 1588–1596.
76. Meijer W.G., van der Veer E., Jager P.L. et al. (2003) Bone metastases in carcinoid tumors: clinical features, imaging characteristics, and markers of bone metabolism. J. Nucl. Med., 44: 184–191.
77. Miederer M., Seidl S., Buck A. et al. (2009) Correlation of immunohistopathological expression of somatostatin receptor 2 with standardised uptake values in 68Ga-DOTATOC PET/CT. Eur. J. Nucl. Med. Mol. Imaging, 36: 48–52.
78. Modlin I.M., Oberg K., Chung D.C. et al. (2008) Gastroenteropancreatic neuroendocrine tumours. Lancet Oncol., 9: 61–72.
79. Moertel C.G. (1987) Karnofsky memorial lecture. An odyssey in the land of small tumors. J. Clin. Oncol., 5: 1502–1522.
80. Moller J.E., Connolly H.M., Rubin J. et al. (2003) Factors associated with progression of carcinoid heart disease. N. Engl. J. Med., 348: 1005–1015.
81. Moller J.E., Pellikka P.A., Bernheim A.M. et al. (2005) Prognosis of carcinoid heart disease: analysis of 200 cases over two decades. Circulation, 112: 3320–3327.
82. Montravers F., Kerrou K., Nataf V. et al. (2009) Impact of fluorodihydroxyphenylalanine-18F positron emission tomography on management of adult patients with documented or occult digestive endocrine tumors. J. Clin. Endocrinol. Metab., 94: 1295–1301.
83. Niederle M.B., Niederle B. (2011) Diagnosis and treatment of gastroenteropancreatic neuroendocrine tumors: current data on a prospectively collected, retrospectively analyzed clinical multicenter investigation. Oncologist, 16: 602–613.
84. Niederle M.B., Hackl M., Kaserer K., Niederle B. (2010) Gastroenteropancreatic neuroendocrine tumours: the current incidence and staging based on the WHO and European Neuroendocrine Tumour Society classification: an analysis based on prospectively collected parameters. Endocr. Relat. Cancer, 17: 909– 918.
85. Norheim I., Oberg K., Theodorsson-Norheim E. et al. (1987) Malignant carcinoid tumors. An analysis of 103 patients with regard to tumor localization, hormone production, and survival. Ann. Surg., 206: 115–125.
86. Norlen O., Hessman O., Stalberg P. et al. (2010) Prophylactic cholecystectomy in midgut carcinoid patients. World. J. Surg., 34: 1361–1367.
87. Norlen O., Stalberg P., Oberg K. et al. (2012) Long-term results of surgery for small intestinal neuroendocrine tumors at a tertiary referral center. World J. Surg., 36: 1419–1431.
88. Norton J.A. (1994) Surgical management of carcinoid tumors: role of debulking and surgery for patients with advanced disease. Digestion, 55(suppl. 3): 98–103.
89. O’Toole D., Grossman A., Gross D. et al. (2009) ENETS consensus guidelines for the standards of care in neuroendocrine tumors: biochemical markers. Neuroendocrinology, 90: 194–202.
90. Oberndorfer S. (1907) Karzinoide Tumoren des Dünndarms. Frankf Z. Pathol., 1: 426–432.
91. Ohrvall U., Eriksson B., Juhlin C. et al. (2000) Method for dissection of mesenteric metastases in mid-gut carcinoid tumors. World J. Surg., 24: 1402–1408.
92. Orlefors H., Sundin A., Garske U. et al. (2005) Whole-body (11)C-5-hydroxytryptophan positron emission tomography as a universal imaging technique for neuroendocrine tumors: comparison with somatostatin receptor scintigraphy and computed tomography. J. Clin. Endocrinol. Metab., 90: 3392–3400.
93. Pape U.F., Berndt U., Muller-Nordhorn J. et al. (2008) Prognostic factors of long-term outcome in gastroenteropancreatic neuroendocrine tumours. Endocr. Relat. Cancer, 15: 1083–1097.
94. Pape U.F., Bohmig M., Berndt U. et al. (2004) Survival and clinical outcome of patients with neuroendocrine tumors of the gastroenteropancreatic tract in a German referral center. Ann. NY Acad. Sci., 1014: 222–233.
95. Pape U.F., Niederle B., Costa F. et al. (2016) Vienna Consensus Conference participants: ENETS consensus guidelines for neuroendocrine neoplasms of the appendix (excluding goblet cell carcinomas). Neuroendocrinology, 103: 144–152.
96. Pape U.F., Perren A., Niederle B. et al. (2012) ENETS Consensus Guidelines for the management of patients with neuroendocrine neoplasms from the jejunoileum and the appendix including goblet cell carcinomas. Neuroendocrinology, 95: 135–156.
97. Pavel M., Baudin E., Couvelard A. et al. (2012) ENETS consensus guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut and unknown primary. Neuroendocrinology, 95: 157–176.
98. Pavel M., O’Toole D., Costa F. et al. (2016) Vienna Consensus Conference participants: ENETS consensus guidelines update for the management of distant metastatic disease of intestinal, pancreatic, bronchial neuroendocrine neoplasms (NEN) and NEN of unknown primary site. Neuroendocrinology, 103: 172–185.
99. Peracchi M., Gebbia C., Basilisco G. et al. (2005) Plasma chromogranin A in patients with autoimmune chronic atrophic gastritis, enterochromaffin-like cell lesions and gastric carcinoids. Eur. J. Endocrinol., 152: 443–448
100. Perez E.A., Koniaris L.G., Snell S.E. et al. (2007) 7201 carcinoids: increasing incidence overall and disproportionate mortality in the elderly. World J. Surg., 31: 1022–1030.
101. Plockinger U., Rindi G., Arnold R. et al. (2004) Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology, 80: 394–424.
102. Ploeckinger U., Kloeppel G., Wiedenmann B., Lohmann R. (2009) The German NET-registry: an audit on the diagnosis and therapy of neuroendocrine tumors. Neuroendocrinology, 90: 349–363.
103. Prasad V., Ambrosini V., Hommann M. et al. (2010) Detection of unknown primary neuroendocrine tumours (CUP-NET) using (68)Ga-DOTA-NOC receptor PET/CT. Eur. J. Nucl. Med. Mol. Imaging, 37: 67–77.
104. Prasad V., Baum R.P. (2010) Biodistribution of the Ga-68 labeled somatostatin analogue DOTA-NOC in patients with neuroendocrine tumors: characterization of uptake in normal organs and tumor lesions. Q. J. Nucl. Med. Mol. Imaging, 54: 61–67.
105. Quaedvlieg P.F., Visser O., Lamers C.B. et al. (2001) Epidemiology and survival in patients with carcinoid disease in The Netherlands. An epidemiological study with 2391 patients. Ann. Oncol., 12: 1295–1300.
106. Ramage J.K., De Herder W.W., Delle Fave G. et al. (2016) Vienna Consensus Conference participants: ENETS consensus guidelines update for colorectal neuroendocrine neoplasms. Neuroendocrinology, 103: 139–143.
107. Ricke J., Klose K.J., Mignon M. et al. (2001) Standardisation of imaging in neuroendocrine tumours: results of a European delphi process. Eur. J. Radiol., 37: 8–17.
108. Rindi G., Kloppel G., Couvelard A. et al. (2007) TNM staging of midgut and hindgut (neuro) endocrine tumors: a consensus proposal including a grading system. Virchows Arch., 451: 757–762.
109. Rinke A., Wittenberg M., Schade-Brittinger C. et al. (2016) Placebo controlled, double blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors (PROMID): results on long term survival. Neuroendocrinology, 104(1): 26–32.
110. Rothmund M., Kisker O. (1994) Surgical treatment of carcinoid tumors of the small bowel, appendix, colon and rectum. Digestion, 55(suppl. 3): 86–91.
111. Ruf J., Heuck F., Schiefer J. et al. (2010) Impact of multiphase 68Ga-DOTATOC-PET/CT on therapy management in patients with neuroendocrine tumors. Neuroendocrinology, 91: 101–109.
112. Ruf J., Schiefer J., Furth C. et al. (2011) 68Ga-DOTA-TOC PET/CT of neuroendocrine tumors: spotlight on the CT phases of a triple-phase protocol. J. Nucl. Med., 52: 697–704.
113. Ruf J., Steffen I., Mehl S. et al. (2007) Influence of attenuation correction by integrated low-dose CT on somatostatin receptor SPECT. Nucl. Med. Commun, 28: 782–788.
114. Sandmann H., Pakkal M., Steeds R. (2009) Cardiovascular magnetic resonance imaging in the assessment of carcinoid heart disease. Clin. Radiol., 64: 761–766.
115. Scherübl H., Jensen R.T., Cadiot G. et al. (2010) Neuroendocrine tumors of the small bowels are on the rise: Early aspects and management. World J. Gastrointest. Endosc., 2(10): 325–334.
116. Scherubl H., Streller B., Stabenow R. et al. (2013) Clinically detected gastroenteropancreatic neuroendocrine tumors are on the rise: epidemiological changes in Germany. World J. Gastroenterol., 19: 9012–9019.
117. Schindl M., Kaczirek K., Passler C. et al. (2002) Treatment of small intestinal neuroendocrine tumors: is an extended multimodal approach justified? World J. Surg., 26: 976–984.
118. Schmitt A.M., Riniker F., Anlauf M. et al. (2008) Islet 1 (Isl1) expression is a reliable marker for pancreatic endocrine tumors and their metastases. Am. J. Surg. Pathol., 32: 420–425.
119. Schreiter N.F., Bartels A.M., Froeling V. et al. (2014) Searching for primaries in patients with neuroendocrine tumors (NET) of unknown primary and clinically suspected NET: evaluation of Ga-68 DOTATOC PET/CT and In-111 DTPA octreotide SPECT/CT. Radiol. Oncol., 48: 339–347.
120. Shamiyeh A., Gabriel M. (2014) Laparoscopic resection of gastrointestinal neuroendocrine tumors with special contribution of radionuclide imaging. World J. Gastroenterol., 20: 15608–15615.
121. Sobin L.H., Gospodarowicz M.K., Wittekind C. (2009) TNM Classification of Malignant Tumours. Oxford, Wiley-Blackwell.
122. Spadaro A., Ajello A., Morace C. et al. (2005) Serum chromogranin-A in hepatocellular carcinoma: diagnostic utility and limits. World J. Gastroenterol., 11: 1987–1990.
123. Stancu M., Wu T.T., Wallace C. et al. (2003) Genetic alterations in goblet cell carcinoids of the vermiform appendix and comparison with gastrointestinal carcinoid tumors. Mod. Pathol., 16: 1189–1198.
124. Steinmuller T., Kianmanesh R., Falconi M. et al. (2008) Consensus guidelines for the management of patients with liver metastases from digestive (neuro)endocrine tumors: foregut, midgut, hindgut, and unknown primary. Neuroendocrinology, 87: 47–62.
125. Strosberg J., Gardner N., Kvols L. (2009) Survival and prognostic factor analysis of 146 metastatic neuroendocrine tumors of the mid-gut. Neuroendocrinology, 89: 471–476.
126. Sutton R., Doran H.E., Williams E.M. et al. (2003) Surgery for midgut carcinoid. Endocr. Relat. Cancer, 10: 469–481.
127. Tonnies H., Toliat M.R., Ramel C. et al. (2001) Analysis of sporadic neuroendocrine tumours of the enteropancreatic system by comparative genomic hybridisation. Gut, 48: 536–541.
128. Toumpanakis C., Garland J., Marelli L. et al. (2009) Long-term results of patients with malignant carcinoid syndrome receiving octreotide LAR. Aliment. Pharmacol. Ther., 30: 733–740.
129. Voland P., Besig S., Rad R. et al. (2009) Correlation of matrix metalloproteinases and tissue inhibitors of matrix metalloproteinase expression in ileal carcinoids, lymph nodes and liver metastasis with prognosis and survival. Neuroendocrinology, 89: 66–78.
130. Wang Y.Z., Carrasquillo J.P., McCord E. et al. (2014) Reappraisal of lymphatic mapping for midgut neuroendocrine patients undergoing cytoreductive surgery. Surgery, 156: 1498–1502; discussion 1502–1503.
131. Welin S., Sorbye H., Sebjornsen S. et al. (2011) Clinical effect of temozolomide-based chemotherapy in poorly differentiated endocrine carcinoma after progression on first-line chemotherapy. Cancer, 117: 4617–4622.
132. Welin S., Stridsberg M., Cunningham J. et al. (2009) Elevated plasma chromogranin A is the first indication of recurrence in radically operated midgut carcinoid tumors. Neuroendocrinology, 89: 302–307.
133. Yao J.C., Hassan M., Phan A. et al. (2008) One hundred years after ‘carcinoid’: epidemiology of and prognostic factors for neuroendocrine tumors in 35, 825 cases in the United States. J. Clin. Oncol., 26: 3063–3072.
134. Zuetenhorst J.M., Bonfrer J.M., Korse C.M. et al. (2003) Carcinoid heart disease: the role of urinary 5-hydroxyindoleacetic acid excretion and plasma levels of atrial natriuretic peptide, transforming growth factor-beta and fibroblast growth factor. Cancer, 97: 1609–1615.
135. Zuetenhorst J.M., Korse C.M., Bonfrer J.M. et al. (2004) Role of natriuretic peptides in the diagnosis and treatment of patients with carcinoid heart disease. Br. J. Cancer, 90: 2073–2079.
Клинические рекомендации по диагностике и лечению нейроэндокринных опухолей тонкой кишки
Национальный институт рака, Киев
Резюме. Нейроэндокринные опухоли (НЭО) объединяют довольно большую группу новообразований, характеризующихся биологическим разнообразием и гетерогенностью. По данным Всемирной организации здравоохранения, за последние годы отмечается повышение частоты выявления НЭО до 3,65 на 100 тыс. населения. Стадия и дифференцирование НЭО являются основными факторами прогноза у пациентов с НЭО желудочно-кишечного тракта (ЖКТ). Применение современных методов диагностики — компьютерной томографии, магнитно-резонансной томографии, сцинтиграфии, позитронно-эмиссионной томографии, совмещенной с компьютерной томографией, и иммуногистохимического исследования биологического материала — играет ключевую роль в выявлении НЭО ЖКТ. Основные принципы хирургического лечения заключаются в адекватном объеме лимфодиссекции, удалении всех видимых первичных пальпабельных опухолей, устранении рецидива и метастазов. Медикаментозное лечение пациентов с НЭО ЖКТ IV стадии зависит от степени градации (G), индекса пролиферации (Ki-67) и митотической активности и заключается в применении пролонгированных октреотидов, иммунотерапии, системной химиотерапии и локорегионарной терапии. Медиана общей выживаемости пациентов с НЭО ЖКТ I–II стадии, получивших лечение, составляет 112–70 мес, III — 70–105 мес и IV — 13–60 мес. Представленные рекомендации по диагностике и лечению пациентов с НЭО ЖКТ базируются на рекомендациях ENETS 2016 г., NCCN 03/2017, данные которых обновлялись на основе просмотра литературы на базе поискового ресурса PubMed за 2015–2016 гг.
нейроэндокринные опухоли желудочно-кишечного тракта; клинические рекомендации; методы диагностики; хирургическое лечение; циторедуктивные операции; гормонотерапия; химиотерапия.
Зубарєв Микола Геннадійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: mykola.zubaryev@gmail.com
Correspondence:
Zubaryev Mykola Hennadiiovych
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: mykola.zubaryev@gmail.com














Leave a comment