Клінічні рекомендації діагностики та лікування метастатичних нейроендокринних пухлин шлунково-кишкового тракту
Зубарєв М.Г., Колеснік О.О., Лукашенко А.В., Бойко А.В., Рудськой А.Д., Остапенко Ю.В.
Резюме. Метастатичні нейроендокринні пухлини (НЕП) шлунково-кишкового тракту (ШКТ) виникають доволі часто порівняно з іншими локалізаціями НЕП. Найчастіше метастази локалізуються у печінці та лімфатичних вузлах, рідше — у кістках та інших органах. Завдяки сучасним методам діагностики, таким як магнітно-резонансна томографія, комп’ютерна томографія, октреоскан та позитронно-емісійна томографія, поєднана з комп’ютерною томографією, із застосуванням нових радіофармпрепаратів, вдається не тільки виявляти метастази (Мтс) НЕП, але і локалізувати первинну пухлину, що до останнього часу було однією з основних проблем у діагностиці та лікуванні Мтс НЕП. Хірургічний метод залишається найефективнішим лікуванням Мтс НЕП, метою якого є видалення первинної пухлини та всіх Мтс (з печінки, очеревини, легень та ін.), що значно покращує загальну виживаність пацієнтів. Також з успіхом використовуються локорегіонарні методи лікування (радіочастотна термоабляція, емболізація та локальна променева терапія). Знайшли своє застосування аналоги октреотиду (пролонговані октреотиди) та таргетні препарати, які дозволили покращити віддалені результати у випадку нерезектабельних НЕП та Мтс, а також ефективно контролювати карциноїдний синдром. Метою цього дослідження було провести огляд літератури за останнє десятиліття, присвяченої проблемі діагностики та лікування метастатичних НЕП, і висвітлити сучасний підхід та останні дані щодо використання нових методів і технологій у лікуванні Мтс НЕП. Слід врахувати, що більшість робіт, присвячених цій проблемі, базується на даних незначної кількості проспективних та неконтрольованих досліджень, тому, беручи до уваги різноманітність ефективних лікувальних опцій для пацієнтів з Мтс НЕП ШКТ, дуже важливо ретельно оцінити кожний конкретний випадок та обговорити майбутній план лікування мультидисциплінарною командою. Наведені рекомендації базуються на даних клінічних рекомендацій Європейської асоціації нейроендокринних пухлин (ENETS) за 2016 р., американських Національних стандартів діагностики та лікування злоякісних пухлин (NCCN), 3-тє видання за 2017 р., огляду літератури за 2010–2017 рр. з використанням пошукового ресурсу PubMed та даних хворих з Мтс НЕП, пролікованих у Національному інституті раку в період з 1997 по 2017 р.
Отримано 20.03.2018
Прийнято до друку 30.04.2018
Вступ
Наведені рекомендації базуються на даних клінічних рекомендацій Європейської асоціації нейроендокринних пухлин (European Neuroendocrine Tumor Society — ENETS) за 2016 р., американських Національних стандартів діагностики та лікування злоякісних пухлин (National Comprehensive Cancer Network — NCCN), 3-тє видання за 2017 р., огляду літератури за 2010–2017 рр. з використанням пошукового ресурсу PubMed та даних хворих з метастазами (Мтс) НЕП, пролікованих у Національному інституті раку (Київ, Україна) в період з 1997 по 2017 р.
Метастатичні нейроендокринні пухлини (НЕП) шлунково-кишкового тракту (ШКТ) виникають доволі часто порівняно з іншими локалізаціями НЕП [4, 5]. Так, майже у 50% пацієнтів при встановленні первинної НЕП тонкої кишки та підшлункової залози (ПЗ) виявляють віддалені Мтс, кількість яких пропорційно збільшується в часі від моменту виявлення первинної НЕП [2–4]. Найчастіше віддалені Мтс локалізуються у печінці та лімфатичних вузлах, на відміну від Мтс у кістках, які відмічають у 15% випадків [5, 6]. Хоча останні дані свідчать про те, що кількість Мтс у кістках недооцінена і їх може бути значно більше. Так, завдяки сучасним методам діагностики, таким як магнітно-резонансна томографія (МРТ) та Ga-DOTA-TOC/NOC/TATE PET/CT, кількість виявлених Мтс у кістках є значно більшою, ніж при інших методах діагностики, наприклад комп’ютерній томографії (КТ) та октреоскані. Рідше НЕП ШКТ метастазують у легені, центральну нервову систему та очеревину [6–9].
Найефективнішим методом лікування Мтс НЕП, як і первинних НЕП, залишається хірургічний. Він включає резекцію печінки, уражену Мтс, локорегіонарний вплив та радіочастотну термоабляцію (РЧТА). Найчастіше хірургічний метод використовується за відсутності позапечінкових Мтс, у випадку функціонуючих НЕП, якщо основна маса пухлини локалізується у печінці. Ефективність резекції та локорегіонарних методів лікування оцінено на основі незначної кількості проспективних та неконтрольованих досліджень, тому прийняття рішення щодо ефективності того чи іншого методу базується на експертній оцінці у кожному конкретному випадку. Обмаль доказової бази слід врахувати при плануванні лікування пацієнтів з Мтс НЕП ШКТ, коли будуть застосовані хірургічний підхід, різні локорегіонарні методи (емболізація, хемоемболізація, РЧТА, селективна внутрішня променева терапія — SIRT) та системна терапія. Аналоги октреотиду (пролонговані октреотиди — ПО) та таргетні препарати, такі як тирозинкіназний інгібітор сунітиніб та mTOR інгібітор еверолімус, є єдиними препаратами, ефективність яких оцінена у плацебо-контрольованих дослідженнях. Завдяки цим дослідженням ПО, сунітиніб та еверолімус випробувані, затверджені та зареєстровані як препарати з антипроліферативним ефектом при лікуванні НЕП різних локалізацій, крім низькодиференційованої нейроендокринної карциноми. Останні дані, отримані у плацебо-контрольованому дослідженні із застосуванням ланреотиду (CLARINET), підтверджують антипроліферативний ефект останнього у пацієнтів з НЕП тонкої кишки та ПЗ. Також нещодавно представлено дані інших плацебо-контрольованих досліджень із застосуванням еверолімусу при НЕП тонкої кишки та НЕП без виявленого первинного вогнища (RADIAT-3, RADIANT-4), Lu177-DOTATATE проти високих доз ПО у пацієнтів з Мтс НЕП ШКТ (NETTER-1), телотристату етипрату проти плацебо при карциноїдному синдромі (TELESTAR), які свідчать про ефективність застосування досліджуваних препаратів, що проявлялося у збільшенні медіани загальної та безрецидивної виживаності [10–12]. Власне, отримані дані з наведених вище досліджень кардинально вплинули на формування сучасних клінічних рекомендацій та терапевтичного алгоритму лікування при метастатичних НЕП ШКТ.
Враховуючи різноманітність ефективних лікувальних опцій для пацієнтів з Мтс НЕП ШКТ, дуже важливо ретельно оцінити кожний конкретний випадок із застосуванням сучасних методів досліджень, обговорити майбутній план мультидисциплінарною командою спеціалістів та приділити особливу увагу можливостям застосування хірургічного методу у випадку потенційно резектабельної НЕП, локорегіонарного та медикаментозного методів лікування у випадку місцево-поширеної та метастатичної НЕП ШКТ. У статті підсумовано варіанти застосування різних методів лікування Мтс НЕП. При плануванні системного лікування ПО, таргетними препаратами та хіміотерапією (ХТ) важливо врахувати морфологічні особливості НЕП, ступінь градації (G), експресію соматостатинових рецепторів, розповсюдженість хвороби у кожному конкретному випадку.
Практичні рекомендації діагностики та лікування метастатичних НЕП ШКТ
Особливості діагностики метастатичних НЕП ШКТ
Близько 50% пацієнтів з метастатичними НЕП ШКТ мають клінічні прояви у вигляді карциноїдного синдрому або його складових симптомів, такі як припливи, діарея, підвищення артеріального тиску, синдром карциноїдного серця, підвищення специфічних маркерів у крові та сечі. Але все ж таки у більшості пацієнтів Мтс НЕП ШКТ є безсимптомними, за винятком значно поширених Мтс, великих за розміром Мтс та первинної пухлини, які призводять до виникнення непрохідності ШКТ, кровотечі, печінкової недостатності та ін. Перш за все велику роль відіграють сучасні методи обстеження, такі як звичайна та капсульна ендоскопія, КТ та МРТ, ендо-УЗД. Але найбільшого значення у діагностиці та диференційній діагностиці Мтс НЕП ШКТ набули специфічні методи, а саме: позитронно-емісійна томографія, поєднана з комп’ютерною томографією (ПЕТ-КТ), із застосуванням радіонукліду 68Ga, міченого радіопептидами, тропними до 5 субтипів соматостатинових рецепторів 68Ga-DOTA-Tyr-octreotide, 68Ga-DOTATOC та 68Ga-DOTATATE; октреосканування із визначенням експресії соматостатинових рецепторів на поверхні НЕП.
Морфологічна діагностика відіграє вирішальну роль у виявленні НЕП, диференційній діагностиці та подальшій тактиці лікування пацієнтів з Мтс НЕП ШКТ. З метою отримання матеріалу для дослідження найчастіше використовують тонкоголкову біопсію або (що краще) трепан-біопсію для отримання достатньої кількості пухлинної тканини. Отриманий матеріал оцінюють за допомогою імуногістохімічного визначення синаптофізину та хромограніну. Визначення ступеня диференціації, grade G та рівня експресії Ki-67 є необхідним для вибору тактики лікування та подальшого прогнозу. У тих випадках, коли визначити первинну пухлини неможливо, слід проводити додаткові дослідження з метою встановлення походження метастатичних вогнищ шляхом дослідження матеріалу, отриманого з Мтс. Більш детально ця інформація представлена у розділі, присвяченому діагностиці та лікуванню Мтс НЕП ШКТ без виявленого первинного вогнища [13].
Хірургічне лікування
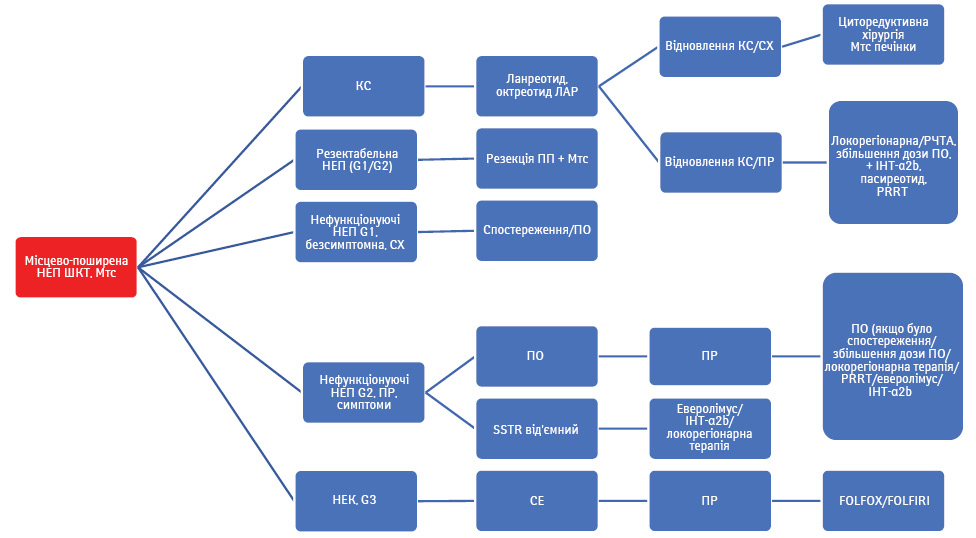
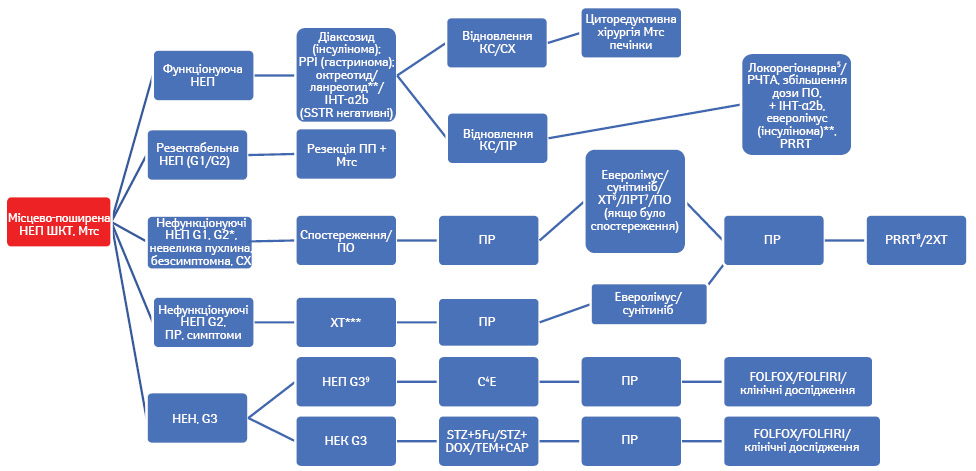
У випадку НЕП G1/G2 показане хірургічне лікування, навіть якщо присутні Мтс у печінці та лімфатичних вузлах. При нерезектабельній НЕП показане застосування локальних та медикаментозних методів лікування з метою контролю симптомів функціонуючих НЕП (карциноїдний синдром, діарея та ін.) та росту пухлини. У деяких випадках потрібно комбінувати методи лікування, наприклад симптоматичне — використання ПО разом з локорегіонарними методами (рис. 1).
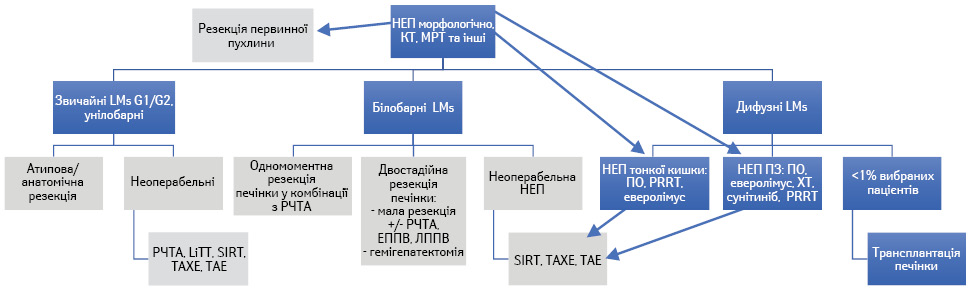
Локорегіонарні методи лікування
Усі локорегіонарні методи лікування Мтс НЕП ШКТ а саме емболізація, хемоемболізація, радіоемболізація, РЧТА та мікрохвильова термоабляція, або системне лікування слід використовувати при наявності певного досвіду та з індивідуальним підходом у кожному конкретному випадку з остаточним рішенням, прийнятим мультидисциплінарною командою. При плануванні локорегіонарного лікування слід враховувати індивідуальні особливості пацієнта та НЕП, такі як розмір, поширеність та кількість Мтс у печінці, їх васкуляризація, проліферативний індекс, наявність карциноїдного синдрому, супутня патологія та ін. [15]. При наявності Мтс НЕП тонкої кишки та карциноїдного синдрому слід разом з хірургічними методами використовувати ПО. Також локорегіонарна терапія Мтс НЕП може бути альтернативою системній терапії у разі нефункціонуючих НЕП. Застосування селективної внутрішньої променевої терапії все ще перебуває у стадії дослідження, тому широке застосування цього методу у випадку Мтс НЕП у печінці недоцільне [16–20].
За даними літератури, оцінка ефективності трьох варіантів локорегіонарної терапії, а саме емболізації, хемоемболізації та радіоемболізації (також відомої як селективна внутрішньопечінкова радіотерапія — STIR), проведена лише у невеликих локальних дослідженнях. На сьогодні не існує стандартів застосування зазначених методів у лікуванні Мтс НЕП ШКТ. Також немає даних, отриманих із рандомізованих проспективних досліджень про їх ефективність. Одне з проспективних досліджень, в якому порівнювали емболізацію з хемоемболізацією НЕТ ШКТ, було не завершене через недостатній набір пацієнтів. У 26 пацієнтів виявлено відсутність покращення безрецидивної виживаності при порівнянні двох методів, також не було різниці у токсичності. Селективна радіоемболізація відрізняється нижчою короткотривалою токсичністю порівняно з попередніми двома методами, але спричиняла хронічне захворювання печінки, подібне до цирозу, яке проявляється жовтяницею та портальною гіпертензією. Хоча все ж таки не існує достатньої доказової бази [13].
Циторедуктивна терапія
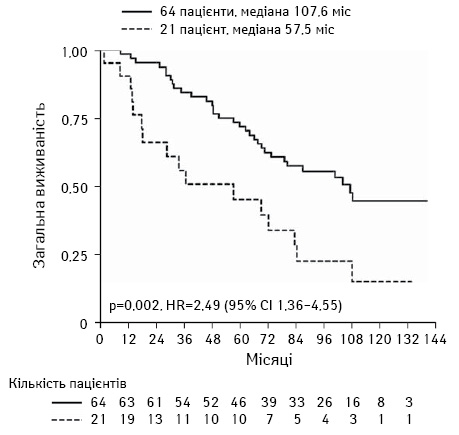
Циторедуктивна терапія — альтернативний метод локорегіонарної терапії у випадку неконтрольованих Мтс функціонуючих НЕП з карциноїдним синдромом, рефрактерною інсуліномою, глюкагономою та ВІПомою. Також циторедуктивна хірургія може бути використана у разі нефункціонуючих Мтс НЕП при відсутності прогресування протягом останніх 6 міс або коли великі розміри НЕП спричиняють локальні симптоми. Хоча, за даними деяких ретроспективних досліджень, видалення Мтс НЕП з печінки асоціюється з покращенням віддалених результатів [19–22], все ще залишається невизначеним ефективність такого методу у випадку нефункціонуючих НЕП. На жаль, відсоток рецидивів доволі високий, навіть якщо проведено хірургічне лікування, протягом 3–5 років хвороба повертається [4, 24]. Слід також пам’ятати, якщо у пацієнта наявний карциноїдний синдром, треба призначати октреотиди до та після хірургічного лікування з метою запобігання карциноїдному кризу.
Трансплантація печінки
Загалом трансплантація печінки не рекомендована пацієнтам з поширеною НЕП. Але в окремих випадках може бути варіантом лікування прицільно відібраних пацієнтів з карциноїдним синдромом або іншими функціонуючими НЕП з поширенням на печінку, які виявилися стійкими до локорегіонарної та системної терапії. Критерії відбору пацієнтів для трансплантації печінки у випадку Мтс НЕП такі: відсутність позапечінкових Мтс, високодиференційовані НЕП, відсутність жовтяниці. За даними деяких досліджень, вдалося досягти прийнятної 5-річної виживаності хворих на НЕП з Мтс у печінку після її трансплантації [25–27].
Системна терапія
Гормональна терапія
Контроль карциноїдного синдрому. ПО застосовуються у першій лінії терапії функціонуючих НЕП, у тому числі НЕП ПЗ (ВІПома та глюкагонома), а також НЕП, асоційованих із карциноїдним синдромом. Два основні сучасні препарати, доступні на ринку, а саме ПО та ланреотид, мають однакову ефективність у лікуванні кациноїдного синдрому. Застосовуються такі дози цих препаратів: октреотид ЛАР 10–30 мг 1 раз на місяць, ланреотид 60–120 мг 1 раз на місяць протягом тривалого часу. Перед застосуванням ПО слід проводити початкову терапію звичайним октреотидом 0,05–0,1 мг 2–3 рази на добу протягом 7–10 діб, особливо це важливо у пацієнтів з тяжким карциноїдним синдромом [28–30].
Згідно з сучасними рекомендаціями у випадку повернення синдрому рекомендовано підвищити дози ПО, але не ескалацією самої дози, а зменшенням інтервалу між введеннями, наприклад з 4 до 3 тиж.
Пасиреотид — новий ПО, який блокує 4- та 5-рецептори, не застосовується у лікуванні карциноїдного синдрому та функціонуючих НЕП, але з успіхом використовується у лікуванні Кушинг-синдрому у хворих на НЕП гіпофіза. Хоча існують дані, які підтверджують, що у 30% пацієнтів із карциноїдним синдромом на фоні неефективного лікування октреотидом ЛАР відмічається поліпшення після застосування пасиреотиду [32]. Але в іншому порівняльному дослідженні пасиреотид ЛАР 60 мг не показав жодних переваг перед октреотидом ЛАР 40 мг/міс [33]. Виходячи з даних цих досліджень, рекомендовано застосування пасиреотиду ЛАР у випадку відновлення карциноїдного синдрому на фоні лікування іншим ПО за умови ретельної селекції пацієнтів, яким неможливо застосувати всі інші варіанти терапії НЕП, такі як локорегіонарні, циторедуктивні, інтерферон-альфа (ІНТ-α) та інші сучасні препарати у рамках клінічних досліджень [34].
Телотристат етипрат — синтетичний інгібітор серотоніну, застосовується перорально, є ще одним новим препаратом, який виявився ефективним у лікуванні повторного карциноїдного синдрому на фоні лікування ПО [35, 36]. У III фазі плацебо-контрольованого дослідження TELESTAR телотристат етипрат суттєво зменшив вираженість симптомів діареї у пацієнтів з карциноїдним синдромом на фоні неефективного лікування ПО [12]. Крім того, цей препарат може бути ефективно застосований у терапії синдрому карциноїдного серця, коли ПО неефективні та визначаються високі рівні серотоніну у крові та 5-гідроксиіндолоцтової кислоти у сечі, а також є дані про ураження клапанів серця. Хоча знову ж такі ці дані не підтверджені відповідними дослідженнями.
Антипроліферативна дія ПО. У двох плацебо-контрольованих дослідженнях CLARINET (рис. 2) та PROMID (рис. 3) виявили антипроліферативну дію ПО — октреотиду та ланреотиду [37, 38]. З того часу ці два препарати рекомендовано до застосування з антипроліферативною метою у першій лінії терапії у пацієнтів з НЕП тонкої кишки. Також, керуючись сучасним консенсусом, ПО можуть бути застосовані у першій лінії лікування НЕП ПЗ (Ki-67 <10%). За даними дослідження CLARINET, виявлено антипроліферативні властивості ланреотиду у пацієнтів із НЕП ПЗ, тоді як не визначено подібного ефекту від октреотиду ЛАР [38, 39]. Застосування ПО у пацієнтів із НЕП ШКТ (окрім тонкої кишки та ПЗ) також базується на дослідженні CLARINET та рекомендовано при показниках Ki-67 <10% [38]. Але на сьогодні не існує єдиної думки експертів щодо застосування ПО при НЕП ШКТ у першій лінії саме з метою контролю росту пухлини. Рекомендації щодо застосування ПО також стосуються пацієнтів з метастатичним ураженням печінки (>25%), які базуються на дослідженні CLARINET [38]. Однак згідно з даними досліджень CLARINET та PROMID не виявлено покращення у медіані загальної виживаності пацієнтів з Мтс НЕП порівняно з плацебо [41]. Відповідно до сучасного консенсусу ПО призначають на початку лікування за умови наявності НЕП з Мтс в печінку (при ураженні печінки >25%) або/та наявності місцевого поширення і Мтс у інші органи. Також ПО призначають відразу у випадку НЕП ПЗ, беручи до уваги той факт, що 5-річна виживаність пацієнтів з IV стадією не перевищує 40% [42, 43]. Не існує даних про припинення застосування ПО у разі подальшого прогресування НЕП ШКТ на фоні їх застосування. У такому випадку рекомендується продовжити їх застосування при функціонуючих НЕП з метою корекції карциноїдного синдрому.
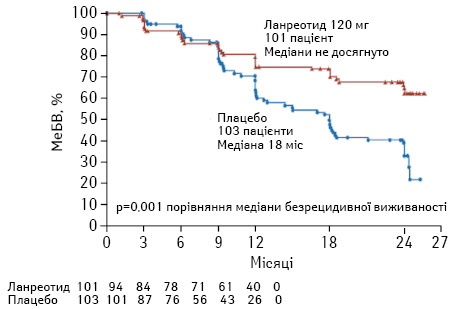
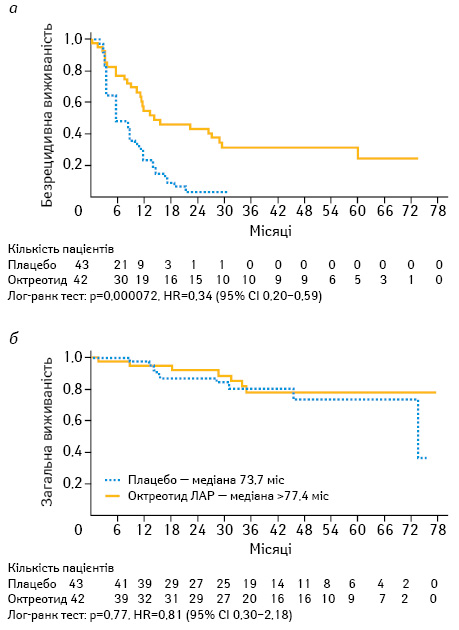
ПО можуть бути застосовані при інших НЕП, локалізованих, наприклад, у прямій кишці або бронхах, коли виявляються позитивні соматостатинові рецептори (позитивний рецепторний статус SSTR при октреоскануванні або імуногістохімічному дослідженні) та за умови G1/G2, при повільному прогресуванні пухлини та Ki-67 <10%.
ПО також рекомендовані при НЕП, коли SSTR від’ємний при малих за розміром пухлинах. Береться до уваги той факт, що у цьому випадку визначення негативного SSTR може бути помилковим внаслідок незначних розмірів НЕП. У цій ситуації визначення антитіл до рецепторів 2 за допомогою імуногістохімічного дослідження може бути вирішальним [44, 45] (див. рис. 2–4).
Інтерферон-альфа (ІНТ-α). ІНТ-α володіє антипроліферативною активністю щодо НЕП та застосовується у другій лінії системної терапії функціонально активних Мтс НЕП ШКТ.
Також рекомендовано проводити терапію ІНТ-α разом з ПО у випадку функціонуючих Мтс НЕП. Рекомендовані дози ІНТ-α2b 3×3, 3×5 МО/тиж [29, 44]. У випадку непереносимості останнього рекомендовано застосування пегільованого ІНТ-α2b у дозі 50–100 нг/тиж [46]. В одному рандомізованому дослідженні (SWOG trial) порівнювали антипроліферативну дію ІНТ-α та бевацизумабу у 400 пацієнтів з різними НЕП з карциноїдним синдромом та отримували у першій лінії ПО. Результатами цього дослідження показано відсутність різниці у антипроліферативній активності між двома досліджуваними препаратами. Також завдяки цьому дослідженню виявлено антипроліферативну активність ІНТ-α при Мтс НЕП G1/G2, прогресуючих НЕП та інших негативних факторах з медіаною безрецидивної виживаності 15,4 міс, досягнутою у групі ІНТ-α [47].
Таргетна терапія
Сучасні таргетні препарати, а саме еверолімус та сунітиніб, показані при НЕП ПЗ на основі даних двох плацебо-контрольованих досліджень лікування прогресуючих НЕП ПЗ. Медіана безрецидивної виживаності становила близько 11 міс у випадку застосування одного з цих двох препаратів, тоді як регресія пухлини виявлена у 5 та <10% пацієнтів з еверолімусом або сунітинібом відповідно. Застосування еверолімусу або сунітинібу рекомендовано при прогресуючих G1/G2 НЕП ПЗ, незалежно від показників Ki-67 та розмірів пухлини. Стандартна доза еверолімусу становить 10 мг/добу та сунітинібу — 37,5 мг/добу впродовж лікування. При виникненні побічних ефектів доза препаратів може бути знижена до 5 мг/добу еверолімусу та 25 мг/добу сунітинібу [48, 49]. Оскільки порівняння ефективності цих двох препаратів не проводилося, вибір одного з них відбувався на основі анамнезу хвороби та лікування пацієнтів, наявності побічної дії та доступності лікування.
Таргетні препарати, еверолімус або сунітиніб, представляють собою різні режими лікування НЕП ПЗ та можуть бути використані у першій та другій лінії терапії, враховуючи можливі варіанти ХТ та лікування із застосуванням ПО. Незважаючи на те що таргетні препарати можуть бути застосовані у першій лінії терапії НЕП ПЗ, згідно з останнім консенсусом їх широке застосування у першій лінії не рекомендоване внаслідок потенційної токсичності. Немає даних щодо послідовності застосування різних режимів системної терапії НЕП ПЗ. Потенційна токсичність також має бути взята до уваги при плануванні різних режимів, оскільки, наприклад, у одному ретроспективному мультицентровому дослідженні 169 пацієнтів в Італії виявлено збільшення проявів токсичності еверолімусу у хворих, які попередньо лікувалися із застосуванням пептидної рецепторної радіонуклідної терапії (PRRT) або ХТ [50].
В одному з клінічних досліджень SEQTOR на даний момент вивчається антипроліферативна активність еверолімусу порівняно з 5-флуороурацилом у комбінації зі стрептозоцином у пацієнтів з прогресуючими НЕП ПЗ.
Еверолімус також може бути застосований у пацієнтів з НЕП інших локалізацій ШКТ у разі наявності даних про їх прогресування (НЕП тонкої кишки та легень). Цей препарат може бути використаний у терапії НЕП тонкої кишки у другій та третій лінії після неефективного застосування ПО або ІНТ-α чи PRRT. Ці рекомендації засновані на даних дослідження RADIANT-4 [10], які демонструють поліпшення медіани безрецидивної виживаності у групі еверолімусу порівняно з групою плацебо у нефункціонуючих НЕП тонкої кишки та легень. Ці дані також підтверджені в іншому дослідженні RADIANT-2, в якому вивчали лікування пацієнтів із поширеними НЕП, які супроводжувалися карциноїдним синдромом [52].
Послідовність застосування еверолімусу у другій та третій лінії терапії поширених НЕП тонкої кишки також залежить від інших факторів, таких як, наприклад, доступність PRRT. У випадку експресії соматостатинових рецепторів при октреоскануванні можна досягти кращих результатів лікування, застосувавши PRRT, але, коли є значне ураження Мтс печінки, кісток та порушення функції нирок, використання цього методу терапії може бути протипоказано. Застосування еверолімусу також може бути обмеженим при наявності супутньої патології, такої як цукровий діабет та хвороби легень. Лікування еверолімусом та PRRT може розглядатися, коли є дані про неефективність ПО.
Не існує переконливих даних про ефективність інших відомих таргетних препаратів, а саме бевацизумабу, сорафенібу, пазопанібу, акситинібу, у хворих на НЕП ПЗ та інші НЕП ШКТ. Триває дослідження SUNLAND, в якому вивчається ефективність застосування сунітинібу у пацієнтів з НЕП тонкої кишки, але результати ще не доступні.
Вважається стандартною практикою комбінація таргетних препаратів з ПО при функціонуючих НЕП. Метою комбінації еверолімусу з ПО є не тільки антипроліферативна активність препаратів, але і контроль карциноїдного синдрому, наприклад, у пацієнтів із рецидивуючою гіпоглікемією, спричиненою метастатичною інсуліномою.
Застосування таргетних препаратів у комбінації з ПО у пацієнтів з нефункціонуючими НЕП може бути виправданим, враховуючи той факт, що майже у всіх пацієнтів відмічається надмірна експресія соматостатинових рецепторів. Але немає жодного вагомого доказу, що існує перевага цієї комбінації перед монотерапією з метою антипроліферативної дії еверолімусу або сунітинібу. Для прикладу, в одному сучасному порівняльному дослідженні лікування прогресуючих НЕП ПЗ (COOPERATE-2) не виявлено переваги між ефективністю еверолімусу в монотерапії проти еверолімусу у комбінації з більш ефективним пасиреотидом — препаратом нового покоління ПО — у медіані безрецидивної виживаності [52]. В іншому недавньому дослідженні II фази, в якому порівнювали ефективність комбінації еверолімусу з ПО — ланреотидом та октреотидом ЛАР — виявлено ефективність останньої комбінації, яка проявилася у позитивній відповіді на лікування — >90% при застосуванні її у першій лінії НЕП ШКТ [54].
Хіміотерапія
Системна ХТ рекомендована у випадку прогресуючої НЕП ПЗ та при нейроендокринній неоплазії ШКТ G3. Термін «G3 нейроендокринна неоплазія» об’єднує добре та помірно диференційовані НЕП з Ki-67 >20%, які не класифікуються за ВООЗ як велико- або дрібноклітинні з Ki-67 >20% нейроендокринні карциноми G3. ХТ також рекомендована при НЕП інших локалізацій, таких як НЕП шлунка, товстої та прямої кишки, за певних умов, а саме: при високому Ki-67 (>G2), швидкому прогресуванні, відсутності ефекту від попереднього лікування, негативних серотонінових рецепторах.
При G1-2 НЕП ПЗ хіміотерапевтичне лікування може використовуватися як інший варіант терапії. Режими ХТ включають: стрептозоцин + 5-флуороурацил (основний) або + доксорубіцин (альтернативний). Внаслідок кумулятивного ефекту доксорубіцину в дозі 500 мг/м, яка спричиняє кардіотоксичність, його використання є обмеженим. Терапевтичні режими можуть бути рекомендовані згідно з C.G. Moertel та співавторами (цикл — кожні 6 тиж) або M.L. Fjallskog та співавторами (цикл — кожні 3 тиж) [55–57]. За даними досліджень, режим ХТ з використанням трьох препаратів із додаванням цисплатину або із заміною 5-флуороурацилу на капецитабін не рекомендований [58–60]. Системна ХТ може бути застосована навіть без даних про попереднє прогресування патологічного процесу у пацієнтів із великою НЕП. Також слід вважати, що немає рекомендованого визначального рівня Ki-67 для прийняття рішення щодо проведення ХТ. Пацієнти з НЕП ПЗ з Ki-67 5–20% можуть одержувати ХТ. Інші фактори, які беруться до уваги на користь ХТ, такі: розповсюджена велика НЕП, симптоматична НЕП, швидке прогресування НЕП протягом 6–12 міс, пацієнти, у яких потенційно очікується позитивний ефект від ХТ, та подальше хірургічне лікування (неоад’ювантна ХТ).
Даних про ефективність комбінації темозоломіду з капецитабіном, якою нерідко заміняють схему стрептозоцин + 5-флуороурацил, обмаль, хоча ця схема набула певної популярності. Тому темозоломід/5-флуороурацил може бути альтернативним режимом ХТ, коли інша схема недоступна. За даними деяких невеликих проспективних та ретроспективних досліджень ефективності темозоломіду у комбінації з антиангіогенними препаратами та капецитабіном, об’єктивна відповідь коливалася між 15 та 70% [61, 63].
Після того як було виявлено недостатню ефективність схем із застосуванням стрептозоцину при НЕП ПЗ, почали використовувати альтернативні режими ХТ, такі як: темозоломід +/– капецитабін, оксаліплатин + 5-флуороурацил/капецитабін. Все ж таки залишається невідомим, який із цих режимів має бути в якості першої лінії, але у випадку НЕП ПЗ є відомості, що режим темозоломід +/– капецитабін є найефективнішим [61, 66 ,67].
Системна ХТ не рекомендована при НЕП інших відділів ШКТ, крім випадків виявлення G2 (Ki-67 >15%), агресивної біологічної поведінки НЕП (RECIST прогресування 3–6 міс) або якщо серотонінові рецептори негативні. Метрономічна ХТ може бути рекомендована як варіант із застосуванням темозоломіду та/або капецитабіну +/– ПО при G2 НЕП або коли SSTR-cтатус негативний. Комбінація капецитабіну та бевацизумабу може призначатися у разі неефективності інших режимів ХТ та типів терапії (таких як локорегіонарна або ІНТ-α2b, або еверолімус) [68–71].
При G3 нейроендокринній карциномі стандартним режимом ХТ є комбінація цисплатину та етопозиду як перша лінія. Цисплатин може бути замінений на карбоплатин, дані базуються на дослідженні Nordic NEC trial [74], у якому об’єктивна відповідь на лікування є високою і становить 40–67%, медіана безрецидивної виживаності є невеликою — 4–6 міс [75–77]. Друга лінія ХТ складається з режимів FOLFOX та FOLFIRI [78, 79]. Топотекан виявився неефективним при G3 нейроендокринній карциномі [80]. При G3 НЕП ШКТ з Ki-67 >55% має бути надана перевага схемам з темозоломідом [66, 77]. У другій лінії ХТ застосовуються FOLFOX та FOLFIRI [78, 79], топотекан виявився неефективним препаратом у випадку G3 нейроендокринної карциноми [80].
Слід пам’ятати, що схеми із застосуванням темозоломіду необхідні пацієнтам з НЕП ПЗ G3 та нейроендокринною карциномою ШКТ з Ki-67 <55% [67, 78]. Таргетна терапія у комбінації з ХТ при G3 НЕП залишається у стадії дослідження [82, 83].
Пептидна рецепторна радіонуклідна терапія
PRRT застосовується у разі прогресуючих SSTR-позитивних НЕП з так званою гомогенною експресією серотонінових рецепторів (усі вогнища позитивні — визначається при октреоскануванні). PRRT можна використовувати після невдалої першої лінії медикаментозної терапії. Радіонуклідна терапія міченими соматостатиновими аналогами (ПО), як ітрієм (90Y), так і лютецієм (177Lu), з однаковою ефективністю застосовується для лікування НЕП, але оскільки лютецій має набагато нижчу нефротоксичність, використовується набагато частіше. Мінімальні вимоги для PRRT наведено в окремих рекомендаціях [84]. Стали доступними перші дані найсучаснішого клінічного дослідження, присвяченого PRRT прогресуючих НЕП ШКТ із застосуванням 177Lu-DOTATATE (NETTER-1). У ньому виявлено, що завдяки PRRT вдалося покращити медіану безрецидивної виживаності до 20 міс у 65% пацієнтів порівняно з 10% у групі пацієнтів, які отримували високі дозами октреотиду ЛАР (60 мг/міс). Відповідь на лікування виявлено у 18% у групі PRRT та у 3% — у групі ПО. Тому з огляду на дані зазначеного дослідження та інших проспективних та ретроспективних досліджень за останні 15 років PRRT може бути рекомендована для пацієнтів із НЕП ШКТ як друга лінія терапії після невдалої першої лінії із застосуванням ПО, а також як третя лінія після неефективного застосування еверолімусу. PRRT також рекомендована пацієнтам з НЕП ПЗ G1/G2 після невдалої терапії ПО, ХТ та таргетної терапії. При плануванні PRRT слід врахувати токсичний вплив попередньої ХТ та ретельно відібрати пацієнтів для PRRT згідно з критеріями, представленими у літературі [84–87].
На рис. 5 та 6 наведено алгоритми лікування місцево-поширених та метастатичних НЕП тонкої кишки та ПЗ. У таблиці представлені варіанти лікування пацієнтів з метастатичними НЕП різних локалізацій із застосуванням однієї лінії.
| Препарат | Функціонування | G | Локалізація первинної пухлини |
SSTR статус | Додаткові умови |
| Октреотид | +/– | 1 | Тонка кишка | + | Невеликий розмір пухлини |
| Ланреотид | +/– | 1/2 (-10%) | Тонка кишки, ПЗ | + | Малий або великий об’єм ураження печінки (>25%) |
| ІНТ-α2b | +/– | 1/2 | Тонка кишка | Якщо ОКТР негативна | |
| Стрептозоцин/ 5-флуороурацил |
+/– | 1/2 | ПЗ | Прогресування за короткий період*/великий об’єм пухлини/симптоматична/протипоказано стрептозоцин | |
| Темозоломід/ капецитабін |
+/– | 2 | ПЗ | Прогресування за короткий період*/великий об’єм пухлини/симптоматична | |
| Еверолімус | +/– | 1/2 | Легеня | Атиповий карциноїд/ОКТР негативна | |
| ПЗ | Інсулінома/протипоказано стрептозоцин | ||||
| Тонка кишка | ОКТР негативна | ||||
| Сунітиніб | +/– | 1/2 | ПЗ | Протипоказано стрептозоцин | |
| PRRT | +/– | 1/2 | Тонка кишка | + (обов’язково) | Поширена НЕП, позапечінкові Мтс (кістки) |
| Цисплатин/етопозид | +/– | 3 | Будь-яка | Усі низькодиференційовані НЕП |
ОКТР — октреосцинтиграфія; *<6–12 міс.
Діагностика та лікування Мтс НЕП з невідомим первинним вогнищем
Роль імуногістохімічних маркерів. Приблизно у 13% пацієнтів, у яких діагностовані Мтс НЕП, неможливо виявити первинне вогнище. Найчастіше потенційна первинна НЕП у таких випадках локалізується або у тонкій кишці, або у легенях. З метою визначення первинного походження НЕП необхідно застосовувати додаткові імуногістохімічні маркери, а саме: CDX-2 — свідчить про походження з тонкої кишки, Islet-1 — з ПЗ, TTF-1 — з легенів [87].
Роль октреоскану та ПЕТ-КТ. Більшість НЕП ШКТ, особливо, які локалізуються у дистальному відділі дванадцятипалої кишки, голодної та клубової кишки, сліпої, висхідної та частково попереково-ободової кишки, апендиксу, експресують високий рівень соматостатинових рецепторів, які можуть бути виявлені за допомогою соматостатин-рецептор-сцинтиграфії (октреоскан). Нещодавно набуло розвитку та застосування ПЕТ-КТ із використанням радіопептидів, тропних до різних субтипів соматостатинових рецепторів від 1 до 5. Ось декілька назв та комбінацій цих досліджень: 68Ga-DOTA-Tyr-octreotide, 68Ga-DOTATOC та 68Ga-DOTATATE. Ці дослідження показали високу чутливість у виявленні НЕП, особливо малих за розміром первинних та вторинних вогнищ [89, 90].
Роль інших досліджень. Ендоскопічне дослідження верхнього та нижнього відділів ШКТ, капсульної ендоскопії певною мірою дозволяє виявити малі за розміром НЕП, які не були ідентифіковані іншими методами досліджень та навпаки [91, 92].
Якщо все ж таки первинне вогнище залишається не виявленим, лікувальна тактика базується на даних, отриманих з Мтс-вогнищ: G, функціональна активність, рецепторний статус, розповсюдженість та ступінь ураження Мтс печінки або інших органів [83, 94–97].
131I-MIBG-терапія
(131I meta-iodobenzylguanidine — 131I-MIBG) йод-131 метайодбензилгуанідин терапія відома як ефективний метод у лікуванні метастатичної феохромоцитоми та нейробластом [98, 99]. Також є дані, які підтверджують ефективність цього методу терапії при НЕП шлунка та ПЗ. Відомо, що 50% НЕП шлунка, дванадцятипалої кишки та ПЗ поглинають MIBG [100–104]. Механізм дії базується на фізико-хімічних особливостях MIBG. Комплекс MIBG структурно подібний до норадреналіну, тому після внутрішньовенного введення селективно накопичується у тканині, багатій на адренергічну іннервацію, а саме нейроектодермі, включаючи пухлини, що походять із нейроектодерми. MIBG може захоплюватися шляхом нейронпоглинаючого механізму або пасивно за допомогою дифузії та згодом зберігатися у нейросекреторних гранулах. Перехід MIBG із внутрішньоклітинного простору у нейросекреторні везикули відбувається за участю АТФ-залежної протонної помпи. Але на відміну від норадреналіну цей комплекс не бере участі у метаболізмі, тому залишається незмінним при секреції. Відповідно, у цьому стані з нього відбувається випромінювання іонізуючої енергії з розпадних радіонуклідів йоду-131, 90% якого складається з β-частинок, проникна здатність яких не перевищує 0,5 мм [105–110].
Показаннями до застосування MIBG є неоперабельні НЕП та нейробластоми, тоді як протипоказаннями — вагітність, грудне вигодовування, очікувана тривалість життя пацієнта <3 міс, ниркова недостатність, яка потребує гемодіалізу. Відносні протипоказання — ризик перевищення дози опромінення, некурабельна ниркова недостатність або швидке її погіршення (індекс фільтрації <30 мл/хв), прогресуюча гематотоксичність та нефротоксичність внаслідок попереднього лікування, мієлосупресія (лейкоцити <3•109/л та тромбоцити 100•109/л). В одному із сучасних досліджень вивчали ефективність комбінації MIBG та PRRT терапії. Виявлено покращення безпосередніх та віддалених результатів лікування у групі пацієнтів із комбінованим лікуванням. Доведено, що при застосуванні двох методів одночасно охоплюється майже 98% всіх метастатичних вогнищ, тому що далеко не завжди радіофармпрепарат PRRT або MIBG накопичується у всіх вогнищах [111]. В одному з досліджень доведено ефективність MIBG-терапії у лікуванні пацієнтів з метастатичними НЕТ ШКТ та Мтс НЕП без виявленого первинного вогнища. Тридцять вісім пацієнтів з Мтс НЕП ШКТ та без виявленого первинного вогнища циклічно отримали MIBG-терапію протягом майже 9 років. Відповідь на лікування оцінено за допомогою системи RECIST 1.1. Також протягом лікування кожні 3–6 міс оцінювалися такі показники: рівень хромограніну А та 5-гідроксиіндолоцтової кислоти і зменшення вираженості симптомів карциноїдного синдрому. Проведено оцінку медіани загальної виживаності, загальної виживаності та безрецидивної виживаності. Встановлено, що у наступні 3–6 міс після першої MIBG-терапії у 75% пацієнтів відмічалася часткова відповідь, у 67% — стабілізація хвороби за всіма оцінюваними критеріями (КТ, МРТ, біохімічні показники та симптоми). Повної відповіді на лікування не зафіксовано. Загальна виживаність після першої MIBG-терапії становила 8 років, 29 пацієнтів прожили 10 років. Набагато кращі результати були у пацієнтів, в яких відмічалися часткова відповідь або стабілізація хвороби порівняно з пацієнтами з прогресуванням хвороби на фоні лікування [112].
Перелік використаної та рекомендованої літератури
1. Pavel M., Baudin E., Couvelard A. et al.; Barcelona Consensus Conference participants (2012) ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. Neuroendocrinology, 95: 157–176.
2. Niederle M.B., Hackl M., Kaserer K., Niederle B. (2010) Gastroenteropancreatic neuroendocrine tumours: the current incidence and staging based on the WHO and European Neuroendocrine Tumour Society classification: an analysis based on prospectively collected parameters. Endocr. Relat. Cancer, 17: 909–918.
3. Lawrence B., Gustafsson B.I., Chan A. et al. (2011) The epidemiology of gastroenteropancreatic neuroendocrine tumors. Endocrinol. Metab. Clin. North Am., 40: 1–18.
4. Frilling A., Modlin I.M., Kidd M. et al. (2014) Recommendations for management of patients with neuroendocrine liver metastases. Lancet Oncol., 15: e8–e21.
5. Van Loon K., Zhang L., Keiser J. et al. (2015) Bone metastases and skeletal-related events from neuroendocrine tumors. Endocr. Connect., 4: 9–17.
6. Kos-Kudla B., O’Toole D., Falconi M. et al. (2010) ENETS Consensus Guidelines for the management of bone and lung metastases from neuroendocrine tumors. Neuroendocrinology, 91: 341–350.
7. O’Toole D., Rindi G., Plöckinger U., Wiedenmann B. (2010) ENETS Consensus Guidelines for the management of patients with rare metastases from digestive neuroendocrine tumors: rationale and working framework. Introduction. Neuroendocrinology, 91: 324–325.
8. Pavel M., Grossman A., Arnold R. et al. (2010) ENETS Consensus Guidelines for the management of brain, cardiac and ovarian metastases from neuroendocrine tumors. Neuroendocrinology, 91: 326–332.
9. Kianmanesh R., Ruszniewski P., Rindi G. et al. (2010) ENETS Consensus Guidelines for the management of peritoneal carcinomatosis from neuroendocrine tumors. Neuroendocrinology, 91: 333–340.
10. Yao J.C., Fazio N., Singh S. et al. for RAD001 in Advanced Neuroendocrine Tumours, Fourth Trial (RADIANT-4) Study Group (2015) Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet [Epub. ahead of print].
11. Strosberg J., Wolin E., Chasen B. et al. (2015) 177-Lu-Dotatate significantly improves progression-free survival in patients with midgut neuroendocrine tumours: results of the phase III NETTER-1 trial. Eur. J. Cancer, 51(suppl 3): S710.
12. Kulke M.H., Hörsch D., Caplin M. et al. (2015) Telotristat etiprate is effective in treating patients with carcinoid syndrome that is inadequately controlled by somatostatin an-alog therapy (the phase 3 TELESTAR clinical trial). Eur. J. Cancer, 51(suppl 3): S728.
13. Strosberg J., Halfdanarson T., Bellizzi А. et al. (2017) The North American Neuroendocrine Tumor Society Consensus Guidelines for surveillance and medical management of midgut neuroendocrine tumors. Pancreas, 46: 707–714.
14. Caplin M.E., Baudin E., Ferolla P. et al.; ENETS consensus conference participants (2015) Pulmonary neuroendocrine (carcinoid) tumors: European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Ann. Oncol., 26: 1604–1620.
15. De Baere T., Deschamps F., Tselikas L. et al. (2015) GEP-NETS update: interventional radiology: role in the treatment of liver metastases from GEP-NETs. Eur. J. Endocrinol., 172: R151–R166.
16. Fiore F., Del Prete M., Franco R. et al. (2014) Transarterial embolization (TAE) is equally effective and slightly safer than transarterial chemoembolization (TACE) to manage liver metastases in neuroendocrine tumors. Endocrine, 47: 177–182.
17. Maire F., Lombard-Bohas C., O’Toole D. et al. (2012) Hepatic arterial embolization versus chemoembolization in the treatment of liver metastases from well-differentiated midgut endocrine tumors: a prospective randomized study. Neuroendocrinology, 96: 294–300.
18. Engelman E.S., Leon-Ferre R., Naraev B.G. et al. (2014) Comparison of transarterial liver-directed therapies for low-grade metastatic neuroendocrine tumors in a single institution. Pancreas, 43: 219–225.
19. Benson A.B. 3, Geschwind J.F., Mulcahy M.F. et al. (2013) Radioembolisation for liver metastases: results from a prospective 151 patient multi-institutional phase II study. Eur. J. Cancer, 49: 3122–3130.
20. Franko J., Feng W., Yip L. et al. (2010) Non-functional neuroendocrine carcino- ma of the pancreas: incidence, tumor biology, and outcomes in 2,158 patients. J. Gastrointest. Surg., 14: 541–548.
21. Yuan C.H., Wang J., Xiu D.R. et al. (2016) Meta-analysis of liver resection versus nonsurgical treatments for pancreatic neuroendocrine tumors with liver metastases. Ann. Surg. Oncol., 23: 244–249.
22. Watzka F.M., Fottner C., Miederer M. et al. (2015) Surgical therapy of neuroendocrine neoplasm with hepatic metastasis: patient selection and prognosis. Langenbecks Arch. Surg., 400: 349–358.
23. Mayo S.C., Herman J.M., Cosgrove D. et al. (2013) Emerging approaches in the management of patients with neuroendocrine liver metastasis: role of liver-directed and systemic therapies. J. Am. Coll. Surg., 216: 123–134.
24. Sarmiento J.M., Heywood G., Rubin J. et al. (2003) Surgical treatment of neuroendocrine metastases to the liver: a plea for resection to increase survival. J. Am. Coll. Surg., 197: 29–37.
25. Nobel Y.R., Goldberg D.S. (2015) Variable use of model for end-stage liver disease exception points in patients with neuroendocrine tumors metastatic to the liver and its impact on patient outcomes. Transplantation, 99: 2341–2346.
26. Chung H., Chapman W.C. (2014) Liver transplantation for metastatic neuroendocrine tumors. Adv. Surg., 48: 235–252.
27. Fan S.T., Le Treut Y.P., Mazzaferro V. et al. (2015) Liver transplantation for neuroendo- crine tumour liver metastases. HPB (Oxford), 17: 23–28.
28. Kvols L.K. (1994) Metastatic carcinoid tumors and the malignant carcinoid syndrome. Ann. NY Acad. Sci., 733: 464–470.
29. Eriksson B., Klöppel G., Krenning E. et al. (2008) Consensus guidelines for the management of patients with digestive neuroendocrine tumors — well-differentiated jejunalileal tumor/carcinoma. Neuroendocrinology, 87: 8–19.
30. Ruszniewski P., Ish-Shalom S., Wymenga M. et al. (2004) Rapid and sustained relief from the symptoms of carcinoid syndrome: results from an open 6-month study of the 28-day prolonged release formulation of lanreotide. Neuroendocrinology, 80: 244–251.
31. Strosberg J.R., Benson A.B., Huynh L. et al. (2014) Clinical benefits of above-standard dose of octreotide LAR in patients with neuroendocrine tumors for control of carcinoid syndrome symptoms: a multicenter retrospective chart review study. Oncologist, 19: 930–936.
32. Al-Efraij K., Aljama M.A., Kennecke H.F. (2015) Association of dose escalation of octreotide long-acting release on clinical symptoms and tumor markers and response among patients with neuroendocrine tumors. Cancer Med., 4: 864–870.
33. Kvols L.K., Oberg K.E., O’Dorisio T.M. et al. (2012) Pasireotide (SOM230) shows efficacy and tolerability in the treatment of patients with advanced neuroendocrine tumors refractory or resistant to octreotide LAR: results from a phase II study. Endocr. Relat. Cancer, 19: 657–666.
34. Wolin E., Jarzab B., Eriksson B. et al. (2015) Phase III study of pasireotide long-acting release in patients with metastatic neuroendocrine tumors and carcinoid symptoms refractory to available somatostatin analogues. Drug. Des. Devel. Ther., 9: 5075–5086.
35. Kulke M.H., O’Dorisio T., Phan A. et al. (2014) Telotristat etiprate, a novel serotonin synthesis inhibitor, in patients with carcinoid syndrome and diarrhea not adequately controlled by octreotide. Endocr. Relat. Cancer, 21: 705–714.
36. Pavel M., Hörsch D., Caplin M. et al. (2015) Telotristat etiprate for carcinoid syn- drome: a single-arm, multicenter trial. J. Clin. Endocrinol. Metab., 100: 1511–1519.
37. Rinke A., Müller H.H., Schade-Brittinger C. et al. (2009) Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J. Clin. Oncol., 27: 4656–4663.
38. Caplin M.E., Pavel M., Ćwikła J.B. et al. (2014) Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N. Engl. J. Med., 371: 224–233.
39. Martín-Richard M., Massutí B., Pineda E. et al. (2013) Antiproliferative effects of lanreotide autogel in patients with progressive, well-differentiated neuroendocrine tumours: a Spanish, multicentre, open-label, single arm phase II study. BMC Cancer, 13: 427.
40. Jann H., Denecke T., Koch M. et al. (2013) Impact of octreotide long-acting release on tumour growth control as a first-line treatment in neuroendocrine tumours of pancreatic origin. Neuroendocrinology, 98: 137–143.
41. Shen C., Shih Y.C., Xu Y., Yao J.C. (2014) Octreotide long-acting repeatable use among elderly patients with carcinoid syndrome and survival outcomes: a population-based analysis. Cancer, 120: 2039–2049.
42. Rindi G., Falconi M., Klersy C. et al. (2012) TNM staging of neoplasms of the endocrine pancreas: results from a large international cohort study. J. Natl. Cancer Inst., 104: 764–777.
43. Kaemmerer D., Peter L., Lupp A. et al. (2011) Molecular imaging with Ga-SSTR PET/CT and correlation to immunohistochemistry of somatostatin receptors in neuroendocrine tumours. Eur. J. Nucl. Med. Mol. Imaging, 38: 1659–1668.
44. Oberg K. (1996) Interferon-alpha versus somatostatin or the combination of both in gastroenteropancreatic tumours. Digestion, 57(suppl. 1): 81–83.
45. Papotti M., Bongiovanni M., Volante M. et al. (2002) Expression of somatostatin receptor types 1–5 in 81 cases of gastrointestinal and pancreatic endocrine tumors. A correlative immunohistochemical and reverse transcriptase polymerase chain reaction analysis. Virchows Arch., 440: 461–475.
46. Pavel M.E., Baum U., Hahn E.G. et al. (2006) Efficacy and tolerability of pegylated IFN-alpha in patients with neuroendocrine gastroenteropancreatic carcinomas. J. Interferon Cytokine Res., 26: 8–13.
47. Yao J., Guthrie K., Moran C. et al. (2015) SWOG S0518: phase III prospective randomized comparison of depot octreotide plus interferon alpha-2b versus depot octreotide plus bevacizumab (NSC #704865) in advanced, poor prognosis carcinoid patients (NCT00569127). J. Clin. Oncol., 33(suppl.): abstr 4004.
48. Raymond E., Dahan L., Raoul J.L. et al. (2011) Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N. Engl. J. Med., 364: 501–513.
49. Yao J.C., Shah M.H., Ito T. et al. (2011) RAD001 in Advanced Neuroendocrine Tumors, Third Trial (RADIANT-3) Study Group: Everolimus for advanced pancreatic neuroendocrine tumors. N. Engl. J. Med., 364: 514–523.
50. Panzuto F., Rinzivillo M., Fazio N. et al. (2014) Real-world study of everolimus in advanced progressive neuroendocrine tumors. Oncologist, 19: 966–974.
51. Kamp K., Gumz B., Feelders R.A. et al. (2013) Safety and efficacy of everolimus in gastrointestinal and pancreatic neuroendocrine tumors after (177)Lu-octreotate. Endocr. Relat. Cancer, 20: 825–831.
52. Pavel M.E., Hainsworth J.D., Baudin E. et al. (2011) RADIANT-2 Study Group: Everolimus plus octreotide long-acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (RADIANT-2): a randomised, placebo-controlled, phase 3 study. Lancet, 378: 2005–2012.
53. Kulke M.H., Ruszniewski P., Van Cutsem E. et al. (2015) A randomized open-label phase II study of everolimus alone or in combination with pasireotide LAR in advanced, progressive pancreatic neuroendocrine tumors (pNET): COOPERATE-2 Trial. 12 Annual ENETS Conference for the Diagnosis and Treatment of Neuroendocrine Tumor Disease, March 11–13, 2015, Barcelona, Spain.
54. Bajetta E., Catena L., Fazio N. et al. (2014) Everolimus in combination with octreotide long-acting repeatable in a first-line setting for patients with neuroendocrine tumors: an ITMO group study. Cancer, 120: 2457–2463.
55. Kouvaraki M.A., Ajani J.A., Hoff P. et al. (2004) Fluorouracil, doxorubicin, and streptozocin in the treatment of patients with locally advanced and metastatic pancreatic endocrine carcinomas. J. Clin. Oncol., 22: 4762–4771.
56. Moertel C.G., Lefkopoulo M., Lipsitz S. et al. (1992) Streptozocin-doxorubicin, streptozocin-fluorouracil or chlorozotocin in the treatment of advanced islet-cell carcino- ma. N. Engl. J. Med., 326: 519–523.
57. Fjallskog M.L., Janson E.T., Falkmer U.G. et al. (2008) Treatment with combined streptozotocin and liposomal doxorubicin in metastatic endocrine pancreatic tumors. Neuroendocrinology, 88: 53–58.
58. Dilz L.M., Denecke T., Steffen I.G. et al. (2015) Streptozocin/5-fluorouracil chemotherapy is associated with durable response in patients with advanced pancreatic neuroendocrine tumours. Eur. J. Cancer, 51: 1253–1262.
59. Meyer T., Qian W., Caplin M.E. et al. (2014) Capecitabine and streptozocin ± cisplatin in advanced gastroenteropancreatic neuroendocrine tumours. Eur. J. Cancer, 50: 902–911.
60. Turner N.C., Strauss S.J., Sarker D. et al. (2010) Chemotherapy with 5-fluorouracil, cisplatin and streptozocin for neuroendocrine tumours. Br. J. Cancer, 102: 1106–1112.
61. Chan J.A., Stuart K., Earle C.C. et al. (2012) Prospective study of bevacizumab plus temozolomide in patients with advanced neuroendocrine tumors. J. Clin. Oncol., 30: 2963–2968.
62. Strosberg J.R., Fine R.L., Choi J. et al. (2011) First-line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas. Cancer, 117: 268–275.
63. Kulke M.H., Stuart K., Enzinger P.C. et al. (2006) Phase II study of temozolomide and thalidomide in patients with metastatic neuroendocrine tumors. J. Clin. Oncol., 24: 401–406.
64. Walter T., van Brakel B., Vercherat C. et al. (2015) O-Methylguanine-DNA methyltransferase status in neuroendocrine tumours: prognostic relevance and association with response to alkylating agents. Br. J. Cancer, 112: 523–531.
65. Schmitt A.M., Pavel M., Rudolph T. et al. (2014) Prognostic and predictive roles of MGMT protein expression and promoter methylation in sporadic pancreatic neuroendocrine neoplasms. Neuroendocrinology, 100: 35–44.
66. Kulke M.H., Stuart K., Enzinger P.C. et al. (2009) O-Methylguanine DNA methyltransferase deficiency and response to temozolomide-based therapy in patients with neuroendocrine tumors. Clin. Cancer Res., 15: 338–345.
67. Welin S., Sorbye H., Sebjornsen S. et al. (2011) Clinical effect of temozolomide-based chemotherapy in poorly differentiated endocrine carcinoma after progression on first-line chemotherapy. Cancer, 117: 4617–4622.
68. Fine R.L., Gulati A.P., Krantz B.A. et al. (2013) Capecitabine and temozolomide (CAPTEM) for metastatic, well-differentiated neuroendocrine cancers: the Pancreas Center at Columbia University experience. Cancer Chemother. Pharmacol., 71: 663–670.
69. Brizzi M.P., Berruti A., Ferrero A. et al. (2009) Continuous 5-fluorouracil infusion plus long acting octreotide in advanced well-differentiated neuroendocrine carcinomas. A phase II trial of the Piemonte oncology network. BMC Cancer, 9: 388.
70. Koumarianou A., Kaltsas G., Kulke M.H. et al. (2015) Temozolomide in advanced neuroendocrine neoplasms: pharmacological and clinical aspects. Neuroendocrinology, 101: 274–288.
71. Mitry E., Walter T., Baudin E. et al. (2014) Bevacizumab plus capecitabine in patients with progressive advanced well-differentiated neuroendocrine tumors of the gastro-intestinal (GI-NETs) tract (BETTER trial) — a phase II non-randomised trial. Eur. J. Cancer, 50: 3107–3115.
72. Berruti A., Fazio N., Ferrero A. et al. (2014) Bevacizumab plus octreotide and metronomic capecitabine in patients with metastatic well-to-moderately differentiated neuroendocrine tumors: the XELBEVOCT study. BMC Cancer, 14: 184.
73. Crona J., Fanola I., Lindholm D.P. et al. (2013) Effect of temozolomide in patients with metastatic bronchial carcinoids. Neuroendocrinology, 98: 151–155.
74. Ekeblad S., Sundin A., Janson E.T. et al. (2007) Temozolomide as monotherapy is effective in treatment of advanced malignant neuroendocrine tumors. Clin. Cancer Res., 13: 2986–2991.
75. Sorbye H., Welin S., Langer S.W. et al. (2013) Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann. Oncol., 24: 152–160.
76. Moertel C.G., Kvols L.K., O’Connell M.J., Rubin J. (1991) Treatment of neuroendocrine carcinomas with combined etoposide and cisplatin. Evidence of major therapeutic activity in the anaplastic variants of these neoplasms. Cancer, 68: 227–232.
77. Sorbye H., Strosberg J., Baudin E. et al. (2014) Gastroenteropancreatic high-grade neuroendocrine carcinoma. Cancer, 120: 2814–2823.
78. Heetfeld M., Chougnet C.N., Olsen I.H. et al. (2015) Characteristics and treatment of patients with G3 gastroenteropancreatic neuroendocrine neoplasms. Endocr. Relat. Cancer, 22: 657–664.
79. Hadoux J., Malka D., Planchard D. et al. (2015) Post-first-line FOLFOX chemotherapy for grade 3 neuroendocrine carcinoma. Endocr. Relat. Cancer, 22: 289–298.
80. Hentic O., Hammel P., Couvelard A. et al. (2012) FOLFIRI regimen: an effective second-line chemotherapy after failure of etoposide-platinum combination in patients with neuroendocrine carcinomas grade 3. Endocr. Relat. Cancer, 19: 751–757.
81. Olsen I.H., Knigge U., Federspiel B. et al. (2014) Topotecan monotherapy in heaily pretreated patients with progressive advanced stage neuroendocrine carcinomas. J. Cancer, 5: 628–632.
82. Ilett E., Langer S.W., Olsen I. et al. (2015) Neuroendocrine carcinomas of the gastroenteropancreatic system: a comprehensive review. Diagnostics, 5: 119–176.
83. Garcia-Carbonero R., Sorbye H., Baudin E. et al. (2016) ENETS Consensus Guidelines for high-grade gastroenteropancreatic neuroendocrine tumors and neuroendocrine carcinomas. Neuroendocrinology, 103: 186–194.
84. Kwekkeboom D.J., Krenning E.P., Lebtahi R. et al. (2009) ENETS Consensus Guidelines for the standards of care in neuroendocrine tumors: peptide receptor radionuclide therapy with radiolabeled somatostatin analogs. Neuroendocrinology, 90: 220–226.
85. Imhof A., Brunner P., Marincek N. et al. (2011) Response, survival, and long-term toxicity after therapy with the radiolabeled somatostatin analogue [Y-DOTA]-TOC in metastasized neuroendocrine cancers. J. Clin. Oncol., 29: 2416–2423.
86. Bushnell D.L. Jr, O’Dorisio T.M., O’Dorisio M.S. et al. (2010) Y-Edotreotide for metastatic carcinoid refractory to octreotide. J. Clin. Oncol., 28: 1652–1659.
87. Kwekkeboom D.J., de Herder W.W., Kam B.L. et al. (2008) Treatment with the radiolabeled somatostatin analog [Lu-DOTA 0, Tyr3]octreotate: toxicity, efficacy, and survival. J. Clin. Oncol., 26: 2124–2130.
88. Lin X., Saad R.S., Luckasevic T.M. et al. (2007) Diagnostic value of CDX-2 and TTF-1 expressions in separating metastatic neuroendocrine neoplasms of unknown origin. Appl. Immunohistochem. Mol. Morphol., 15: 407–414.
89. Nakamoto Y., Sano K., Ishimori T. et al. (2015) Additional information gained by positron emission tomography with (68)Ga-DOTATOC for suspected unknown primary or recurrent neuroendocrine tumors. Ann. Nucl. Med., 29: 512–518.
90. Tan T.H., Lee B.N., Hassan S.Z. (2014) Diagnostic value of (68)Ga-DOTATATE PET/CT in liver metastases of neuroendocrine tumours of unknown origin. Nucl. Med. Mol. Imaging, 48: 212–215.
91. Frilling A., Smith G., Clift A.K., Martin J. (2014) Capsule endoscopy to detect primary tumour site in metastatic neuroendocrine tumours. Dig. Liver Dis., 46: 1038–1042.
92. Wang S.C., Parekh J.R., Zuraek M.B. et al. (2010) Identification of unknown primary tumors in patients with neuroendocrine liver metastases. Arch. Surg., 145: 276–280.
93. Delle Fave G., O’Toole D., Sundin A. et al. (2016) ENETS Consensus Guidelines update for gastroduodenal neuroendocrine neoplasms. Neuroendocrinology, 103: 119–124.
94. Niederle B., Pape U.F., Costa F. et al. (2016) ENETS Consensus Guidelines update for neuroendocrine neoplasm of the jejunum and ileum. Neuroendocrinology, 103: 125–138.
95. Ramage J.K., De Herder W.W., Delle Fave G. et al. (2016) ENETS Consensus Guidelines update for colorectal neuroendocrine neoplasms. Neuroendocrinology, 103: 139–143.
96. Pape U.F., Niederle B., Costa F. et al. (2016) ENETS Consensus Guidelines for neuroendocrine neoplasms of the appendix (excluding goblet cell carcinomas). Neuroendocrinology, 103: 144–152.
97. Falconi M., Eriksson B., Kaltsas G. et al. (2016) ENETS Consensus Guidelines update for the management of patients with functional pancreatic neuroendocrine tumors and non-functional pancreatic neuroendocrine tumors. Neuroendocrinology, 103: 153–171.
98. Mukherjee J.J., Kaltsas G.A., Islam N. et al. (2001) Treatment of metastatic carcinoid tumours, phaeochromocytoma, paraganglioma and medullary carcinoma of the thyroid with (131)I-meta-iodobenzylguanidine [(131)I-mIBG]. Clin. Endocrinol., 55(1): 47–60.
99. Safford S.D., Coleman R.E., Gockerman J.P. et al. (2003) Iodine-131 metaiodobenzylguanidine is an effective treatment for malignant pheochromocytoma and paraganglioma. Surgery, 134(6): 956–962 (discussion 962–3).
100. Kaltsas G., Rockall A., Papadogias D. et al. (2004) Recent advances in radiological and radionuclide imaging and therapy of neuroendocrine tumours. Eur. J. Endocrinol. Eur. Fed. Endocr. Soc., 151(1): 15–27.
101. Sisson J.C., Shulkin B.L., Esfandiari N.H. (2006) Courses of malignant pheochromocytoma: implications for therapy. Ann. N Y Acad. Sci., 1073: 505–511.
102. Fitzgerald P.A., Goldsby R.E., Huberty J.P. et al. (2006) Malignant pheochromocytomas and paragangliomas: a phase II study of therapy with high-dose I-metaiodobenzylguanidine (I-MIBG). Ann. N Y Acad. Sci., 1073: 465–490.
103. Troncone L., Rufini V. (1997) I-MIBG therapy of neural crest tumours (review). Anticancer Res., 17(3B): 1823–1831.
104. Shapiro B. (1994) A review of the status of radio-iodinated-MIBG therapy for neuroendocrine tumors. Intern. Med., 2: 61–68.
105. Nakajo M., Yoshinaga K., Oriuchi N. et al. (2008) Guideline draft of appropriate use of I-MIBG for internal radiotherapy of neuroendocrine tumors. Kaku Igaku Jpn. J. Nucl. Med., 45(1): 1–40.
106. Yoshinaga K., Oriuchi N., Wakabayashi H. et al. (2014) Effects and safety of I-metaiodobenzylguanidine (MIBG) radiotherapy in malignant neuroendocrine tumors: results from a multicenter observational registry. Endocr. J., 61(12): 1171–1180.
107. Van Santen H.M., de Kraker J., van Eck B.L. et al. (2002) High incidence of thyroid dysfunction despite prophylaxis with potassium iodide during (131)I-meta-iodobenzylguanidine treatment in children with neuroblastoma. Cancer, 94(7): 2081–2089.
108. Quach A., Ji L., Mishra V. et al. (2011) Thyroid and hepatic function after high-dose I-metaiodobenzylguanidine (I-MIBG) therapy for neuroblastoma. Pediatr. Blood Cancer, 56(2): 191–201.
109. Shapiro B. (1991) Summary, conclusions, and future directions of [I] metaiodobenzylguanidine therapy in the treatment of neural crest tumors. J. Nucl. Biol. Med., 35(4): 357–363.
110. Sisson J.C., Shapiro B., Beierwaltes W.H. et al. (1984) Radiopharmaceutical treatment of malignant pheochromocytoma. J. Nucl. Med. Off. Publ. Soc. Nucl. Med., 25(2): 197–206.
111. Kinuya S., Yoshinaga K., Higuchi T. et al. (2015) Draft guidelines regarding appropriate use of I-MIBG radiotherapy for neuroendocrine tumors Guideline Drafting Committee for Radiotherapy with I-MIBG, Committee for Nuclear Oncology and Immunology, The Japanese Society of Nuclear Medicine. Ann. Nucl. Med., 29: 543–552.
112. Mulholland N., Chakravartty R., Lindsey Devlin L. et al. (2015) Long-term outcomes of 131-Iodine mIBG therapy in metastatic gastrointestinal pancreatic neuroendocrine tumours: single administration predicts non-responders. Eur. J. Nucl. Med. Mol. Imaging, 42: 2002–2012.
113. Rinke A., Wittenberg M., Schade-Brittinger C. et al. (2017) Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors (PROMID): Results of long-term survival. PROMID Study Group. Neuroendocrinology, 104(1): 26−32.
Клинические рекомендации диагностики и лечения метастатических нейроэндокринных опухолей желудочно-кишечного тракта
Национальный институт рака, Киев
Резюме. Метастатические нейроэндокринные опухоли (НЭО) желудочно-кишечного тракта (ЖКТ) возникают довольно часто по сравнению с другими локализациями НЭО. Чаще всего метастазы локализуются в печени и лимфатических узлах, реже — в костях и других органах. Благодаря современным методам диагностики, таким как магнитно-резонансная томография, компьютерная томография, октреоскан и позитронно-эмиссионная томография, совмещенная с компьютерной томографией, с применением новых радиофармпрепаратов, удается не только выявлять метастазы (Мтс) НЭО, но и локализовать первичную опухоль, что до последнего времени было одной из основных проблем в диагностике и лечении Мтс НЭО. Хирургический метод остается наиболее эффективным лечением Мтс НЭО, целью которого является удаление первичной опухоли и всех Мтс (из печени, брюшины, легких и др.), что значительно улучшает общую выживаемость пациентов. Также с успехом используются локорегионарные методы лечения (радиочастотная абляция, эмболизация и локальная лучевая терапия). Нашли свое применение аналоги октреотида (пролонгированные октреотиды) и таргетные препараты, которые позволили улучшить отдаленные результаты в случае нерезектабельных НЭО и Мтс, а также в эффективном контроле карциноидного синдрома. Целью данного исследования было провести обзор литературы за последнее десятилетие, посвященной проблеме диагностики и лечения метастатических НЭО, и осветить современный подход и последние данные по использованию новых методов и технологий в лечении Мтс НЭО. Следует учесть, что большинство работ, посвященных этой проблеме, базируется на данных незначительного количества проспективных и неконтролируемых исследований, поэтому, принимая во внимание разнообразие эффективных лечебных опций для пациентов с Мтс НЭО ЖКТ, очень важно тщательно оценить каждый конкретный случай и обсудить будущий план лечения мультидисциплинарной командой. Представленные рекомендации базируются на данных клинических рекомендаций Европейской ассоциации нейроэндокринных опухолей (ENETS) за 2016 г., американских Национальных стандартов диагностики и лечения злокачественных опухолей (NCCN), 3-е издание за 2017 г., обзора литературы за 2010–2017 гг. с использованием поискового ресурса PubMed и данных больных с Мтс НЭО, пролеченных в Национальном институте рака в период с 1997 по 2017 г.
метастазы нейроэндокринных опухолей желудочно-кишечного тракта; клинические рекомендации; методы диагностики; хирургическое лечение; локорегионарные методы; гормонотерапия; таргетная терапия; химиотерапия.
Адреса:
Зубарєв Микола Геннадійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: mykola.zubaryev@gmail.com
Correspondence:
Zubaryev Mykola
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: mykola.zubaryev@gmail.com














Leave a comment