Особливості діагностики та хірургічного лікування ураження серця лімфомою Беркітта
Витовский Р.М., Исаенко В.В., Онищенко В.Ф., Лозовой А.А., Пищурин А.А., Дядюн Д.Н., Мартыщенко И.В.
Резюме. У структурі хірургічної патології серцево-судинної системи пухлини серця становлять меньше 1%. У статті описується незвичайний випадок ураження серця лімфомою Беркітта у чоловіка віком 27 років. Наведено спроби застосування різних способів діагностики для визначення характеру новоутворення та подальші методи лікування з позитивним віддаленим результатом.
Резюме. В структуре хирургической патологии сердечно-сосудистой системы опухоли сердца составляют менее 1%. В статье описывается необычный случай поражения сердца лимфомой Беркитта у мужчины в возрасте 27 лет. Представлены попытки применения различных способов диагностики для определения характера новообразования и последующие методы лечения с положительным отдаленным результатом.
Получено 15.03.2018
Принято в печать 19.05.2018
Первичные злокачественные новообразования, исходящие непосредственно из тканей сердца, возникают крайне редко [4, 10, 11]. Опухоли сердца в структуре хирургической патологии сердечно-сосудистой системы составляют менее 1% [1, 9]. В литературе в основном описываются случаи миксом сердца или его метастатических поражений с первичной локализацией злокачественной опухоли в легких, перикарде, почках и других органах. Вместе с тем проблема эффективности оперативного лечения при этом виде патологии волнует кардиохирургов особенно остро.
В связи с трудностью ранней диагностики злокачественных опухолей сердца (ЗОС) у 50–80% пациентов к моменту установления диагноза уже имеются регионарные или отдаленные метастазы, что существенно ухудшает клиническое состояние больных и прогноз хирургического лечения [2, 3, 10, 13, 14]. Значительная распространенность опухолевого процесса в сердце на момент его диагностирования приводит к высокой (25–50%) госпитальной летальности больных со злокачественными новообразованиями. Это зачастую связано с необходимостью проведения более широкого объема оперативного вмешательства, которое может одновременно включать реконструкцию камер сердца, протезирование его клапанов, аортокоронарное шунтирование и, при необходимости, имплантацию кардиостимулятора [4, 6, 8, 11].
В мировой литературе приводится описание случаев успешного хирургического лечения злокачественных новообразований как правых, так и левых отделов сердца с вполне удовлетворительными отдаленными результатами на фоне повторных курсов химио- и радиотерапии [1, 10, 12, 14]. Эти сообщения свидетельствуют о возможности эффективного хирургического лечения пациентов с ЗОС на ранней стадии заболевания.
В настоящее время кардиохирурги ведущих мировых клиник видят выход в ранней дифференциальной диагностике злокачественного опухолевого роста, а также в безотлагательной пересадке сердца, что позволяет добиться значительно лучших результатов [3, 5–7]. Применение современных диагностических средств, таких как магнитно-резонансная томография (МРТ), компьютерная томография (КТ), а также проведение трансторакальной и эндоваскулярной биопсии позволяют ориентировочно, а иногда и абсолютно точно определить характер новообразования до выполнения оперативного вмешательства. Поэтому проблема своевременной диагностики и хирургического лечения ЗОС требует дальнейшего изучения и максимального освещения.
В данной статье мы приводим собственные наблюдения об особенностях клинического течения, методах поэтапной диагностики и хирургического лечения, а также непосредственных и отдаленных результатах операции у пациента с лимфомой Беркитта сердечной локализации. Как первичная ЗОС, указанное новообразование встречается крайне редко. В доступной англоязычной литературе освещены лишь 22 сообщения о такой локализации опухоли. При этом летальный исход зафиксирован в 10 (45%) случаях. Большинство из этих пациентов (9 из 10) умерли в течение нескольких дней, а один — через 6 нед после установления диагноза. Также сообщается, что наиболее длинный период выживания при лимфоме Беркитта в сердце отмечен у 2 пациентов, которые были живы через 36 мес, прошедших с момента диагностирования новообразования [3].
Целью работы является демонстрация сложности дооперационной диагностики и принятия решения об оперативном вмешательстве у пациента с обширным опухолевым поражением сердца, вызванным лимфомой Беркитта.
Объект и методы исследования
Пациент З., 29 лет, история болезни № 4218, поступил в ГУ «Национальный институт сердечно-сосудистой хирургии им. Н.М. Амосова НАМН Украины» 06.08.2014 г. с диагнозом «опухоль сердца». Из анамнеза стало известно, что считает себя больным с марта 2014 г., когда начали беспокоить общая слабость, одышка и сердцебиение. Вскоре к этому присоединились пароксизмы трепетания и мерцания предсердий. До этого времени активно занимался спортом, в частности бегом. 31.07.2014 г. в тяжелом клиническом состоянии поступил в областное кардиологическое отделение с приступом мерцательной аритмии с частотой сердечных сокращений 90–100 уд./мин и признаками тампонады перикарда. Эхокардиографическое (эхоКГ) исследование определило наличие большого количества жидкости в полости перикарда, а также объемного образования правого предсердия (ПП), заполняющего его полость и распространяющегося вдоль стенок предсердия до фиброзного кольца трехстворчатого клапана (ТК), что было расценено, как опухолевая ткань либо «свежие» тромбы. При пункции и дренировании полости перикарда эвакуировано около 1000 мл мутного экссудата желтого цвета, что значительно улучшило состояние пациента. Цитологическое исследование полученной жидкости выявило атипичную пролиферацию мезотелия на фоне элементов воспаления. Дополнительно выполнена КТ органов грудной полости. При этом в базальных отделах легких с обеих сторон определялись участки консолидации легочной ткани неправильной полигональной формы. В остальных отделах легких очаговых и инфильтративных изменений не выявлено.
На момент поступления в ГУ «Национальный институт сердечно-сосудистой хирургии им. Н.М. Амосова НАМН Украины» больной предъявлял жалобы на выраженную общую слабость, боль в области сердца. При осмотре отмечены бледность кожных покровов, умеренная отечность нижних конечностей, выступание печени ниже реберной дуги на 2 см. При аускультации выслушивался небольшой интенсивности систолический шум в проекции верхушки сердца. На электрокардиограмме трепетание предсердий с частотой сердечных сокращений 82 уд./мин. Рентгенологически выраженных отклонений со стороны контуров сердечной тени не отмечалось, кардиоторакальный индекс 0,45, патологических образований в легких не выявлено. Общий анализ крови: гемоглобин — 115 г/л, эритроциты — 4,8•10/л, скорость оседания эритроцитов — 9 мм/ч, лейкоциты — 14,2•10/л, лейкоцитарная формула в пределах нормы.
Пациенту проведена эхоКГ, выявившая малоподвижное фрагментированное опухолевое образование размером 5,2×5,8 см, с инвазивным поражением стенки ПП, правого желудочка (ПЖ) и фиброзного кольца ТК. Образование частично заполняет полость ПП и создает умеренную обструкцию правого атриовентрикулярного отверстия с градиентом давления 15 мм рт. ст. (рис. 1). Обратный ток через ТК не определяется. Фракция выброса левого желудочка (ЛЖ) составляет 66%. В полости перикарда содержится небольшое количество жидкости.
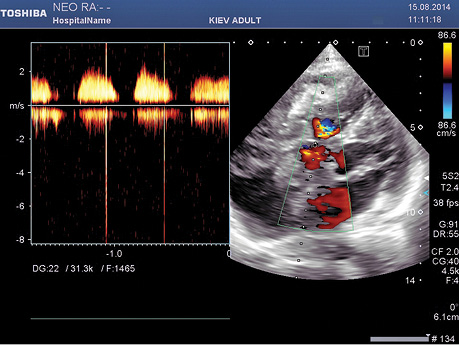
Таким образом, результаты эхоКГ-исследования свидетельствовали о том, что в данном случае речь идет о возможном злокачественном поражении сердца.
Учитывая подозрение на злокачественный характер новообразования, для уточнения распространенности опухолевого процесса у больного проведена спиральная КТ. Обследование показало наличие образования сердца общими размерами 87×80×70 мм, расположенного преимущественно в области правых отделов, заполняющего ⅓ полости ПП, прорастающего в полость ПЖ и вызывающего резкий стеноз его приточного отдела, а также деформацию ТК. Опухоль прорастает в нижнюю треть межпредсердной перегородки, заднюю стенку левого предсердия, задний и нижнеперегородочный сегмент ЛЖ на базальном уровне. Процесс распространяется на ствол легочной артерии (ЛА) и правую ее ветвь без признаков стенозирования просвета. Контур новообразования четкий, бугристый, дифференцирование прилежащего миокарда затруднено.
Правая коронарная артерия в средней и дистальной трети, а также дистальная треть огибающей ветви левой коронарной артерии муфтообразно окружены образованием. Коронарный синус стенозирован в проксимальной трети на 30–50% за счет сдавливания образованием. Также выявлена лимфоаденопатия заднего средостения и корня правого легкого. В результате проведенного исследования диагностировано опухолевое поражение сердца с подозрением на лимфому.
Для дополнительной информации о распространении процесса пациенту проведена МРТ. Согласно полученным данным, интрамиокардиально, в проекции предсердно-желудочковой борозды определялось образование общими размерами 81×58×81 мм, распространяющееся на боковую стенку ПП и ПЖ, заднебазальные отделы ЛЖ, а также прорастающее в нижнюю треть межпредсердной перегородки. Образование заполняло полость ПП и ПЖ, вызывая их редукцию и деформируя ТК. Приточная часть ПЖ щелевидная. Также определялось распространение образования на нижнюю часть ствола ЛА и ее правую ветвь, без признаков стеноза просвета (рис. 2).
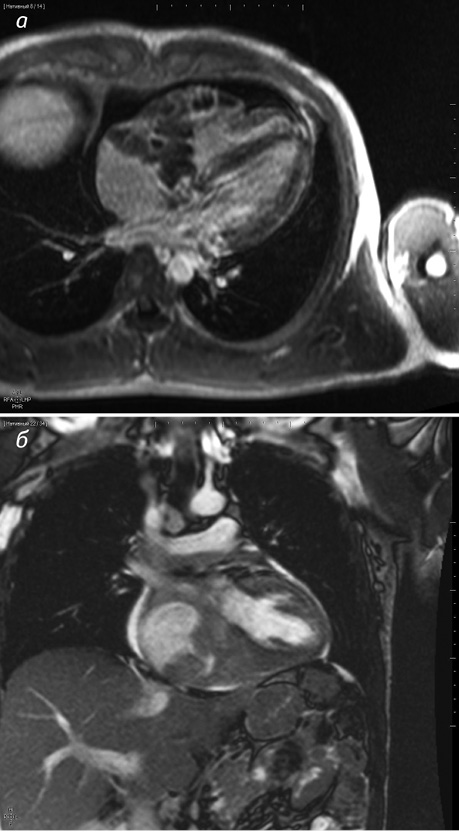
В дальнейшем, с целью дифференциальной диагностики опухолевого поражения и для определения тактики лечения, предпринята попытка биопсии новообразования эндоваскулярным способом. С учетом значительного заполнения опухолевой тканью полостей ПП и ПЖ вероятность успешного забора опухолевой ткани специальными щипцами казалась довольно высокой. Доступом через правую бедренную вену осуществлен забор пяти биоптатов из ПП и ПЖ. Однако, несмотря на сопутствующий процедуре эхоКГ-контроль, при гистологическом исследовании в биоптате определялась исключительно миокардиальная ткань, а опухолевые клетки отсутствовали.
Целесообразность хирургического вмешательства в данном клиническом случае в значительной мере обусловливалась гистологическим характером опухоли. Стремление получить точный диагноз побудило нас прибегнуть еще к одному методу идентификации новообразования — трансторакальной транскутанной пункционной биопсии.
Компьютерное ремоделирование опухолевого поражения сердца продемонстрировало наличие опухолевой ткани с замещением миокарда на передней стенке сердца. Исходя из этого, трансторакально и под контролем эхоКГ иглой для биопсии был взят биоптат из стенки ПЖ. Поскольку такая манипуляция может сопровождаться развитием гемоперикарда вплоть до тампонады сердца, через некоторое время после ее выполнения повторно произведено эхоКГ-исследование полости околосердечной сумки. Признаков кровотечения не выявлено. Обнаружить опухолевые клетки в полученном таким методом биоптате также не удалось.
Вместе с тем в результате очередного эхоКГ-контроля состояния новообразования выявлены признаки его стремительного роста по сравнению с данными, полученными при поступлении больного в клинику. Отмечено практически полное заполнение опухолью полости ПП со значительной прогрессирующей обструкцией правого атриовентрикулярного отверстия и высоким давлением в сегменте ПП над опухолью. Связанное с этим критическое состояние больного обусловило необходимость выполнения экстренной операции, невзирая на отсутствие достоверных сведений о гистологическом характере новообразования.
18.08.2014 г. у пациента произведена паллиативная операция, направленная на устранение препятствия притоку крови к правому атриовентрикулярному отверстию. Доступом к сердцу избрана продольная срединная стернотомия. Перикардиальная полость свободна от спаечного процесса, выявлено до 50 мл гемолизированной крови (следствие проведения биопсии). При осмотре сердца отмечается плотное, бугристое образование, возвышающееся над ПЖ и занимающее практически всю его переднюю поверхность. Опухоль инвазивно прорастает в стенку желудочка, переходит на диафрагмальную поверхность сердца и на ПП, оставляя нетронутой небольшую боковую поверхность последнего в области впадения верхней и нижней полой вены. Пальпаторно определяется прорастание опухолью базального отдела ЛЖ, ствола и правой ветви ЛА (рис. 3).
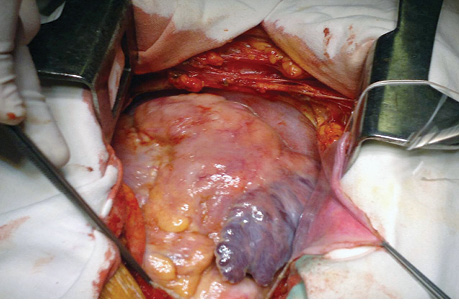
Несмотря на значительное заполнение новообразованием полости ПП, нижнюю полую вену удалось канюлировать через ее стенку, верхняя полая вена канюлирована выше места впадения в ПП на 2,5 см. После подключения аппарата искусственного кровообращения спавшаяся стенка ПП обозначила контуры опухоли (рис. 4).
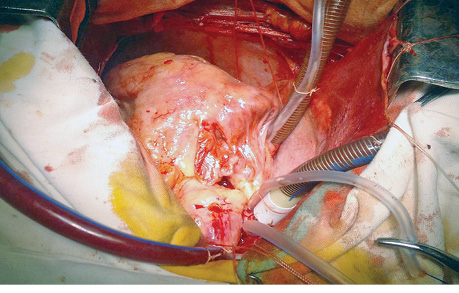
После рассечения передней стенки ПП в неизмененной ее части стало видно, что опухолевая ткань заполняет всю полость предсердия, имеет множественные участки крепления и неодинаковую плотность — от ткани, подобной неорганизованным тромбам, до плотной соединительной ткани. Оставляя лишь узкое щелевидное отверстие, новообразование плотно прикрывает ТК, тем самым значительно препятствуя свободному притоку крови к ПЖ (рис. 5). При этом сам ТК не был вовлечен в патологический процесс.
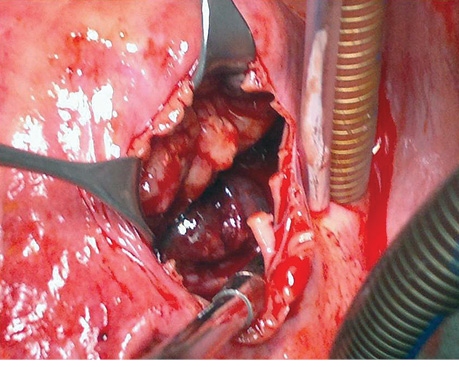
«Острым» путем опухолевые ткани максимально удалены из ПП таким образом, чтобы обеспечить свободный приток крови к ТК (рис. 6).
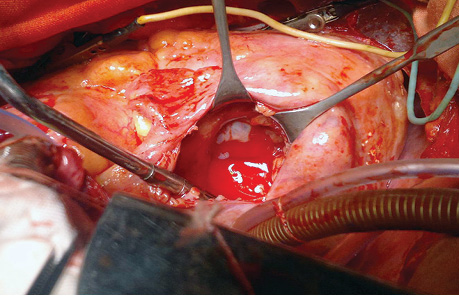
Выполненная гидропроба продемонстрировала компетентность ТК, а осмотр подклапанного пространства свидетельствовал о достаточном объеме свободной полости ПЖ. Дальнейшие манипуляции на «открытом» сердце были признаны нецелесообразными. После восстановления самостоятельной сердечной деятельности и при минимальной инотропной поддержке операцию завершили.
С помощью патогистологического исследования удаленного новообразования его классифицировали как лимфому.
В послеоперационный период в условиях реанимации и в отделении у пациента неоднократно возникала необходимость проведения дезинтоксикационной терапии, в остальном осложнений не отмечено.
Иммуногистохимическое исследование полученного во время операции материала проведено в Киевском городском клиническом онкологическом центре и Институте экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины. Для верификации диагноза и определения тактики дальнейшего лечения больной также консультирован в Национальном институте рака, где был проведен молекулярно-цитогенетический анализ опухолевой ткани. В результате всех исследований рассматриваемое новообразование определено как лимфома Беркитта.
В удовлетворительном состоянии пациент выписан на 14-е сутки после операции и направлен для дальнейшего лечения в стационар по месту жительства, где получил несколько курсов противоопухолевой терапии, включающей комплексное химиотерапевтическое, противовирусное, гормональное и иммуномодулирующее лечение. Шестикратное проведение курсов противоопухолевой терапии проходило по программе DA-R-EPOCH (циклофосфамид, винкристин, доксорубицин, преднизолон, этопозид, ритуксимаб). В результате лечения, как указывается в эпикризах истории болезни, состояние пациента значительно улучшилось, проявления сердечной недостаточности уменьшились.
Изучение четырехмесячных отдаленных результатов хирургического и консервативного противорецидивного лечения с применением эхоКГ и МРТ показало не только отсутствие рецидива новообразования в полости ПП, но и выраженное уменьшение всего объема поражения сердца опухолевым процессом (рис. 7).
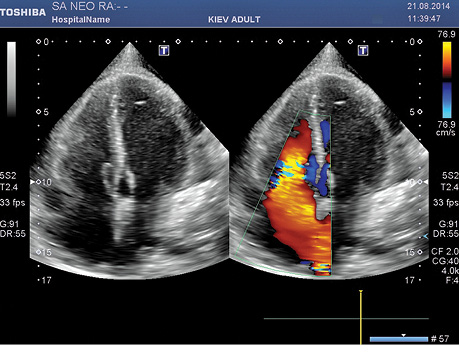
Более того, изучение отдаленных результатов через 3 года после операции с применением тех же методов диагностики продемонстрировало полное отсутствие опухолевой ткани в сердце.
Таким образом, полученные данные инструментальных методов исследования, а также удовлетворительное состояние пациента в отдаленный период наблюдения свидетельствовали об эффективности проведенного лечения и правильно выбранной его тактике.
Выводы
1. Лимфома Беркитта — крайне редкое опухолевое заболевание сердца, которое необходимо учитывать при проведении дифференциальной диагностики внутрисердечных новообразований.
2. Быстрый и агрессивный рост лимфомы Беркитта, стремительно нарушающий внутрисердечную гемодинамику, требует незамедлительной диагностики и адекватного лечения, включая хирургическое и консервативное. Только в таком случае следует рассчитывать на положительный результат с возможным полным выздоровлением пациента даже при значительном объеме поражения миокарда опухолевым процессом.
Список использованной литературы
1. Hoffmeier А., Sindermann J.R., Scheld H.H., Martens S. (2014) Cardiac tumors — diagnosis and surgical treatment. Dtsch. Arztebl. Int., 111(12): 205–211.
2. Gowdamarajan А., Michler R.E., Gowdamarajan A. (2000) Therapy for primary cardiac tumors: is there a role for heart transplantation? Curr. Opin. Cardiol., 15(2): 121–125.
3. Chan O., Igwe M., Breburda C.S., Amar S. (2016) Burkitt lymphoma presenting as an intracardiac mass: case report and review of literature. Am. J. Case Rep., 3(17): 553–558.
4. Yuan S.M., Shinfeld A., Lavee J. et al. (2009) Imaging morphology of cardiac tumors. Cardiol. J., 16(1): 26–35.
5. Jimenez Mazuecos J.M., Fuentes Manso R., Segovia Cubero J. et al. (2003) Is heart transplantation for primary cardiac sarcoma a useful therapeutic option? Rev. Esp. Cardiol., 56(4): 408–411 (in Spanish).
6. Kośmider А., Jaszewski R., Marcinkiewicz A. et al. (2013) 23-year experience on diagnosis and surgical treatment of benign and malignant cardiac tumors. Arch. Med. Sci., 9(5): 826–830.
7. Habertheuer A., Laufer G., Wiedemann D. et al. (2015) Primary cardiac tumors on the verge of oblivion: a European experience over 15 years. J. Cardiothorac. Surg., 10: 56.
8. Cresti A., Chiavarelli M., Glauber M. et al. (2016) Incidence rate of primary cardiac tumors: a 14-year population study. J. Cardiovasc. Med. (Hagerstown), 17: 37–43.
9. Burazor I., Aviel-Ronen S., Imazio M. et al. (2014) Primary malignancies of the heart and pericardium. Clin. Cardiol., 37: 582–588.
10. Isogai T., Yasunaga H., Matsui H. et al. (2016) Factors affecting in-hospital mortality and likelihood of undergoing surgical resection in patients with primary cardiac tumors. J. Cardiol., 10: 1016.
11. Barreiro M., Renilla A., Jimenez J.M. et al. (2013) Primary cardiac tumors: 32 years of experience from a Spanish tertiary surgical center. Cardiovasc. Pathol., 22: 424–427.
12. Padalino M.A., Vida V.L., Boccuzzo G. et al. (2012) Surgery for primary cardiac tumors in children: early and late results in a multicenter European Congenital Heart Surgeons Association study. Circulation, 126: 22–30.
13. Dias R.R., Fernandes F., Ramires F.J. et al. (2014) Mortality and embolic potential of cardiac tumors. Arq. Bras. Cardiol., 103: 13–18.
14. Barnes H., Conaglen P., Russell P. et al. (2014) Clinicopathological and surgical experience with primary cardiac tumors. Asian Cardiovasc. Thorac. Ann., 22: 1054–1058.
Исаенко Владимир Владиславович
03038, Киев, ул. Н. Амосова, 6
ГУ «Национальный институт сердечно-сосудистой хирургии имени Н.М. Амосова НАМН Украины»
E-mail: vladvis6@gmail.com
Correspondence:
Isaіenko Volodymyr
6 Amosov str., Kyiv 03038
SI «M.M. Amosov National Institute of Cardiovascular Surgery, NAMS of Ukraine»
E-mail: vladvis6@gmail.com














Leave a comment