Сучасні стратегії хірургічного лікування хворих на рак яєчника з тазовим канцероматозом
Ткаченко О.І., А.І. Рибін, Кузнецова О.В., Максимовський В.Є.
Резюме. У статті показано власний досвід застосування методики інтраопераційної гіпертермічної інтраперитонеальної хіміоперфузії (HIPEC) у хворих на поширений рак яєчника. На підставі аналізу 25 клінічних випадків зазначено, що розроблена методика є інноваційною та ефективною. На фоні багатьох переваг методу не виявлено відмінностей в токсичності застосовуваних препаратів між традиційною терапією хворих на рак яєчника і вдосконаленою методикою із використанням HIPEC. Вважається, що гіпертермія є одним з можливих механізмів подолання резистентності до платини.
Одержано 07.09.2018
Прийнято до руку 28.09.2018
Актуальність
Рак яєчника (РЯ) є складною медико-соціальною проблемою. За даними популяційних канцер-реєстрів країн Європи, однорічна виживаність хворих на РЯ становить 63%, трирічна — 41%, п’ятирічна — лише 35%. Відзначене в останнє десятиліття підвищення п’ятирічної виживаності хворих на РЯ в Європі на 3% (з 32 до 35%), а в США — на 4% (з 35 до 39%) зумовлене не стільки покращенням діагностики, скільки ефективним застосуванням платиновмісної хіміотерапії в лікуванні дисемінованих форм РЯ та герміногенних пухлин [1, 2, 5, 8].
Більше 70% всіх випадків РЯ реєструють на пізніх стадіях захворювання, що значно погіршує прогноз дожиття. Світовий стандарт лікування РЯ передбачає поєднання хірургічної циторедукції та застосування комбінованої терапії паклітакселом та карбоплатином [1, 3, 4]. Навіть при виконанні оптимальної циторедуктивної операції з подальшим призначенням хіміотерапії препаратами платини (хіміотерапія першої лінії) з досягненням ефекту повної регресії і нормалізації рівнів пухлинних маркерів 5-річна виживаність хворих на РЯ ІІІ стадії становить 20–25%, а ІV стадії — не перевищує 10% [9, 10]. Більшість хворих на РЯ добре відповідають на терапію препаратами першої лінії, але близько 30% пацієнток мають платинорезистентні або платинорефрактерні пухлини. Для них різні дослідники пропонують застосовувати підтримуючу терапію, комбінації інших протипухлинних препаратів, таргетну молекулярну терапію та імунотерапію. Тобто, попри відсутність клінічних ознак захворювання, у більшості пацієнток у перші 2–3 роки після закінчення хіміотерапії першої лінії слід очікувати прогресування хвороби. Частота об’єктивного ефекту коливається в межах 10–25%, а медіана тривалості життя становить 7–18 міс. Більшість вітчизняних і зарубіжних авторів сходяться на думці, що максимально можлива циторедукція є основним аспектом успішного лікування пацієнток з РЯ [1, 3, 4, 7, 11]. Але оперативних втручань таких обсягів виконується лише 10–15% при РЯ, і якісна хіміотерапія має дуже важливе значення в плані подальшого прогнозу захворювання [6, 12, 13]. Таким чином, удосконалення методик хірургічного і комбінованого лікування хворих на РЯ — надзвичайно актуальна і нагальна проблема сучасної онкогінекології.
Метою дослідження є оцінка ефективності використання гіпертермічної інтраперитонеальної хіміотерапії (HIPEC) та циторедуктивної хірургії в лікуванні хворих на РЯ, що поєднується із канцероматозом черевини.
Об’єкт і методи дослідження
Протягом 2015–2018 рр. на базах кафедри хірургії № 4 з курсом онкології Одеського національного медичного університету виконано 37 оперативних втручань з використанням HIPEC. У всіх хворих діагностовано серозну аденокарциному яєчника ІІІА–ІІІС стадії. Вік пацієнток коливався від 21 до 59 років, обсяг оперативного втручання був оцінений як субоптимальна циторедуктивна операція. Порівняльний аналіз проводився з 25 пацієнтками (група контролю) з РЯ аналогічних стадій після оперативного втручання без використання методики HIPEC. У подальшому пацієнтки обох груп отримували 4–6 курсів ад’ювантної поліхіміотерапії. Процедуру HIPEC виконували за допомогою апарата Perfomer LRT.
Perfomer LRT — це мультифункціональна спеціалізована хіміотерапія, орієнтована на підтримку декількох режимів терапії, заснованих на екстракорпоральному циркулюванні крові/рідини. Хіміотерапевтичні препарати, за визначенням, є токсичними, і їх застосування у високих концентраціях може бути пов’язане з виникненням побічних ефектів терапії. Локальна регіонарна хіміотерапія дозволяє створити набагато більш високі цільові концентрації в злоякісному вогнищі, однак існує єдине «але»: препарати повинні бути захищені від негайного вимивання із зони їх локальної активності. Циркуляторні параметри (такі як температура, об’єм, швидкість інфузії) можуть бути легко відкориговані та моніторуватися в онлайн-режимі (рис. 1).

Процедура внутрішньочеревної гіпертермічної хіміоперфузії виконується наступним чином. Цей вид лікування складається з перфузування порожнини живота хіміотерапевтичним агентом (зазвичай — цисплатин або мітоміцин С) при температурі 42,5 °С і середній швидкості потоку 800/900 мл/хв протягом 60–90 хв. Лікування призначається після циторедуктивної хірургічної операції з приводу перитонеального канцероматозу або саркоматозу, спричинених гастроінтестинальною карциномою або карциномою яєчника, псевдоміксомою, перитонеальною мезотеліомою. Іншими можливими режимами є ізольована гіпертермія кінцівок (41,5 °С, 60–90 хв) і гемофільтрація (нормотемпературна, 20 хв). Після хірургічного видалення якомога більшого об’єму пухлинної тканини 5 силіконових трубок поміщають у черевну порожнину, температурні датчики розміщують у черевній порожнині вище мезоколона і в тазу, операційну рану зашивають залишковими швами. Процедуру HIPEC виконують на апараті RAND Perfomer (Модена, Італія) за допомогою двох помп (насоси, які нагнітають і евакуюють рідину із черевної порожнини), температурного охолоджувача і стерильного закритого контуру (рис. 2).
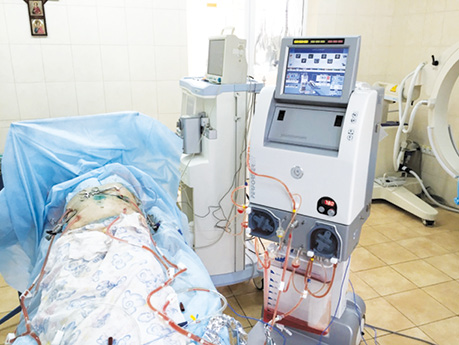
Після досягнення інтраабдомінальної температури як мінімум 42 °С мітоміцин С 25 мг/мл, цисплатин 100 мг/мл розчиняють у 5000,0 мл перфузату, який циркулює зі швидкістю 700–800 мл/хв протягом 60 хв. Середній об’єм перфузату, який міститься в черевній порожнині, щосекундно становить близько 3000 мл. Інтраабдомінальна температура коливається від 41 °С до 43 °С. Фаза охолодження черевної порожнини і фаза промивання від хіміопрепаратів займають максимально до 5–10 хв (рис. 3). Пацієнта переводять на одну добу в реанімаційне відділення для проведення інтенсивної терапії і спостереження.
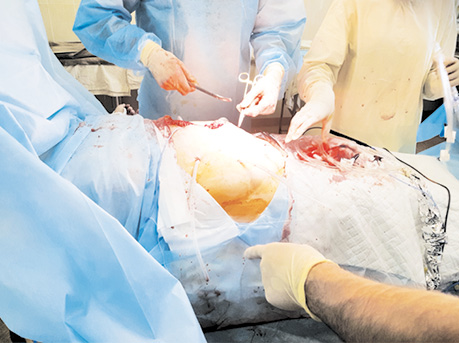
У всіх пацієнток інтраопераційно визначали індекс перитонеального канцероматозу, а також індекс повноти циторедукції. Критеріями ефективності проведеного лікування були показники якості життя та ступеня токсичності препаратів.
Якість життя хворих оцінювали за допомогою методики Medical Outcomes Study 36-Item Short Form Health Survey (SF-36). Обробку даних проводили, використовуючи статистичну програму «Біостат». Побічні ефекти комбінації лікування оцінювали окремо в розрахунку на кількість хворих та кількість курсів хіміотерапії.
Результати дослідження
З огляду на рандомізований відбір пацієнток у досліджувані групи слід зазначити, що із 37 пацієнток основної групи 29 хворих були з IIIC стадією захворювання, 5 жінок мали IIIA стадію, а у 3 пацієнток була виявлена IIIB стадія РЯ. Розподіл пацієнток контрольної групи за стадіями був таким: із 25 пацієнток групи контролю 13 хворих були з IIIC стадією, 10 жінок мали IIIA стадію, а у 2 пацієнток була виявлена IIIB стадія РЯ. Індекс перитонеального канцероматозу в основній групи становив LS-1 (28,0%) та LS-2 (72,0%). У групі контролю аналогічний показник вірогідно не відрізнявся та сягав 36,0% (LS-1) та 64,0% (LS-2). Індекс повноти циторедукції також не відрізнявся між групами і становив у основній групі СС-1 (28,0%) та СС-2 (72,0%), не відрізняючись від аналогічного показника у контрольній групі (СС-1 — 36,0%, СС-2 — 64,0%).
Порівняльний аналіз показників якості життя у досліджуваних групах через 6 міс після закінчення лікування не показав статистично достовірних відмінностей (табл. 1).
| Шкала SF-36 | Основна група (n=37) | Контрольна група (n=25) |
| Фізична активність | 34,08±21,14 | 31,88±19,44 |
| Рольові обмеження внаслідок фізичних проблем | 28,42±13,43 | 21,01±14,23 |
| Фізичний біль | 46,29±16,23 | 41,27±20,11 |
| Сприйняття загального стану здоров’я | 35,33±14,76 | 33,72±23,27 |
| Енергійність (життєздатність) | 49,85±24,16 | 44,25±34,26 |
| Соціальне функціонування | 65,42±26,16 | 63,12±22,39 |
| Рольові обмеження внаслідок емоційних проблем | 42,11±15,46 | 44,25±17,24 |
| Психічне здоров’я | 66,32±22,26 | 59,32±22,26 |
За результатами порівняльного аналізу зазначених показників нами не виявлено жодного випадку алергічних або побічних реакцій у пацієнток із поширеним РЯ основної групи. У 9 (24,3%) пацієнток основної групи, в якій використовували HIPEC, протягом першої доби спостереження після проведення HIPEC відмічено гіпертермічну реакцію (підвищення температури тіла до 38,0 °С протягом 6–7 год), яку купірували прийомом нестероїдних протизапальних препаратів. Також слід підкреслити, що 5 (13,5%) пацієнток скаржилися на біль і дискомфорт в ділянці введення промивних дренажів.
Порівняльний аналіз ступеня токсичності застосовуваних хіміопрепаратів в обох групах показав наступне (табл. 2, 3).
| Вид токсичності | Ступінь токсичності | Усього, % | |||
| I, n (%) | II, n (%) | III, n (%) | IV, n (%) | ||
| Лейкопенія | 13 (35,1) | 7 (18,8) | 4 (10,8) | 3 (8,1) | 72,8 |
| Нейтропенія | 12 (32,4) | 6 (16,2) | 5 (13,5) | – | 62,1 |
| Анемія | 3 (8,1) | 2 (5,4) | – | – | 13,5 |
| Тромбоцитопенія | 6 (16,2) | – | – | – | 16,2 |
| Нудота | 7 (18,9) | 5 (13,5) | 5 (13,5) | – | 45,9 |
| Блювання | 16 (43,2) | 1 (2,7) | 1 (2,7) | – | 48,6 |
| Діарея | 3 (8,1) | – | – | – | 8,1 |
| Стоматити | 8 (21,6) | 1 (2,7) | – | – | 24,3 |
| Вид токсичності | Ступінь токсичності | Усього, % | |||
| I, n (%) | II, n (%) | III, n (%) | IV, n (%) | ||
| Лейкопенія | 10 (40,0) | 8 (32,0) | 1 (4,0) | 1 (4,0) | 80,0 |
| Нейтропенія | 11 (44,0) | 4 (16,0) | 2 (8,0) | 1 (4,0) | 72,0 |
| Анемія | 5 (20,0) | 4 (16,0) | 4 (16,0) | – | 52,0 |
| Тромбоцитопенія | 4 (16,0) | – | – | – | 8,0 |
| Нудота | 7 (28,0) | 4 (16,0) | 4 (16,0) | – | 60,0 |
| Блювання | 10 (40,0) | 4 (16,0) | 1 (4,0) | – | 60,0 |
| Діарея | 3 (12,0) | – | – | – | 12,0 |
| Стоматити | 2 (8,0) | 4 (16,0) | 1 (4,0) | – | 28,0 |
Отримані нами результати свідчать, що ступінь гематологічної токсичності хіміопрепаратів вірогідно не відрізнявся у пацієнток обох груп. Стосовно гастроінтестинальної токсичності ми не отримали вірогідної різниці між групами дослідження. Варто зазначити також, що відсоток наявності стоматиту в основній групі також вірогідно нижчий за аналогічний показник в групі контролю.
Середня тривалість післяопераційного перебування хворих основної групи в стаціонарі становила 8,9 ліжко-дня і достовірно не відрізнялася від такої у хворих на РЯ без проведення HIPEC (контроль) (рис. 4).
Висновки
1. Застосування HIPEC у хворих на поширений РЯ у поєднанні з канцероматозом очеревини вірогідно підвищує якість життя хворих на РЯ.
2. Ефективність методики HIPEC підтверджена лише у пацієнток з РЯ ІІІА–ІІІС стадії, яким проведена оптимальна або субоптимальна циторедуктивна операція.
3. Слід відмітити відсутність ускладнень у післяопераційний період у досліджуваних групах та добру переносимість запропонованої методики в основній групі.
4. Не зареєстровано відмінностей у токсичності застосовуваних препаратів між традиційної терапією РЯ і вдосконаленою методикою з використанням HIPEC.
Список використаної літератури
- Ивченко А.Л. (2015) Рак яичников: современные аспекты диагностики. Харківська хірургічна школа, 4(73): 147–151.
- Козаченко В.П. (2005) Клиническая онкогинекология. М.: Медицина, 376 с.
- Ашрафян Л.А., Киселев В.И., Муйжнек Е.Л. и др. (2015) Рак яичников: концепция патогенеза и принципы терапии. Журнал им. П.А. Герцена, 4(3): 73–81.
- Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2018) Рак в Україні 2016–2017. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 19, 136 с.
- Свинцицкий В.С. (2015) Серозный рак яичников: тестирование мутаций генов BRCA1 и BRCA2 в Украине. Евразийский онкологический журнал (прилож.): 79–82.
- Халафян А.А. (2008) Statistica 6. Статистический анализ данных. М.: ООО «Бином-Пресс», 512 с.
- Poisson L.M., Munkarah A., Madi H. et al. (2015) A metabolomic approach to identifying platinum resistance in ovarian cancer. J. Ovarian Res., 8: 13.
- Ustün T.B., Chatterji S., Kostanjsek N. et al. (2010) Developing the World Health Organization Disability Assessment Schedule 2.0. Bul. World Health Organ., 88(11): 815–823.
- Bryand A., Hamidou Z., Paget-Bailly S. et al. (2015) Etude de la qualite de vie dans les neoplasies ovariennes: outils et enjeux. Gynecol. Obstet. Fertil., 43(2): 151–157.
- Hippisley-Cox J., Coupland C. (2013) Independent external validation of QCancer (Ovarian). Eur. J. Cancer Care (Engl.), 22(4): 559–560.
- Sugarbaker P.H. (1998) Management of peritoneal surface malignancy using intraperitoneal chemotherapy and cytoreductive surgery. Ludann Company Grand Rapids, Michigan, USA, 59 p.
- Alkema N.G., Wisman G.B., van der Zee A.G. et al. (2016) Studying platinum sensitivity and resistance in high-grade serous ovarian cancer: Different models for different questions. Drug. Resist. Updat., 24: 55–69.
- Zikos E., Coens C., Quinten C. et al. (2015) The added value of analyzing pooled health-related quality of life data: a review of the EORTC PROBE Initiative. J. Natl. Cancer Inst., 108(5): 39–41.
Современные стратегии хирургического лечения больных раком яичника с тазовым канцероматозом
Одесский национальный медицинский университет
Резюме. В статье показан собственный опыт применения методики интраоперационной гипертермической интраперитонеальной химиоперфузии (HIPEC) у больных распространенным раком яичника. На основании анализа 25 клинических случаев отмечено, что разработанная методика является инновационной и эффективной. На фоне многих преимуществ метода не выявлено различий в токсичности применяемых препаратов между традиционной терапией больных раком яичника и усовершенствованной методикой с использованием HIPEC. Как полагают, гипертермия является одним из возможных механизмов преодоления резистентности к платине.
канцероматоз таза; рак яичника; лечение; оптимизация; интраоперационная гипертермическая интраперитонеальная химиоперфузия.
Рибін Андрій Ігорович
65023, Одеса, Валіховський пров., 2
Одеський національний медичний університет
Тел.: 048-720-26-17
E-mail: Andriy.Rybin@gmail.com
Correspondence:
Rybin Andrii
2 Valikhovsky Lane, Odessa 65028
Odessa National Medical University
Tel.: 048-720-26-17
E-mail: Andriy.Rybin@gmail.com














Leave a comment