Клінічні рекомендації з діагностики та лікування раку ендометрія
Резюме. Рак ендометрія займає друге місце в структурі злоякісних новоутворень жіночої статевої системи. На сучасному етапі визначається невпинне збільшення кількості випадків цієї патології, особливо серед жінок молодого віку. Висока поширеність раку ендометрія, значні соціально-економічні затрати та психомедичні чинники зумовлюють актуальність цієї проблеми та необхідність пошуку нових методів скринінгу, діагностики та лікування. Стадія, ступінь диференціації, гістологічний тип є основними факторами прогнозу та вибору методів лікування пацієнток з раком ендометрія. Виокремлення груп ризику захворювання на основі клініко-патологічних прогностичних факторів дозволяє підібрати адекватну ад’ювантну терапію. Вибір методу лікування пацієнток залежить також від таких основних факторів: вік, загальний стан, репродуктивні плани хворої, ступінь вираженості обмінно-ендокринних порушень; гістологічний тип пухлини, ступінь її диференціації, розміри, локалізація в порожнині матки, поширеність пухлинного процесу. Основні принципи хірургічного лікування полягають в індивідуальному підборі обсягу хірургічного втручання, виконанні адекватної лімфодисекції, усуненні рецидиву та метастазів. Променеве лікування та хіміотерапія частіше застосовуються в ад’ювантному режимі, а також при неможливості виконати хірургічне лікування. Гормонотерапія показана при консервативному лікуванні початкового процесу раку ендометрія, а також при поширеному захворюванні та рецидивах. Ефективність застосування таргетної терапії ще до кінця не вивчена. Наведені рекомендації побудовані на даних клінічних рекомендацій з ведення пацієнтів зі злоякісними новоутвореннями жіночої статевої системи Європейської асоціації медичної онкології (European Society for Medical Oncology) за 2016 р. і оновлені на основі огляду літератури за останні 5 років з використанням пошукового ресурсу PubMed.
Одержано 19.09.2018
Прийнято до друку 27.09.2018
Вступ
Рак ендометрія займає друге місце серед злоякісних новоутворень жіночих статевих органів та більше ніж в 90% випадків виникає у жінок після 50 років. Рівень захворюваності на рак ендометрія в світі становить 18,8 на 100 тис. жіночого населення, а рівень летальності — 4,0 на 100 тис. жіночого населення. Крім того, відмічається невпинне зростання його частоти протягом останніх років, особливо серед жінок молодого віку. Згідно з даними Національного канцер-реєстру України за 2017 р. рівень захворюваності на рак ендометрія становив 27,9 на 100 тис. жіночого населення, а рівень летальності — 6,7 на 100 тис. жіночого населення [1].
Основними клінічними проявами раку ендометрія є маткові кровотечі. Цей симптом відмічають у 70–80% хворих: у репродуктивному віці за типом менометрорагії, у пременопаузальному — ациклічних маткових кровотеч, в постменопаузі — у вигляді кров’янистих виділень мажучого характеру. Такі симптоми, як лейкорея та переймоподібний біль внизу живота, з’являються раніше, ніж при раку шийки матки. Біль в животі постійного, тупого характеру свідчить про метастатичне ураження тазових та парааортальних лімфатичних вузлів і поширення пухлини за межі матки, що призводить до стиснення пухлинними інфільтратами нервових стовбурів малого таза та черевної порожнини [2].
До факторів ризику виникнення раку ендометрія відносять раннє менархе та пізню менопаузу (при менопаузі після 52 років ризик виникнення раку ендометрія зростає у 2 рази порівняно з менопаузою до 49 років); високий індекс маси тіла, найчастіше у поєднанні з іншими проявами метаболічного синдрому, такими як цукровий діабет, гіпертензія; безпліддя та відсутність пологів; гормонопродукуючі пухлини в анамнезі; доброякісні та передракові захворювання матки (лейоміома матки, аденоміоз, гіперпластичні процеси ендометрія); синдром полікістозних яєчників; неадекватне застосування препаратів з високим вмістом естрогенів; синдром Лінча (спадковий неполіпозний рак товстої кишки) [4–9].
Жінки мають бути проінформовані про фактори ризику та симптоми раку ендометрія. А також необхідно заохочувати жінок вести активний спосіб життя та підтримувати нормальну масу тіла. Поширення інформації серед населення про клінічні прояви, фактори ризику та профілактичні заходи дозволить знизити рівень захворюваності та збільшити виявлення хвороби на ранніх стадіях.
Наведені рекомендації побудовані на даних клінічних рекомендацій з ведення пацієнтів зі злоякісними новоутвореннями жіночої статевої системи Європейської асоціації медичної онкології (European Society for Medical Oncology — ESMO) за 2016 р. і оновлені на основі огляду літератури за останні 5 років з використанням пошукового ресурсу PubMed [3].
Скринінг
Наразі не розроблено стандартів зі скринінгу раку ендометрія. Скринінг не проводять жінкам із низьким та середнім ризиком виникнення раку ендометрія. Не рекомендовано рутинне спостереження жінок з ожирінням, синдромом полікістозних яєчників, цукровим діабетом, безпліддям/відсутністю пологів, пізньою менопаузою/раннім менархе, а також жінок, які приймають тамоксифен. Але жінкам зі зрілими гранульозоклітинними пухлинами та жінкам з епітеліальним раком яєчника, яким було проведено лікування зі збереженням репродуктивної функції, рекомендовано проводити біопсію ендометрія.
Жінки з синдромом Лінча підлягають щорічному обстеженню, включаючи гінекологічний огляд, трансвагінальне ультразвукове дослідження та аспіраційну біопсію ендометрія (вік >35 років). Також цій групі пацієнток рекомендовано застосування місцевого прогестерону (внутрішньоматкової рилізинг-системи з левоноргестрелом) та лікування передракових захворювань ендометрія (атипова гіперплазія ендометрія (АЕН)/інтраепітеліальна гіперплазія ендометрія (ІЕN)). На сьогодні для зниження ризику розвитку злоякісних новоутворень у жінок із синдромом Лінча рекомендовано проводити профілактичну гістеректомію та білатеральну сальпінгоофоректомію після 40 років [2–9].
Класифікація
Стадія, ступінь диференціації, гістологічний тип є основними факторами прогнозу та вибору методів лікування у пацієнток з раком ендометрія. Виокремлення груп ризику захворювання на основі клініко-патологічних прогностичних факторів дозволяє підібрати адекватну ад’ювантну терапію (табл. 1).
| Група ризику | Опис |
| Низька | Стадія І ендометріоїдної карциноми, G1–2, інвазія міометрія <50%, неуражений LVS |
| Проміжна | Стадія І ендометріоїдної карциноми, G1–2, інвазія міометрія ≥50%, неуражений LVS |
| Високопроміжна | Стадія І ендометріоїдної карциноми, G3, інвазія міометрія <50%, незалежно від ураження LVS Стадія І ендометріоїдної карциноми, G1–2, ураження LVS, незалежно від глибини інвазії |
| Висока | Стадія І ендометріоїдної карциноми, G3, інвазія міометрія ≥50%, незалежно від ураження LVS Стадія ІІ Стадія ІІІ ендометріоїдної карциноми, без залишкових явищ захворювання Неендометріоїдне злоякісне новоутворення (серозна, світлоклітинна чи недиференційована карцинома, карциносаркома) |
| Прогресивна | Стадія ІІІ, із залишковими явищами хвороби та стадія ІVA |
| Метастатична | Стадія ІVB |
LVS — lymphovascular space — лімфоваскулярний простір.
Визначення стадій раку ендометрія проводиться згідно з класифікацією Міжнародної федерації акушерів та гінекологів (International Federation of Gynecology and Obstetrics — FIGO). Нова система стадіювання опублікована в 2009 р. (табл. 2), але в існуючий літературі та довідниках користуються версією 1988 р. (табл. 3).
| Стадія | Характеристика |
| І | Пухлина обмежена тілом матки |
| ІА | Пухлина інфільтрує <½ товщі міометрія |
| ІВ | Пухлина інфільтрує ≥½ товщі міометрія |
| ІІ | Пухлина поширюється на шийку матки, але не виходить за межі матки |
| ІІІ | Місцеві та/чи регіонарні поширення пухлини за межі матки |
| ІІІА | Пухлина уражає серозну оболонку матки та/чи додатки |
| ІІІВ | Ураження піхви та/чи параметрія |
| ІІІС | Метастази в тазові та/чи парааортальні лімфатичні вузли |
| ІІІС1 | Ураження тазових лімфатичних вузлів |
| ІІІС2 | Ураження парааортальних лімфатичних вузлів з/без ураження тазових лімфатичних вузлів |
| IV | Пухлина поширюється на сечовий міхур та/чи слизову оболонку товстої кишки та/чи наявні віддалені метастази |
| IVA | Інвазія пухлини на сечовий міхур та/чи слизову оболонку товстої кишки |
| IVB | Віддалені метастази, включаючи внутрішньочеревні та/чи пахові лімфатичні вузли |
| Стадія | Характеристика |
| І | Пухлина обмежена тілом матки |
| ІА | Пухлина обмежена ендометрієм |
| ІВ | Пухлина інфільтрує міометрій до половини |
| ІС | Пухлина інфільтрує більше половини міометрія |
| ІІ | Пухлина поширюється на шийку матки |
| ІІА | Залучення лише залоз |
| ІІВ | Інвазія строми шийки матки |
| ІІІ | Поширення пухлини за межі матки |
| ІІІА | Пухлина поширюється на серозну оболонку матки та/чи додатки, виявляється в перитонеальних змивах/асциті |
| ІІІВ | Ураження піхви |
| ІІІС | Метастази в тазові чи парааортальні лімфатичні вузли |
| ІV | Пухлина поширюється на сусідні органи чи є віддалені метастази |
| IVA | Пухлина поширюється на сечовий міхур та/чи слизову оболонку товстої кишки |
| IVB | Віддалені метастази, включаючи ураження внутрішньочеревних та пахових лімфатичних вузлів |
Найчастіше виявляють ендометріоїдну карциному, її частка від загальної кількості злоякісних новоутворень становить 75–80%. До інших гістологічних варіантів раку ендометрія належать: муцинозна, серозна та світлоклітинна аденокарциноми, а також плоскоклітинна, перехідно-клітинна, дрібноклітинна, змішана та недиференційована карциноми.
Діагностика раку ендометрія
Морфологічна діагностика відіграє вирішальну роль у виявленні раку ендометрія, диференційній діагностиці та подальшій тактиці лікування пацієнток. З метою отримання матеріалу використовують дилатацію та кюретаж із морфологічним дослідженням матеріалу (D&C — Dilatation and Curettage), які все ще лишаються основним методом обстеження пацієнток з раком ендометрія, та гістероскопію з біопсією ендометрія [10, 11].
Нові діагностичні підходи включають трансвагінальну ультрасонографію та гістероскопію з біопсією. Застосування ультразвукового дослідження дозволяє виміряти товщину ендометрія, а проведення гідросонографії дає можливість диференціювати локальні та дифузні патологічні утворення.
Диференційна діагностика між доброякісними та злоякісними захворюваннями побудована на результатах морфологічного дослідження. У складних випадках гістологічний діагноз повинен бути підтверджений імуногістохімічними та молекулярними дослідженнями. Проведення імуногістохімічного дослідження рекомендовано для диференційної діагностики між атиповою гіперплазією ендометрія/інтраепітеліальною гіперплазією ендометрія та доброякісними імітаціями (при втраті експресії PTEN та PAX-2), між серозним інтраепітеліальним раком ендометрія та його імітаціями (при втраті експресії p53). Не показано застосування імуногістохімічного дослідження при диференційній діагностиці між атиповими поліпоїдними аденоміомами та атиповою гіперплазією ендометрія/інтраепітеліальною гіперплазією ендометрія, оскільки при цих станах немає характерних діагностичних ознак.
При підозрі на наявність раку ендоцервікса за допомогою імуногістохімічного дослідження проводиться визначення таких маркерів, як рецептори до естрогенів, віментин, раковоембріональний антиген (СЕА), р16. Отримані дані дослідження маркерів повинні бути оцінені в клінічному та гістологічному контексті. Дослідження пухлинного гена Вільмса (WT-1) проводять для визначення походження серозної карциноми. Визначення онкомаркера СА-125 не має ніякої клінічної цінності при раку ендометрія [11].
Методи візуалізації (комп’ютерна томографія — КТ, магнітно-резонансна томографія — МРТ, позитронно-емісійна томографія, поєднана з комп’ютерною томографією, — ПЕТ-КТ, ПЕТ-КТ з 2-флуоро-2-деокси-Д-глюкозою, ультразвукове дослідження) застосовують для оцінки ураження органів малого таза, лімфатичних вузлів, очеревини та наявності віддалених метастазів [12, 13].
Передопераційне обстеження повинно включати: збір сімейного анамнезу; загальну оцінку супутніх захворювань; геріатричну оцінку, якщо це доречно; клінічний огляд, у тому числі вагінальне дослідження; трансвагінальне чи трансректальне ультразвукове дослідження; рентгенографію органів черевної порожнини; загальний аналіз крові, біохімічний аналіз крові; повну морфологічну оцінку матеріалу ендометрія (гістологічний тип та ступінь диференціації (G)). Якщо планується проведення лімфодисекції при І клінічній стадії і ступені диференціації пухлини G1–2, з метою визначення ступеня інвазії міометрія необхідно оцінити результати ультразвукового дослідження та МРТ, а також провести інтраопераційне гістологічне дослідження.
Лікування раку ендометрія
Вибір методу лікування пацієнток залежить від таких основних факторів: вік, загальний стан, репродуктивні плани хворої, ступінь вираженості обмінно-ендокринних порушень; гістологічний тип пухлини, ступінь її диференціації, розміри, локалізація в порожнині матки, поширеність пухлинного процесу.
Основним методом лікування хворих на рак ендометрія є хірургічний, який залежно від прогнозу захворювання доповнюється променевим лікуванням, гормоно- або хіміотерапією. На сучасному етапі є можливість проведення консервативного лікування з метою збереження фертильності у ретельно відібраній групі пацієнток.
Основні принципи консервативного лікування
Консервативне лікування з метою збереження репродуктивної функції можна застосовувати для пацієнток з атиповою гіперплазією ендометрія/інтраепітеліальною гіперплазією ендометрія або раком ендометрія І стадії зі ступенем диференціації G1. Дилатацію та кюретаж або/та гістероскопію необхідно проводити для отримання результатів гістологічного дослідження. Гістологічне дослідження повинно бути виконане досвідченим патоморфологом. А для підтвердження відсутності інвазії в міометрій має бути проведена високоякісна МРТ або, як альтернативній метод, ультразвукове дослідження досвідченим спеціалістом.
Пацієнтці необхідно повідомити про те, що консервативне лікування не є стандартним методом лікування, вимагає постійного та регулярного спостереження, а в подальшому — проведення гістеректомії.
Консервативне лікування включає призначення препаратів прогестерону, медроксипрогестерону ацетату (400–600 мг/добу), мегестролу ацетату (160–320 мг/добу), а також застосування внутрішньоматкової рилізинг-системи з левоноргестрелом з/без аналогів гонадотропін-рилізинг гормону [14, 15].
Для оцінки ефективності лікування кожні 6 міс проводять дилатацію та кюрентаж, гістероскопію з подальшим гістологічним дослідженням матеріалу та діагностичне дослідження з візуалізацією. При відсутності ефекту від лікування необхідно виконати стандартне хірургічне лікування (гістеректомію).
Групі пацієнток з повним ефектом лікування необхідно рекомендувати планувати вагітність та направити їх до репродуктивних клінік. При бажанні пацієнток цієї групи відтермінувати планування вагітності застосовується підтримувальна терапія протягом наступних 6 міс. Після виношування та народження дитини пацієнткам рекомендоване проведення гістеректомії та білатеральної сальпінгоофоректомії. Питання збереження яєчників необхідно вирішувати з врахуванням віку пацієнтки та наявності генетичних факторів ризику. Стандартне хірургічне лікування необхідно виконувати у пацієнток, у яких виник рецидив захворювання після ефективного застосування консервативного лікування [3].
Основні принципи хірургічного лікування
Для визначення обсягу хірургічного лікування дуже важливо ретельно оцінити кожен конкретний випадок із застосуванням сучасних методів досліджень.
Використання малоінвазивних технік хірургічного лікування не впливає на рівень загальної виживаності та може бути рекомендоване для лікування хворих низької, проміжної, високопроміжної груп ризику захворювання, а також може бути виконане навіть у пацієнток високої групи ризику. Хворим, у яких неможливо провести хірургічне лікування лапаротомним чи лапароскопічним методами, або відібраній групі пацієнток низького ризику можна виконати гістеректомію та аднексектомію вагінальним доступом. При наявності протипоказань до хірургічного лікування необхідно проводити променеву чи гормонотерапію [16].
Виконання лімфодисекції дозволяє повноцінно провести стадіювання раку ендометрія та визначити необхідність в подальшому призначенні ад’ювантної терапії. Однак терапевтичний ефект від проведення лімфодисекції ще досі невідомий. Ураження парааортальних лімфатичних вузлів зазвичай пов’язане з наявністю метастазів вище рівня нижньої брижової артерії, тому проведення систематичної тазової та парааортальної лімфодисекції повинно бути зроблено до рівня ниркових вен (рис. 1).
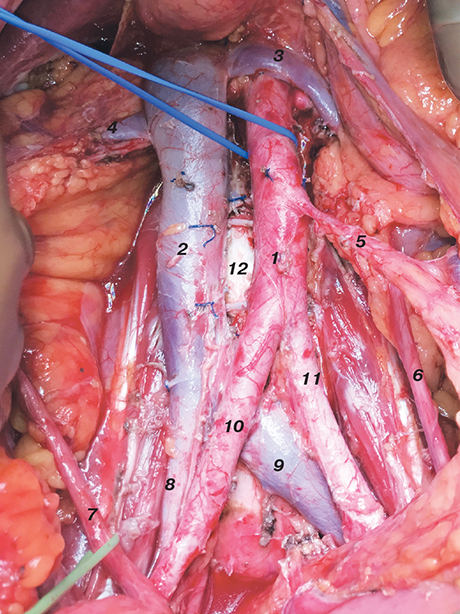
Лімфодисекція сигнальних лімфовузлів є своєрідним компромісом між проведенням повної лімфодисекції та її відсутністю. Застосування цього виду лімфодисекції дозволяє визначити невеликі метастази та солітарні пухлинні клітини. Але наразі немає даних, які підтверджують важливість проведення лімфодисекції сигнальних вузлів.
Доведено, що кількість видалених лімфатичних вузлів є дуже важлива, оскільки видалення більшої кількості лімфовузлів сприяє підвищенню рівня загальної виживаності при проміжному та високому ризику захворювання.
Застосування лімфодисекції не рекомендовано групі хворих низького ризику захворювання (І стадія ендометріоїдного раку, G1–2, глибина інвазії міометрія <50%). У той же час її необхідно проводити для стадіювання в групі хворих проміжного (І стадія, G1–2, глибина інвазії міометрія ≥50%) чи високопроміжного (G3, глибина інвазії міометрія <50%) ризику захворювання [17, 18].
При І стадії раку ендометрія стандартом хірургічного лікування є виконання тотальної гістеректомії з двобічною аднексектомією без вагінальної манжетки та з/без лімфодисекції (залежно від групи ризику захворювання). Збереження яєчників можливе в групі хворих віком <45 років, з І стадією ендометріоїдного раку та інвазією міометрія <50% та при відсутності явних захворювань яєчників. Водночас видалення маткових труб є обов’язковим.
Для групи пацієнток із сімейним раковим анамнезом, включаючи синдром раку яєчника, наприклад синдромом Лінча, не рекомендоване хірургічне лікування зі збереженням яєчників.
Хірургічне лікування хворих з ІІ стадією раку ендометрія включає проведення тотальної гістеректомії з білатеральною сальпінгоофоректомією та тазової лімфодисекції (видаляються загальні, зовнішні, внутрішні клубові та обтураторні лімфатичні вузли). Але у певних випадках, таких як явне ураження параметрія, виконують модифіковану (тип В) або радикальну гістеректомію типу А з метою отримання чистих країв рани від пухлинних тканин. Лімфодисекція проводиться при клінічно або інтраопераційно встановленій ІІ стадії захворювання [17–20].
При поширеному раку ендометрія (ІІІ–IV стадії) та рецидивах виконується повна циторедукція макроскопічних пухлинних утворень. Виконання оптимальної циторедукції покращує рівень загальної виживаності. Однак проведення системної тазової та парааортальної лімфодисекції не повинно бути рутинним, оскільки не впливає на виживаність від прогресування захворювання та загальну виживаність. Видалення пухлинних утворень показане пацієнткам із місцево-поширеними пухлинами та при ізольованому місцевому рецидиві після радіотерапії за умови отримання чистих країв рани від пухлинних тканин. При рецидивах, за наявності технічної можливості, проводять резекцію всіх олігометастазів та метастазів у тазових та заочеревинних лімфатичних вузлах (рис. 2). Метою паліативного хірургічного лікування є зменшення вираженості таких симптомів, як кровотечі та кишкова непрохідність.
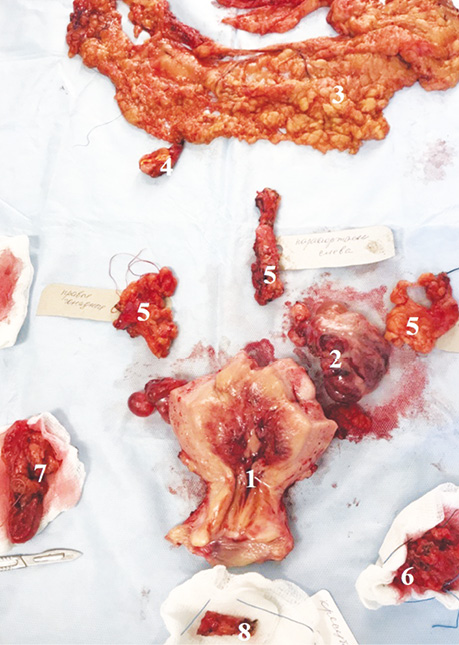
Стандарти лікування при інших гістологічних типах раку ендометрія такі самі, як при ендометріоїдному раку. Лімфодисекція проводиться при І стадії захворювання, інвазії ≥50% товщі ендометрія. Виконання оментектомії не є обов’язковим при карциносаркомі, світлоклітинній та недиференційованій карциномі ендометрія, але показане при серозній карциномі.
Принципи ад’ювантної терапії при раку ендометрія
Стратегія ад’ювантної терапії побудована згідно з групами ризику раку ендометрія. Ад’ювантну терапію не проводять при низькому ризику захворювання.
Хворим з проміжним ризиком захворювання застосовують піхвову брахітерапію та дистанційну променеву терапію з метою зниження розвитку вагінального рецидиву. Доведено, що ефективність дистанційної променевої терапії така ж, як і брахітерапії, але водночас токсичність її менша. Пацієнткам віком <60 років можна не проводити ад’ювантну променеву терапію [21, 22].
При раку ендометрія високопроміжного ризику з негативними лімфатичними вузлами застосовують ад’ювантну брахітерапію, хоча її відсутність також є альтернативним варіантом. При захворюванні високопроміжного ризику без проведеного хірургічного стадіювання лімфовузлів виконання ад’ювантної дистанційної променевої терапії однозначно знижує ризик виникнення вагінального рецидиву при наявності ураження лімфоваскулярного простору (lymphovascular space involvement — LVSІ). Ад’ювантна брахітерапія показана при низькодиференційованій пухлині та відсутності LVSI для зниження ризику виникнення вагінального рецидиву. Ефективність застосування хіміотерапії сумнівна.
Стандартом лікування хворих з високим ризиком захворювання є дистанційна променева терапія на проекцію таза. Ад’ювантна дистанційна променева терапія на обмежені ділянки проводиться при І стадії, високому ризику захворювання для зниження ризику розвитку локально-регіонарного рецидиву. Поєднання цього методу з брахітерапією є альтернативним варіантом лікування для зниження ризику вагінального рецидиву. При захворюванні високого ризику, І стадії без проведеного хірургічного стадіювання лімфовузлів застосування ад’ювантної дистанційної променевої терапії дозволяє підвищити рівень віддаленої виживаності без рецидивів. Наразі немає достатньої кількості даних, що підтверджують ефективність застосування комбінації хіміотерапії і дистанційної променевої терапії та для порівняння використання цих методів окремо у хворих високого ризику з І стадією захворювання [3, 18].
При захворюванні високого ризику і ІІ стадії раку ендометрія з негативними лімфатичними вузлами після проведення простої гістеректомії застосування вагінальної брахітерапії рекомендоване для зниження ризику розвитку тазових рецидивів при захворюванні зі ступенем диференціації G1–2 та відсутністю LVSІ. Дистанційна променева терапія на обмежені ділянки з метою підсилення лікувального ефекту брахітерапії застосовується при захворюванні зі ступенем диференціації G3 та наявністю LVSІ. А також при захворюванні зі ступенем диференціації G3 чи при явних ознаках LVSІ показано застосування послідовної ад’ювантної хіміотерапії. Доведено, що проведення хіміотерапії у хворих з ІІ стадією раку ендометрія, високим ризиком захворювання без залишкових явищ після хірургічного лікування підвищує рівень виживаності від прогресування хвороби та рівень онкоспецифічної виживаності. А також у пацієнток такої групи проводять дистанційну променеву терапію для зниження ризику виникнення рецидиву, покращення рівня виживаності від прогресування захворювання та рівня загальної виживаності [3, 23].
На сьогодні є багато досліджень, які підтверджують, що поєднання хіміотерапії та дистанційної променевої терапії при стадіях захворювання ІІІА, ІІІВ та ІІІС1 має кращий ефект, ніж застосування лише одного методу лікування.
При стадії захворювання ІІІС2 доведено ефективність застосування хіміотерапії та дистанційної променевої терапії на обмежені ділянки.
Отже, хіміотерапію на основі препаратів платини проводять лише у хворих з І стадією, G3 та наявністю несприятливих факторів ризику (вік пацієнтки, наявність LVSІ, великий об’єм пухлини) та пацієнток з ІІ–ІІІ стадією захворювання [2, 3, 25].
За результатами поточних досліджень не підтверджено ефективність застосування гормонотерапії прогестинами в ад’ювантному режимі.
При високому ризику серозного та світлоклітинного раку ендометрія після повноцінного стадіювання проводять: хіміотерапію; вагінальну брахітерапію (стадія ІА, відсутність LVSІ); поєднання дистанційної променевої терапії та хіміотерапії (стадія ≥ІВ), особливо при наявності уражених лімфатичних вузлів. А також необхідно застосовувати хіміотерапію та дистанційну променеву терапію при карциносаркомі та недиференційованих пухлинах тіла матки.
Основні принципи лікування поширеного раку ендометрія та рецидивів
На сьогодні немає остаточного консенсусу в стандартах лікування жінок з поширеним раком ендометрія (ІІІА–ІV стадій за FIGO). Застосовується поєднання хірургічного лікування з радіотерапією та/або хіміотерапією [2, 3].
Радіотерапія застосовується при нерезектабельних первинних пухлинах та у випадках, в яких неможливо виконати хірургічне лікування з приводу наявності медичних протипоказань. При тазових рецидивах вибором методу лікування є хірургічне, радіотерапія (центральний рецидив) або хіміорадіотерапія (регіональний рецидив). Пацієнткам, які належать до групи високого ризику виникнення системних рецидивів, при рецидиві в піхву чи тазові лімфатичні вузли показано застосування хіміорадіотерапії. Хіміотерапія чи хірургічне лікування з подальшою радіотерапією показано хворим з масивним ураженням лімфатичних вузлів [2, 3, 27, 28].
Повторне опромінення з візуальним контролем можна використовувати у відібраних групах хворих. Але у клінічних випробуваннях недостатньо даних щодо застосування цієї методики [24].
Проведення променевої терапії з паліативною метою показано хворим з місцевими чи системними рецидивами з наявністю таких симптомів захворювання, як кровотеча, метастази в кістках, больовий синдром при рецидивах в лімфатичні вузли [2, 3, 18, 24].
Принципи гормонотерапії при раку ендометрія
Гормонотерапія показана при поширеному раку ендометрія та його рецидивах. Цей метод лікування застосовується як перша лінія системної терапії у групі пацієнток із позитивними естроген-прогестероновими рецепторами (PgR-позитивні), ступенем диференціації G1–2 та повільним прогресуванням захворювання. При рецидивах хвороби необхідно обов’язково проводити біопсію, оскільки може бути різний стан рецепторів між первинними та рецидивними пухлинами. Застосовують медроксипрогестерону ацетат 200 мг або мегестролу ацетат 300 мг, а також інші препарати (тамоксифен, фулвестрант та інгібітори ароматази) [3, 14, 15].
Принципи хіміотерапії при раку ендометрія
Рак ендометрія досить чутливий до хіміотерапії. Найбільш активними препаратами в лікуванні раку ендометрія є антрацикліни, препарати платини, таксани. Стандартною схемою лікування є карбоплатин + паклітаксел, яка ефективна та менш токсична порівняно зі комбінацією цисплатин + доксорубіцин + паклітаксел. Схему хіміотерапії карбоплатин + паклітаксел призначають тривалістю 6 курсів, через кожні 3 тиж. При ІІІ–ІV стадії серозної та світлоклітинної карциноми застосування схеми терапії на основі препаратів платини підвищує рівень виживаності від прогресування захворювання та рівень загальної виживаності [2, 3, 25].
Схеми хіміотерапії, які застосовуються в лікуванні епітеліального раку яєчника, можуть використовуватися в терапії серозного та світлоклітинного раку тіла матки [26].
Принципи таргетної терапії при раку ендометрія
Існує велика кількість специфічних генних аномалій та аберантних сигнальних каскадів, які можуть стати перспективними цілями (включаючи PI3K/PTEN/AKT/mTOR, RAS-MAPK та шляхи ангіогенезу, ER/PgR альтерації та дефіцит гомологічної рекомбінації [HRD]/мікросателітну нестабільність [MSI]). У клінічних випробуваннях із таргетними препаратами досліджується їх важливість у лікуванні раку ендометрія. Препарати, направлені на РI3K/mTOR сигнальні каскади та ангіогенез, показали активність у клінічних дослідженнях, але на сьогодні вони ще не затверджені для клінічного застосування [2, 3].
Спостереження
Рекомендована частота оглядів при диспансеризації — кожні 3–4 міс протягом перших 2 років, потім — кожні 6 міс до 5 років. Додаткові клінічні дослідження проводяться при необхідності. ПЕТ-КТ є кращим та більш специфічним методом дослідження при оцінюванні рецидивів раку ендометрія, ніж КТ [2, 3].
Список використаної літератури
- Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2018) Рак в Україні 2016–2017. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 19, 136 с.
- Воробьева Л.И. (2012) Практическая онкология. Киев, 228 с.
- ESMO Guidelines Gynaecological Malignancies (2016). Електронний ресурс: https://www.esmo.org/Guidelines/Gynaecological-Cancers
- Adán-Merino L., Aldeguer-Martínez M., Alonso-Gamarra E. et al. (2018) Diagnosis and clinical behavior in patients with Lynch-like syndrome. Rev. Gastroenterol. Mex., 83(4): 470–474.
- Ryan N.A.J., Blake D., Cabrera-Dandy M. et al. (2018) The prevalence of Lynch syndrome in women with endometrial cancer: a systematic review protocol. Systematic Reviews, 7: 121.
- La Russa M., Zapardiel I., Halaska M.J. et al. (2018) Conservative management of endometrial cancer: a survey amongst European clinicians. Arch. Gynecol. Obstet., 298(2): 373–380.
- Singh S., Resnick K.E. (2017) Lynch syndrome and endometrial cancer. South. Med. J., 110(4): 265–269.
- Dashti S.G., Chau R., Ouakrim D.A. et al. (2015) Female hormonal factors and the risk of endometrial cancer in Lynch syndrome. JAMA, 314(1): 61–71.
- Ding D.C., Chen W., Wang J.H., Lin S.Z. (2018) Association between polycystic ovarian syndrome and endometrial, ovarian, and breast cancer: A population-based cohort study in Taiwan. Medicine (Baltimore), 97(39): e12608.
- Matteson K.A., Robison K., Jacoby V.L. (2018) Opportunities for early detection of endometrial cancer in women with postmenopausal bleeding. JAMA Intern. Med., 178(9): 1222–1223.
- Bonte A.S., Luyckx A., Wyckmans L. et al. (2018) Quality indicators for the management of endometrial, cervical and ovarian cancer. Eur. J. Surg. Oncol. doi: 10.1016/j.ejso.2018.10.051
- Lin M.Y., Dobrotwir A., McNally O. et al. (2018) Role of imaging in the routine management of endometrial cancer. Int. J. Gynaecol. Obstet., 143(2): 109–117.
- Laifer-Narin S.L., Genestine W.F., Okechukwu N.C. et al. (2018) The role of computed tomography and magnetic resonance imaging in gynecologic oncology. PET Clin., 13(2): 127–141.
- Tomica D., Ramić S., Danolić D. et al. (2018) Impact of oestrogen and progesterone receptor expression in the cancer cells and myometrium on survival of patients with endometrial cancer. J. Obstet. Gynaecol., 38(1): 96–102.
- Pal N., Broaddus R.R., Urbauer D.L. et al. (2018) Treatment of low-risk endometrial cancer and complex atypical hyperplasia with the levonorgestrel-releasing intrauterine device. Obstet. Gynecol., 131(1): 109–116.
- Asher R., Obermair A., Janda M., Gebski V. (2018) Disease-free and survival outcomes for total laparoscopic hysterectomy compared with total abdominal hysterectomy in early-stage endometrial carcinoma: a meta-analysis. Int. J. Gynecol. Cancer, 28(3): 529–538.
- Kato K., Okamoto S., Ota E., Takeshima N. (2018) Secondary debulking surgery for para-aortic nodal recurrence in endometrial cancer requiring circumferential resection of the inferior vena cava. Gynecol. Oncol., 149(1): 221–222.
- Lucic N., Draganovic D., Sibincic S. et al. (2017) Myometrium invasion, tumour size and lymphovascular invasion as a prognostic factor in dissemination of pelvic lymphatics at endometrial carcinoma. Med. Arch., 71(5): 325–329.
- Papathemelis T., Hassas D., Gerken M. et al. (2018) There a benefit of lymphadenectomy for overall and recurrence-free survival in type I FIGO IB G1-2 endometrialcarcinoma? A retrospective population-based cohort analysis. J. Cancer Res. Clin. Oncol., 144(10): 2019–2027.
- Свинцицкий В.С., Воробьева Л.И., Стаховский Э.А. и др. (2013) Расширенная гистерэктомия (С1 nerve-sparing dissection) у больных инвазивным раком шейки матки. Клин. онкология, 2(10): 72–78.
- Scharl S., Papathemelis T., Kronberger K. et al. (2018) Does post-operative radiochemotherapy improve survival in high-grade endometrial cancer patients? Results of a population-based cohort analysis of a cancer registry. Arch. Gynecol. Obstet., 297(5): 1245–1253.
- Modh A., Ghanem A.I., Burmeister C. et al. (2018) What is the optimal adjuvant treatment sequence for node-positive endometrial cancer? Results of a national cancer database analysis. Int. J. Gynecol. Cancer, 28(2): 248–253.
- Lester-Coll N.H., Young M.R., Park H.S. et al. (2017) Adjuvant therapy use and survival in stage II endometrial cancer. Int. J. Gynecol. Cancer, 27(9): 1904–1911.
- Lopes J., Horta M., Cunha T.M. (2018) Endometrial cancer after radiation therapy for cervical carcinoma: A radiological approach. Eur. J. Radiol., 105: 283–288.
- Kogan L., Laskov I., Amajoud Z. et al. (2017) Dose dense carboplatin paclitaxel improves progression free survival in patients with endometrial cancer. Gynecol. Oncol., 147(1): 30–35.
- Bogani G., Ditto A., Leone Roberti Maggiore U. et al. (2018) Neoadjuvant chemotherapy followed by interval debulking surgery for unresectable stage IVB serous endometrial cancer. Tumori. doi: 10.1177/0300891618784785
- Connor E.V., Rose P.G. (2018) Management strategies for recurrent endometrial cancer. Expert. Rev. Anticancer Ther., 18(9): 873–885.
- Sari M.E., Yalcin I., Sahin H. et al. (2018) Risk factors for paraaortic lymph node metastasis in endometrial cancer. Int. J. Clin. Oncol., 22(5): 937–944.
Клинические рекомендации по диагностике и лечению рака эндометрия
Национальный институт рака, Киев
Резюме. Рак эндометрия занимает второе место в структуре злокачественных новообразований женской половой системы. На современном этапе определяется непрерывное увеличение количества случаев данной патологии, особенно среди женщин молодого возраста. Высокая распространенность рака эндометрия, значительные социально-экономические затраты и психомедицинские факторы обусловливают актуальность данной проблемы и необходимость поиска новых методов скрининга, диагностики и лечения. Стадия, степень дифференциации, гистологический тип являются основными факторами прогноза и выбора методов лечения пациенток с раком эндометрия. Выделение групп риска заболевания на основе клинико-патологических прогностических факторов позволяет подобрать адекватную адъювантную терапию. Выбор метода лечения пациенток зависит от следующих основных факторов: возраст, общее состояние, репродуктивные планы больной, степень выраженности обменно-эндокринных нарушений; гистологический тип опухоли, степень ее дифференциации, размеры, локализация в полости матки, распространенность опухолевого процесса. Основные принципы хирургического лечения заключаются в индивидуальном подборе объема хирургического вмешательства, выполнении адекватной лимфодиссекции, устранении рецидива и метастазов. Лучевое лечение и химиотерапия чаще применяются в адъювантном режиме, а также при невозможности проведения хирургического лечения. Гормонотерапия показана при консервативном лечении начального процесса рака эндометрия, а также при распространенном заболевании и рецидивах. Эффективность применения таргетной терапии еще до конца не изучена. Представленные рекомендации построены на данных клинических рекомендаций по ведению пациентов со злокачественными новообразованиями женской половой системы Европейской ассоциации медицинской онкологии (European Society for Medical Oncology) за 2016 г. и обновленные на основе обзора литературы за последние 5 лет с использованием поискового ресурса PubMed.
рак эндометрия; клинические рекомендации; методы диагностики; хирургическое лечение; лучевая терапия; химиотерапия; гормонотерапия.
Ренкас Олена Павлівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: renkas.elen@gmail.com
Correspondence:
Renkas Olena
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: renkas.elen@gmail.com














Leave a comment