Результати хірургічного лікування хворих з пухлинами крижової кістки за використання передопераційного 3D-моделювання
Дєдков А.Г., Максименко Б.В., Бойчук С.І., Костюк В.Ю.
Резюме. Метою дослідження було покращення результатів хірургічного лікування за рахунок зменшення кількості локальних рецидивів у хворих з пухлинами крижової кістки шляхом точного вибору рівня резекції за методом комп’ютерної томографії з 3D-моделюванням. Отримані результати порівнювали з даними ретроспективної групи хворих. Аналіз даних включав оцінку частоти локальних рецидивів та ускладнень.
Одержано 09.10.2018
Прийнято до друку 12.11.2018
Вступ
Пухлини крижової кістки (ПКК) виникають рідко, становлять до 5% усіх пухлин кісток та 0,2% усіх злоякісних новоутворень [1], а їхня частка в структурі первинних пухлин хребта, за даними різних реєстрів, сягає від 32 до 71% [2, 3]. Ефективне лікування таких пацієнтів потребує залучення мультидисциплінарної команди спеціалістів у складі: онкохірурга, нейрохірурга, радіолога-діагноста, променевого терапевта та хіміотерапевта. Часто хворі тривалий час отримують лікування з приводу дегенеративно-дистрофічних захворювань хребта, адже, на думку багатьох авторів, ПКК не завжди можна діагностувати методом звичайної рентгенографії. J.K. Amorosa та співавтори у своєму дослідженні демонструють, що точність рентгенографії для візуалізації ПКК становить усього 17% [5]. Внаслідок цього хворі звертаються в спеціалізовані центри вже з пухлинами значного розміру, що ускладнює їх подальше лікування [4, 5].
Використання комп’ютерної томографії (КТ) та магнітно-резонансної томографії дозволяє з високою точністю візуалізувати зону пухлинного ураження. У більшості випадків застосування обох цих методів є необхідним з огляду на їх різні характеристики: КТ надає можливість отримати дані про стан кісткових структур, наявність осифікатів у структурі пухлини та використовувати результати дослідження для подальшого 3D-моделювання при плануванні оперативного втручання; магнітно-резонансна томографія дозволяє отримати більш точні дані щодо ураження м’яких тканин [6].
Першим важливим кроком перед початком лікування є виконання морфологічної верифікації пухлинного процесу шляхом біопсії з урахуванням того, що біопсійний канал повинен видалятися в комплексі з препаратом [7]. Радикальна резекція з дотриманням чистоти країв резекції є стандартом для всіх злоякісних ПКК та більшості доброякісних [8]. Це дозволяє знизити ризик локального рецидиву до 5–17%, а втім, при порушенні абластики цей показник може сягати 70–81% [9, 10]. Р. Ruggieri та співавтори дійшли висновку, що досягнення чистоти країв резекції під час первинного хірургічного втручання є основним прогностичним фактором безрецидивної виживаності [11].
Хірургічне лікування хворих на ПКК пов’язане зі значним ризиком операційних ускладнень через близьке розташування магістральних судин, крижово-здухвинного зчленування, прямої кишки та нервових структур, що ускладнює досягнення чистих країв резекції, крім того, збільшує кількість інтраопераційних та післяопераційних ускладнень, що, в свою чергу, подовжує тривалість перебування хворого в стаціонарі та підвищує ризик виникнення рецидиву [12].
Об’єкт і методи дослідження
У відділенні онкоортопедії Національного інституту раку виконано когортне дослідження з проспективним використанням 3D-моделювання на основі даних КТ для точного вибору рівня резекції у хворих на ПКК.
3D-моделювання здійснювали із використанням пакета програмного забезпечення RadiAnt DICOM Viewer with 3D Volume Rendering. Метою дослідження було покращення результатів хірургічного лікування хворих шляхом визначення оптимального рівня резекції крижової кістки. Отримані результати порівнювали з ретроспективною когортою хворих (рис. 1, 2).
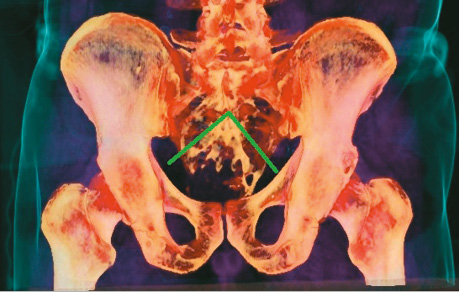
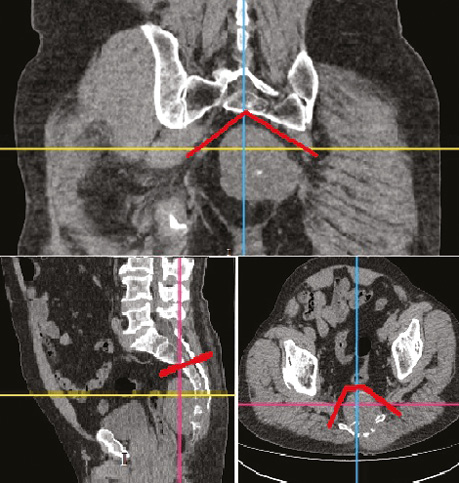
Контрольну (ретроспективну) групу склали 21 хворий, яким виконано резекцію крижової кістки у період з 2008 до 2014 р. Серед них було 57,1% жінок та 42,9% чоловіків, середній вік хворих становив 53±7,3 року. Найчисельнішу групу сформували пацієнти з хордомами – 12 хворих (57,1% загальної кількості).
В основну групу включено 12 хворих, яким виконано хірургічне втручання в період з 2015 до 2018 р. із плануванням рівня резекції з використанням 3D-моделювання. Чоловіків було 41,7%, а жінок — 58,3%, середній вік хворих становив 56±4,2 року. Середній термін спостереження — 19±4,5 міс.
Розподіл хворих у групах за статтю та віком представлено у таблиці.
| Група хворих | Чоловіки | Жінки | Разом | ||||
| Вік, років | |||||||
| 18–25 | 26–50 | понад 50 | 18–25 | 26–50 | понад 50 | ||
| Основна, n=12 | 0 | 1 | 4 | 1 | 2 | 4 | 12 |
| Контрольна, n=21 | 1 | 3 | 5 | 2 | 5 | 5 | 21 |
Аналіз даних включав оцінку частоти локальних рецидивів упродовж 18 міс спостереження, інтраопераційних та післяопераційних ускладнень. Статистичний аналіз отриманих результатів виконували за допомогою пакета програмного забезпечення Statistica 6.0 шляхом оцінки параметричного показника точного критерію Фішера та визначення 95% довірчого інтервалу (ДІ).
Результати та їх обговорення
У контрольній (ретроспективній) групі виконано 21 хірургічне втручання в обсязі резекції крижової кістки: на рівні SIV хребця — у 2 (9,5%), SIII хребця — у 9 (42,9%), SII хребця — у 9 (42,9%), SI хребця — в 1 (4,7%) пацієнта. Частота локальних рецидивів становила 47,6%. Найчастішими інтраопераційними ускладненнями були кровотечі — 42,8%, а в одному випадку розвинулася лікворея (4,8%). При оцінці післяопераційних ускладнень виявлено, що найчастіше діагностували порушення функції тазових органів — 66,6%.
В основній групі пацієнтів виконано 12 хірургічних втручань в обсязі резекції крижової кістки на різних рівнях. Усім пацієнтам перед операцією виконано 3D-моделювання для вибору оптимального рівня резекції. Резекцію крижової кістки на рівні SIV хребця виконано в 1 (8,3%) пацієнта, SIII хребця — у 6 (50,0%), SII хребця — у 4 (33,4%), SI хребця — в 1 (8,3%). Частота рецидивів — 8,3%, рівень інтраопераційних ускладнень — 50,0%. Інтраопераційних ускладнень у вигляді ліквореї та травм органів малого таза не було. При оцінці післяопераційних ускладнень виявлено, що найчастіше діагностували порушення іннервації тазових органів — 58,3%, некроз шкірних клаптів — 58,3%, інфекційне запалення післяопераційної рани — 41,6%. Розподіл та характеристику ускладнень у групах представлено на рис. 3.
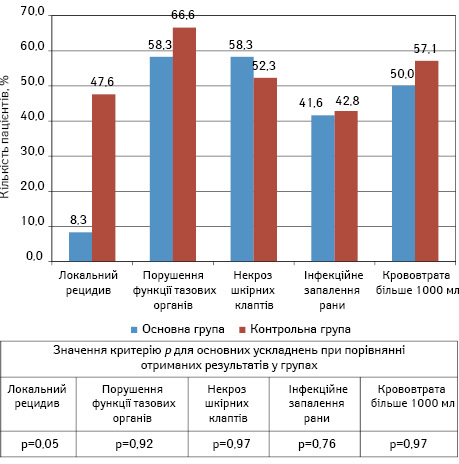
Отже, частота локального рецидиву в контрольній (ретроспективній) групі становила 47,6% (95% ДІ 30,2–74,1), а в основній групі — 8,3% (95% ДІ 0–32,9). Отримані результати свідчать про статистично значуще (p=0,05 за критерієм Фішера) зниження частоти локальних рецидивів в основній групі (відносний ризик 1,75; 95% ДІ 1,12–2,72). Частота виникнення решти ускладнень в основній та контрольній групі достовірно не відрізнялася.
Висновки
Застосування 3D-моделювання при плануванні рівня резекції за методом КТ з 3D-моделюванням у хворих на ПКК дозволяє знизити частоту виникнення локальних рецидивів, достовірно не впливаючи на кількість і частоту ускладнень.
Список використаної літератури
1. American Cancer Society. Cancer Facts & Figures (2008) Atlanta: American Cancer Society.
2. Kelley S.P., Ashford R.U., Rao A.S. et al. (2007) Primary bone tumours of the spine: a 42-year survey from the Leeds Regional Bone Tumour Registry. Eur. Spine J., 16: 405–409.
3. Mukherjee D., Chaichana K.L., Gokaslan Z.L. et al. (2011) Survival of patients with malignant primary osseous spinal neoplasms: results from the Surveillance, Epidemiology, and End Results (SEER) database from 1973 to 2003. J. Neurosurg. Spine, 14: 143–150.
4. Manaster B.J., Graham T. (2003) Imaging of sacral tumors. Neurosurg Focus, 15: E2.
5. Amorosa J.K., Weintraub S., Amorosa L.F. et al. (1985) Sacral destruction: foraminal lines revisited. AJR Am. J. Roentgenol., 145: 773–775.
6. Peh W.C., Koh W.L., Kwek J.W. et al. (2007) Imaging of painful solitary lesions of the sacrum. Australas Radiol., 51(6): 507–515.
7. Sciubba D.M., Petteys R.J., Garces-Ambrossi G.L. et al. (2009) Diagnosis and management of sacral tumors. J. Neurosurg. Spine, 10: 244–256.
8. Ajay Puri S., Agarwal M.G., Shah M. et al. (2009) Decision making in primary sacral tumors. Spine J., 9(5): 396–403.
9. Bergh P., Kindblom L.G., Gunterberg B. (2000) Prognostic factors in chordoma of the sacrum and mobile spine: a study of 39 patients. Cancer, 88: 2122–2134.
10. Fuchs B., Dickey I.D., Yaszemski M.J. (2005) Operative management of sacral chordoma. J. Bone Joint Surg. Am., 87: 2211–2116.
11. Ruggieri P., Angelini A., Ussia G. et al. (2010) Surgical margins and local control in resection of sacral chordomas. Clin. Orthop. Relat. Res., 468: 2939–2947.
12. Fourney D.R., Gokaslan Z.L. (2006) Sacral tumors: primary and metastatic. In: Spinal cord and spinal column tumors: principles and practice. Dickman CA, Fehlings MG, Gokaslan ZL, eds. New York: Thieme: 404–419.
Результаты хирургического лечения больных с опухолями крестцовой кости при использовании предоперационного 3D-моделирования
Национальный институт рака, Киев
Резюме. Целью исследования было улучшение результатов хирургического лечения за счет уменьшения количества локальных рецидивов у больных с опухолями крестцовой кости путем точного выбора уровня резекции по методу компьютерной томографии с 3D-моделированием. Полученные результаты сравнивали с данными ретроспективной группы больных. Анализ данных включал оценку частоты локальных рецидивов и осложнений.
опухоль крестцовой кости; рецидив; осложнения; 3D-моделирование.
Дєдков Анатолій Григорович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: an.dedkov@gmail.com
Correspondence:
Dedkov Anatoliy
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: an.dedkov@gmail.com














Leave a comment