Вплив неоад’ювантної поліхіміотерапії на тактику хірургічного лікування м’язово-інвазивного раку сечового міхура
Стаховський О.Е., Вітрук Ю.В., Войленко О.А., Вукалович П.С.
Резюме. Метою дослідження було вивчення впливу неоад’ювантної поліхіміотерапії (ПХТ) на пухлинний процес та хірургічну тактику лікування м’язово-інвазивного раку сечового міхура. Проспективно оцінено ефективність неоад’ювантної ПХТ та якість життя 41 хворого на м’язово-інвазивний рак сечового міхура. Повну регресію пухлини діагностовано у 4 (9,8%), часткову регресію — у 24 (58,5%), стабілізацію пухлинного процесу — у 11 (26,8%), а прогресію — у 2 (4,9%) хворих. У 4 (9,8%) випадках виконано цистоскопію з трансуретральною біопсією стінки сечового міхура, у 6 (14,6%) — відкриту, у 18 (43,9%) — трансуретральну резекцію стінки сечового міхура з пухлиною, у 11 (26,8%) — радикальну цистектомію. Двом (4,9%) хворим проведено паліативну трансуретральну резекцію стінки сечового міхура з пухлиною через наявність абсолютних протипоказань до цистектомії. Неоад’ювантна ПХТ достовірно викликає регресію м’язово-інвазивного раку сечового міхура в 68,3%, зменшення глибини інвазії — в 26,8% випадках, що дозволяє провести органозберігаюче лікування і, таким чином, підвищити показники загальної виживаності та покращити якість життя
Вступ
 В Україні, аналізуючи показники захворюваності на злоякісні новоутворення, рак сечового міхура (РСМ) займає 4-те місце серед чоловіків і характеризується високою агресивністю та низькими показниками ефективності лікування [1].
В Україні, аналізуючи показники захворюваності на злоякісні новоутворення, рак сечового міхура (РСМ) займає 4-те місце серед чоловіків і характеризується високою агресивністю та низькими показниками ефективності лікування [1].
Стандартом лікування м’язово-інвазивного РСМ вважається повне видалення сечового міхура — радикальна цистектомія, хоча більшість результатів вказують на низьку її ефективність, а 5-річна виживаність коливається від 35 до 50% [2–5].
Слід зазначити, що результат оперативного лікування прямо пропорційно залежить від глибини пухлинної інвазії, тобто чим більша стадія (Т), тим гірший результат цистектомії, тим «гірший» метод відведення сечі використовується. Саме метод деривації сечі після цистектомії має важливе значення для визначення якості життя [6].
За останні десятиріччя відбувся значний прогрес у покращенні способів деривації сечі. На місце сечових, нашкірних стом прийшли методики створення артифіціального сечового міхура, які забезпечують високу якість життя завдяки збереженню цілісності сечовивідної системи і акту сечовипускання. Але більшість хворих на час встановлення діагнозу мають розповсюджений пухлинний процес або супутню патологію, які не дозволяють виконати цистектомію [7].
Променева терапія — малоефективна та призводить до послаблення скоротливої функції міхура і мікроцисту, уретерогідронефрозу та хронічної ниркової недостатності [8].
Безумовно, постає питання: як покращити результати лікування хворих на РСМ? З 1985 р., коли вперше було розроблено схему хіміотерапії, яка включала цисплатин, РСМ став вважатися хіміочутливим захворюванням [9, 10]. Використання хіміотерапії за схемою метотрексат, вінбластин, доксорубіцин та цисплатин (M-VAC) характеризується високою ефективністю, але супроводжується суттєвою токсичністю, що обмежує її широке використання.
Втілення в клінічну практику нових хіміопрепаратів, таких як гемцитабін, сприяло появі нових схем — гемцитабін+цисплатин, які відрізняються малою токсичністю та високою протипухлинною дією і показали свою ефективність у хворих на м’язово-інвазивний РСМ [11–13].
Призначення системної поліхіміотерапії (ПХТ) перед оперативним втручанням (неоад’ювантна хіміотерапія) має багато переваг: вона краще переноситься до хірургічного втручання, ніж після; пацієнти здатні переносити більші дози препаратів та більше циклів; дає можливість оцінити ефективність хіміотерапії, знизити стадію захворювання, дозволяючи полегшити, з технічного боку, хірургічне втручання; є доцільною в плані лікування можливих мікрометастазів, які не виявляються при первинній діагностиці [14–17].
Метою дослідження було вивчити вплив неоад’ювантної ПХТ на пухлинний процес та хірургічну тактику лікування м’язово-інвазивного РСМ.
Матеріали та методи дослідження
Дослідження носило проспективний характер і передбачало оцінку ефективності неоад’ювантної ПХТ та якості життя 41 хворого на м’язово-інвазивний РСМ, які з 2008 по 2011 рр. знаходилися на лікуванні в науково-дослідному відділенні пластичної та реконструктивної онкоурології Національного інституту раку.
Вік пацієнтів коливався від 36 до 75 років і в середньому становив 62,2±9,0 років. Чоловіків було 38 (92,7%), жінок — 3 (7,3%). У 32 (78%) випадках мав місце первинний, у 9 (22%) — рецидивний РСМ.
Усім хворим було проведено комплексне обстеження як в до-, так і в післяопераційний період з використанням сучасних методів променевої діагностики: ультразвукову діагностику, спіральну комп’ютерну томографію, оглядову та екскреторну урографію з низхідною цистографією, що дозволили чітко поставити діагноз, визначити стадію захворювання, виявити зміни в сечовивідних шляхах, регіонарних лімфовузлах та інших органах і системах.
З метою верифікації діагнозу, визначення глибини інвазії в обов’язковому порядку виконували трансуретральну резекцію (ТУР) — біопсію стінки сечового міхура з подальшим морфологічним дослідження матеріалу.
Після встановленого м’язово-інвазивного РСМ пацієнтам проведено 3 курси неоад’ювантної ПХТ за схемою гемцитабін+цисплатин (гемцитабін — 1000 мг/м — внутрішньовенна інфузія протягом 30 хв на 1-й, 8-й і 15-й день, цисплатин — 75 мг/м — внутрішньовенна інфузія зі швидкістю не більше 1 мг/хв на 2-й день кожного 28-денного циклу) з подальшою оцінкою відповіді солідних пухлин на проведену терапію за критеріями RECIST (Response Evaluation Criteria in Solid Tumors), згідно з якими розрізняли повну регресію (зникнення всіх пухлинних ділянок), часткову регресію (зменшення більше ніж на 30% суми найбільших діаметрів пухлинних вогнищ), стабілізацію процесу (недостатнє зменшення пухлини для встановлення часткової регресії або недостатнє збільшення пухлини для встановлення прогресії) та прогресування захворювання (збільшення більше ніж на 20% суми найбільших діаметрів пухлинних вогнищ або поява нового вогнища/вогнищ).
Залежно від ефективності хіміотерапії та проведеного клінічного рестадіювання, яке передбачало виконання повторної комп’ютерної томографії та ТУР стінки сечового міхура, пацієнтам проводили оперативне втручання: ТУР чи відкриту резекцію стінки сечового міхура або радикальну цистектомію.
Для оцінки якості життя використовували опитувальник SF-36 (Medical Outcomes Study 36-Item Short-Form Health Survey), який в даний час широко розповсюджений і розцінюється як «золотий стандарт» оцінки якості життя, пов’язаної зі здоров’ям. Даний опитувальник пройшов процес валідації, культурної та мовної адаптації в Україні.
Результати та їх обговорення
У результаті комплексного клінічного дослідження у всіх хворих діагностовано перехідно-клітинний м’язово-інвазивний РСМ в Т2а–Т4а стадії (табл. 1). Загальний стан пацієнтів (Performance status) за шкалою Карновського становив більше 60%.
Таблиця 1. Характеристика пацієнтів
| Показник | Кількість, n (%) |
|---|---|
|
Первинна пухлина (Т) Т2а Т2в Т3а Т3в Т4а |
10 (24,4%) 22 (53,6%) 4 (9,8%) 1 (2,4%) 4 (9,8%) |
|
Гістологічна градація (G) G1 G2 G3 |
5 (12,2%) 24 (57,1%) 12 (28,6%) |
|
Pегіонарні лімфатичні N1 N2 N3 |
2 (4,9%) 1 (2,4%) 1 (2,4%) |
|
Віддалені метастази (M) M1 |
4 (9,8%) |
| Уретерогідронефроз | 10 (24,4%) |
До проведення ПХТ зміни з боку загального аналізу крові характеризувалися наявністю анемії І ступеня в 14 (34,1%) випадках, що було обумовлено, в першу чергу, гематурією як основним симптомом РСМ, активізацією запального процесу в паренхімі нирки та інтоксикацією. Після проведення ПХТ анемія зустрічалася у 10 (23,8%) хворих, однак тільки у 4 (9,6%) хворих її причиною був токсичний вплив хіміотерапії. Цією ж причиною можна пояснити появу після проведення ПХТ тромбоцитопенії в 6 (14,6%) та нейтропенії у 8 (19,5%) випадках, які були усунені медикаментозно, однак наступне введення хіміопрепарату було відкладено, але не більше ніж на 1 тиж.
У результаті дослідження встановлено прямо пропорційну залежність між ступенем диференціювання пухлини (G) та ступенем регресії пухлини під дією неоад’ювантної ПХТ. Отримані дані є статистично достовірними при порівнянні ступеня злоякісності G1 та G2, G1 та G3 (p
Таблиця 2. Оцінка ефективності неоад’ювантної ПХТ за критеріями RECIST в залежності від гістологічної градації (G)
| Гістологічна градація (G) | Кількість пацієнтів, n (%) |
RECIST, % регресії |
|---|---|---|
| G1 | 5 (12,2) | 84±10,8* |
| G2 | 24 (57,1) | 55,8±31,7 |
| G3 | 12 (28,6) | 32,1±35,3* |
* — різниця показників достовірна (р
Повна регресія пухлини (100%) мала місце у 4 (9,8%) випадках. Після повторної цистоскопії з біопсією стінки сечового міхура патоморфологічне дослідження даних щодо пухлинного процесу не виявило.
У 24 (58,5%) хворих діагностовано часткову регресію пухлини в середньому на 67,4±15,2%, що дало можливість в 6 (14,6%) випадках виконати відкриту резекцію, у 18 (43,9%) — ТУР стінки сечового міхура з пухлиною. Показаннями до органозберігаючого оперативного втручання були поодинокі вогнища первинного або рецидивного РСМ з наявністю повної або часткової відповіді на проведену неоад’ювантну ПХТ без залучення в пухлинний процес шийки сечового міхура, передміхурової залози, задньої уретри.
У 2 (4,9%) випадках стабілізації процесу радикальну цистектомію не було проведено через виражену анемію (гемоглобін крові
У 9 (22%) пацієнтів із стабілізацією процесу (середній показник — 16,6±9,9%) та 2 (4,9%) пацієнтів із прогресуванням захворювання (+27,5±3,5%) виконано радикальну цистектомію. Показаннями до її проведення були: відсутність відповіді на проведену неоад’ювантну ПХТ; мультифокальне ураження сечового міхура та наявність Саrcinoma in situ; пухлинне ураження передміхурової залози (табл. 3).
Таблиця 3. Оперативні втручання у хворих на м’язово-інвазивний РСМ залежно від ефективності неоад’ювантної ПХТ
|
Відповідь на лікування за RECIST |
Середнє значення, |
Вид оперативного втручання |
Кількість |
|
Повна регресія |
-100 |
ТУР-біопсія СМ |
4 (9,8) |
|
Часткова регресія |
-67,4±15,2 |
ТУР стінки СМ з Са |
18 (43,9) |
|
Резекція стінки СМ з Са |
6 (14,6) |
||
|
Стабілізація |
-16,6±9,9 |
Радикальна цистектомія |
9 (22) |
|
ТУР стінки СМ з Са |
2 (4,9) |
||
|
Прогресія |
+27,5±3,5 |
Радикальна цистектомія |
2 (4,9) |
*СМ — сечовий міхур.
**Са — Carcinoma.
Проведене оперативне втручання після неоад’ювантної ПХТ дозволило здійснити рестадіювання РСМ. Загалом у 11 (26,8%) хворих відмічено зниження стадії захворювання за системою TMN, при цьому в 4 (9,8%) випадках при проведенні патоморфологічного дослідження матеріалу біопсії стінки сечового міхура пухлинних тканин виявлено не було (зріла м’язова тканина). Лише в 1 (2,4%) випадку глибина інвазії пухлини збільшилася з глибокого м’язового шару (Т2в) до проростання в паравезикальну клітковину (Т3в).
Віддалений післяопераційний період характеризується стабілізацією загального стану хворого, відновленням функціонального стану сечових шляхів та адаптацією хворих до нових умов життя. Оцінка якості життя, поряд із аналізом показників виживаності, дозволяє визначити ефективність того чи іншого методу лікування.
У період спостереження від прогресування захворювання загинуло 3 (7,3%) хворих відповідно через 14; 18 та 23 міс після лікування. Показник 2-річної канцерспецифічної виживаності становив 85,4% (рис. 1).

Якість життя хворих оцінювали як до операції, так і кожні 3 міс після неї протягом 1-го року. Цей період вважається достатнім для адаптації пацієнтів після проведеного лікування. У подальшому, залежно від стану хворого, терміни обстеження відрізнялися за тривалістю та частотою.
При оцінці якості життя в передопераційний період відзначено зниження показників за всіма шкалами. Поганий загальний фізичний стан (70,6±8,6 бала), низький загальний стан здоров’я (54,7±9,4 бала) та виснаження життєвих сил (57,8±7,7 бала) були викликані наявністю больового синдрому різної інтенсивності (62,2±9,8 бала), що в кінцевому результаті обумовлювало обмеження в повсякденній діяльності та зниженні її якості (62,0±8,6 бала). Сильне переживання про майбутнє життя, відчуття смутку призводили до порушення психічного самопочуття (62,4±10,9 бала), що є цілком зрозумілим. Показники суспільної активності та впливу емоційного стану були низькими (65,1±7,4 та 62,2±9,0 бала відповідно), що пов’язано з обмеженням соціальних контактів у результаті погіршення фізичного здоров’я та психічного благополуччя.
Через 3 міс після операції у хворих, яким було проведено органозберігаючу операцію, показники якості життя, а саме фізичного здоров’я (63,9±18,5 бала), життєвих сил (51,9±16,3 бала) та соціального функціонування (62,5±15,7 бала) незначно погіршилися, що було пов’язано із перенесеним оперативним втручанням та поступовою адаптацією до нового стану. При цьому показники загального (55,0±13,9 бала) та психічного (64,7±17,8 бала) стану здоров’я покращилися, що свідчило про позитивний настрій пацієнтів щодо проведеного лікування та перспективи подальшого життя .
При оцінці якості життя через 6 міс достовірно підвищилися показники фізичного стану (до 75,0±15,4 бала за рахунок збільшення видів фізичної активності (73,6±9,6 бала)), психічного стану (до 70,5±22,3 бала внаслідок зниження показників нервового напруження), соціальної активності (до 70,6±15,5 бала). Відмічено зниження ролі емоційного стану — до 71,8±17,3 бала — як результат здатності виконувати великий обсяг роботи. Однак багато хворих мали біль різної інтенсивності (69,8±17,6 бала).
Через 9–12 міс значно покращилися, перевищивши доопераційні дані, показники фізичного стану (84,4±16,2 та 86,3± 13,0 бала), життєвих сил (73,5±17,7 та 81,1±14,4 бала), соціальної активності (78,1±14,6 та 85,4± 12,8 бала), ролі емоційного стану (79,0±16,3 та 78,8±13,2 бала), загального здоров’я (76,6±16,9 та 81,8±14,1 бала відповідно).
Якщо порівняти показники якості життя хворих після органозберігаючої операції із показниками після радикальної цистектомії, вони, без сумніву, були набагато вищими, оскільки основною перевагою даного комбінованого лікування є проведення органозберігаючого лікування.
Загалом, показники якості життя пацієнтів, яким було проведено органозберігаюче лікування, через 3 міс після операції знизилися на 3%, а протягом наступних 6 міс підвищилися на 25% у порівнянні з доопераційними (рис. 2).
Показники якості життя пацієнтів через 3 міс після радикальної цистектомії знизилися на 31%, а протягом наступних 6 міс підвищилися тільки на 15% у порівнянні з доопераційними (рис. 3).
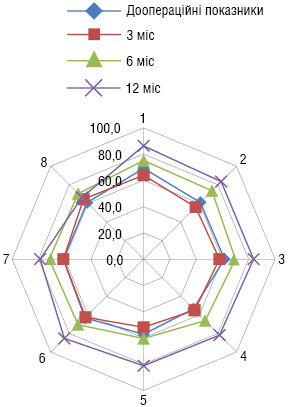
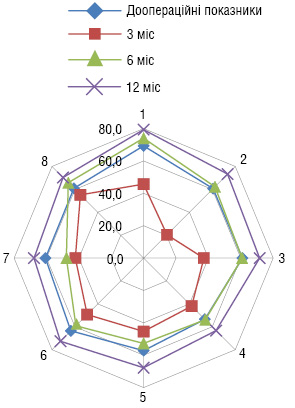
Таким чином, розроблені нами показання до органозберігаючих оперативних втручань та цистектомії у хворих на м’язово-інвазивний РСМ після проведення неоад’ювантної ПХТ потребують комплексної діагностики, кваліфікованого підходу з визначенням усіх можливих ускладнень перебігу РСМ. Саме тому проведення ПХТ та подальша оперативна тактика повинні визначатися та виконуватися в спеціалізованих онкоурологічних стаціонарах, що дозволить накопичити достатній досвід, розробити заходи профілактики можливих ускладнень, підвищити ефективність лікування та, тим самим, покращити якість життя пацієнтів.
Висновки
Неоад’ювантна ПХТ викликає регресію м’язово-інвазивного РСМ в 68,3%, зменшення глибини інвазії в 26,8%, покращує уродинаміку верхніх та нижніх сечовивідних шляхів, що дає можливість виконати органозберігаюче оперативне втручання.
Проведення комбінованого лікування з використанням неоад’ювантної ПХТ та хірургічного лікування достовірно підвищує показник канцерспецифічної 2-річної виживаності до 85,4% та залежить від стадії захворювання.
Показники якості життя у хворих на м’язово-інвазивний РСМ після проведення неоад’ювантної ПХТ та органозберігаючої операції підвищуються на 25% у порівнянні із доопераційними показниками.
Література
1. Рак в Україні, 2009-2010: захворюваність, смертність, показники діяльності онкологічної служби (2011) Під ред. І.Б. Щепотіна. Бюл. національного канцер-реєстру України, 12: 102 с.
2. Shabsigh A., Korets R. et al. (2009) Defining early morbidity of radical cystectomy for patients with bladder cancer using a standardized reporting methodology. Eur. Urol., 1(55): 164–174.
3. Dalbagni G., Genega E., Hashibe M. et al. (2001) Cystectomy for bladder cancer: A contemporary series. G. Dalbagni, J. Urol., 165: 1111–1116.
4. Bassi P., Ferrante G.D., Piazza N. et al. (1999) Prognostic factors outcome after radical cystectomy for bladder cancer: A retrospective study of a homogeneous patient cohort. J. Urol., 161: 1494–1497.
5. Stein J.P., Lieskovsky G., Cote R. et al. (2001) Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1054 patients. J. Clin. Oncol., 19 : 666–675.
6. Стаховский Э.А., Вукалович П.С., Войленко О.А., Степушкин С.П. (2005) Показания и особенности цистэктомии при раке мочевого пузыря. Архив клинической и экспериментальной медицины,1(14): 107–110.
7. Sternberg C.N., Collette L. (2006) What has been learned from meta-analyses of neoadjuvant and adjuvant chemotherapy in bladder cancer? BJU Int., Vol. 98: 487–489.
8. Petrovich Z., Jozsef G., Brady L.W. (2001) Radiotherapy for carcinoma of the bladder: a review. Am. J. Clin. Oncol., 1(24): 1–9.
9. Sternberg C.N., Yagoda A., Scher H.I. et al. (1985) Preliminary results of methotrexatе, vinblastine, adriamycin and cysplatin (M-VAC) in advanced urothelial tumors. J. Urol., 133: 401–407
10. Harker W., Meyers F.J., Freiha F.S. et al. (1985) Cisplatin, methotrexatе and vinblastin (CMV): An effective chemotherapy regimen for metastatic transitional cell carcinoma of the urinary tract : A Northern California Oncology Group study. J. Clin. Oncol., 11(3): 1463–1470.
11. Advance Bladder Cancer (ABC). Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration (2005) Eur. Urol., 2(48): 202–205.
12. Moore M.J., Tannock I.F., Ernst D.S. et al. (1997)Gemcitabine: a promising new agent in the treatment of advanced urothelial cancer. J. Clin. Oncol., 12(15): 3441–3445.
13. von der Maase H., Hansen S.W., Roberts J.T. et al. (2000) Gemcitabine and cisplatine versus methotrxate, vinblastine, doxorubicin and cisplatin in advanced or metastatic bladder cancer:results of a large randomized, multinational, multicenter, phase III study. J. Clin. Oncol., 17(18): 3068–3077.
14. Sternberg C.N., Calabro F. (2001) Neo-adjuvant chemotherapy in invasive bladder cancer. World. J. Urol., 2(19): 94–98.
15. Hall R.R. (2002) Updates results of a randomized controlled trial of neoadjuvant cisplatin (C), methotrexate (M) and vinblastine (V) chemotherapy for muscle-invasive bladder cancer. Integrational Collaboration of Trialists of the MRC Advanced Bladder Cancer Group. Proc. Am. Soc. Clin. Oncol., 21: Abstr. 710.
16. Teramukai S., Nishiyama H., Matsui Y. et al. (2006) Evaluation for surrogacy of end points by using data from observational studies: tumor downstaging for evaluating neoadjuvant chemotherapy invasive bladder cancer. Clin. Cancer Res., 12: 139–143.
17. Grossman H.B., Natale R.B., Tangen C.M. et al. (2003) Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N. Engl. J. Med., 349: 859–866.
Влияние неоадъювантной полихимиотерапии на тактику хирургического лечения мышечно-инвазивного рака мочевого пузыря
Национальный институт рака, Киев
Резюме. Целью исследования было изучение влияния неоадъювантной полихимиотерапии на опухолевый процесс и хирургическую тактику лечения мышечно-инвазивного рака мочевого пузыря. Проспективно оценена эффективность неоадъювантной полихимиотерапии и качество жизни 41 больного на мышечно-инвазивный рак мочевого пузыря. Полная регрессия опухоли диагностирована у 4 (9,8%), частичная регресия — у 24 (58,5%), стабилизация процесса — у 11 (26,8%), а прогресия — у 2 (4,9%) больных. В 4 (9,8%) случаях выполнена цистоскопия с трансуретральной биопсией стенки мочевого пузыря, в 6 (14,6%) — открытая, в 18 (43,9%) — трансуретральная резекция стенки мочевого пузыря с опухолью, в 11 (26,8%) — радикальная цистэктомия. У 2 (4,9%) больных с абсолютными противопоказаниями к цистэктомии проведено паллиативную трансуретральную резекцию стенки мочевого пузыря. Неоадъювантная полихимиотерапия достоверно вызывает регрессию мышечно-инвазивного рака мочевого пузыря в 68,3%, уменьшение глубины инвазии в 26,8% случаях, что позволяет провести органосохраняющее лечение и, тем самым, повысить показатель общей 2-летней выживаемости до 85,4%, улучшить качество жизни на 25%.
мышечно-инвазивный рак мочевого пузыря, неоадъювантная полихимиотерапия, радикальная цистэктомия.














Leave a comment