Фотодинамическая терапия в клинической онкологии (аналитический обзор и собственный опыт)
Дунаевская В.В.1, Церковский Д.А.2, Татарчук Т.Ф.1, Гончарук И.В.3
- 1ГУ «Институт педиатрии, акушерства и гинекологии имени академика А.Н. Лукьяновой НАМН Украины», Киев
- 2ГУ «Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова», аг. Лесной, Республика Беларусь
- 3Национальный институт рака, Киев
Резюме. Фотодинамическая терапия (ФДТ) представляет собой метод лечения, основанный на комбинированном применении фотосенсибилизаторов и лазерного излучения с определенной длиной волны. По данным многочисленных клинических, в том числе, рандомизированных исследований, проведенных в ведущих научно-практических центрах стран Европы, Азии и США, данный метод лечения продемонстрировал хорошую переносимость и высокую противоопухолевую эффективность в лечении ряда предопухолевых заболеваний и злокачественных новообразований. В публикации авторами систематизированы ключевые аспекты применения ФДТ в клинической онкологии, а именно: рассмотрена классификация наиболее часто используемых фотосенсибилизирующих агентов и их производных, представлены основные источники лазерного излучения и ведущие механизмы реализации противоопухолевого ответа на фотооблучение патологически измененных тканей, а также основные показания и противопоказания к применению в клинической онкологии. Во второй части статьи проанализирован имеющийся мировой опыт применения ФДТ в лечении предопухолевых заболеваний слизистых оболочек полости рта, вульвы и шейки матки, а также злокачественных новообразований кожи, легкого, пищевода, поджелудочной и предстательной желез, злокачественных глиом головного мозга. Метод ФДТ является эффективной альтернативой традиционным подходам в лечении указанных заболеваний и может применяться как самостоятельно, так и в схемах комбинированного и комплексного лечения. Имея весомые преимущества, такие как незначительная токсичность для окружающих нормальных тканей, минимальный риск возникновения выраженного болевого синдрома, отсутствие механизмов первичной и приобретенной резистентности, возможность амбулаторного проведения и комбинации с другими методами лечебного воздействия, отсутствие лимитирующих кумулятивных доз ФС и лазерного излучения, удобство применения при множественном характере поражения, хорошие косметические результаты и возможность реализации органосохраняющих методов лечения, ФДТ является актуальным и перспективным направлением дальнейших научных исследований.
Получено: 19.09.2020
Принято в печать: 1.10.2020
DOI: 10.32471/clinicaloncology.2663-466X.39-3.27393
Введение
Злокачественные новообразования представляют собой серьезную медицинскую и социальную проблему в практическом здравоохранении. В последние годы отмечается тенденция к неуклонному повышению показателей заболеваемости и смертности вследствие ряда их нозологических форм. Все силы онкологической службы направлены на раннее выявление и эффективное лечение данной тяжелой патологии. Основным подходом в достижении высоких результатов является использование хорошо зарекомендовавших себя методов, таких как оперативное вмешательство, химиотерапия и лучевая терапия, в схемах комбинированного, комплексного и многокомпонентного лечения. Вместе с тем, не стоит на месте медицинская наука, основной целью которой является поиск и разработка новых направлений оказания эффективной медицинской помощи пациентам с различными нозологическими формами предопухолевой патологии и заболеваний онкологического профиля. Одним из таковых является фотодинамическая терапия (ФДТ) — метод лечения, основанный на комбинированном применении специальных лекарственных средств — фотосенсибилизаторов (ФС) и лазерного излучения с определенной длинной волны [31]. Как свидетельствуют данные многочисленных клинических, в том числе и рандомизированных исследований, проведенных в ведущих научно-практических центрах стран Европы, Азии и США, метод ФДТ показал свою хорошую переносимость и высокую противоопухолевую эффективность в лечении ряда предопухолевых заболеваний и злокачественных новообразований [11].
Фотосенсибилизаторы
На данный момент при ФДТ применяются более 60 лекарственных средств, обладающих фотосенсибилизирующей активностью. Условно их подразделяют на 3 больших класса, а именно: производные порфиринов (гематопорфирина дериват, порфимер натрия и др.), производные хлоринов (димеглюмин хлорин е6, хлорин е6, мета-тетрагидроксифенилхлорин и др.) и синтетические производные красителей (гидроксиалюминия трисульфофталоцианин и др.) [10, 11]. К ФС первого поколения относят гематопорфирин и его производные. Первые шаги в применении гематопорфирина сделаны еще в начале XX в., начиная с сенсационного эксперимента F. Meyer-Betz. В дальнейшем исследователями разных стран ФС подвергался химической обработке и очистке от различных примесей и, в конце концов, представляет собой смесь мономеров, димеров и олигомеров и получил свое окончательное международное наименование «порфимер натрия». В течение последних лет внимание ученых привлекает синтез и разработка ФС второго поколения (хлорины, фталоцианины, порфирины и бактериохлорины), имеющих максимумы поглощения лазерного излучения в диапазоне волн 650 и более нанометров. В отличие от порфиринов и их производных хлорины хорошо адсорбируют свет в красной области спектра. Основные препараты данной группы получены путем модификации хлорофилла и химическим синтезом. Весьма перспективным направлением является разработка и применение ФС третьего поколения, получаемых путем связывания препаратов с молекулами других веществ, наночастицами и липосомами с целью увеличения селективности накопления фотосенсибилизирующих агентов в опухолевой ткани и повышения противоопухолевой эффективности лечения новообразований. Официально разрешенными для клинического применения Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) в США является ФС порфимер натрия, который активно используется для ФДТ у пациентов с пищеводом Баретта, раком легкого и пищевода. В ряде стран Европы Европейским агентством по лекарственным средствам (European Medicines Agency — EMA) разрешен ФС мета-тетрагидроксифенилхлорин, применяющийся для ФДТ у пациентов со злокачественными новообразованиями головы и шеи. Эффективность многих ФС активно изучается в рамках всевозможных научных исследований. В странах СНГ, в ряде онкологических учреждений внедрен и активно применяется метод ФДТ с ФС хлоринового ряда (димеглюмин хлорин е6, хлорин е6) [8]. Для эффективного применения тех или иных ФС в клинической онкологии, они прежде всего должны соответствовать определенным требованиям, а именно: обладать химической чистотой, постоянным и неизменным составом и структурой, а также стабильностью в течение всего срока хранения, быстро и избирательно накапливаться в патологических тканях, иметь высокий квантовый выход синглетного кислорода и интенсивный максимум поглощения в красном и инфракрасном диапазонах спектра, обладать низкой фототоксичностью и, конечно же, отсутствием риска развития различных нежелательных реакций [8, 11].
Источники лазерного излучения для ФДТ
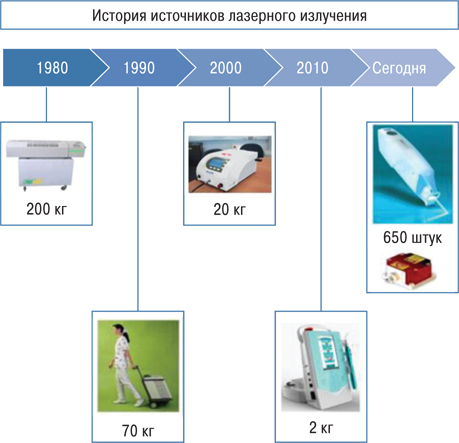
Важнейшим компонентом метода ФДТ являются источники лазерного излучения, которые подразделяются на широкополосные (лампы) и монохроматические (лазерные установки) [2, 9]. В клинической практике чаще всего эксплуатируются источники света с λ=600–900 нм, что связано с фактом сильного поглощения света эндогенными красителями при λ <600 нм, а для λ >900 нм энергетически невыгодным является образование синглетного кислорода, участвующего в фотохимических реакциях [3]. Для реализации сеансов ФДТ применяют источники, генерирующие излучение с λ, характерных для определенных классов ФС: для аминолевулиновой кислоты (5-АЛА) и ее производных ФС порфимер натрия — λ=630±5 нм, для хлориновых ФС — λ=660±10 нм. Все источники света можно подразделить на лазерные и нелазерные. К нелазерным относят ксеноновые, галогеновые, металогалоидные, ртутные и лампы, матрица которых состоит из светодиодов. Их использование осуществлялось до 80-х годов XX в. К основным их недостаткам можно отнести нестабильность в работе, крупногабаритность и большую массу, непродолжительный срок службы и эксплуатации (несколько сотен часов). Указанные недостатки серьезно сдерживали широкое применение этих источников света в клинической онкологии.
В дальнейшем более широкое распространение получили лазерные установки с накачкой ионным аргоновым лазером, генерирующие свет в ультрафиолетовом (λ=488 нм) и сине-зеленом диапазонах (λ=514 нм). При средней мощности накачки 20 Вт при эксплуатации обеспечивается средняя мощность 4–5 Вт перестраиваемого в диапазоне λ=600–650 нм излучения. Основными недостатками являются сложность в управлении и эксплуатации, громоздкость, низкий коэффициент полезного действия, высокая стоимость и незначительный срок службы.
В Российской Федерации активно использовался импульсный лазер на парах меди, генерирующий излучение при λ=510 и 578 нм. Обладая высоким коэффициентом полезного действия, данный тип лазера имеет ряд недостатков, а именно: необходимость водяного охлаждения, длительный временной интервал разогрева до начала активной эксплуатации и сложная конструкция излучателя и источника питания [4].
Использование лазеров на парах золота, генерирующих излучение при λ=628 нм с выходной мощностью до 5 Вт, имеет право на существование при сеансах ФДТ с 5-АЛА и производными гематопорфининов. Основным ограничением является незначительная глубина проникновения света в биологические ткани (до 3 мм).
Настоящим прорывом являлась разработка полупроводниковых лазеров, отличающихся относительной дешевизной, надежностью работы и длительным сроком активной эксплуатации (несколько тысяч часов). Среди серийно выпускаемых в настоящее время диодных лазеров можно найти устройство с длиной волны излучения, соответствующей максимуму поглощения любого класса ФС и с достаточной для применения в клинике мощностью [2].
Полупроводниковые лазеры являются первостепенными для применения в ФДТ. Аппараты на основе полупроводниковых лазеров просты в эксплуатации, компактны, надежны, долговечны и не требуют специального обслуживания. Использование световодов с сечением 200–400 мкм позволяет применять приборы данной группы для всех вариантов фотооблучения (поверхностное, внутритканевое, внутриполостное, с использованием эндоскопической техники). Немаловажным преимуществом является широкий спектральный диапазон — от синего до инфракрасного – от 400 до 1200 нм [4]. Перечисленные выше обстоятельства значительно расширяют возможности применения ФДТ в клинической онкологии (рис. 1).
Ключевые механизмы ФДТ
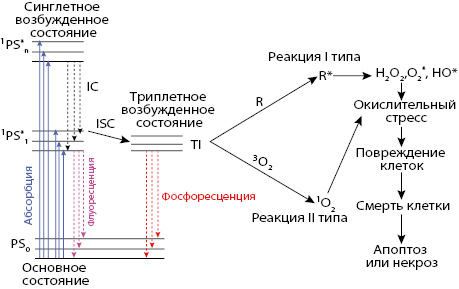
В результате фотооблучения в опухолевой клетке начинаются фотохимические реакции. Молекула ФС, поглощая квант света, переходит из основного состояния в возбужденное. В дальнейшем инициируются фотохимические реакции I и II типов [7]. При фотохимических реакциях I типа молекулы ФС, поглощая квант света, переходят из основного состояния в синглетное и триплетное и вступают в реакцию с биологическим субстратом [17]. Результатом данного взаимодействия является появление промежуточных радикалов, вступающих в химическое взаимодействие с кислородом тканей, вследствие чего образуются продукты — активные формы кислорода, запускающих окислительный стресс. Наиболее токсичными продуктами окисления являются гидроксил-радикал и супероксид-анион [9]. Обладая высоким окислительным потенциалом, активные формы кислорода взаимодействуют с липидами мембран органелл опухолевой клетки, вызывая их дестабилизацию и последующее разрушение клетки в целом. При фотохимических реакциях II типа кислород тканей поглощает энергию возбужденного квантом света ФС с образованием высокотоксичного синглетного кислорода (1O2), который ответственен за окисление структур опухолевой клетки [18] (рис. 2).
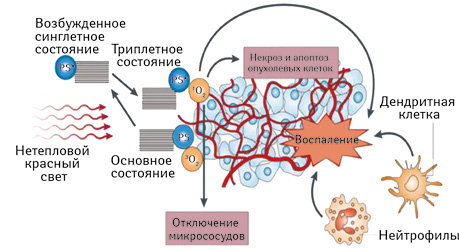
В результате всех перечисленных реакций, протекающих в опухолевой клетке, при фотооблучении возникают апоптоз, аутофагия и некроз [7, 11, 21, 22, 27] (рис. 3).
Основным фактором, определяющим путь гибели опухолевой клетки, является целостность клеточной мембраны. При наличии дефектов данной структуры первостепенным является некроз, при отсутствии — апоптоз. В основе апоптотической гибели клетки лежит активация ферментов, ответственных за разрушение ее компонентов (липазы, нуклеазы, протеазы). Их инициация осуществляется каспазами 3, 6, 7, 8, 9, 10 и 12. Цепь взаимодействий приводит к повышению активности вышеперечисленных гидролитических ферментов, основными мишенями которых являются белки, участвующие в дезинтеграции цитоскелета, мембран, клеточных органелл, апоптотических телец; регуляторные белки цитоплазмы (адгезионная киназа, протеинкиназа MEEK1 и др.); белки цитоскелета (актин, фодрин); белки ядра, ответственные за фрагментацию ДНК (фактор фрагментации ДНК, ДНК-зависимая протеинкиназа и др.) [7, 6, 9]. Запуск каскада каспазных ферментов, ответственных за основные процессы, происходящие при апоптозе, происходит двумя путями. Во-первых, процесс гибели клетки начинается со связывания специальных лигандов (фактор некроза опухоли (tumor necrosis factor-alfa — TNF-ɑ); fas-ligand (FasL); TNF-related apoptosis-inducting ligand (TRAIL) и др.) с мембранными рецепторами фактора некроза опухоли 1; Fas и TRAIL R. Результатом чего является последовательная активация каспаз 8, 3 и дальнейшее развитие апоптотической гибели клетки [6, 7]. Также инициация апоптоза возможна при получении соответствующих сигналов из внутриклеточных органелл. Так, при повреждении мембран митохондрий в цитоплазму высвобождаются специальные белки-активаторы апоптоза: цитохром С, SMAC-DIABLO, AIF, OMI-Htr и ряд других, каждый из которых играет важную роль в реализации клеточной гибели. Цитохром С, связываясь с белком цитоплазмы Apaf-1 и дезоксиаденинтрифосфатом, стимулируют цепь каспаз 3, 6, 7 и 9. Белки SMAC-DIABLO и OMI-Htr ингибируют активность apoptosis inhibitor factor, тем самым потенциируя активность апоптоза. Белки apoptosis inhibitor factor и эндонуклеаза G активируют ядерные нуклеазы, ответственные за фрагментацию ДНК [6, 7]. Из разрушенных лизосом в цитоплазму опухолевой клетки поступают протолитические белки — катепсины, функцией которых является активация каспазы 3 и белка Bid, стимулирующего выход цитохрома С из митохондрий с развитием митохондриального пути апоптоза. Результатом повреждения структур эндоплазматического ретикулума является высвобождение большого количества ионов Ca2+, стимулирующих фермент кальпаин, активирующий каспазы 3 и 12 [6, 7]. Ключевым звеном в развитии апоптотической гибели опухолевой клетки является активация каспазы 3, имеющая место как при первом, так и при втором путях запуска запрограммированной гибели клетки.
Вторым путем повреждения опухолевой клетки является некроз [6, 7, 11]. Его результатом является выраженное набухание митохондрий и эндоплазматического ретикулума, секвестрация цитоплазмы аутофагическими вакуолями, разрушение лизосом и выход содержащихся в них ферментов в цитоплазму, деградация цитоскелета и разрушение ядра. Финальным событием в данном процессе является разрыв плазматической мембраны, способствующий излиянию содержимого клетки в межклеточное пространство и индукции воспалительной реакции. Основополагающим моментом, запускающим некроз, является создание в цитоплазме повышенной концентрации ионов Ca2+ вследствие нарушения целостности мембран митохондрий и эндоплазматического ретикулума. В данном процессе принимают участие гидролитические ферменты (каспазы, эндонуклеаза G и катепсины), высвобождаемые из лизосом, а также Ca2+-зависимые протеазы — кальпаины [5, 6]. Описанные выше ионы активируют цистеиновые протеиназы — кальпаины — приводящие к разрушению лизосом и высвобождению лизосомальных ферментов (катепсины) с последующим запуском кальпаин-катепсинового пути развития некротической гибели опухолевой клетки.
Третьим механизмом повреждения опухолевой клетки при фотооблучении является аутофагия, в основе которой лежит образование в клетке большого количества аутофагосом, содержащих цитоплазму и компоненты клеточных органелл, слияние которых с лизосомами приводит к образованию комплексов (аутофаголизосомы), в которых и происходит переработка клеточных структур [6, 7, 11, 21]. Являясь достаточно медленным процессом, аутофагия управляется системой сигнальных белков, кодируемых семейством генов — autophagy-related genes. Рядом авторских коллективов экспериментальным путем подтверждена гибель опухолевых клеток вследствие развития аутофагии и последующего их разрушения [6, 7]. Оксидативный стресс, развивающийся вследствие фотохимических реакций в опухолевой клетке, вызывает аутофагию и возможную клеточную смерть. Согласно современным данным, аутофагия подразделяется на три типа: микроаутофагия, макроаутофагия и шаперон-зависимая аутофагия. Основной тип аутофагии — макроаутофагия, включающая этапы инициации, нуклеации, элонгации и слияния с лизосомой [21]. Измененные белки цитоплазмы, поврежденные митохондрии и эндоплазматический ретикулум транслоцируются к мембранам органелл благодаря образованию комплексов со специальными белками ULK 1/2, Atg13, Atg101 и FIP-200. На мембранах органелл, в первую очередь митохондрий и комплекса Гольджи, представленные белки формируют комплекс, дополнительно включающий белки Vps34, Beclin I, Vps15 и Atg14L, вокруг которого образуется внутренняя мембрана фагофоры. Формирование аутофагосомы с двойной мембраной происходит при непосредственном участии LC 3 II, образующегося в результате липолизации фосфатидилэтаноламином цитозольного белка LC 3, и комплекса белков Atg5–Atg12/Atg16L1. Последующее созревание аутофагосомы в аутофаголизосому осуществляется путем слияния с лизосомами с помощью белков Vps34, Beclin 1 и UV RAG [24]. В аутофаголизосоме происходит гидролитическая деградация измененных белков и дальнейшее высвобождение в цитоплазму питательных и энергоемких субстанций [28]. По мнению ряда авторов, при фотоиндуцированной реакции чаще всего имеет место макроаутофагия, в результате которой участок цитоплазмы с органеллами окружается мембранным компартментом, похожим на цистерну эндоплазматической сети, и ограничивается двумя мембранами. Таким образом формируются аутофагосомамы, которые в последующем сливаются с лизосомами, образуя аутофаголизосомы, функция которых — расщепление органелл опухолевой клетки.
Стоит отметить, что одну из ключевых ролей в реализации противоопухолевого ответа при ФДТ играет повреждение сосудистого русла опухоли [7, 11]. Общеизвестно, что фотооблучение опухолевой ткани приводит к нарушению целостности эндотелия кровеносных сосудов с последующей агрегацией тромбоцитов с образованием пристеночных или окклюзионных тромбов и развитием интерстициального отека. В дальнейшем инициируется вазоконстрикция и, как следствие, сосудистый стаз, приводящий к прекращению кровотока и гибели опухоли вследствие ишемического некроза. По мнению некоторых авторов, данные реакции в ответ на фотооблучение вызывают повреждение опухоли опосредованно и без реализации прямого цитотоксического влияния. Следует сообщить, что возникающая гипоксия может носить как временный (обратимый), так и необратимый характер. Данный факт связан с особенностями аккумуляции различных классов ФС в эндотелии. Так, ФС порфимер натрия в большей степени накапливается в нем в максимальной концентрации через 1 ч после введения, а некоторые производные хлорина е6 — через 24 ч. Фотоактивация ряда ФС ингибирует высвобождение NO из эндотелиоцитов, усиливая таким образом эффект вазоконстрикции: для некоторых ФС сосудистый коллапс носит длительный характер, а в ряде случаев после прекращения фотооблучения сенсибилизированной опухолевой ткани отмечается быстрое восстановление кровотока по причине выработки вазодилататоров (в том числе NO, простагландины, гистамин и др.) [6, 7, 9].
Еще одним из путей, ответственных за непрямое повреждение опухоли при ФДТ, являются иммунные реакции, развивающиеся в ответ на фотооблучение [9, 11, 23]. В ответ на лазерное воздействие на сенсибилизированную опухоль осуществляется захват опухолевого антигена дендритными клетками путем фагоцитоза апоптозных клеток, фрагментов некротизированных клеток и дальнейшее представление антигена в комплексе с внеклеточным белком HSP70, который образует прочные комплексы с антигенами цитоплазмы опухолевых клеток и связывается с рецепторами дендритных клеток, приводя к их активации. Зрелые дендритные клетки мигрируют в лимфатические узлы, где они представляют опухолевые антигены в комплексе с молекулами класса I и II главного комплекса гистосовместимости (major histocompatibility complex — MHC), Т-лимфоцитам: CD8+, CD4+. Для дальнейшей активации Т-лимфоцитов требуется высвобождение цитокинов, играющих важную роль в определении типа иммунного ответа, следующего после представления антигена. Далее Т-хелперы проходят процесс дифференцировки на Th1, Th2 и некоторые другие подклассы. Клетки Th1 секретируют интерлейкин (interleukin — IL)-2, интерферон и фактор некроза опухоли и тем самым определяют развитие иммунного ответа. Клетки Th2 посредством секреции IL-4, IL-5, IL-6, IL-10, IL-13 отвечают за гуморальный иммунитет. Активированные CD8+ и CD4+ Т-лимфоциты мигрируют из лимфатических узлов к опухоли: так, клетки CD8+ уничтожают опухолевые клетки напрямую, а CD4+ действуют опосредованно через другие клетки иммунной системы (макрофаги) [7, 9, 11].
Основные аспекты применения ФДТ в клинической онкологии
Проанализировав и систематизировав существующий мировой опыт применения ФДТ у пациентов с различными онкологическими заболеваниями, можно заключить следующее. Данный метод может использоваться по радикальной программе при лечении предопухолевых заболеваний (лейкоплакии, дисплазии и др.) и начальных стадий злокачественных новообразований (рак кожных покровов и слизистых оболочек и др.), по паллиативным программам, основной целью которых является эффективное включение ФДТ в схемы комбинированного и комплексного лечения поздних стадий злокачественных новообразований (реканализация при раке пищевода, трахеи, бронхов) и по паллиативным программам, направленным на уменьшение объема опухолевого поражения и гемостаз в случае существования риска распада при далеко зашедших процессах (опухоли кожных покровов и слизистых оболочек) [11]. На основании данных результатов различных научных проектов можно прийти к выводу, что эффективность ФДТ доказана при локализации патологического процесса в практически каждой системе органов. Актуальными направлениями исследований в медицинских учреждениях онкологического профиля в США, Японии, Китае, Германии, Австрии, Российской Федерации является ФДТ предопухолевых заболеваний (актинический кератоз) и рака кожных покровов (базально-плоскоклеточный рак кожи), предопухолевых заболеваний полости рта, вульвы и шейки матки (лейкоплакии, дисплазии), злокачественных новообразований головы и шеи, легкого, пищевода, поджелудочной железы, злокачественных глиом и др. [11, 31].
Что же касается существующей ситуации в Республике Беларусь и странах СНГ, ФДТ с ФС внедрена и активно используется при раке кожи, внутрикожных метастазах меланомы, рака гортани, молочной железы и злокачественных опухолях головного мозга. В рамках научных исследований доказана высокая эффективность ФДТ при лечении предопухолевых заболеваний слизистых оболочек (лейкоплакии слизистых оболочек вульвы и полости рта, цервикальные интраэпителиальные неоплазии) и меланомы хориоидеи.
Возможность проведения ФДТ для каждого пациента оценивается в индивидуальном порядке и на основании локального статуса, анамнеза заболевания, предшествующего лечения и ряда других факторов. Ключевыми противопоказаниями для ФДТ является индивидуальная непереносимость ФС и его компонентов, отягощенный аллергоанамнез, а также сердечно-сосудистая и дыхательная недостаточность, заболевания печени и почек в стадии декомпенсации, системная красная волчанка, кахексия и детский возраст.
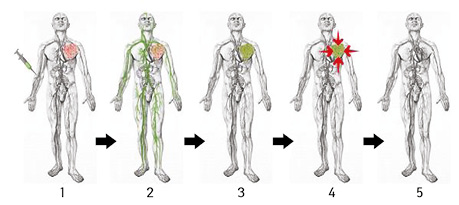
Если говорить об этапах проведения сеанса ФДТ, то в первую очередь осуществляется инфузия раствора ФС (либо локальная аппликация) в дозировках согласно существующим инструкциям. Продолжительность инфузии (аппликации) ФС варьирует в определенных пределах и в среднем составляет 30–60 мин, после чего в зависимости от степени злокачественности процесса либо нозологической формы заболевания ФС в течение различных периодов времени: от 2–4 ч — для большинства хлориновых ФС до 24–72 часов — для порфириновых ФС, накапливается в патологически измененных тканях. Далее, по достижении максимальной концентрации, осуществляется фотооблучение с различными параметрами лазерного излучения. В дальнейшем, в течение 2–5 сут после ФДТ в области облучения развиваются реакции, приводящие к гибели патологических тканей и их отторжению в течение 3–8 нед. Сформировавшаяся раневая поверхность полностью эпителизируется либо замещается соединительно-тканным рубцом (рис. 4).
При проведении сеансов ФДТ, в определенном количестве наблюдений, возможно развитие умеренно-выраженных нежелательных реакций, которые легко купируются и не влияют на сроки лечения и госпитализации. К основным из них можно отнести кожную фототоксичность (зуд, гиперемия, конъюнктивит), которая возникает в период содержания в организме пациентов терапевтически эффективных концентраций ФС в случае нарушения светового режима, повышение температуры тела до +37,7–37,8 °С (редко), умеренный отек мягких тканей в зоне фотооблучения, временная гипо- или гиперпигментация (редко) и аллергические реакции — кожная сыпь, зуд, крапивница (крайне редко). Все нежелательные реакции, связанные с системным введением ФС, указаны в инструкции по применению лекарственного средства [11].
Клиническое применение ФДТ в лечении предопухолевых заболеваний в гинекологии
ФДТ предопухолевых заболеваний вульвы. Значительное количество публикаций посвящено применению ФДТ с аппликационными формами ФС 5-АЛА в лечении предопухолевых заболеваний вульвы (вульварная интраэпителиальная неоплазия (ВИН), лейкоплакия, крауроз и др.) Результаты первого исследования, посвященного применению ФДТ с 5-АЛА в лечении ВИН, были опубликованы в 1998 г. в журнале «Lancet». P.L. Martin-Hirsh и соавторы сообщили об опыте лечения 18 пациенток. Фотооблучение осуществляли во фракционном режиме: на первом этапе — в экспозиционной дозе 50 Дж/см2, на втором — 100 Дж/см2. Однако при использовании дозы 50 Дж/см2 частота ПР составила 20% (у 2 из 10), при 100 Дж/см2 — 37,5% (у 3 из 8). В 89% наблюдений, вне зависимости от режимов ФДТ, отмечено стойкое купирование клинических симптомов заболевания [25].
В дальнейшем, после оптимизации подходов, в том числе и усовершенствования параметров фотооблучения, отмечено существенное улучшение результатов применения ФДТ с данным ФС. Так, M.K. Fehr и соавторы сообщили об опыте лечения 15 пациенток с ВИН II–III стадии методом ФДТ с 10% гелем 5-АЛА и фотооблучением в экспозиционной дозе 120 Дж/см2 (λ=635 нм). Лечение было проведено без анестезии. В контрольных группах пациентки получали лечение методами лазерной вапоризации (n=30) и хирургической эксцизии (n=27). При контрольном наблюдении через 2 мес после ФДТ частота полных регрессий (ПР) составила 73,3%. Вместе с тем при контроле через 12 мес частота ПР статистически значимо не различалась в основных и обеих контрольных группах (p<0,05) [19].
Более актуальным направлением исследований в этом области является применение инъекционных форм ФС для ФДТ патологически измененных тканей вульвы. Основными из них являются производные гематопорфирина деривата и хлоринов. Так, M.C. Choi и соавторы представили опыт применения ФДТ с российским аналогом гематопорфирина деривата в лечении 7 пациенток с ВИН II–III стадии. Через 48 ч после внутривенного введения ФС в дозе 2 мг/кг было произведено фотооблучение в экспозиционной дозе 150 Дж/см2. При контроле через 12 мес после проведенного лечения частота ПР, подтвержденных гистологически, составила 85%. Вместе с тем стоит отметить, что у каждого второго пациента после лечения был отмечен болевой синдром и симптомы кожной фототоксичности [16]. По данным, S.M. Campbell и соавторов, опубликовавших результаты применения ФДТ с хлориновым ФС мета-тетрагидроксифенилхлорином в лечении 6 пациенток с ВИН II–III стадии, отмечены обнадеживающие данные. Через 96 ч после внутривенного введения ФС в дозе 0,1 мг производили фотооблучение патологически измененных тканей в экспозиционной дозе 10 Дж/см2 (λ=652 нм). Авторы сообщили, что сеанс сопровождался минимально выраженным болевым синдромом. Вместе с тем у 2 пациенток было отмечено значительное усиление боли в зоне фотооблучения в течение 2 нед после проведенного лечения. При контроле через 6 мес у 2 из 6 пациенток отмечен локальный рецидив, что потребовало проведение повторного сеанса ФДТ. При контрольном наблюдении в отдаленные сроки (через 24 мес после ФДТ) клинических и гистологических симптомов заболевания выявлено не было [30].
В работе белорусских ученых оценена эффективность применения ФДТ с инъекционной формой ФС — тринатриевой солью хлорина е6 с повидоном в дозах от 1,8 до 2,5 мг/кг. В исследование было включено 50 пациенток с верифицированным диагнозом «лейкоплакия вульвы». Фотооблучение патологических очагов осуществляли через 2,5–3 ч после внутривенного введения ФС в экспозиционных дозах от 30 до 100 Дж/см2 с плотностью мощности излучения 0,1–0,17 мВт/см2 (λ=660±5 нм). Нежелательных реакций после введения ФС и дальнейшего облучения зарегистрировано не было. ПР пролеченных патологических очагов отмечена в 100% случаев при контрольном наблюдении через 1 месяц после проведенного лечения. При контрольном наблюдении через 3 месяца у 4 пациенток выявлены локальные очаги продолженного роста опухоли, которые были успешно пролечены с помощью повторного курса ФДТ. Частота ПР составила 92%, частичных — 8%. Полученные результаты позволяют судить о возможности применения ФДТ в лечении пациенток с лейкоплакией вульвы с сохранением целостности органа при получении удовлетворительного функционального и косметического результата [1].
В исследовании В.В. Дунаевской (Национальный институт рака, Киев, Украина) представлен первый опыт применения метода ФДТ в лечении 10 пациенток с верифицированным диагнозом ВИН II–III стадии. В качестве ФС использовали инъекционную форму белорусского ФС — тринатриевой соли хлорина е6 с повидоном, который вводился однократно в дозах от 1 до 2,5 мг/кг. Сеанс ФДТ проводили через 3–4 ч после окончания инфузии ФС с использованием коагулятора лазерного универсального «Лика-хирург» («Фотоника Плюс», Украина, λ=660 нм) в экспозиционных дозах света от 100 до 150 Дж/см2 с мощностью 0,4 Вт. Продолжительность сеансов зависела от степени распространенности патологических очагов и составляла 10–25 мин в зависимости от количества полей облучения. В зону фотооблучения включали нормальные ткани вульвы с отступом от краев зоны поражения не менее 5 мм. Во всех наблюдениях симптомов кожной фототоксичности (зуд, гиперемия открытых участков кожных покровов, отек мягких тканей лица) не зарегистрировано. В течение всего периода внутривенной инфузии ФС и времени до проведения сеанса ФДТ общее состояние пациентов было удовлетворительным. Аллергических реакций, которые сопровождались выраженными нарушениями функции жизненно важных органов (отек Квинке, крапивница, снижение артериального давления, бронхоспазм), не зафиксировано. Несмотря на проведенную до сеанса ФДТ премедикацию, у пациенток отмечался умеренно выраженный болевой синдром. В течение 1–5 сут после проведенного лечения отмечено начало формирования зоны фотохимического некроза темно-коричневого или черного цвета. В срок наблюдения 3 и 6 мес у всех пациенток отмечена ремиссия клинических симптомов заболевания (зуд в области вульвы) в пролеченных патологических очагах. Стоит отметить, что недостаточная эффективность применения ФДТ в 3 случаях связана с использованием субтерапевтических доз ФС (1 мг/кг). В связи с этим у указанных пациентов зарегистрировано отсутствие эффекта проведенного лечения либо частичная регрессия патологических очагов. Применение терапевтических доз ФС и экспозиционных доз фотооблучения 130 и более Дж/см2 позволило достигнуть как клинических, так и морфологических ПР через 3 и 6 мес после проведенного лечения. При контрольном наблюдении через 3 мес у пациентов с ВИН II стадии: клинические ПР зарегистрированы в 40% наблюдений (n=2), частичные регрессии — в 40% (n=2) и отсутствие эффекта в 20% наблюдений (n=1). Морфологические ПР — 60% (n=3), отсутствие эффекта — 40% (n=2). Наличие частичной регрессии и отсутствие эффекта связано с применением субтерапевтической дозы ФС. При контрольном исследовании через 6 мес у пациентов с ВИН II стадии: клинические ПР зарегистрированы в 60% наблюдений (n=3), частичные регрессии — в 20% (n=1), отсутствие эффекта — 20% (n=1); морфологические ПР — у 60% (n=3), отсутствие эффекта — у 40% (n=2). У 2 пациенток со смешанной формой дистрофии вульвы в сроки 3 и 6 мес отмечены как клинические, так и морфологические ПР (при использовании дозы ФС 2,5 мг/кг и экспозиционных доз света 100 Дж/см2. У 1 пациентки в указанные сроки отмечена частичная регрессия в связи с распространенностью патологического процесса и использованием субтерапевтической дозы ФС (1 мг/кг). У 2 пациенток с раком вульвы in situ в сроки 3 и 6 мес отмечены как клинические, так морфологические ПР (при использовании дозы ФС 2,5 мг/кг и экспозиционных доз света 130150 Дж/см2).
ФДТ предопухолевых заболеваний шейки матки. Важными преимуществами ФДТ по сравнению с традиционными методами лечения предопухолевых заболеваний шейки матки, в частности цервикальной интраэпителиальной неоплазии (ЦИН), являются селективность воздействия, возможность совмещения лечебных и диагностических опций, отсутствие риска возникновения серьезных нежелательных реакций, характерных для хирургического вмешательства, относительная дешевизна применения метода и возможность его многократного повторения. Выбор щадящего и органосохраняющего метода ФДТ у молодых женщин с ЦИН различной степени обусловлен стремлением обеспечить высокий процент излеченных пациенток с целью предупреждения рецидивов заболевания и перехода в более выраженный патологический процесс, с сохранением менструальной и репродуктивной функций, что важно для женщин, планирующих роды.
В большинстве случаев наиболее высокая эффективность достигается при системном (внутривенном) введении ФС, использование же аппликационных форм 5-АЛА (растворы, гели и мази) не приводит к достижению высокой частоты ПР. Полученные результаты свидетельствуют о хорошей переносимости метода (отсутствие серьезных нежелательных реакций) и достаточно высокой эффективности применения ФДТ (частота ПР варьирует от 30–67% в случае использования аппликационных форм 5-АЛА и от 90–98,1% при использовании гематопорфириновых и хлориновых производных [12, 15, 26, 29].
Так, A. Barnett и соавторы сообщили о низкой эффективности ФДТ с 3% гелем 5-АЛА у 25 пациенток с ЦИН I–II стадии, включенных в двойное слепое плацебо-контролируемое рандомизированное исследование (12 пациентов в основной группе, 13 — в контрольной группе — получали лечение гелем, не содержащим 5-АЛА). Фотооблучение патологических очагов шейки матки производилось через 4 ч после локального применения геля 5-АЛА в экспозиционной дозе 100 Дж/см2 с плотностью мощности излучения 100 мВт/см2 (λ=635 нм). Частота ПР в основной группе составила 33%, в контрольной — 31%. Авторы не получили статистических различий в результате лечения с плацебо-контролем (р>0,05) [12].
P. Soergel и соавторы сообщили о собственном опыте применения ФДТ с гелевой формой ФС гексаминолевулинат (термогель) в лечении 24 пациенток с ЦИН I–III стадии. Фотооблучение шейки матки и цервикального канала осуществляли через 3–5 ч после нанесения геля, используя лазер с λ=633 нм. Серьезных нежелательных реакций после проведенного лечения отмечено не было. При контрольном наблюдении через 6 мес частота ПР составила 63%. У пациенток отмечена длительная 6-месячная ремиссия вируса папилломы человека (ВПЧ): при ЦИН I стадии — 71%, ЦИН II стадии — 50% и ЦИН III стадии — 71% [29].
M.C. Choi и соавторы исследовали эффективность применения ФДТ в комбинации с электрохирургической эксцизией и конизацией у 73 пациенток с ЦИН II–III стадии. Фотооблучение проводили через 48 ч после внутривенного введения ФС порфимер натрия в дозе 2 мг/кг, используя лазер с λ=630 нм. Частота ПР в течение 12-месячного срока наблюдения составила 98,1%. Эрадикация ВПЧ в сроки контрольных наблюдений 3 и 12 мес была достигнута в 89,8 и 87% соответственно. Частота нежелательных реакций (кожная фототоксичность, стеноз цервикального канала) составила 13,6% [15].
Y.K. Park и соавторы представили опыт лечения 19 пациенток с ЦИН II–IIIстадии методом ФДТ с инъекционной формой ФС — производного порфимера натрия (2 мг/кг) и фотофрина II (2 мг/кг). Фотооблучение осуществляли через 48 ч после введения ФС в световой дозе 240 Дж/см2 (λ=630 нм). Из отмеченных нежелательных реакций авторы сообщили о кожной фототоксичности и умеренно выраженном болевом синдроме, имеющим место во время проведения сеанса ФДТ. Частота ПР составила 91% [26].
Yu.P. Istomin и соавторы представили опыт применения ФДТ с инъекционной формой белорусского ФС хлоринового ряда у 112 пациенток с ЦИН II–III стадии. Фотооблучение шейки матки и цервикального канала производили, используя световые дозы 100–150 Дж/см2 (λ=660±5 нм) через 2,5–3 ч после окончания инфузии ФС. Серьезных нежелательных реакций вследствие проведенного лечения выявлено не было и, тем не менее, у нескольких пациентов отмечен дискомфорт, умеренно выраженный болевой синдром и выделения из влагалища при фотооблучении. По данным авторов, частота ПР, зафиксированных через 3 мес после проведенного лечения, составила 92,8%, а полная эрадикация ВПЧ отмечена в 53,4% наблюдений [20].
Заключение
Полученные данные свидетельствуют о том, что метод ФДТ является хорошо переносимой и достаточно эффективной опцией в лечении пациентов с различными нозологическими формами предопухолевых заболеваний (слизистые полости рта, вульвы, шейки матки и др.) и злокачественных новообразований (злокачественные опухоли головы и шеи, рак кожи, легкого, пищевода, поджелудочной железы, глиальные опухоли головного мозга и др.). В ряде крупных научно-исследовательских центров США, Европы и Азии реализуются крупные исследования, направленные на изучение возможностей расширения спектра показаний к применению ФДТ в клинической онкологии. На данный момент опубликованы результаты ряда исследований, показывающих положительные аспекты применения ФДТ с различными классами фотосенсибилизирующих агентов (5-АЛА и ее производные, гематопорфирина дериват и его производные, хлорины и их производные) [8, 9, 11].
ФДТ может использоваться по радикальной программе при лечении предопухолевых заболеваний (лейкоплакии, дисплазии и др.) и начальных стадий злокачественных новообразований (рак кожных покровов и слизистых оболочек и др.), по паллиативным программам, основной целью которых является эффективное включение ФДТ в схемы комбинированного и комплексного лечения поздних стадий злокачественных новообразований (реканализация при раке пищевода, трахеи, бронхов) и по паллиативным программам, направленным на уменьшение объема опухолевого поражения и гемостаз в случае наличия риска распада при далеко зашедших процессах (опухоли кожных покровов и слизистых оболочек) [8, 9, 11]. Основными преимуществами ФДТ по сравнению с традиционными подходами в лечении заболеваний онкологического профиля являются:
- незначительная токсичность для окружающих нормальных тканей в связи с избирательным накоплением ФС в патологически измененных тканях;
- минимальный риск возникновения выраженного болевого синдрома;
- отсутствие механизмов первичной и приобретенной резистентности;
- возможность амбулаторного проведения процедуры;
- возможность комбинации с другими методами лечебного воздействия;
- отсутствие лимитирующих кумулятивных доз ФС и лазерного излучения;
- удобство применения при множественном характере поражения;
- хорошие косметические результаты;
- возможность реализации органосохраняющих методов лечения.
Список использованной литературы
- 1. Артемьева, Т. П., & Церковский, Д. А. (2018). Фотодинамическая терапия при лейкоплакии вульвы. Biomedical Photonics, 7(4),4–10. https://doi.org/10.24931/2413-9432-2018-7-4-4-10.
- 2. Истомин, Ю. П., Артемьева, Т. П., & Церковский, Д. А. (2016). Фотодинамическая терапия в клинической онкологии: основные исторические аспекты и этапы становления метода. Здравоохранение. Healthcare, 11, 37–46.
- 3. Санарова, Е. В., Ланцова, А. В., Дмитриева, М. В., & Смирнова, З. С. (2014). Фотодинамическая терапия — способ повышения селективности и эффективности лечения опухолей. Российский биотерапевтический журнал, 13(3),109–118.
- 4. Странадко, Е. Ф., Армичев, А. В., & Гейниц, А. В. (2011). Источники света для фотодинамической терапии. Лазерная медицина, 15(3), 63–69.
- 5. Судаков, Н. П., Никифоров, С. Б., Константинов, Ю. М., & Лепехова, С. А. (2007). Роль митохондрий в реализации механизмов программированной гибели клеток. Бюллетень ВСНЦ СО РАМН, 1, 103–107.
- 6. Узденский, А. Б. (2010). Клеточно-молекулярные механизмы фотодинамической терапии. Санкт-Петербург: Наука.
- 7. Церковский, Д. А., & Истомин, Ю. П. (2016). Фотодинамическая терапия: основные механизмы повреждения опухоли. Онкологический журнал, 10(3), 94–105.
- 8. Церковский, Д. А., Протопович, Е. Л., & Ступак, Д. С. (2019). Основные аспекты применения фотосенсибилизирующих агентов в фотодинамической терапии. Онкологический журнал, 13(2), 79–99.
- 9. Abder-Kader, M. H. (2014). Photodynamic therapy. From theory to application. Berlin, Heidelberg: Springer.
- 10. Abrahamse, H., & Hamblin, M. R. (2016). New photosensitizers for photodynamic therapy. Biochemical Journal, 473(4), 347–364. doi: 10.1042/BJ20150942.
- 11. Agostinis, P., Berg, K., Cengel, K. A., Foster, T. H., Girotti, A. W., Gollnick, S. O., …, Golab, J. (2011). Photodynamic therapy of cancer: an update. CA Cancer Journal for Clinicians, 61(4), 250–281. doi: 10.3322/caac.20114.
- 12. Barnett, A. A., Haller, J. C., Cairnduff, F., Lane, G., Brown, S. B., & Roberts, D. J. (2003). A randomised, double-blind, placebo-controlled trial of photodynamic therapy using 5-aminolaevulinic acid for the treatment of cervical intraepithelial neoplasia. International Journal of Cancer, 103(6), 829–832. doi: 10.1002/ijc.10888.
- 13. Bastogne, T., & Bonneau, S. (2017). Photodynamic therapies of high-grade gliomas: from theory to clinical perspectives. Retrived from https://hal.archives-ouvertes.fr/tel-01806848/document.
- 14. Castano, A. P., Mroz, P. & Hamblin, M. R. (2006). Photodynamic therapy and anti-tumour immunity. Nature Reviews Cancer, 6, 535–545. Retrived from https://www.nature.com/articles/nrc1894.
- 15. Choi, M. C., Jung, S. G., Park, H., Lee, S. Y., Lee, C., Hwang, Y. Y., & Kim, S. J. 9 (2013). Photodynamic therapy for management of cervical intraepithelial neoplasia II and III in young patients and obstetric outcomes. Lasers in Surgery and Medicine, 45(9),564-572. doi: 10.1002/lsm.22187.
- 16. Choi, M. C., Kim, M. S., Lee, G. H., Jung, S. G., & Park, H. (2015). Photodynamic therapy for premalignant lesions of the vulva and vagina: A long-term follow-up study. Lasers in Surgery and Medicine, 47(7), 566–570. doi: 10.1002/lsm.22384.
- 17. Girotti, A. (1990). Photodynamic lipid peroxidation in biological systems. Journal of Photochemistry and Photobiology, 51, 497–509. doi: 10.1111/j.1751-1097.1990.tb01744.x.
- 18. Gomer, C. J. (2010). Photodynamic therapy. Methods and protocols, New York: Humana Press.
- 19. Grimes, C., Cunningham, C., Lee, M., & Murina, A. (2016). Use of topical imiquimod in the treatment of VIN: a case report and review of the literature. International Journal of Women’s Dermatology, 2(1), 35–38. doi: 10.1016/j.ijwd.2015.12.007.
- 20. Istomin, Y. P., Lapzevich, T. P., Chalau, V. N., Shliakhtsin, S. V., & Trukhachova, T. V. (2010). Photodynamic therapy of cervical intraepithelial neoplasia grades II and III with Photolon. Photodiagnosis and Photodynamic Therapy, 7(3),144–151. doi: 10.1016/j.pdpdt.2010.06.005.
- 21. Kessel, D. (2019). Apoptosis, paraptosis and autophagy: Death and survival pathways associated with photodynamic therapy. Photochemistry and Photobiology, 95,119–125. doi: 10.1111/php.12952.
- 22. Kessel, D., & Oleinick, N. L. (2018). Cell death pathways associated with photodynamic therapy. Photochemistry and Photobiology, 94, 213–218. doi: 10.1111/php.12857.
- 23. Kubiak, M., Łysenko, L., Gerber, H., & Nowak, R. (2016). Cell reactions and immune responses to photodynamic therapy in oncology. Postępy Higieny i Medycyny Doświadczalnej, 70, 735–742. doi: 10.5604/17322693.1208196.
- 24. Liu, G., Bi, Y., Wang, R., & Wang X. J. (2013). Self-eating and self-defense: autophagy controls innate immunity and adaptive immunity. Journal of Leukocyte Biology, 93(4), 511–519. doi: 10.1189/jlb.0812389.
- 25. Martin-Hirsch, P. L., Whitehurst, C., Buckley, C. H., Moore, J. V., & Kitchener, H. C. (1998). Photodynamic treatment for lower genital tract intraepithelial neoplasia. Lancet, 351,1403. doi: 10.1016/s0140-6736(98)24019-0.
- 26. Park, Y. K., & Park, C. H.(2016). Clinical efficacy of photodynamic therapy. Obstetrics & Gynecology Science, 59(6), 479–488. DOI:10.5468/ogs.2016.59.6.479.
- 27. Rapozzi, V.,& Jori, G. (2015). Resistance to photodynamic therapy in cancer. Switzerland: Springer.
- 28. Rubinsztein, D. C., Marino, G., & Kroemer, G. (2011). Autophagy and aging. Cell, 146(5), 682–695. doi: 10.1016/j.cell.2011.07.030.
- 29. Soergel, P., Wang, X., Stepp, H., Hertel, H., & Hillemanns, P. (2008). Photodynamic therapy of cervical intraepithelial neoplasia with hexaminolevulinate. Lasers in Surgery and Medicine, 40(9), 611–615. doi: 10.1002/lsm.20686.
- 30. van Straten, D., Mashayekhi, V., de Bruijn, H. S., Oliveira, S., & Robinson, D. J. (2017). Oncologic photodynamic therapy: basic principles, current clinical status and future directions. Cancers (Basel), 9(2), 19. doi: 10.3390/cancers9020019.
- 31. Yanovsky, R. L., Bartenstein, D. W., Rogers, G. S., Isakoff, S. J., & Chen, S. T. (2019). Photodynamic therapy for solid tumors: A review of the literature. Photodermatol. Photoimmunol. Photomed, 35(5), 295–303. doi: 10.1111/phpp.12489.
Фотодинамічна терапія в клінічній онкології
1ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової НАМН України»
2ДУ «Республіканський науково-практичний центр онкології та медичної радіології ім. М.М. Александрова », аг. Лісний, Республіка Білорусь
3Національний інститут раку, Київ
Резюме. Фотодинамічна терапія (ФДТ) є методом лікування, заснованим на комбінованому застосуванні фотосенсибілізаторів і лазерного випромінювання з певною довжиною хвилі. За даними численних клінічних, у тому числі рандомізованих досліджень, проведених у провідних науково-практичних центрах країн Європи, Азії та США, даний метод лікування продемонстрував хорошу переносимість і високу протипухлинну ефективність в лікуванні ряду передпухлинних захворювань і злоякісних новоутворень. У публікації авторами систематизовані ключові аспекти застосування ФДТ в клінічній онкології, а саме: розглянуто класифікацію найбільш часто використовуваних фотосенсибілізуючих агентів і їх похідних, представлено основні джерела лазерного випромінювання і провідні механізми реалізації протипухлинної відповіді на фотоопромінення патологічно змінених тканин, а також основні показання та протипоказання до застосування в клінічній онкології. У другій частині статті проаналізовано наявний світовий досвід застосування ФДТ в лікуванні передпухлинних захворювань слизових оболонок порожнини рота, вульви і шийки матки, а також злоякісних новоутворень шкіри, легені, стравоходу, підшлункової та передміхурової залоз, злоякісних гліом головного мозку. Метод ФДТ є ефективною альтернативою традиційним підходам в лікуванні зазначених захворювань і може застосовуватися як самостійно, так і в схемах комбінованого й комплексного лікування. Маючи вагомі переваги, такі як незначна токсичність для нормальних тканин, що оточують пухлину, мінімальний ризик виникнення вираженого больового синдрому, відсутність механізмів первинної та набутої резистентності, можливість амбулаторного проведення і комбінації з іншими методами лікувальної дії, відсутність лімітуючих кумулятивних доз ФС і лазерного випромінювання, зручність застосування при множинному характері ураження, хороші косметичні результати і можливість реалізації органозберігаючих методів лікування, ФДТ є актуальним і перспективним напрямком подальших наукових досліджень.
Ключові слова: фотодинамічна терапія; фотосенсибілізатори, фотохімічні реакції; апоптоз; некроз; аутофагія; показання; протипоказання; клінічне застосування.
Адреса для листування:
Дунаєвська Вікторія Вікторівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: dunaevskaya80@ukr.net
Correspondence:
Dunaevskaya Viktoria
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
E-mail: dunaevskaya80@ukr.net














Leave a comment