Внутрішньоартеріальна хіміотерапія при метастатичному колоректальному раку: огляд літератури та клінічного випадку
Черченко К.Д., Лукашенко А.В., Остапенко Ю.В., Пацко В.В., Віноградова М.О., Валіхновська К.Г., Паманська С.Ю.
Резюме. Мета. Аналіз досліджень, присвячених вивченню ефективності внутрішньоартеріального введення цитотоксичних та таргетних препаратів при метастазах колоректального раку (КРР) у печінку, порівняння його з традиційною хіміотерапією та іншими варіантами системної терапії, оцінка перспективності методу з точки зору конверсії неоперабельних метастазів в операбельні, оцінка впливу внутрішньоартеріальної хіміотерапії на показники виживаності. Матеріали і методи дослідження. У роботі використовувалися матеріали публікацій Національного центру біотехнологічної інформації (National Center for Biotechnology Information — NCBI), PubMed, Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO), ASCOPubs за пошуковими критеріями, що включали ключові слова «НАІ — hepatic arterial infusion, внутрішньопечінкове артеріальне введення», «метастатичний колоректальний рак», «печінкові метастази колоректального раку», «внутрішньоартеріальна хіміотерапія», «регіонарна хіміотерапія», а також архівні дані відділення малоінвазивної та ендоскопічної хірургії, інтервенційної радіології Національного інституту раку для аналізу клінічного випадку. Результати. У зв’язку з високою селективністю пацієнтів, яким може бути запропоновано цю методику, та технічну складність її виконання в літературі представлено здебільшого результати клінічних досліджень І–ІІ фази. Схеми із застосуванням фторпіримідинів та оксаліплатину внутрішньоартеріально (окремо або в поєднаннях) продемонстрували позитивні результати щодо безрецидивної, загальної виживаності та можливості конверсії нерезектабельних печінкових метастазів у резектабельні. Внутрішньоартеріальне введення іринотекану не продемонструвало переваг порівняно з внутрішньовенним введенням. Внутрішньоартеріальне застосування бевацизумабу в рамках наявних досліджень не мало переваг при регіонарному введенні, до того ж характеризувалося розрізненими даними щодо безпеки: за описами деяких дослідників підвищувало ризик розвитку побічних явищ (у разі комбінації з внутрішньоартеріальним введенням фторпіримідинів), а за іншими — не впливало на їх частоту (при комбінації з оксаліплатином внутрішньоартеріально). Тож, можливість та доцільність використання цього препарату в печінковій інфузії не однозначні. Також у публікації наведено позитивний досвід застосування методики в Національному інституті раку. Пацієнту з неоперабельними печінковими метастазами колоректального раку було проведено чотири повних та один неповний курс внутрішньоартеріальної хіміотерапії FOLFOX (5-фторурацил, лейковорин, оксаліплатин). Після переоцінки виявлено перехід стану в резектабельний, виконано резекцію печінки. За результатами патогістологічного висновку мікроскопічно отримано повну відповідь. Висновки. Внутрішньоартеріальна хіміотерапія при печінкових метастазах колоректального раку є нестандартною методикою, що може використовуватися далеко не в усіх пацієнтів, проте за потрібного поєднання показань та відсутності протипоказань вона може стати рятівним варіантом для хворих, які вичерпали загальнорекомендовані лінії лікування чи є резистентними до системної хіміотерапії. Подальший розвиток цього напряму із залученням нових препаратів та комбінування раніше відомих має клінічне значення для лікарів-онкологів України та світу.
DOI: 10.32471/clinicaloncology.2663-466X.49-1.29873
Вступ
Колоректальний рак (КРР) займає третю позицію за поширеністю у світі, є третім за частотою діагностування у чоловіків та другим у жінок серед інших видів раку [1]. В Україні рак ободової та прямої кишки окремо відстежуються статистично, проте загалом показники відповідають загальносвітовим тенденціям. У 2020–2021 рр. захворюваність на злоякісні новоутворення ободової кишки у чоловіків і жінок була на четвертому місці (7,1 і 6,8% відповідно), злоякісні новоутворення прямої кишки — на шостому (6,7%) у чоловіків і на сьомому (5,0%) у жінок (серед усіх видів раку). Смертність від раку ободової та прямої кишки посідає третє (7,7%) та п’яте (7,3%) місця відповідно у чоловіків і третє (7,5%) та шосте (5,5%) місця у жінок [2].
Розповсюджені форми захворювання найчастіше характеризуються метастазуванням первинної пухлини в печінку. Печінкові метастази КРР (ПМКРР) виникають у 60% пацієнтів на певному етапі розвитку їх захворювання, при цьому близько 85% з них виявляються нерезектабельними, а це, у свою чергу, погіршує прогноз виживаності — 6–10% для 5 років [3, 4]. Якщо ж метастази можна хірургічно видалити, цей показник зростає до 30% [5]. При лікуванні пацієнтів з первинно-метастатичним КРР комбінацією оксаліплатину з 5-фторурацилом (5-ФУ) та лейковорином у першій лінії медіана загальної виживаності (ЗВ) становить 19,5 міс, комбінацією оксаліплатину з іринотеканом — 17,4 міс, загальна частота відповіді (ЗЧВ) на первинне лікування за схемами із вмістом оксаліплатину чи іринотекану становить 45%, проте, якщо ці препарати використовуються в якості другої чи наступних ліній, показник ЗЧВ знижується до 30%, а медіани ЗВ — до 9–12 міс [6].
На сьогодні завдяки покращенню методів діагностики КРР усе частіше виявляють на ранніх етапах, ще до появи віддалених метастазів (лише у 15–25% пацієнтів відмічають метастатичне захворювання на етапі первинної діагностики). У більшості випадків хворий на КРР на момент виявлення метастазів у печінку вже встигає отримати одну або декілька ліній системної терапії, що ускладнює подальшу терапевтичну тактику, адже світові рекомендації для хіміорезистентного метастатичного КРР (мКРР) навіть сьогодні наводять не надто широкий діапазон цитотоксичних агентів. Використання ж таргетних чи імунотерапевтичних препаратів, на жаль, є відносно обмеженим в Україні з фінансових та соціальних причин. Перед лікарем-онкологом постає непросте завдання розробки терапевтичних схем для таких пацієнтів.
Загальні положення щодо внутрішньоартеріальної хіміотерапії
Одним з підходів до лікування пацієнтів з КРР з метастазами в печінку є внутрішньоартеріальна хіміотерапія (ХТ). Вона базується на введенні хіміотерапевтичного препарату безпосередньо в судину, що кровопостачає пухлину. Внутрішньопечінкова артеріальна ХТ (hepatic arterial infusion — НАІ) має ряд обґрунтувань, що дозволили методиці стати досить розповсюдженим альтернативним підходом до системного лікування при мКРР. Одна з причин — хірургічна зручність встановлення катетера або помпи в судини печінки, а саме — гілки печінкової артерії. Не останню роль відіграють і анатомічні особливості кровопостачання печінкових метастазів: так, вони майже винятково перфузуються печінковою артерією, тоді як здорова тканина печінки отримує більшу частину крові з ворітної вени [7]. Існують переваги і в загальному профілі сприйнятливості лікування пацієнтом: HAI забезпечує підведення високих концентрацій цитотоксичних речовин безпосередньо до печінкових метастазів з нижчою системною токсичністю [8]. Окремо слід виділити також перспективність цього методу в розрізі переведення нерезектабельних печінкових метастазів у резектабельні, що також має значний вплив на довготривалу виживаність пацієнтів. Успіх такої конверсії при класичному внутрішньовенному введенні ХТ становить ~15%, що є досить низьким показником та спонукає до пошуку додаткових, більш дієвих на локальному рівні підходів, і НАІ — обнадійливий напрямок руху до цієї мети [9]. До того ж НАІ перед резекцією ПМКРР покращує віддалені результати виживаності. В. Koerkamp та співавтори повідомляють про більшу медіану ЗВ у пацієнтів, яким було проведено НАІ перед резекцією, порівняно з хворими когорти системної терапії, не зважаючи на те, що у групі НАІ розповсюдженість захворювання була більшою (67 міс та 44 міс відповідно). 10-річна ЗВ становила 38,0% у групі НАІ та 23,8% у групі, в якій її не проводили [10].
Методика НАІ не є новою та використовується у світі більше 40 років, проте досі лишається більше альтернативою, ніж загальноприйнятою клінічною практикою. Так відбувається у зв’язку з обмеженою кількістю пацієнтів, яким можна проводити таке лікування (протипоказання висвітлено в наступному підрозділі), що, у свою чергу, позначається на клінічних дослідженнях оптимальних комбінацій препаратів для внутрішньоартеріального введення — у більшості публікацій учених з провідних онкологічних клінік світу представлено результати клінічних досліджень І–ІІ фаз. Також важливо враховувати технічну складність проведення НАІ у зв’язку з необхідністю залучення великої різнопрофільної команди: хіміотерапевтів, хірургів, рентгенологів, анестезіологів та спеціалістів, що володіють навичками проведення ангіографії. Втім зацікавленість у розвитку цього напряму не зменшується, бо для деяких когорт пацієнтів він може стати справжнім виходом: не тільки враховуючи перспективи конверсії метастазів з нерезектабельних у резектабельні, а й для хворих, що вичерпали загальнорекомендовані лінії терапії чи є резистентними до системної ХТ.
Наразі внутрішньоартеріальна ХТ при ПМКРР не є стандартом лікування, проте вона вже наводиться в рекомендаціях Національної загальної онкологічної мережі (National Comprehensive Cancer Network — NCCN) як можливий варіант [11]. Пошук та дослідження нових схем для внутрішньопечінкового введення активно тривають і дотепер.
Технічні аспекти НАІ
Внутрішньоартеріальна ХТ вводиться через порт, що встановлюється в печінкову артерію, або помпу. У разі використання порта у нього встановлюється катетер шляхом проколу шкіри та підключається до зовнішньої помпи або інфузомата. Деякі види помп імплантують хірургічно. Під час розміщення такої помпи перев’язують дистальну шлунково-дванадцятипалу артерію, праву шлункову артерію та дрібні колатеральні гілки, що живлять шлунок, тонку кишку та підшлункову залозу. Помпу розмішують у підшкірній кишені на передній черевній стінці. Одночасно виконується холецистектомія для запобігання хіміоіндукованого холециститу. Для оцінки білобарної печінкової перфузії та позапечінкової перфузії вводять синій барвник або рентгенконтрастну речовину (якщо встановлення порта чи помпи відбувається під контролем ангіографа). Імплантовані хірургічним шляхом помпи забезпечують нижчий ризик інфекційних заражень та кращу фіксацію катетера в печінковій артерії [12–14].
Протипоказання
НАІ має ряд протипоказань, серед них: загальний стан пацієнта за шкалою Східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) від 2 включно, супутня патологія печінки, недостатність функції печінки, значне пухлинне навантаження печінки, портальна гіпертензія або оклюзія портальної вени та наявність позапечінкових метастазів [15]. Останній пункт, втім, може бути переглянуто мультидисциплінарною комісією, якщо позапечінкові метастази наявні в невеликій кількості, клінічно стабільні, інші варіанти лікування неможливі з різних причин, а користь від проведення НАІ перевищує імовірну шкоду від відсутності будь-якого лікування.
Ускладнення НАІ
Враховуючи багатоступеневість реалізації внутрішньопечінкових схем (хірургічне встановлення порта або помпи, догляд за ними, власне введення хіміопрепарату), можливі ускладнення доцільно розділити на декілька груп.
Пов’язані з хірургічним втручанням ускладнення найчастіше включають ризик травмування великих судин, формування абсцесів, інфікування. Пов’язані з портом/катетером ускладнення здебільшого представлені міграцією порта (особливо у пацієнтів з надлишковою масою тіла), екстравазацією препарату (у зв’язку зі значним тиском та опором в артерії — введення тільки за допомогою помпи чи інфузомата), оклюзією печінкової артерії, тромбозом катетера [15]. Ускладнення, пов’язані з хіміотерапевтичними агентами, є подібними до таких при звичайному системному введенні. Проте їх частота є нижчою у разі використання препаратів з високим рівнем печінкового метаболізму. Якщо системне введення зазвичай асоціюється із загальнотоксичними, еметогенними, мієлосупресивними проявами, то у разі НАІ на перший план виходять місцеві та печінковоспецифічні явища: біль, біліарний склероз, токсичний гепатит, підвищення рівня печінкових ферментів або білірубіну. Позапечінковий витік препарату може викликати виразки шлунка чи дванадцятипалої кишки, діарею [15, 16]. Проте, враховуючи те, що на сьогодні відповідно до більшості схем препарати все ще не вводять цілковито внутрішньоартеріально, а поєднують регіонарне та класичне внутрішньовенне введення, можуть мати місце типові системні побічні явища використовуваних хіміопрепаратів.
Найнебезпечнішим побічним ефектом НАІ є дилатація печінкових синусоїдальних капілярів та атрофія гепатоцитів, прогресуючий дегенеративний процес, який може призвести до цирозу та некрозу печінки [17]. З огляду на це надзвичайно важливим є посилений та регулярний контроль біохімічних показників печінкової активності, а також, можливо, доцільними є більш часті сонографічні, еластографічні та/або рентгенографічні обстеження, ніж при рутинній ХТ.
Цитотоксичні агенти для внутрішньоартеріального введення
Ще на самому початку дослідження підходу НАІ було визначено основні вимоги до препаратів для внутрішньопечінкового введення. «Ідеальний кандидат» має виводитися печінкою у значній концентрації; мати короткий період напіввиведення, щоб уникнути накопичення в системному кровообігу; мати високий загальний кліренс тіла. Відповідність цим вимогам дозволила б підвищити місцеву концентрацію, збільшуючи терапевтичну відповідь, та зменшити системний вплив препарату та його токсичність [18]. На сьогодні таким препаратом вважається флоксуридин (floxuridine — FUDR), що у процесі метаболізму перетворюється на 5-ФУ. Він має високий показник виведення печінкою — 95%, короткий період напіввиведення (16 хв) та високий рівень пресистемного метаболізму (first pass metabolism). Усе це дозволяє підвищити концентрацію препарату в пухлинах печінки та знизити системну концентрацію (експозиція печінки є майже у 400 разів більшою за системну) [8, 19, 20].
Схеми із застосуванням FUDR зарекомендували себе як такі, що мають меншу загальну токсичність у порівнянні із загальноприйнятими схемами на основі фторпіримідинів, проте цей препарат асоціюється з біліарною токсичністю. З метою зменшення її вираженості за результатами наявних клінічних досліджень запропоновано внутрішньоартеріальне введення FUDR разом з дексаметазоном (dexamethasone — Dex) (N. Kemeny та співавтори описують частоту підвищення білірубіну у групах НАІ FUDR/Dex та НАІ FUDR 9% проти 30% відповідно [21]), чергування HAI FUDR з HAI 5-ФУ [22, 23] або послідовне введення НАІ FUDR та внутрішньовенно 5-ФУ в межах одного циклу [6, 24].
Дослідження J.S. Bolton та співавторів послідовної схеми НАІ FUDR та внутрішньовенно 5-ФУ з лейковорином в ад’ювантному режимі після резекції печінки продемонструвало покращення віддалених результатів безрецидивної виживаності (БРВ) та виживаності без печінкових рецидивів порівняно з наявними статистичними даними для хірургії без ад’юванту [24]. Комбінація НАІ FUDR/Dex та двох оксаліплатинвмісних схем, що вводяться внутрішньовенно, у пацієнтів з нерезектабельними ПМКРР досліджували N. Kemeny та співавтори. Дві групи пацієнтів отримували НАІ FUDR/Dex з послідовним введенням внутрішньовенно оксаліплатину, лейковорину та 5-ФУ в першій групі та послідовним введенням внутрішньовенно оксаліплатину й іринотекану в другій групі. У результаті було отримано обнадійливо високі показники відповіді: повна та часткова відповідь спостерігалися у 90% учасників першої групи та у 87% другої групи, таким чином, ЗЧВ становила 88%. Медіана ЗВ для першої та другої груп становила 36 та 22 міс відповідно. Цією ж групою дослідників було оцінено частоту конверсії нерезектабельних ПМКРР у резектабельні у пацієнтів, що отримували НАІ FUDR/Dex та внутрішньовенно оксаліплатин й іринотекан. У загальній групі цей показник становив 47%, у підгрупі раніше нелікованих пацієнтів — 57%, що значно вище за історичний показник конвертабельності за лише внутрішньовенного введення поліхіміотерапії 15% [25]. М. D’Angelica та співавтори наводять результати свого дослідження ІІ фази впливу НАІ FUDR/Dex на конверсію нерезектабельних печінкових метастазів, підтверджують показник 47% та асоціюють можливість проведення хірургічного втручання з кращими показниками виживаності. До схем, які застосовувалися разом з НАІ та вводилися внутрішньовенно, входили оксаліплатин, іринотекан та бевацизумаб; іринотекан, 5-ФУ, лейковорин та бевацизумаб. ЗЧВ становила 76%, медіани БРВ та ЗВ — 13 та 38 міс відповідно для всіх пацієнтів [26]. В іншому дослідженні І/ІІ фази N. Kemeny та співавтори розглядали НАІ FUDR/Dex та внутрішньовенне введення іринотекану з точки зору перспектив збільшення ЗВ для пацієнтів після метастазектомії. За отриманими даними, 2-річна виживаність у досліджуваній групі становила 89% (для порівняння — цей показник для ад’ювантної НАІ FUDR/Dex та внутрішньовенного введення 5-ФУ з лейковорином становив 86%, для лише внутрішньовенної ад’ювантної терапії — 65%) [27]. Х. Li та співавтори розглядали HAI FUDR також як потенційний низькотоксичний агент для пацієнтів старших вікових груп з нерезектабельними ПМКРР у комбінації з капецитабіном, що застосовувався перорально. Частота об’єктивної відповіді (ЧОВ) у групі НАІ FUDR та капецитабіну становила 95,8%, тоді як у контрольній групі, у якій застосовували лише капецитабін, — 48,1%. Переносимість внутрішньоартеріальної ХТ також була задовільною, побічні явища були очікуваними: усі вони були оборотними та жодне з них не вимагало відміни НАІ [28].
Хоча вказаний препарат і зарекомендував себе як класичний агент для внутрішньоартеріального введення в практиці світових онкологічних лікарень, в Україні на сьогодні він не зареєстрований. Проте схеми, що включають 5-ФУ в якості НАІ-агента, також активно досліджувалися та використовуються у світовій клінічній практиці. М. Lorenz та Н. Müller ще у 2000 р. опублікували результати порівняння різних препаратів групи фторпіримідинів з різними шляхами введення та виявили, що результати виживаності є співставними для НАІ FUDR та 5-ФУ [29].
Поряд із фторпіримідинами препаратом, що підходить для внутрішньопечінкового введення, вважається оксаліплатин, оскільки у разі введення в артерію лише половина дози потрапляє до загального кровообігу, а це свідчить про дуже сприятливий профіль безпеки [30]. Порівняльні дані щодо результатів НАІ з використанням оксаліплатину наведено в таблиці.
| Дослідження | Фаза | Кількість пацієнтів | Попереднє лікування | Доза | Супутня системна ХТ | ЗЧВ | мБРВ, міс | мЗВ, міс |
|---|---|---|---|---|---|---|---|---|
| W. Kern та спіавтори, 2001 [32] | I | 21 | Так/ні | 25 мг/м2 зі збільшенням по 25 мг/м2 | ФУЛ | 59% | н.о. | н.о. |
| A. Mancuso та спіавтори, 2003 [33] | I | 17 | Так | 20 мг/м2/добу × 5 днів кожних 3 тиж | Жодної | 67% | н.о. | 19 |
| G. Fiorentini та спіавтори, 2004 [34] | I–II | 12 | Так | 150 мг/м2 кожні 3 тиж | Жодної або ФУЛ ± іринотекан | 50% | 4 | 13 |
| M. Ducreux та спіавтори, 2005 [35] | II | 26 | Ні або 1 лінія внутрішньовенної ХТ без оксаліплатину | 100 мг/м2 кожні 2 тиж | ФУЛ | 64% | 27 | 27 |
| V. Boige та спіавтори, 2007 [36] | II | 44 | Так (>2 ліній) | 100 мг/м2 кожні 2 тиж | ФУЛ | 55% | 7 | 16 |
| A.M. Tsimberidou та спіавтори, 2010 [37] | I | 29 | Так (>2 ліній) | 60–175 мг/м2 кожні 2 тиж | ФУЛ + бевацизумаб | 43% | н.о. | н.о. |
| A.M. Tsimberidou та спіавтори, 2013 [38] | I | 58 | Так | 140 мг/м2 кожні 3 тиж | ФУЛ + бевацизумаб/цетуксимаб | 12% (KRAS-) 6% (KRAS+) | н.о. | 12 (KRAS-) 7 (KRAS+) |
| M.A. Allard та спіавтори, 2015 [39] | II | 68 | Ні | 100 мг/м2 кожні 2 тиж | ФУЛ + цетуксимаб | н.о. | н.о. | 114 |
| S.R. Volovat та спіавтори, 2016 [40] | II | 24 | Так/ні | 85 мг/м2 кожні 2 тиж | FOLFIRI | 78% | 20 | 29 |
| F.A. Lévi та спіавтори, 2016 [41] | II | 64 | Так | 85 мг/м2 кожні 2 тиж | HAI іринотекан 180 мг/м2 + НАІ 5-ФУ 2800 мг/м2 + внутрішньовенно цетуксимаб | 41% | 9 | 26 |
| A. Lim та спіавтори, 2017 [42] | MCS | 61 | Так/ні | Кожні 2 тиж | ФУЛ + бевацизумаб/цетуксимаб | 11–27% | 9–6 | 14–8 |
| Y. Sato та спіавтори, 2018 [43] | I–II | 13 | Так | 50–100 мг/м2 кожні 2 тиж | ФУЛ | 70% | н.о. | 7 |
Примітки: ФУЛ — 5-ФУ та лейковорин;
н.о. — не оцінювалося;
FOLFIRI –5-ФУ, лейковорин, іринотекан;
мБРВ — медіана безрецидивної виживаності;
мЗВ — медіана загальної виживаності.
Дані щодо використання інших хіміотерапевтичних агентів у монорежимі або в якості єдиного НАІ-елемента схеми є обмеженими. Наприклад, дослідження J. van Riel та співавторів демонструє, що внутрішньоартеріальне введення іринотекану в дозі 20 мг/м2/добу, в 1–5-й дні 3-тижневих циклів не показало потенційної переваги для пацієнтів з ПМКРР [44]. Цей препарат продемонстрував обнадійливі результати за частотою відповіді та виживаності лише у формі препарату вивільнювальних мікросфер (DEBIRI) [45].
R. Mancini та співавтори наводять результати клінічного випробування ІІ фази, у якому в якості НАІ-агента використовувався цисплатин у дозі 24 мг/м2/добу з подальшим внутрішньовенним введенням 5-ФУ. Так, ЧОВ становила 52%, а також спостерігалася нижча токсичність, ніж у контрольній групі (цисплатин та 5-ФУ внутрішньовенно). На сьогодні це єдине дослідження НАІ з використанням цисплатину при ПМКРР [46].
Використання дублетів та триплетів для внутрішньоартеріального введення
З появою нових препаратів та подальшим розвитком напряму НАІ почали з’являтися дані щодо внутрішньопечінкового введення декількох препаратів — так звані дублети та триплети.
Дослідження терапевтичного ефекту та безпеки НАІ з використанням триплета іринотекан, оксаліплатин та FUDR описано Y. Chen та співавторами. У ході дослідження 31 пацієнт з ПМКРР отримував у якості першої лінії терапії іринотекан у дозі 120 мг/м2, оксаліплатин — 100 мг/м2 та FUDR — 500 мг/м2 в артерії, що живлять пухлину, з подальшим внутрішньовенним введенням лейковорину 200 мг/добу та FUDR 300 мг/м2/добу протягом 3 днів із загальною схемою введення кожні 4–8 тиж. ЗЧВ у результаті дослідження становила 61,3%, а медіана БРВ та ЗВ — 24,8 міс та 10,1 міс відповідно. Частота виникнення побічних ефектів була наступною: нейтропенії 3–4-го ступеня — 6,5%, діареї — 9,7%, підвищення рівня білірубіну в сироватці крові — 3,2%, підвищення рівня трансаміназ у сироватці крові — 19,4% та блювання — 90,3%. Таким чином, схему було визначено як ефективну та таку, що добре переноситься [47].
Результати застосування схожої схеми, проте з 5-ФУ, опубліковано в ретроспективному аналізі B. Melichar та співавторів. У ньому наведено дані 68 пацієнтів з ПМКРР, кожен з яких отримав щонайменше один цикл HAI з використанням послідовного триплета іринотекан 100 мг/м2 1–2 год, лейковорин 50–350 мг болюсно чи у вигляді короткої інфузії, 5-ФУ 750–1250 мг/м2 2–5 год у режимі weekly (для двох з них схема модифікувалася: режим biweekly, та чотиритижневий режим з додаванням цетуксимабу). 36 пацієнтів отримували це лікування в якості 1-ї лінії терапії, 32 хворих — у якості 2-ї або наступних ліній. ЗЧВ для цієї схеми становила 72%, медіана БРВ та ЗВ — 11 та 26 міс відповідно. ЗВ була значно кращою у тих пацієнтів, яким було проведено хірургічне втручання з приводу печінкових метастазів на будь-якому етапі лікування: медіана 81 міс для хворих, яких було прооперовано до початку НАІ, та медіана 60 міс для тих пацієнтів, що внаслідок НАІ перейшли з нерезектабельного статусу метастазів у резектабельний. У всіх випадках операції після НАІ патогістологічно спостерігався стеатоз. Хоча дані і є дещо розрізненими у зв’язку з ретроспективністю аналізу та не можуть бути ідеально співставлені, загальні тенденції свідчать на користь НАІ при ПМКРР [48].
У ході європейського багатоцентрового дослідження ІІ фази OPTILIV досліджували потенціал конверсії нерезектабельних ПМКРР у резектабельні при НАІ із застосуванням іринотекану, оксаліплатину та 5-ФУ у поєднанні з внутрішньовенним введенням цетуксимабу. Пацієнти отримували цетуксимаб внутрішньовенно в дозі 500 мг/м2 з подальшою НАІ (іринотекан 180 мг/м2, оксаліплатин 85 мг/м2 та 5-ФУ 2800 мг/м2) у хрономодульованому або послідовному режимах (рис. 1) кожні 14 днів. У дослідженні взяли участь 64 хворих з нерезектабельними ПМКРР та wild-type KRAS. Рішення щодо резектабельності мультидисциплінарно переглядалися після кожного третього курсу. Оцінювали частоту повної макроскопічної резекції печінкових метастазів (R0 + R1), БРВ та ЗВ. Первинною кінцевою точкою було визначено досягнення частоти можливості резекції 30% (порівняно з 15% при внутрішньовенній ХТ).
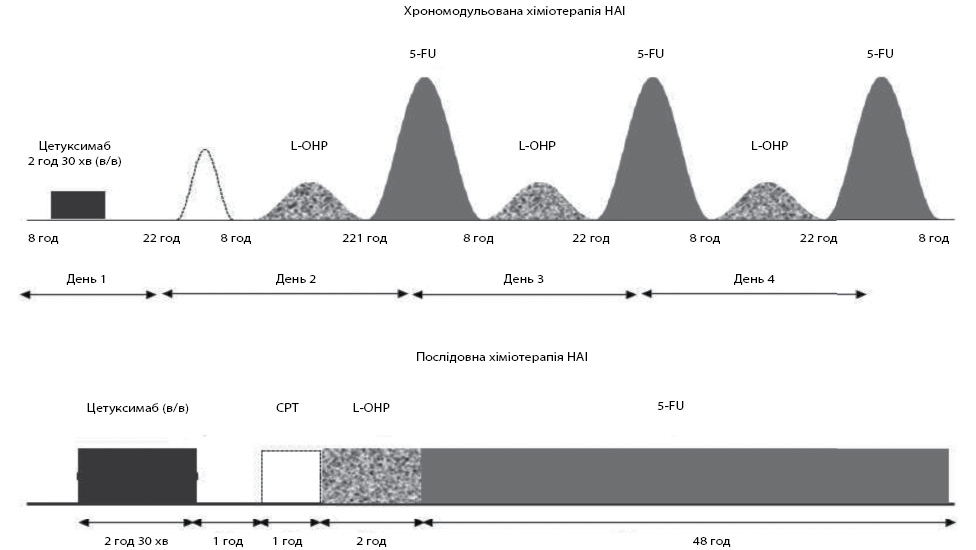
Верхня панель, хрономодульоване введення: іринотекан, оксаліплатин та 5-ФУ вводили в один день за допомогою програмованої за часом мультиканальної помпи (Melodie, Axon Cable, Montmirail, France), приєднаної до НАІ-порта за допомогою голки Губера 20G.
Нижня панель, послідовне введення: 1-годинне введення іринотекану, 2-годинне введення оксаліплатину в 1-й день та 48-годинне введення 5-ФУ в послідовному порядку. Препарати вводилися за допомогою шприцевої помпи Alaris (San Diego, California, USA).
У результаті було рапортовано про досягнення первинної кінцевої точки — частота R0–R1-гепатектомії після проведеного лікування становила 29,7% (95% довірчий інтервал (ДІ) 18,5–40,9). ЧОВ відповідала 40,6% (28,6–52,3). Медіана БРВ та ЗВ становила 9,3 (7,8–10,9) та 25,5 міс (18,8–32,1) відповідно. У учасників, яким було виконано гепатектомію R0–R1, відмічали медіану ЗВ 35,2 міс (32,6–37,8), з них 37,4% (23,6–51,2) були живими через 4 роки після проведеного лікування. Отримані результати демонструють високий лікувальний потенціал передусім завдяки збільшенню частоти конверсії ПМКРР порівняно з середніми показниками за класичного введення ХТ [41].
Перспективність НАІ з використанням дублета ралтітрексед та оксаліплатин у хіміорезистентних пацієнтів досліджувалася в рандомізованому клінічному дослідженні ІІ фази HEARTO. До нього було включено пацієнтів, рефрактерних до попереднього лікування або з неможливістю продовжувати його у зв’язку з токсичністю (фторпіримідин, іринотекан, оксаліплатин, анти-VEGF-препарати та у разі пухлин з wild-type KRAS — анти-EGFR препарати). Учасників було розподілено на групу НАІ за послідовною схемою: ралтітрексед 3 мг/м2 більше 1 год, оксаліплатин 130 мг/м2 більше 2 год кожні 3 тиж та групу стандарту лікування у співвідношенні 2:1. Після включення 27 пацієнтів дослідження було припинено у зв’язку з недостатністю фінансування, проте проміжні результати продемонстрували перевагу та безпеку дублета при хіміорезистентному мКРР: так, медіана БРВ становила 6,7 міс (95% ДІ 3,9–7,2) у групі НАІ проти 2,2 міс (95% ДI 1,2–4,3) у групі стандарту лікування (коефіцієнт небезпеки 0,32 (95% ДI 0,14–0,76), p=0,01). Медіана ЗВ не відрізнялася у двох групах: 11,2 міс (95% ДI 4,8–17,6) та 11,9 міс (95% ДI 2,8–14,3) для НАІ та стандарту лікування відповідно (коефіцієнт небезпеки 0,86 (95% ДI 0,36–2,04), p=0,73) [49].
Таргетна терапія та НАІ
На сьогодні наявні обмежені дані щодо внутрішньоартеріального введення таргетних препаратів при мКРР. Однією зі спроб дослідити можливі переваги анти-VEGF-терапії в режимі НАІ стало клінічне випробування ІІ фази BEVIAC, у рамках якого пацієнтам з ПМКРР в якості 2-ї лінії терапії вводили бевацизумаб у дозі 7,5 мг/кг внутрішньоартеріально, аби перевірити гіпотезу, що антиангіогенний ефект може забезпечити додаткові переваги при регіонарному введенні. Окрім анти-VEGF, протокол дослідження передбачав системну ХТ за схемами XELOX або XELIRI (залежно від 1-ї лінії) у стандартних дозуваннях. Бевацизумаб вводили в 1-й день кожного 21-денного циклу перед ХТ. Проте результати, отримані від 10 пацієнтів, не продемонстрували значної переваги такого підходу за ЧОВ, БРВ та ЗВ порівняно із середніми значеннями цих показників для стандартного введення аналогічних комбінацій препаратів [50].
Дещо більше інформації отримано щодо додавання внутрішньовенної таргетної терапії, зокрема бевацизумабу, до НАІ з використанням цитотоксичних агентів. У наявних публікаціях на цю тему домінує думка, що поєднання вказаного препарату зі схемами на основі фторпіримідинів потенційно підвищує токсичність. Так, дослідження S. Sadahiro та співавторів, у якому внутрішньовенне введення бевацизумабу було включено до схеми із застосуванням НАІ 5-ФУ та лейковорину з подальшим внутрішньовенним застосуванням препаратів за схемою FOLFOX4, продемонструвало збільшення частоти побічних ефектів. У 8 з 14 пацієнтів, які отримували вищезазначені лікарські засоби, спостерігалися тромбози, що стало причиною припинення НАІ, а також погіршувалося загоєння ран у порівнянні з групою з 16 пацієнтів НАІ 5-ФУ та лейковорину + внутрішньовенне введення препаратів за схемою FOLFOX4. На думку дослідників, не слід рекомендувати застосування бевацизумабу в одній схемі з внутрішньоартеріальними препаратами [51]. За результатами іншого дослідження ІІ фази, описаного N. Kemeny та співавторами, також повідомлялося про збільшення частоти побічних ефектів, а саме — біліарної токсичності при додаванні бевацизумабу до НАІ FUDR/Dex та системної терапії FOLFOX/FOLFIRI (залежно від 1-ї лінії) після резекції печінки. При цьому мети дослідження — збільшення БРВ — не було досягнуто, а 4-річна виживаність у групах з бевацизумабом та без нього становила відповідно 81 та 85% [52].
При цьому в дослідженні поєднання внутрішньовенного введення бевацизумабу з НАІ з використанням оксаліплатину та пероральним капецитабіном E. Fountzilas та співавторів подібна залежність не простежувалася. Згідно зі схемою бевацизумаб вводили внутрішньовенно в дозі 10 мг/кг в 1-й день, HAI з оксаліплатином 140 мг/м2 в 1-й день та капецитабін 750 мг/м2 двічі на добу в 1–14-й дні 21-денного циклу. Терапія добре переносилася та демонструвала сприятливі результати у пацієнтів з печінковими метастазами різних видів раку, здебільшого саме КРР [53].
Невелика кількість досліджень з використанням бевацизумабу та розрізнені дані не дозволяють об’єктивно оцінити, чи дійсно внутрішньоартеріальне введення цього агента підвищує ризик виникнення побічних ефектів, або ж несприятливі явища є реалізацією загальновідомих побічних ефектів бевацизумабу.
Клінічний випадок
З метою ілюстрації можливостей НАІ в клінічній практиці лікаря доцільним буде навести випадок з клінічної практики Національного інституту раку.
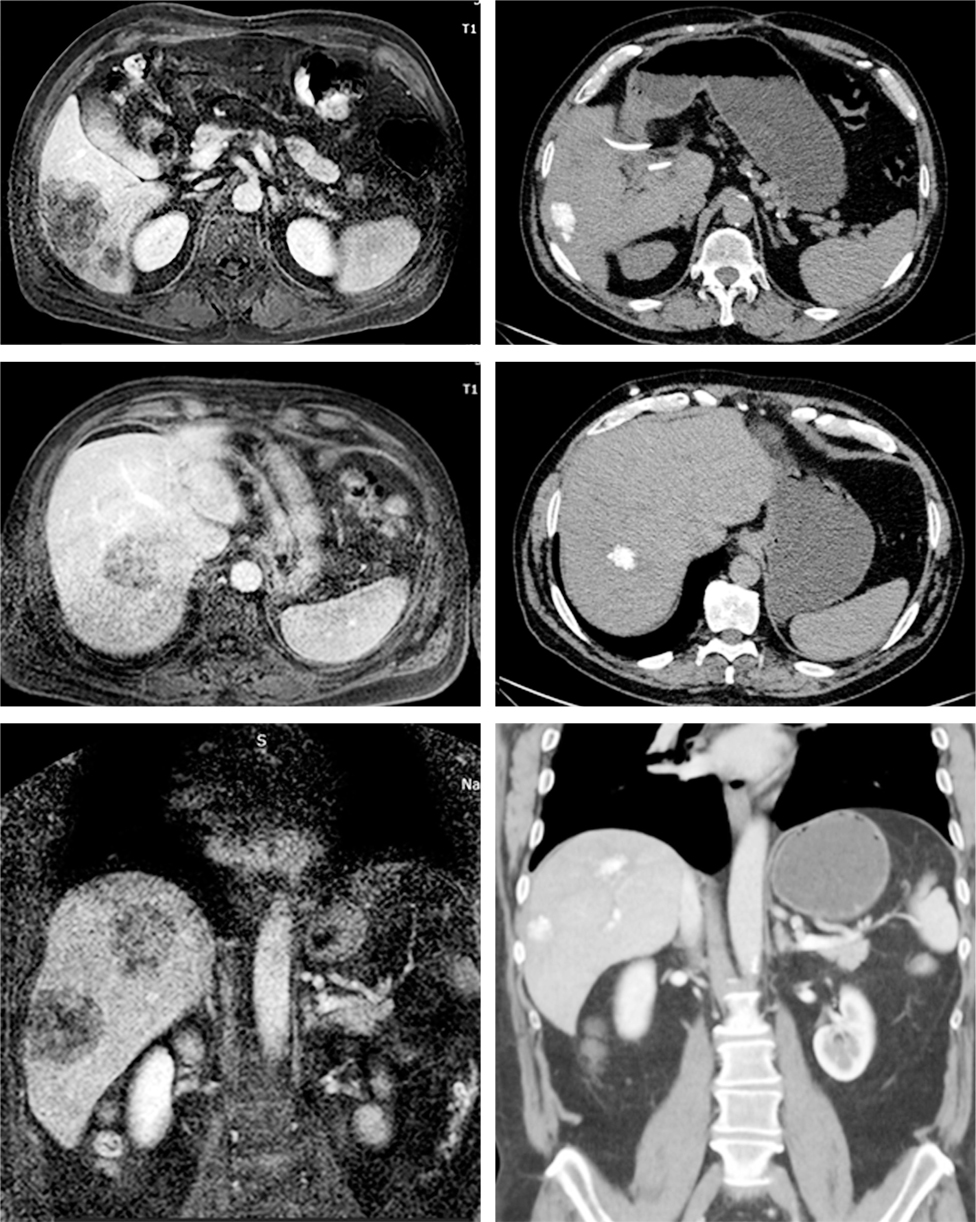
Пацієнт Ю. — чоловік, 1959 р. н. (57 років на момент звернення), звернувся до Національного інституту раку в лютому 2018 р. з метою подальшого лікування. Надав наступні дані анамнезу. У червні 2016 р. пацієнту було виконано резекцію сигмоподібної кишки, післяопераційний патологогістологічний висновок: помірно диференційована аденокарцинома. Пацієнт отримав 7 курсів ад’ювантної монохіміотерапії капецитабіном. У березні 2017 р. на плановому КТ prol. morbi: mts ad pulm dex.S3. У тому ж місяці виконано часткову резекцію S3 правої легені. Проведено 2 курси паліативної поліхіміотерапії із застосуванням іринотекану + оксаліплатину. У лютому 2018 р. на плановому КТ prol.morbi: mts ad hepar S6, 7, 8, 5. У Національному інституті раку пацієнту було встановлено діагноз: Са сигмоподібної кишки рT3pN1M0, prol. morbi: mts ad pulm dex.S3, стан після резекції правої легені, prol. morbi: mts ad hepar S6, 7, 8, 5, клінічна група ІІ. Заплановано хірургічне лікування з приводу печінкових метастазів: резекцію печінки. Проте в ході операції було виявлено, що залишковий обсяг печінки становитиме <30%, що свідчить про неоперабельність випадку. Пацієнту було виконано холецистектомію, катетеризовано загальну печінкову артерію та встановлено порт. З березня до липня 2018 р. він отримав 4 повних курси НАІ FOLFOX та 1 незавершений (зупинено у зв’язку з кардіотоксичністю). У листопаді 2018 р. було виконано комп’ютерну томографію органів грудної, черевної порожнини та малого таза з внутрішньовенним контрастуванням та магнітно-резонансну томографію органів черевної порожнини з внутрішньовенним контрастуванням. За сукупними даними ефект від лікування було оцінено як часткову відповідь, відмічено ознаки вираженого постлікувального патоморфозу метастатичних вогнищ у печінці. З огляду на це мультидисциплінарним консиліумом було повторно розглянуто можливість проведення хірургічного втручання на печінці та оцінено ситуацію як операбельну. У грудні 2018 р. пацієнту було виконано паренхімозберігальну резекцію печінки S6/7, радіочастотну термічну абляцію S8. Післяопераційний патологогістологічний висновок: перипортальна інфільтрація, склероз, кальцинати, вогнищеві некрози.
Цей випадок наглядно демонструє можливість НАІ в переведенні неоперабельних ПМКРР в операбельні навіть після декількох попередніх ліній ХТ. Порівняльні знімки КТ пацієнта наведено на рис. 2.
Висновки
Внутрішньоартеріальна ХТ при ПМКРР є нестандартною методикою, що може використовуватися далеко не в усіх пацієнтів, проте за потрібного поєднання показань та відсутності протипоказань вона може стати рятівним варіантом для хворих, які вичерпали загальнорекомендовані лінії терапії чи є резистентними до системної ХТ. Схеми із застосуванням фторпіримідинів та оксаліплатину внутрішньоартеріально (окремо або в поєднаннях) продемонстрували позитивні результати у клінічних дослідженнях І–ІІ фаз. Внутрішньоартеріальне введення іринотекану не мало переваг порівняно з внутрішньовенним. Внутрішньоартеріальне застосування бевацизумабу в рамках наявних досліджень не продемонструвало переваг у разі регіонарного введення, до того ж має розрізнені дані щодо безпеки: за описами деяких дослідників, підвищує ризик побічних явищ (у разі комбінації з фторпіримідинами, що застосовуються внутрішньоартеріально), а за даними інших — не впливає на їх частоту (в комбінації з оксаліплатином, введеним внутрішньоартеріально), тож, можливість та доцільність використання цього препарату у якості печінкової інфузії є неоднозначними. Подальший розвиток цього напряму із залученням нових препаратів та комбінуванням відомих раніше має клінічне значення для лікарів-онкологів України та світу.
Список використаної літератури
1. WCRF International. Colorectal cancer statistics. Retrieved from https://www.wcrf.org/dietandcancer/colorectal-cancer-statistics.
2. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., Гулак, Л. О., & Куценко, Л. Б. (2022). Рак в Україні, 2020–2021. Захворюваність, смертність, показники діяльності онкологічної служби. А. Ф. Шипко (Ред.), Бюлетень Національного канцер-реєстру України, 23, 129.
3. Siegel, R., Naishadham, D., & Jemal, A. (2012). Cancer statistics, 2012. A Cancer Journal for Clinicians, 62(1), 10–29. doi.org/10.3322/caac.20138.
4. Sanoff, H. K., Sargent, D. J., Campbell, M. E., Morton, R. F., Fuchs, C. S., Ramanathan, R. K., … Goldberg, R. M. (2008). Five-year data and prognostic factor analysis of oxaliplatin and irinotecan combinations for advanced colorectal cancer: N9741. Journal of Clinical Oncology, 26(35), 5721–5727. doi.org/10.1200/JCO.2008.17.7147.
5. Fong, Y., Cohen, A. M., Fortner, J. G., Enker, W. E., Turnbull, A. D., Coit, D. G., … Brennan, M. F. (1997). Liver resection for colorectal metastases. Journal of Clinical Oncology, 15(3), 938–946. doi.org/10.1200/JCO.1997.15.3.938.
6. Kemeny, N., Jarnagin, W., Paty, P., Gönen, M., Schwartz, L., Morse, M., … Fong, Y. (2005). Phase I trial of systemic oxaliplatin combination chemotherapy with hepatic arterial infusion in patients with unresectable liver metastases from colorectal cancer. Journal of Clinical Oncology, 23(22), 4888–4896. doi.org/10.1200/JCO.2005.07.100.
7. Breedis, C., & Young, G. (1954). The blood supply of neoplasms in the liver. The American Journal of Pathology, 30(5), 969–977.
8. Ensminger, W. D., & Gyves, J. W. (1983). Clinical pharmacology of hepatic arterial chemotherapy. Seminars in Oncology, 10(2), 176–182.
9. Adam, R., De Gramont, A., Figueras, J., Guthrie, A., Kokudo, N., Kunstlinger, F., … Vauthey, J.-N.s (2012). The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus. The Oncologist, 17(10), 1225–1239. doi.org/10.1634/theoncologist.2012-0121.
10. Groot Koerkamp, B., Sadot, E., Kemeny, N. E., Gönen, M., Leal, J. N., Allen, P. J., … D’Angelica, M. I. (2017). Perioperative Hepatic Arterial Infusion Pump Chemotherapy Is Associated With Longer Survival After Resection of Colorectal Liver Metastases: A Propensity Score Analysis. Journal of Clinical Oncology, 35(17), 1938–1944. doi.org/10.1200/JCO.2016.71.8346.
11. NCCN Guidelines. Colon Cancer. Version 3.2021 — September 10, 2021.
12. Ammori, J. B., & Kemeny, N. E. (2010). Regional hepatic chemotherapies in treatment of colorectal cancer metastases to the liver. Seminars in Oncology, 37(2), 139–148. doi.org/10.1053/j.seminoncol.2010.03.003.
13. Ensminger, W., Niederhuber, J., Dakhil, S., Thrall, J., & Wheeler, R. (1981). Totally implanted drug delivery system for hepatic arterial chemotherapy. Cancer Treatment Reports, 65(5–6), 393–400.
14. Kemeny, N., & Fong, Y. (1997). Treatment of liver metastases. In J. F. Holland, E. Frei, R. C. Jr. Bast, D. W. Kufe, D. L. Morton, R. R. Weichselbaum (Ed.), Cancer Medicine (ed. 4). (pp 1939–1953). Baltimore: Williams & Wilkins.
15. Thiels, C. A., & D’Angelica, M. I. (2020). Hepatic artery infusion pumps. Journal of Surgical Oncology, 122(1), 70–77. doi.org/10.1002/jso.25913.
16. Zervoudakis, A., Boucher, T., & Kemeny, N. E. (2017). Treatment Options in Colorectal Liver Metastases: Hepatic Arterial Infusion. Visceral Medicine, 33(1), 47–53. doi.org/10.1159/000454693.
17. Kemeny, M. M., Battifora, H., Blayney, D. W., Cecchi, G., Goldberg, D. A., Leong, L. A., … Terz, J. J. (1985). Sclerosing cholangitis after continuous hepatic artery infusion of FUDR. Annals of Surgery, 202(2), 176–181. doi.org/10.1097/00000658-198508000-00007.
18. Melendez, F. D. H., & Kemeny, N. (2008). Clinical management of patients with colorectal liver metastasis using hepatic arterial infusion. In J.-F.H. Geschwind, M.C. Soulen (Ed.), Interventional Oncology: Principles and Practice (pp. 249–263). New York, NY: Cambridge University Press.
19. Li, X., Shi, L., Wu, J., Ji, M., Zhao, J., Qiang, W., … Wu, C. (2016). First-line treatment with hepatic arterial infusion plus capecitabine vs capecitabine alone for elderly patients with unresectable colorectal liver metastases. Cancer Biology & Therapy, 17(1), 14–19. doi.org/10.1080/15384047.2015.1108487.
20. Zervoudakis, A., Boucher, T., & Kemeny, N. E. (2017). Treatment Options in Colorectal Liver Metastases: Hepatic Arterial Infusion. Visceral Medicine, 33(1), 47–53. doi.org/10.1159/000454693.
21. Kemeny, N., Seiter, K., Niedzwiecki, D., Chapman, D., Sigurdson, E., Cohen, A., … Murray, P. (1992). A randomized trial of intrahepatic infusion of fluorodeoxyuridine with dexamethasone versus fluorodeoxyuridine alone in the treatment of metastatic colorectal cancer. Cancer, 69, 327–334.
22. Stagg, R. J., Venook, A. P., Chase, J. L., Lewis, B. J., Warren, R. S., Roh, M., … Hohn, D. C. (1991). Alternating hepatic intra-arterial floxuridine and fluorouracil: a less toxic regimen for treatment of liver metastases from colorectal cancer. Journal of the National Cancer Institute, 83(6), 423–428. doi.org/10.1093/jnci/83.6.423.
23. Davidson, B. S., Izzo, F., Chase, J. L., DuBrow, R. A., Patt, Y., Hohn, D. C., & Curley, S. A. (1996). Alternating floxuridine and 5-fluorouracil hepatic arterial chemotherapy for colorectal liver metastases minimizes biliary toxicity. American Journal of Surgery, 172(3), 244–247. doi.org/10.1016/s0002-9610(96)00159-6.
24. Bolton, J. S., O’Connell, M. J., Mahoney, M. R., Farr, G. H., Fitch, T. R., Maples, W. J., … Alberts, S. R. (2012). Hepatic arterial infusion and systemic chemotherapy after multiple metastasectomy in patients with colorectal carcinoma metastatic to the liver: a North Central Cancer Treatment Group (NCCTG) phase II study, 92-46-52. Clinical Colorectal Cancer, 11(1), 31–37. doi.org/10.1016/j.clcc.2011.03.029.
25. Kemeny, N. E., Melendez, F. D., Capanu, M., Paty, P. B., Fong, Y., Schwartz, L. H., … D’Angelica, M. (2009). Conversion to resectability using hepatic artery infusion plus systemic chemotherapy for the treatment of unresectable liver metastases from colorectal carcinoma. Journal of Clinical Oncology, 27(21), 3465–3471. doi.org/10.1200/JCO.2008.20.1301.
26. DʼAngelica, M. I., Correa-Gallego, C., Paty, P. B., Cercek, A., Gewirtz, A. N., Chou, J. F., … Kemeny, N. (2015). Phase II trial of hepatic artery infusional and systemic chemotherapy for patients with unresectable hepatic metastases from colorectal cancer: conversion to resection and long-term outcomes. Annals of Surgery, 261(2), 353–360. doi.org/10.1097/SLA.0000000000000614.
27. Kemeny, N., Jarnagin, W., Gonen, M., Stockman, J., Blumgart, L., Sperber, D., … Fong, Y. (2003). Phase I/II study of hepatic arterial therapy with floxuridine and dexamethasone in combination with intravenous irinotecan as adjuvant treatment after resection of hepatic metastases from colorectal cancer. Journal of Clinical Oncology, 21(17), 3303–3309. doi.org/10.1200/JCO.2003.03.142.
28. Li, X., Shi, L., Wu, J., Ji, M., Zhao, J., Qiang, W., … Wu, C. (2016). First-line treatment with hepatic arterial infusion plus capecitabine vs capecitabine alone for elderly patients with unresectable colorectal liver metastases. Cancer Biology & Therapy, 17(1), 14–19. doi.org/10.1080/15384047.2015.1108487.
29. Lorenz, M., & Müller, H. H. (2000). Randomized, multicenter trial of fluorouracil plus leucovorin administered either via hepatic arterial or intravenous infusion versus fluorodeoxyuridine administered via hepatic arterial infusion in patients with nonresectable liver metastases from colorectal carcinoma. Journal of Clinical Oncology, 18(2), 243–254. doi.org/10.1200/JCO.2000.18.2.243.
30. Guthoff, I., Lotspeich, E., Fester, C., Wallin, I., Schatz, M., Ehrsson, H., & Kornmann, M. (2003). Hepatic artery infusion using oxaliplatin in combination with 5-fluorouracil, folinic acid and mitomycin C: oxaliplatin pharmacokinetics and feasibility. Anticancer Research, 23(6D), 5203–5208.
31. Ranieri, G., Laforgia, M., Nardulli, P., Ferraiuolo, S., Molinari, P., Marech, I., & Gadaleta, C. D. (2019). Oxaliplatin-Based Intra-arterial Chemotherapy in Colo-Rectal Cancer Liver Metastases: A Review from Pharmacology to Clinical Application. Cancers, 11(2), 141. doi.org/10.3390/cancers11020141.
32. Kern, W., Beckert, B., Lang, N., Stemmler, J., Beykirch, M., Stein, J., … Schalhorn, A. (2001). Phase I and pharmacokinetic study of hepatic arterial infusion with oxaliplatin in combination with folinic acid and 5-fluorouracil in patients with hepatic metastases from colorectal cancer. Annals of Oncology, 12, 599–603. doi: 10.1023/A:1011186708754.
33. Mancuso, A., Giuliani, R., Accettura, C., Palma, M., D’Auria, G., Cecere, F., … Cortesi, E. (2003). Hepatic arterial continuous infusion (HACI) of oxaliplatin in patients with unresectable liver metastases from colorectal cancer. Anticancer Research, 23, 1917–1922.
34. Fiorentini, G., Rossi, S., Dentico, P., Meucci, F., Bonechi, F., Bernardeschi, P., … DeSimone, M. (2004). Oxaliplatin hepatic arterial infusion chemotherapy for hepatic metastases from colorectal cancer: A phase I-II clinical study. Anticancer Research, 24, 2093–2096.
35. Ducreux, M., Ychou, M., Laplanche, A., Gamelin, E., Lasser, P., Husseini, F., … Boige, V. (2002). Hepatic arterial oxaliplatin infusion plus intravenous chemotherapy in colorectal cancer with inoperable hepatic metastases: A trial of the gastrointestinal group of the Federation Nationale des Centres de Lutte Contre le Cancer. Journal of Clinical Oncology, 23, 4881–4887. doi: 10.1200/JCO.2005.05.120.
36. Boige, V., Malka, D., Elias, D., Castaing, M., De Baere, T., Goere, D., … Ducreux, M. (2007). Hepatic arterial infusion of oxaliplatin and intravenous LV 5FU2 in unresectable liver metastases from colorectal cancer after systemic chemotherapy failure. Annals of Surgical Oncology, 15, 219–226. doi: 10.1245/s10434-007-9581-7.
37. Tsimberidou, A. M., Fu, S., Ng, C., Lim, J. A., Wen, S., Hong, D., Wheler, J., … Wallace M. (2010). A phase 1 study of hepatic arterial infusion of oxaliplatin in combination with systemic 5-fluorouracil, leucovorin, and bevacizumab in patients with advanced solid tumors metastatic to the liver. Cancer, 116, 4086–4094. doi: 10.1002/cncr.25277.
38. Tsimberidou, A. M., Leick, M. B., Lim, J., Fu, S., Wheler, J., Piha-Paul, S. A., … Kurzrock, R. (2013). Dose-finding study of hepatic arterial infusion of oxaliplatin-based treatment in patients with advanced solid tumors metastatic to the liver. Cancer Chemotherapy and Pharmacology, 71, 389–397. doi: 10.1007/s00280-012-2014-8.
39. Allard, M. A., Sebagh, M., Baillie, G., Lemoine, A., Dartigues, P., Faitot, F., … Sa Cunha, A. (2015). Comparison of complete pathologic response and hepatic injuries between hepatic arterial infusion and systemic administration of oxaliplatin in patients with colorectal liver metastases. Annals of Surgical Oncology, 22, 1925–1932. doi: 10.1245/s10434-014-4272-7.
40. Volovat, S. R., Volovat, C., Negru, S. M., Danciu, M., & Scripcariu, V. (2016). The efficacy and safety of hepatic arterial infusion of oxaliplatin plus intravenous irinotecan, leucovorin and fluorouracil in colorectal cancer with inoperable hepatic metastasis. Chemotherapy, 28, 235–241. doi: 10.1179/1973947815Y.0000000042.
41. Lévi, F. A., Boige, V., Hebbar, M., Smith, D., Lepère, C., Focan, C., … Adam, R. (2016). Conversion to resection of liver metastases from colorectal cancer with hepatic artery infusion of combined chemotherapy and systemic cetuximab in multicenter trial OPTILIV. Annals of Oncology, 27(2), 267–274. doi.org/10.1093/annonc/mdv548.
42. Lim, A., LeSourd, S., Senellart, H., Luet, D., Douane, F., Perret, C., … Touchefeu, Y. (2017). Hepatic arterial infusion chemotherapy for unresectable liver metastases of colorectal cancer: A multicenter retrospective study. Clinical Colorectal Cancer, 16, 308–315. doi: 10.1016/j.clcc.2017.03.003.
43. Sato, Y., Inaba, Y., Ura, T., Nishiofuku, H., Yamaura, H., Kato, M., … Muro, K. (2018). Outcomes of a Phase I/II trial of hepatic arterial infusion of oxaliplatin combined with intravenous 5-fluorouracil and I-leucovorin in patients with unresectable liver metastases from colorectal cancer after systemic chemotherapy failure. Journal of Gastrointestinal Cancer, 49(2), 132–137. doi: 10.1007/s12029-016-9915-4.
44. van Riel, J. M. G. H., van Groeningen, C. J., de Greve, J., Gruia, G., Pinedo, H. M., & Giaccone, G. (2004). Continuous infusion of hepatic arterial irinotecan in pretreated patients with colorectal cancer metastatic to the liver. Annals of Oncology, 15(1), 59–63. doi.org/10.1093/annonc/mdh022.
45. Kwan, J., & Pua, U. (2021). Review of Intra-Arterial Therapies for Colorectal Cancer Liver Metastasis. Cancers, 13(6), 1371. doi.org/10.3390/cancers13061371.
46. Mancini, R., Tedesco, M., Garufi, C., Filippini, A., Arcieri, S., Caterino, M., … Cosimelli, M. (2003). Hepatic arterial infusion (HAI) of cisplatin and systemic fluorouracil in the treatment of unresectable colorectal liver metastases. Anticancer Research, 23(2C), 1837–1841.
47. Chen, Y., Wang, X., Yan, Z., Wang, J., Luo, J., & Liu, Q. (2012). Hepatic arterial infusion with irinotecan, oxaliplatin, and floxuridine plus systemic chemotherapy as first-line treatment of unresectable liver metastases from colorectal cancer. Onkologie, 35(9), 480–484. doi.org/10.1159/000341825.
48. Melichar, B., Voboril, Z., Krajina, A., Malírová, E., Weiner, P., Nová, M., … Dvorák, J. (2012). Hepatic arterial infusion of irinotecan, 5-Fluorouracil and leucovorin in patients with liver metastases from colorectal carcinoma. Anticancer Research, 32(12), 5487–5493.
49. Ghiringhelli, F., Vincent, J., Bengrine, L., Borg, C., Jouve, J. L., Loffroy, R., … Bertaut, A. (2019). Hepatic arterial chemotherapy with raltitrexed and oxaliplatin versus standard chemotherapy in unresectable liver metastases from colorectal cancer after conventional chemotherapy failure (HEARTO): a randomized phase-II study. Journal of Cancer Research and Clinical Oncology, 145(9), 2357–2363. doi.org/10.1007/s00432-019-02970-8.
50. Ducreux, M., Glehen, O., Tergemina-Clain, G., Smith, D. M., Lacas, B., Boige, V., … Guimbaud, R. (2016). Phase 2 of intra-arterial hepatic (IAH) bevacizumab with systemic chemotherapy (CT) in second line treatment of liver metastases of colorectal cancer (LMCRC). Journal of Clinical Oncology, 34(15), e15003–e15003. doi.org/10.1093/annonc/mdw370.38.
51. Sadahiro, S., Suzuki, T., Maeda, Y., Tanaka, A., Okada, K., … Kamijo, A. (2011). Increased incidence of adverse events after concomitant hepatic arterial infusion plus systemic chemotherapy and bevacizumab for colorectal cancer with liver metastasis. Journal of Clinical Oncology, 29(4), 591.
52. Kemeny, N. E., Jarnagin, W. R., Capanu, M., Fong, Y., Gewirtz, A. N., Dematteo, R. P., & D’Angelica, M. I. (2011). Randomized phase II trial of adjuvant hepatic arterial infusion and systemic chemotherapy with or without bevacizumab in patients with resected hepatic metastases from colorectal cancer. Journal of Clinical Oncology, 29(7), 884–889. doi.org/10.1200/JCO.2010.32.5977.
53. Fountzilas, E., Krishnan, E., Janku, F., Fu, S., Karp, D. D., Naing, A., … Tsimberidou, A. M. (2018). A phase I clinical trial of hepatic arterial infusion of oxaliplatin and oral capecitabine, with or without intravenous bevacizumab, in patients with advanced cancer and predominant liver involvement. Cancer Chemotherapy and Pharmacology, 82(5), 877–885. doi.org/10.1007/s00280-018-3680-y.
Адреса для листування:
Черченко Катерина Дмитрівна
03022, м. Київ, вул. Ломоносова, 33/43
Національний інститут раку
Е-mail: katerynacherchenko.nir@gmail.com
Сorrespondence:
Kateryna Cherchenko
33/43 Lomonosova Str., Kyiv, 03022
National Cancer Institute
E-mail: katerynacherchenko.nir@gmail.com














Leave a comment