Рак шлунка з імплантаційними метастазами: сучасні стратегії комбінованого лікування (огляд медичної літератури та результати власних досліджень)
Ярема Р.Р.1, Огорчак М.А.2, Гиря П.І.2, Ковальчук Ю.Я.2, Сафіян В.І.2, Рілінг О.П.2, Рау Б.3
- 1Львівський національний медичний університет ім. Данила Галицького, Україна
- 2Львівський онкологічний регіональний лікувально-діагностичний центр, Україна
- 3Університетська клініка Шаріте, кафедра хірургії, Берлін, Німеччина
Резюме. Рак шлунка з імплантаційними метастазами до сьогодні залишається однією із найскладніших проблем клінічної онкології. У таких хворих традиційно відмічають гіршу відповідь на паліативну хіміо-/таргетну/імунну терапію порівняно з випадками гематогенного чи лімфогенного метастазування. Метою цього дослідження був аналіз актуальних даних медичної літератури щодо сучасних терапевтичних стратегій лікування таких хворих, зокрема сучасних схем системної терапії, паліативних та циторедуктивних втручань у межах концепції конверсійної хірургії, а також методів локорегіонарного впливу, зокрема результатів власних досліджень. Диференційований підхід з урахуванням об’єму метастатичного ураження та сегрегація хворих з олігометастатичним характером патології дають можливість оптимізації комбінованого лікування хворих цієї складної категорії та досягнення тривалих термінів виживаності у високоселективній групі.
Одержано 26.02.2024
Прийнято до друку 15.03.2024
DOI: 10.32471/clinicaloncology.2663-466X.53-1.31940
Вступ
Одним із найчастіших шляхів метастазування раку шлунка є імплантаційна дисемінація по очеревині. Згідно з даними європейських національних реєстрів імплантаційні метастази поряд із гематогенними метастазами в печінку посідають чільні місця у структурі синхронного метастазування раку шлунка: перитонеальні імпланти виявляють у 14% хворих при первинній діагностиці, що становить 32–35% серед усіх метастатичних випадків [1, 2]. У хворих без радіологічних ознак метастатичного поширення, що потенційно плануються на радикальне лікування, при стадіювальній лапароскопії перитонеальні метастази виявляють у 10–20% випадків [3–5]. Більше 50% пацієнтів після радикального хірургічного лікування гинуть внаслідок інтраперитонеального рецидиву, що є найчастішим шляхом метахронного метастазування раку шлунка [6]. Імплантаційний шлях характеризується найгіршим прогнозом з-поміж інших шляхів метастазування — медіана виживаності таких хворих становить лише кілька місяців [1, 2].
Єдиною терапевтичною опцією в якості стандартного лікування для таких хворих у міжнародних клінічних рекомендаціях пропонується лише системна паліативна хіміо-/таргетна/імунна терапія [7–9], яка проте характеризується низьким рівнем виживаності [10, 11]. Ефективність комбінації імунотерапії з хіміотерапією є вірогідно нижчою у хворих з імплантаційними метастазами порівняно з хворими з іншими метастазами [12]. Отже, незважаючи на успіхи системного лікування раку шлунка останніх років, хворі з імплантаційними метастазами залишаються складним викликом в онкологічній клінічній практиці.
Рак шлунка з позитивними цитологічними змивами з очеревини
У хворих з cT3/4a/4b cN0/+ стадіями раку шлунка за умови відсутніх макроскопових ознак імплантаційного метастазування при стадіювальній лапароскопії позитивні результати цитологічних досліджень змивів з очеревини (CY1 згідно з класифікацією Японської асоціації з вивчення раку шлунка (Japanese gastric cancer association — JGCA)) отримують у 13,2% випадків [4]. Хворі з CY1 характеризуються вірогідно несприятливішим прогнозом порівняно із групою CY0 внаслідок підвищеного рівня інтраперитонеальних рецидивів [13]. Позитивний результат цитологічного дослідження вірогідно асоціюється зі зниженням загальної виживаності для таких хворих (коефіцієнт ризику (HR) 3,46; 95% довірчий інтервал (ДI) 2,77–4,31; p<0,0001) [14]. Тому виявлення вільних пухлинних клітин у змивах з очеревини при раку шлунка навіть за умови відсутності макроскопових імплантів на очеревині розглядається сьогодні в якості доклінічної стадії метастатичного процесу, що визначає швидкий інтраперитонеальний рецидив та несприятливий прогноз. Відтак в останніх версіях TNM-класифікації CY1 безапеляційно віднесено до категорії M1 [15].
Спеціального стандарту лікування хворих з CY1 в західних (Європейської спілки медичних онкологів (European Society for Medical Oncology — ESMO), 2022 р., Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN), 2023 р.) та східних (JGCA 2021 р.) рекомендаціях немає. Таким хворим показаний підхід, ідентичний стандарту лікування метастатичного раку шлунка або включення їх у клінічні дослідження [8, 9, 16].
Сучасні стратегії комбінованого лікування. Системна паліативна хіміотерапія, таргетна терапія, імунотерапія
Кокранівський метааналіз підтвердив статистично вірогідне зростання виживаності хворих на дисемінований рак шлунка при застосуванні системної паліативної хіміотерапії порівняно із симптоматичним лікуванням [17]. Тому сучасним міжнародним стандартом лікування таких хворих є системна паліативна хіміотерапія [8, 9, 16], яка проте характеризується лімітованою ефективністю, адже незначно підвищує медіану виживаності при імплантаційних метастазах — до 7,4–7,8 міс [10, 11]. Це може бути наслідком слабкого проникнення хіміотерапевтичних агентів у вільну черевну порожнину через наявність феномену перитонеоплазматичного бар’єра та недостатній кровотік у структурах тканин очеревини, а також наслідком наявності гіпоксичних хіміорезистентних клонів пухлинних клітин із низьким апоптичним потенціалом [18].
Застосування анти-HER2-терапії, зокрема трастузумабу, є обмеженим у хворих на рак шлунка через низький рівень експресії згаданого рецептора, що зустрічається лише у близько 10–20% таких хворих. Окрім того, переважну більшість випадків експресії HER2 становлять випадки інтестинального типу раку шлунка, який вкрай рідко метастазує імплантаційним шляхом [19].
Прийом ніволумабу в комбінації з хіміотерапією SOX/CAPOX при поширеному HER2-негативному раку шлунка у хворих азійського походження в межах рандомізованого дослідження ATTRACTION-4 сприяв зростанню безрецидивної при однаковому рівні загальної виживаності. Відмічено майже вдвічі нижчий рівень медіани загальної виживаності у хворих з перитонеальними метастазами порівняно з хворими із метастазами іншого характеру в групі імунотерапії + хіміотерапії — 13,67 міс проти 25,07 міс відповідно (р=0,0031) [12].
Корейськими онкологами зафіксовано зростання виживаності у хворих з позитивними цитологічними змивами з очеревини (CY1) при додаванні до D2-гастректомії післяопераційної системної хіміотерапії (цисплатин/S1, XELOX, FOLFOX) порівняно із ізольованим застосуванням хірургічного лікування: медіана безрецидивної виживаності становила 11,63 та 6,98 міс (p <0,001) та медіана загальної виживаності — 25,50 та 12,11 міс (p <0,001) відповідно [20]. Японськими онкологами виявлено однакову виживаність хворих з CY1 при використанні неоад’ювантної хіміотерапії чи ініціальної хірургії за умови проведення в обох групах післяопераційної хіміотерапії. Тільки в підгрупі конверсії змивів з очеревини з CY1 до CY0 доопераційна хіміотерапія сприяла зростанню рівня виживаності. Таку конверсію зафіксовано у 38% хворих [21]. У результатах метааналізу також підтверджено вірогідне підвищення загальної виживаності хворих з конверсією змивів з очеревини до негативних після неоад’ювантної хіміотерапії (HR 0,42; 95% ДI 0,31–0,57; р <0,0001) [14]. Однак у медичній літературі практично відсутні публікації щодо ефективності сучасних дво- та трикомпонентних схем системної хіміотерапії в західній популяції хворих на CY1 рак шлунка [14, 22].
Паліативні операції. Циторедуктивні операції як складова частина концепції конверсійної хірургії
У 2016 р. японськими та корейськими дослідниками в межах рандомізованого дослідження ІІІ фази REGATТA встановлено, що паліативна гастректомія без видалення віддалених метастазів у комбінації із системною паліативною хіміотерапією (цисплатин/S1) не забезпечила вірогідного зростання виживаності хворих на олігометастатичний рак шлунка порівняно із групою системної хіміотерапії [23].
Однак пізніше в німецькому проспективному дослідженні AIO-FLOT3 [24] повідомлено про досягнення медіани загальної виживаності 31,3 міс (95% ДІ 18,9 — верхній рівень не досягнуто) у хворих на олігометастатичний рак шлунка при проведенні гастректомії, проте з видаленням віддалених метастазів після індукційної хіміотерапії FLOT. Дослідження однак було нерандомізованим та містило в загальній структурі тільки 6,7% пацієнтів з імплантаційними метастазами.
У 2023 р. китайськими онкологами опубліковано результати проспективного нерандомізованого дослідження Neo-REGATTA, в якому хворі з відсутністю прогресування захворювання після 4 циклів індукційної хіміотерапії DOS отримували або хірургічне лікування з видаленням віддалених метастазів з наступною ад’ювантною хіміотерапією DOS, або тільки системну хіміотерапію. Повідомлено про досягнення вірогідного зростання рівня виживаності у хворих при проведенні агресивного комбінованого лікування, після 30-місячного спостереження медіани загальної виживаності не досягнуто. Однак частка хворих з імплантаційними метастазами в дослідній групі становила лише 20% [25].
Відтак, враховуючи відсутність однозначних результатів проспективних досліджень, паліативна гастректомія для хворих на метастатичний рак шлунка не є регламентованою сьогодні ні європейськими [7], ні північноамериканськими [8], ані також східними клінічними рекомендаціями [16]. Лише в європейських рекомендаціях ESMO–2022 [9] зазначено, що «гастректомія з видаленням метастазів не може бути рекомендованою в якості загального підходу, однак може розглядатися як індивідуальна опція для високоселективної групи хворих з олігометастатичною хворобою та наявністю відповіді на хіміотерапію». Така концепція суб-/тотальної гастректомії з регіонарною лімфодисекцією та видаленням обмежених віддалених метастазів після індукції неоад’ювантною хіміотерапією окреслюється терміном «конверсійна хірургія». Цей термін запропонований для раку шлунка японським хірургом K. Yoshida зі співавт. [26] у 2016 р. та є справедливим також для перитонеальних метастазів лімітованого характеру. Згідно з оригінальним визначенням авторів, конверсійна хірургія раку шлунка «передбачає R0 хірургічну резекцію після хіміотерапії для пухлин, що первинно були погранично або абсолютно нерезектабельні через технічні та/або онкологічні причини (наявність віддалених метастазів)» [26].
Повна хірургічна резекція при поширеній онкопатології різних локалізацій окреслюється також терміном «циторедуктивна хірургія» (cytoreductive surgery — CRS), що став сьогодні стандартним у медичній літературі для визначення втручань, які передбачають видалення гематогенних чи лімфогенних метастазів, або різного об’єму перитонектомії з метою видалення імплантаційних метастазів. Принциповою відмінністю CRS від паліативних операцій є видалення не тільки локорегіонарного сегмента поширеної пухлини, а й повне видалення віддалених метастазів. Власне CRS після індукційної хіміотерапії є невід’ємною інтегральною складовою частиною більш ширшої концепції «конверсійної хірургії» для раку шлунка [26].
З метою потенційної стандартизації стратегії конверсійної хірургії для олігометастатичного раку шлунка сьогодні продовжуються декілька проспективних рандомізованих досліджень. Так, розпочато німецьке мультицентричне рандомізоване дослідження RENAISSANCE (AIO-FLOT-5) [27], що передбачає проведення 4 циклів індукційної хіміотерапії FLOT хворим з потенційно резектабельним олігометастатичним раком шлунка, відбір пацієнтів без прогресування захворювання та їх рандомізацію в групу циторедуктивної гастректомії з видаленням метастазів та післяопераційною хіміотерапією FLOT або в групу контролю паліативної хіміотерапії FLOT. Проспективне рандомізоване дослідження з подібним дизайном під назвою SURGIGAST (NCT03042169) розпочато також французькими дослідниками [28].
CRS та гіпертермічна внутрішньочеревна хіміотерапія
Концепція проведення гіпертермічної внутрішньочеревної хіміотерапії (hyperthermic intraperitoneal chemotherapy — НІРЕС) базується на ідеї комбінації цитотоксичного ефекту локальної гіпертермії та внутрішньочеревної хіміотерапії, що забезпечує високі концентрації цитостатиків інтраперитонеально з їх низькою системною токсичністю. Гіпертермія потенціює цитотоксичну дію хіміопрепаратів та збільшує глибину їх пенетрації у тканини [29–31]. При зміні шляху введення хіміопрепаратів з довенного на внутрішньочеревний, унаслідок існування перитонеоплазматичного бар’єра в черевній порожнині створюються високі терапевтичні концентрації цитостатиків, що значно перевищують сироваткові [32]. Гіпертермія при проведенні НІРЕС ініціює лізосомальну активність та денатурацію білків пухлинної клітини, що призводить до порушення процесів репарації ДНК та кінцевої синергічної взаємодії гіпертермії та цитостатичної терапії [33].
Комбінацію інтраперитонеальної хіміотерапії та гіпертермії вперше застосував американський хірург J.S. Spratt зі співавт. у 1980 р. для лікування хворого на псевдоміксому очеревини [34]. У випадку новоутворення шлунка НІРЕС (рис. 1) здатна реалізувати свій терапевтичний потенціал у відібраних хворих та виключно в умовах повної хірургічної редукції імплантаційних метастазів з очеревини, гастректомії із радикальними краями резекції та D2-лімфодисекцією.
Ефективність комбінованої терапії з використанням CRS/HIPEC при онкопатології шлунка з імплантаційними метастазами вперше зафіксована японськими хірургами. У 1996 р. Y. Yonemura зі співавт. [35] опублікували ретроспективні результати активної лікувальної тактики використання CRS, HIPEC (мітоміцин 30 мг + цисплатин 300 мг + етопозид 150 мг, 60 хв за температури 42–43 °С) та системної хіміотерапії у 83 хворих: 1-річну виживаність досягнуто у 43% хворих та вперше зафіксовано 5-річну виживаність у такій прогностично несприятливій групі хворих на рівні 11%. В оновленому аналізі 2005 р. автори повідомили результати лікування 107 пацієнтів [36]: медіана виживаності становила 11,5 міс, 5-річна виживаність — 6,7% при рівні післяопераційних ускладнень та летальності — 21,5 та 2,8% відповідно. У групі пацієнтів з макроскопово повною циторедукцією (completeness of cytoreduction — СС-0) показники медіани та 5-річної виживаності були вищими — 15,5 міс та 27% відповідно.
У 2010 р. O. Glehen зі співавт. опублікували результати французького ретроспективного мультицентричного аналізу застосування CRS/НІРЕС у 159 хворих на рак шлунка з імплантаційними метастазами. Медіану загальної виживаності зафіксовано на рівні 9,2 міс та 1-, 3- і 5-річну виживаність на рівні 43, 18 та 13% відповідно. Єдиним незалежним фактором прогнозу в мультиваріаційному аналізі визначено показник повноти циторедукції. У пацієнтів з повною циторедукцією (СС-0) медіана виживаності становила 15,0 міс, 5-річна виживаність — 23%. Рівень післяопераційних ускладнень та летальності становив 27,8 та 6,5% відповідно [37].
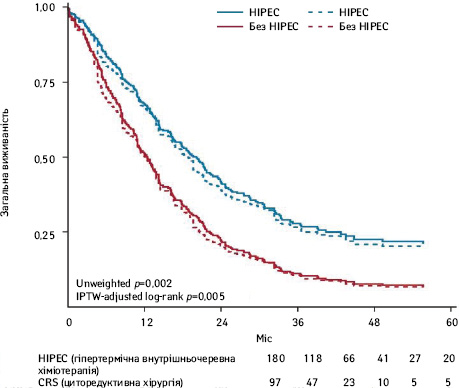
У 2019 р. французькими онкологами опубліковано результати ретроспективного аналізу ефективності CRS/НІРЕС у пацієнтів з 19 французьких центрів — результати дослідження CYTO-CHIP [38]. За 15-річний період спостереження з проспективних баз відібрано 227 хворих на інтраперитонеально дисемінований рак шлунка, яким проведено CC-0,1 циторедукцію. З них 180 особам проведено CRS/НІРЕС та системну хіміотерапію, 97 хворим тільки CRS в комбінації з системною хіміотерапією. Середній показник перитонеального ракового індексу (peritoneal cancer index — РСІ) в обох групах становив 7,2 (0–25) та 5,4 (0–25) балів відповідно. Рівень післяопераційної летальності та ускладнень вірогідно не відрізнявся в обох групах. У віддалених результатах встановлено, що комбінація CRS та НІРЕС забезпечила вірогідне зростання медіани загальної виживаності до 18,8 міс та 5-річної виживаності до 19,9% порівняно із групою самостійної CRS — 12,1 міс та 6,4% відповідно (р=0,005) (рис. 2).
У 2016 р. опубліковано результати китайського ретроспективного моноцентрового дослідження ефективності CRS/НІРЕС у 50 хворих [39]. Рівень післяопераційної летальності та тяжких (ступенів ІІІ–V) післяопераційних ускладнень становив 0 та 23,1% відповідно. Автори повідомляють про медіану загальної виживаності — 14,3 міс (95% ДІ 7,6–21,0) та 1- та 3-річну виживаність — 58 та 32% відповідно при медіані показника РСІ 15 (3–35) балів. У мультиваріаційному аналізі ідентифіковано вірогідні фактори прогнозу: повнота циторедукції СС-0,1, ураження регіонарних лімфовузлів (pN+) та наявність періопераційної системної хіміотерапії.
Згідно з даними реєстру німецької групи з вивчення пухлин перитонеальної поверхні медіана загальної виживаності 235 хворих на рак шлунка з імплантаційними метастазами, що отримали комбіноване лікування з використанням CRS/НІРЕС, становить 13 міс та 5-річна виживаність — 6%. Виживаність вірогідно залежить від величини показника РСІ: при значеннях індексу 0–6 балів (n=74), 7–15 балів (n=70) та 16–39 балів (n=24) медіана виживаності становить 18, 12 та 5 міс відповідно (p=0,002) [40].
Групою американських онкологів з центру MD Anderson опубліковано результати невеликого дослідження ІІ фази (n=20) проведення лапароскопічної НІРЕС перед неоад’ювантною системною хіміотерапією з наступною CRS/НІРЕС (на основі мітоміцину та цисплатину): медіана загальної виживаності становила 16,1 міс, 1-, 2-, та 3-річна виживаність — 90, 50, та 28% відповідно [41].
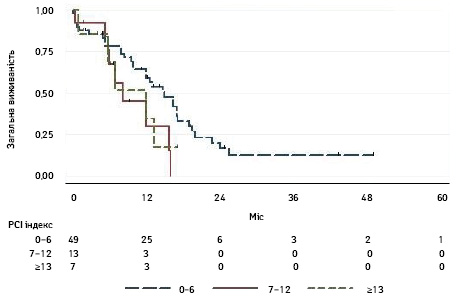
У ретроспективному кооперованому центрально-східноєвропейському дослідженні [42] повідомляється про комбіноване лікування 70 пацієнтів із середнім показником РСІ 5,6±3,6 (0–19) балів. При досягненні 92,8% рівня циторедукцій СС-0,1 медіана безрецидивної та загальної виживаності зафіксована на рівні 10 міс та 12,6 міс відповідно. Тривалі терміни виживаності зафіксовано лише при досягненні повного характеру циторедукції (СС-0) — медіана загальної виживаності становила 15 міс, а також при рівні РСІ ≤6 балів — медіана загальної виживаності та 1-річна виживаність становили 15 міс та 64,1% відповідно (рис. 3).
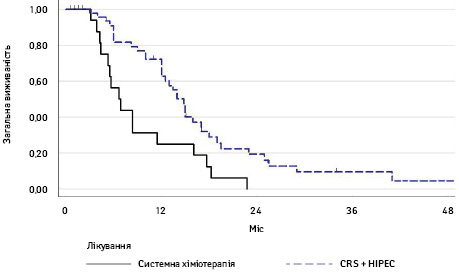
Проведено ретроспективний порівняльний аналіз результатів терапії 67 хворих на рак шлунка з імплантаційними метастазами у Львівському онкологічному регіональному центрі. Пацієнти групи CRS/НІРЕС + системної хіміотерапії (n=51) та групи системної хіміотерапії (n=16) не відрізнялися стосовно об’єму метастатичного імплантаційного ураження. Процедуру HIPEC проводили із застосуванням інтраперитонеально мітоміцину 12,5 мг/м2 та цисплатину 75 мг/м2 протягом 90 хв за температури 42–43 °С (з 2014 р. бідирекційний спосіб із одночасним довенним введенням 5-ФУ 400 мг/м2). У пацієнтів групи CRS/НІРЕС повну циторедукцію (СС-0) досягнуто у 86,3% (n=44) хворих при середньому показнику РСІ 4,2 бала (0–33). Медіана загальної виживаності в групі CRS/НІРЕС становила 14,8±0,78 міс (95% ДІ 12–17) та була вірогідно вищою, ніж у групі системної хіміотерапії — 6,7±1,2 міс (95% ДІ 4,4–11,5) (HR=0,42, 95% ДІ 0,23–0,76, р=0,0075) (рис. 4).
Як видно з результатів ретроспективних досліджень, використовуючи тактику активного комбінованого лікування вдається досягнути навіть 5-річної виживаності у відібраних хворих такої прогностично несприятливої групи. Зокрема A. Brandl зі співавт. [43] у 2021 р. провели ретроспективний аналіз хворих з тривалою виживаністю (більше 5 років) після CRS/НІРЕС-терапії в межах аналізу міжнародної групи пухлин перитонеальної поверхні (Peritoneal Surface Oncology Group International — PSOGI). За 20-річний період дослідження серед 450 пацієнтів ідентифіковано 28 таких хворих з медіаною загальної виживаності терміном 11 років. Незалежними факторами тривалої виживаності визначено РСІ <6 балів та повноту циторедукції СС-0.
Однак, враховуючи ретроспективний характер доказовості, CRS/НІРЕС для раку шлунка з імплантаційними метастазами не регламентовані сьогодні жодними клінічними рекомендаціями до рутинної практики. Необхідними є добре сплановані проспективні рандомізовані дослідження, які проте складно організувати для такої нечисленної високоселективної групи пацієнтів з олігометастатичним характером перебігу онкопатології шлунка. На сьогодні відомо про 3 такі завершені рандомізовані дослідження.
Німецьке дослідження GASTRIPEC мало на меті з’ясувати роль додавання НІРЕС до комбінованого лікування з використанням періопераційної хіміотерапії, гастректомії з CRS. Хворих з верифікованими лімітованими перитонеальними метастазами рандомізовано в групу CRS/НІРЕС (мітоміцин 15 мг/м2 та цисплатин 75 мг/м2 в 5 л фізіологічного розчину протягом 60 хв за температури 42 °С) або в групу тільки CRS [44]. У зв’язку із повільним рекрутингом хворих та високим рівнем інтраперитонеальних прогресувань на тлі індукційної хіміотерапії (тільки у 54% хворих дослідної та 42% пацієнтів контрольної групи виконано CRS) дослідження достроково зупинено на позначці 105 рандомізованих пацієнтів із 180 запланованих. Віддалені результати представлено на конференції ESMO 2021 [45]: первинну гіпотезу не підтверджено, оскільки медіана загальної виживаності в обох групах була однаковою та становила 14,9 міс (р=0,17), однак зафіксовано вірогідне зростання безрецидивної виживаності до 7,1 міс проти 3,5 міс групи контролю (р=0,0089) [46]. «Негативний» результат дослідження можна обґрунтувати кількома факторами, зокрема наявністю серед рандомізованих хворих випадків із поширеним карциноматозом (РСІ >13 балів), а також рандомізацією перед неоад’ювантною хіміотерапією — близько половини пацієнтів в обох групах припиняли участь у дослідженні через констатацію прогресування захворювання на тлі індукційної хіміотерапії під час проведення повторної лапароскопії. Проте результати дослідження GASTRIPEC мають важливе клінічне значення, оскільки навіть в умовах неселективної когорти пацієнтів вдалося досягнути медіани загальної виживаності на рівні 15 міс.
У рандомізованому дослідженні ІІІ фази, проведеному в Китаї [47], у рівних частинах рандомізовано 68 хворих на рак шлунка з імплантаційними метастазами в групу CRS/НІРЕС (цисплатин 120 мг та мітоміцин 30 мг за температури 43±0,5 °С впродовж 60–90 хв) або в групу самостійної CRS з післяопераційною ад’ювантною системною хіміотерапією в обох групах. При досягненні 58,8% рівня CC-0,1 циторедукцій у пацієнтів з групи CRS/HIPEC медіану загальної виживаності зафіксовано на рівні 11 міс на тлі 6,5 міс у хворих з групи CRS (р=0,046). Мультиваріаційний аналіз підтвердив наступні вірогідні фактори прогнозу: синхронний характер імплантаційних метастазів, CC-0,1 характер циторедукції, наявність НІРЕС у програмі лікування, 6 та більше циклів системної хіміотерапії.
У 2014 р. опубліковано результати іншого рандомізованого дослідження, проведеного в США, — GYMSSA trial [48], що мало на меті порівняти виживаність хворих з лімітованими імплантаційними метастазами при проведенні циторедуктивної гастректомії з видаленням метастазів, НІРЕС (оксаліплатин 460 мг/м2 в 5% розчині декстрози за температури 41 °С впродовж 30 хв), системної хіміотерапії FOLFOXIRI та при проведенні тільки хіміотерапії FOLFOXIRI в групі контролю. Отримано підвищення рівня медіани загальної виживаності з 4,3 до 11,3 міс, однак через доволі обмежену кількість рандомізованих хворих результати цього дослідження потрібно інтерпретувати з обережністю.
У недавньому метааналізі досліджень підтверджено вірогідне зростання рівня виживаності при застосуванні CRS/НІРЕС у хворих на інтраперитонеально поширений рак шлунка, однак тільки для показника 3-річної виживаності [49].
Таким чином, у зв’язку з обмеженим обсягом результатів проспективних досліджень НІРЕС сьогодні не є складовою стандартів лікування онкопатології шлунка в національних чи міжнародних рекомендаціях. У контексті лікування олігометастатичного раку шлунка CRS/HIPEC як опція згадується в ESMO 2016, 2022 р. та NCCN 2022 р., проте до моменту отримання вагомих проспективних доказів така комбінована терапія рекомендована виключно в межах клінічних випробувань [8, 9].
Тому сьогодні розпочата та проводиться низка таких рандомізованих досліджень. Зокрема, нідерландськими онкологами проведено І–ІІ фазу проспективного нерандомізованого дослідження PERISCOPE I, що зафіксувало безпечний профіль виконання CRS (суб-/тотальної гастректомії з видаленням перитонеальних метастазів) та HIPEC (оксаліплатин 460 мг/м2 впродовж 30 хв) у комбінації з наступною 90-хвилинною нормотермічною перфузією черевної порожнини доцетакселом 50 мг/м2 (дослідження з підвищенням дози — 0, 50, 75 мг/м2) у хворих з лімітованими перитонеальними метастазами та/чи позитивними змивами з очеревини після неоад’ювантної хіміотерапії [50]. У ІІ фазі цього дослідження виявлено також віддалені результати: медіана безрецидивної та загальної виживаності становила 12 та 15 міс відповідно [51]. Відтак, базуючись на результатах І–ІІ фаз, колективом авторів заплановано та розпочато ІІІ фазу дослідження — PERISCOPE II.
Нідерландське дослідження PERISCOPE II [52] — це подвійне контрольоване мультицентричне рандомізоване дослідження ефективності CRS (суб-/тотальної D2-гастректомії з повною циторедукцією перитонеальних метастазів) у комбінації з HIPEC порівняно із системною паліативною хіміотерапією. Пацієнти з T4a-T4b пухлинами, лімітованими перитонеальними метастазами (PCI <7 балів) та/чи позитивними змивами з очеревини без екстраперитонеальних метастазів є кандидатами на участь у дослідженні. Усі пацієнти отримуватимуть неоад’ювантну хіміотерапію перед включенням і в разі відсутності прогресування захворювання їх рандомізуватимуть у дослідження. Заплановано рандомізацію 226 пацієнтів у 9 європейських центрах.
Китайськими онкологами зареєстровано та розпочато 3 проспективні рандомізовані дослідження: NCT03179579 [53], NCT03604614 [54] та дослідження CLASS-5 (NCT03023436) [55]. Усі 3 дослідження мають подібний дизайн та мають на меті підтвердити чи заперечити перевагу комбінованого лікування з використанням CRS/HIPEC над стандартним підходом системної паліативної хіміотерапії, проте мають у дизайні різні режими НІРЕС.
Внутрішньочеревна аерозольна хіміотерапія з підвищеним тиском
Використання технології внутрішньочеревної аерозольної хіміотерапії з підвищеним тиском (Рressurized intraperitoneal aerosol chemotherapy — РІРАС) уже довело сьогодні свою ефективність навіть у хворих із нерезектабельним дифузним карциноматозом очеревини при раку шлунка. Так, у французькому ретроспективному дослідженні проаналізовано ефективність 163 процедур РІРАС у 42 хворих з медіаною РСІ 17 балів, 78,6% часткою пацієнтів з перснеподібно-клітинною карциномою та наявністю більше 2 ліній паліативної хіміотерапії до застосування РІРАС у майже 50% пацієнтів. Медіана загальної виживаності у такій прогностично несприятливій групі становила 19,1 міс, у 14,3% хворих виявлено регрес до рівня резектабельності пухлинного процесу та проведено CRS/HIPEC [56]. Перевагою цієї методики є малоінвазивний та повторюваний характер, а також можливість оцінки об’єктивної відповіді на лікування під час наступних лапароскопічно-асистованих процедур РІРАС.
Групою італійських дослідників у 2022 р. розпочато проспективне рандомізоване багатоцентрове дослідження ІІІ фази PIPAC VEROne [57]. Дизайн дослідження передбачає після лапароскопічного підтвердження олігометастатичного характеру перитонеальних метастазів (РСІ ≤6 балів чи Р0CY1) рандомізацію хворих: у групу 6 циклів індукційної хіміотерапії з наступними CRS/HIPEC або групу 6 циклів індукційної хіміотерапії в комбінації з 3 процедурами PIPAC з наступними CRS/HIPEC.
Внутрішньочеревна порт-асоційована бідирекційна хіміотерапія
Внутрішньочеревна бідирекційна (комбінована з одночасним системним застосуванням хіміопрепаратів) порт-асоційована хіміотерапія сьогодні активно досліджується для лікування раку шлунка [58] та вже стала стандартом у комбінованій терапії раку яєчників [59]. Однією із переваг такого режиму терапії є повторюваність циклів (на відміну від одноразового характеру проведення НІРЕС), що в умовах резидуальних імплантатів на очеревині є одним із ключів до розв’язання проблеми малої глибини пенетрації цитостатиків у тканини при внутрішньочеревній хіміотерапії. Тому така модальність застосування інтраперитонеальної хіміотерапії може бути варіантом лікування більш поширених стадій карциноматозу (Р1-Р2 згідно з JGCA, РСІ >13 балів) чи резидуальних імплантів.
Ранній досвід порт-асоційованої внутрішньочеревної хіміотерапії раку шлунка базувався на НІРЕС-досвіді та передбачав інтраперитонеальне застосування цисплатину та мітоміцину, що характеризуються термостабільністю та синергійністю з гіпертермією [18]. Однак, окрім високих пікових концентрацій для внутрішньочеревної хіміотерапії, важливою є також тривала висока інтраперитонеальна концентрація хіміопрепаратів. Паклітаксел унаслідок ліпофільності та високої молекулярної маси повільно абсорбується з черевної порожнини через лімфатичну систему. Його експозиція в черевній порожнині, тобто пікові рівні та площа під кривою залежності концентрації від часу (area under the concentration time curve — AUC), після інтраперитонеального введення перевищує експозицію в плазмі крові близько в 1000 разів, при збереженні вірогідної інтраперитонеальної концентрації навіть після 24 год від початку застосування [60]. Тому паклітаксел активно досліджується сьогодні для інтраперитонеального застосування при раку шлунка в основному онкологами східних клінік.
Так, в японському рандомізованому дослідженні ІІІ фази PHOENIX-GC 183 пацієнти з підтвердженими імплантаційними метастазами (в 97% випадків з поширеними стадіями карциноматозу — Р2–3 згідно з JGCA) були рандомізовані в групу інтраперитонеального паклітакселу в комбінації із системною терапією (паклітаксел/S1) чи в групу системної хіміотерапії (цисплатин/S1). Обидва режими добре толерувалися хворими стосовно явищ токсичності. Вірогідної різниці медіани виживаності в дослідній та контрольній групах не досягнуто — 17,7 міс (95% ДI 14,7–21,5 міс) та 15,2 міс (95% ДI 12,8–21,8 міс) (HR 0,72; 95% ДI 0,49–1,04; р=0,08). Однак зафіксовано різницю 3-річної загальної виживаності у хворих цієї несприятливої когорті — 21,9% (95% ДI 14,9–29,9) та 6,0% (95% ДI 1,6–14,9) відповідно [61]. Відтак цією групою дослідників розпочато рандомізоване дослідження PHOENIX-GC2 для пацієнтів без перитонеальних метастазів, проте з CY1 та/або скірозним раком з широким ураженням серозної оболонки шлунка, де подібний режим бідирекційної хіміотерапії досліджуватиметься в періопераційному режимі в комбінації з D2-гастректомією порівняно з періопераційною системною хіміотерапією [62].
В іншому ретроспективному дослідженні з Японії M. Shinkai зі співавт. [63] повідомляють про застосування бідирекційної хіміотерапії у 52 хворих з імплантаційними метастазами (65% хворих з поширеними стадіями карциноматозу — Р2–3 згідно з JGCA): паклітаксел 80 мг/м2 внутрішньочеревно застосовували в 1-шу добу під час стадіювальної лапароскопії, паклітаксел довенно 50 мг/м2 в 1-й та 8-й день, а також перорально S1 з 1-го до 14-го дня 21-денного циклу. Лейкопенію ІІІ–IV ступенів зафіксовано у 17,3% хворих. У 33 пацієнтів (63,5%) після проведення такої індукційної хіміотерапії зафіксовано регрес імплантаційного процесу, що дозволив провести конверсійну D2-гастректомію. Медіана загальної виживаності й 1-, 3- та 5-річна виживаність у них становила 30,7 міс та 78,8, 36,3 та 24,2% відповідно, тоді як у хворих, у яких не вдалося досягнути регресу карциноматозу очеревини (без конверсійної хірургії), — 12,5 міс та 52,6, 5,2 та 0% відповідно (р <0,05). У цьому нерандомізованому дослідженні зафіксовано попередню валідність концепту конверсійної хірургії при імплантаційних метастазах у популяції осіб зі східних країн, застосовуючи бідирекційну інтраперитонеальну хіміотерапію. Серед ускладнень такого режиму хіміотерапії повідомляють про легкі форми порт-асоційованих ускладнень у 20,6% хворих — обструкції інтраперитонеального порта, локальні інфекційні ускладнення тощо [64].
Висновки
Отже, рак шлунка з імплантаційними метастазами до сьогодні залишається вкрай складним викликом у клінічній практиці онколога, зважаючи на виражений несприятливий прогноз у таких пацієнтів. Використання сучасних схем хіміотерапії, анти-HER2 та анти-VEGF-терапії, а також інгібіторів контрольних точок дозволяє вірогідно покращити прогноз для таких хворих. Проте рівень медіани виживаності зростає незначно, оскільки у осіб з імплантаційними метастазами традиційно зафіксовано гіршу відповідь на проведення хіміотаргетної та імунотерапії порівняно з випадками гематогенного чи лімфогенного метастазування.
Однак не всі хворі на рак шлунка з імплантаційними метастазами мають однаковий прогноз. У пацієнтів з початковими стадіями карциноматозу очеревини (РСІ ≤6 балів aбо Р1 згідно з класифікацією JGCA та P0СY1) виявлено вірогідно вищий рівень виживаності при проведенні стандартної системної паліативної терапії, паліативних втручань чи агресивної CRS з інтраперитонеальними методами терапії. Отже, згадана категорія пацієнтів може розглядатися в якості прикладу олігометастатичного характеру перебігу імплантаційного метастазування раку шлунка. Дослідження методів активного комбінованого лікування цієї патології через призму контрольованих рандомізованих досліджень, що зараз тривають, стануть наступним визначальним кроком до потенційної валідації більш агресивного лікування. Перспективною також є концепція ад’ювантного використання інтраперитонеальних методів терапії проактивно — у хворих без реалізованих імплантатів, однак з підвищеним ризиком розвитку інтраперитонеального рецидиву.
Для осіб з множинними імплантаційними метастазами ефективність бідирекційної порт-асоційованої хіміотерапії потребує підтвердження в рандомізованих дослідженнях як на Сході, так і в Європі. Пошук можливих терапевтичних стратегій для хворих з дифузним карциноматозом очеревини лежить очевидно в площині фундаментальних досліджень у контексті системного лікування. Молекулярна характеристика перитонеальних метастазів та інтраперитонеального пухлинного мікрооточення вже сьогодні дає можливість краще розуміти біологію імплантаційного метастазування та дає надію на ідентифікацію нових цілей для таргетної та імунотерапії [65, 66].
Список використаної літератури
1. Thomassen, I., van Gestel, Y. R., van Ramshorst, B., Luyer, M. D., Bosscha, K., Nienhuijs, S. W., … de Hingh, I. H. (2014). Peritoneal carcinomatosis of gastric origin: a population-based study on incidence, survival and risk factors. International Journal of Cancer, 134(3), 622–8. doi: 10.1002/ijc.28373.
2. Riihimäki, M., Hemminki, A., Sundquist, K., Sundquist, J., & Hemminki, K. (2016). Metastatic spread in patients with gastric cancer. Oncotarget, 7(32), 52307–52316. doi: 10.18632/oncotarget.10740.
3. Roviello, F., Caruso, S., Neri, A., & Marrelli, D. (2013). Treatment and prevention of peritoneal carcinomatosis from gastric cancer by cytoreductive surgery and hyperthermic intraperitoneal chemotherapy: overview and rationale. European Journal of Surgical Oncology, 39(12), 1309–16. doi: 10.1016/j.ejso.2013.10.010.
4. Ikoma, N., Blum, M., Chiang, Y. J., Estrella, J. S., Roy-Chowdhuri, S., Fournier, K., … Badgwell, B. D. (2016). Yield of Staging Laparoscopy and Lavage Cytology for Radiologically Occult Peritoneal Carcinomatosis of Gastric Cancer. Annals of Surgical Oncology, 23(13), 4332–4337. doi: 10.1245/s10434-016-5409-7.
5. Ramos, R. F., Scalon, F. M., Scalon, M. M., & Dias, D. I. (2016). Staging laparoscopy in gastric cancer to detect peritoneal metastases: A systematic review and meta-analysis. European Journal of Surgical Oncology, 42(9), 1315–21. doi: 10.1016/j.ejso.2016.06.401.
6. Yoo, C. H., Noh, S. H., Shin, D. W., Choi, S. H., & Min, J. S. (2000). Recurrence following curative resection for gastric carcinoma. British Journal of Surgery, 87(2), 236–42. doi: 10.1046/j.1365-2168.2000.01360.x.
7. Smyth, E. C., Verheij, M., Allum, W., Cunningham, D., Cervantes, A., & Arnold, D. (2016). ESMO Guidelines Committee. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 27(5), v38–v49. doi: 10.1093/annonc/mdw350.
8. Ajani, J. A., D’Amico, T. A., Bentrem, D. J., Chao, J., Cooke, D., Corvera, C., … Pluchino, L. A. (2022). Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. Journal of National Comprehensive Cancer Network, 20(2), 167–192. doi: 10.6004/jnccn.2022.0008.
9. Lordick, F., Carneiro, F., Cascinu, S., Fleitas, T., Haustermans, K., Piessen, G., … Smyth, E. C. (2022). ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology, 33(10), 1005–1020. doi: 10.1016/j.annonc.2022.07.004.
10. Arai, H., Inoue, E., Yamaguchi, K., Boku, N., Hara, H., Nishina, T., … Nakajima, T. E. (2021). Clinical implications of using both fluoropyrimidine and paclitaxel in patients with severe peritoneal metastasis of gastric cancer: A post hoc study of JCOG1108/WJOG7312G. Cancer Medicine, 10(21), 7673–7682. doi: 10.1002/cam4.4303.
11. Koemans, W. J., Lurvink, R. J., Grootscholten, C., Verhoeven, R. H. A., de Hingh, I. H., & van Sandick, J. W. (2021). Synchronous peritoneal metastases of gastric cancer origin: incidence, treatment and survival of a nationwide Dutch cohort. Gastric Cancer, 24(4), 800–809. doi: 10.1007/s10120-021-01160-1.
12. Kang, Y. K., Chen, L. T., Ryu, M. H., Oh, D. Y., Oh, S. C., Chung, H. C., … Boku, N. (2022). Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncology, 23(2), 234–247. doi: 10.1016/S1470-2045(21)00692-6.
13. Katai, H., Ishikawa, T., Akazawa, K., Isobe, Y., Miyashiro, I., Oda, I., … Nashimoto, A. (2018). Registration Committee of the Japanese Gastric Cancer Association. Five-year survival analysis of surgically resected gastric cancer cases in Japan: a retrospective analysis of more than 100,000 patients from the nationwide registry of the Japanese Gastric Cancer Association (2001–2007). Gastric Cancer, 21(1), 144–154. doi: 10.1007/s10120-017-0716-7.
14. Jamel, S., Markar, S. R., Malietzis, G., Acharya, A., Athanasiou, T., & Hanna, G. B. (2018). Prognostic significance of peritoneal lavage cytology in staging gastric cancer: systematic review and meta-analysis. Gastric Cancer, 21(1), 10–18. doi: 10.1007/s10120-017-0749-y.
15. Bertero, L., Massa, F., Metovic, J., Zanetti, R., Castellano, I., Ricardi, U., … Cassoni, P. (2018). Eighth Edition of the UICC Classification of Malignant Tumours: an overview of the changes in the pathological TNM classification criteria-What has changed and why? Virchows Archiv, 472(4), 519–531. doi: 10.1007/s00428-017-2276-y.
16. Japanese Gastric Cancer Association (2021). Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer, 24(1), 1–21. doi: 10.1007/s10120-020-01042-y.
17. Wagner, A. D., Syn, N. L., Moehler, M., Grothe, W., Yong, W. P., Tai, B. C., … Unverzagt, S. (2017). Chemotherapy for advanced gastric cancer. Cochrane Database Systematic Reviews, 8(8), CD004064. doi: 10.1002/14651858.CD004064.pub4.
18. Sugarbaker, P. H., & Van der Speeten, K. (2016). Surgical technology and pharmacology of hyperthermic perioperative chemotherapy. Journal of Gastrointestinal Oncology, 7(1), 29–44. doi: 10.3978/j.issn.2078-6891.2015.105.
19. Gordon, M. A., Gundacker, H. M., Benedetti, J., Macdonald, J. S., Baranda, J. C., Levin, W. J., … Press, M. F. (2013). Assessment of HER2 gene amplification in adenocarcinomas of the stomach or gastroesophageal junction in the INT-0116/SWOG9008 clinical trial. Annals of Oncology, 24(7), 1754–1761. doi: 10.1093/annonc/mdt106.
20. Shim, H. J., Kim, H. J., Lee, S. H., Bae, W. K., Hwang, E. C., Cho, S. H., … Hwang, J. E. (2020). Observational Study of Peritoneal Washing Cytology-Positive Gastric Cancer without Gross Peritoneal Metastasis in Patients who Underwent Radical D2 Gastrectomy. Scientific Reports, 10(1), 9549. doi: 10.1038/s41598-020-66637-y.
21. Yamaguchi, T., Takashima, A., Nagashima, K., Terashima, M., Aizawa, M., Ohashi, M., … Boku, N. (2021). Impact of preoperative chemotherapy as initial treatment for advanced gastric cancer with peritoneal metastasis limited to positive peritoneal lavage cytology (CY1) or localized peritoneal metastasis (P1a): a multi-institutional retrospective study. Gastric Cancer, 24(3), 701–709. doi: 10.1007/s10120-020-01137-6.
22. Pecqueux, M., Fritzmann, J., Adamu, M., Thorlund, K., Kahlert, C., Reißfelder, C., … Rahbari, N. N. (2015). Free intraperitoneal tumor cells and outcome in gastric cancer patients: a systematic review and meta-analysis. Oncotarget, 6(34), 35564–78. doi: 10.18632/oncotarget.5595.
23. Fujitani, K., Yang, H. K., Mizusawal, J., Kim, Y. W., Terashima, M., Han, S. U., … Tsujinaka, T. (2016). REGATTA study investigators. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial. Lancet Oncology, 17(3), 309–318. doi: 10.1016/S1470-2045(15)00553-7.
24. Al-Batran, S. E., Homann, N., Pauligk, C., Illerhaus, G., Martens, U. M., Stoehlmacher, J., … Hofheinz, R. D. (2017). Effect of Neoadjuvant Chemotherapy Followed by Surgical Resection on Survival in Patients With Limited Metastatic Gastric or Gastroesophageal Junction Cancer: The AIO-FLOT3 Trial. JAMA Oncology, 3(9), 1237–1244. doi: 10.1001/jamaoncol.2017.0515.
25. Cui, Y., Yu, Y., Zheng, S., Ying, J., Du, Y., Wang, Y., … Liu, T. (2023). Does resection after neoadjuvant chemotherapy of docetaxel, oxaliplatin, and S-1 (DOS regimen) benefit for gastric cancer patients with single non-curable factor? a multicenter, prospective cohort study (Neo-REGATTA). BMC Cancer, 23(1), 308. doi: 10.1186/s12885-023-10773-x.
26. Yoshida, K., Yamaguchi, K., Okumura, N., Tanahashi, T., & Kodera, Y. (2016). Is conversion therapy possible in stage IV gastric cancer: the proposal of new biological categories of classification. Gastric Cancer, 19(2), 329–338. doi: 10.1007/s10120-015-0575-z.
27. Al-Batran, S. E., Goetze, T. O., Mueller, D. W., Vogel, A., Winkler, M., Lorenzen, S., … Moenig, S. P. (2017). The RENAISSANCE (AIO-FLOT5) trial: effect of chemotherapy alone vs. chemotherapy followed by surgical resection on survival and quality of life in patients with limited-metastatic adenocarcinoma of the stomach or esophagogastric junction — a phase III trial of the German AIO/CAO-V/CAOGI. BMC Cancer, 17(1), 893. doi: 10.1186/s12885-017-3918-9.
28. Piessen, G. (2017). Surgical Resection Plus Chemotherapy Versus Chemotherapy Alone in Oligometastatic Stage IV Gastric Cancer — a Multicenter, Prospective, Open-labeled, Two-armed, Randomized, Controlled Phase III Trial. Retrived from classic.clinicaltrials.gov/ct2/show/NCT03042169.
29. Kok, H. P., Beck, M., Löke, D. R., Helderman, R. F. C. P. A., van Tienhoven, G., Ghadjar, P., … Crezee, H. (2020). Locoregional peritoneal hyperthermia to enhance the effectiveness of chemotherapy in patients with peritoneal carcinomatosis: a simulation study comparing different locoregional heating systems. International Journal of Hyperthermia, 37(1), 76–88. doi: 10.1080/02656736.2019.1710270.
30. Helderman, R. F. C. P. A., Löke, D. R., Verhoeff, J., Rodermond, H. M., van Bochove, G. G. W., Boon, M., … Oei, A. L. (2020). The Temperature-Dependent Effectiveness of Platinum-Based Drugs Mitomycin-C and 5-FU during Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in Colorectal Cancer Cell Lines. Cells, 9(8), 1775. doi: 10.3390/cells9081775.
31. Löke, D. R., Helderman, R. F. C. P. A., Franken, N. A. P., Oei, A. L., Tanis, P. J., Crezee, J., & Kok, H. P. (2021). Simulating drug penetration during hyperthermic intraperitoneal chemotherapy. Drug Delivery, 28(1), 145–161. doi: 10.1080/10717544.2020.1862364.
32. Morgan, R. J. Jr., Synold, T. W., Xi, B., Lim, D., Shibata, S., Margolin, K., … Doroshow, J. H. (2007). Phase I trial of intraperitoneal gemcitabine in the treatment of advanced malignancies primarily confined to the peritoneal cavity. Clinical Cancer Research, 13(4), 1232–7. doi: 10.1158/1078-0432.CCR-06-1735.
33. Lemoine, L., Thijssen, E., Carleer, R., Cops, J., Lemmens, V., Eyken, P. V., … der Speeten, K. V. (2019). Body surface area-based versus concentration-based intraperitoneal perioperative chemotherapy in a rat model of colorectal peritoneal surface malignancy: pharmacologic guidance towards standardization. Oncotarget, 10(14), 1407–1424. doi: 10.18632/oncotarget.26667.
34. Spratt, J. S., Adcock, R. A., Muskovin, M., Sherrill, W., & McKeown, J. (1980). Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Research, 40(2), 256–60. PMID: 6766084.
35. Yonemura, Y., Fujimura, T., Nishimura, G., Falla, R., Sawa, T., Katayama, K., … Sasaki, T. (1996). Effects of intraoperative chemohyperthermia in patients with gastric cancer with peritoneal dissemination. Surgery, 119(4), 437–44. doi: 10.1016/s0039-6060(96)80145-0.
36. Yonemura, Y., Kawamura, T., Bandou, E., Takahashi, S., Sawa, T., & Matsuki, N. (2005). Treatment of peritoneal dissemination from gastric cancer by peritonectomy and chemohyperthermic peritoneal perfusion. British Journal of Surgery, 92(3), 370–5. doi: 10.1002/bjs.4695.
37. Glehen, O., Gilly, F. N., Arvieux, C., Cotte, E., Boutitie, F., Mansvelt, B., … Elias, D. (2010). Association Française de Chirurgie. Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy. Annals of Surgical Oncology, 17(9), 2370–7. doi: 10.1245/s10434-010-1039-7.
38. Bonnot, P. E., Piessen, G., Kepenekian, V., Decullier, E., Pocard, M., Meunier, B., … Glehen, O. (2019). FREGAT and BIG-RENAPE Networks. Cytoreductive Surgery With or Without Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer With Peritoneal Metastases (CYTO-CHIP study): A Propensity Score Analysis. Journal of Clinical Oncology, 37(23), 2028–2040. doi: 10.1200/JCO.18.01688.
39. Wu, H. T., Peng, K. W., Ji, Z. H., Sun, J. H., Zhang, Q., Yang, X. J., … Li, Y. (2016). Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy with lobaplatin and docetaxel to treat synchronous peritoneal carcinomatosis from gastric cancer: Results from a Chinese center. European Journal of Surgical Oncology, 42(7), 1024–34. doi: 10.1016/j.ejso.2016.04.053.
40. Rau, B., Brandl, A., Piso, P., Pelz, J., Busch, P., Demtröder, C., … Königsrainer, A. (2020). Peritoneum Surface Oncology Group and members of the StuDoQ|Peritoneum Registry of the German Society for General and Visceral Surgery (DGAV). Peritoneal metastasis in gastric cancer: results from the German database. Gastric Cancer, 23(1), 11–22. doi: 10.1007/s10120-019-00978-0.
41. Badgwell, B., Ikoma, N., Murphy, M. B., Wang, X., Estrella, J., Roy-Chowdhuri, S., … Ajani, J. (2021). A Phase II Trial of Cytoreduction, Gastrectomy, and Hyperthermic Intraperitoneal Perfusion with Chemotherapy for Patients with Gastric Cancer and Carcinomatosis or Positive Cytology. Annals of Surgical Oncology, 28(1), 258–264. doi: 10.1245/s10434-020-08739-5.
42. Yarema, R., Mielko, J., Fetsych, T., Ohorchak, M., Skorzewska, M., Rawicz-Pruszyński, K., … Paskonis, M. (2019). Hyperthermic intraperitoneal chemotherapy (HIPEC) in combined treatment of locally advanced and intraperitonealy disseminated gastric cancer: A retrospective cooperative Central-Eastern European study. Cancer Medicine, 8(6), 2877–2885. doi: 10.1002/cam4.2204.
43. Brandl, A., Yonemura, Y., Glehen, O., Sugarbaker, P., & Rau, B. (2021). Long term survival in patients with peritoneal metastasised gastric cancer treated with cytoreductive surgery and HIPEC: A multi-institutional cohort from PSOGI. European Journal of Surgical Oncology, 47(1), 172–180. doi: 10.1016/j.ejso.2020.10.006.
44. Rau, B., Loeffler, M., Rau, H. G., Sulkowski, U., Kuhlmann, J., Weimann, A., … Peter, C. (2015). Perioperative chemotherapy and cytoreductive surgery with versus without HIPEC in gastric cancer with limited peritoneal metastases: A randomized phase III study (GASTRIPEC). Journal of Clinical Oncology, 33(15), TPS4132–TPS4132. doi: 10.1200/jco.2015.33.15_suppl.tps4132.
45. Rau, B., Lang, H., Königsrainer, A., Gockel, I., Rau, H.-G., Seeliger, H., … Thuss-Patience, P. C. (2021). 1376O The effect of hyperthermic intraperitoneal chemotherapy (HIPEC) upon cytoreductive surgery (CRS) in gastric cancer (GC) with synchronous peritoneal metastasis (PM): a randomized multicentre phase III trial (GASTRIPEC-I-trial). Annals of Oncology, 32(5), S1040–S1075. doi: 10.1016/ j.annonc.2021.08.1485.
46. Rau, B., Lang, H., Koenigsrainer, A., Gockel, I., Rau, H. G., Seeliger, H., … Thuss-Patience, P. (2023). Effect of Hyperthermic Intraperitoneal Chemotherapy on Cytoreductive Surgery in Gastric Cancer With Synchronous Peritoneal Metastases: The Phase III GASTRIPEC-I Trial. Journal of Clinical Oncology, 31, JCO2202867. doi: 10.1200/JCO.22.02867.
47. Yang, X. J., Huang, C. Q., Suo, T., Mei, L. J., Yang, G. L., Cheng, F. L., … Li, Y. (2011). Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase III randomized clinical trial. Annals of Surgical Oncology, 18(6), 1575–81. doi: 10.1245/s10434-011-1631-5.
48. Rudloff, U., Langan, R. C., Mullinax, J. E., Beane, J. D., Steinberg, S. M., Beresnev, T., … Avital, I. (2014). Impact of maximal cytoreductive surgery plus regional heated intraperitoneal chemotherapy (HIPEC) on outcome of patients with peritoneal carcinomatosis of gastric origin: results of the GYMSSA trial. Journal of Surgical Oncology, 110(3), 275–84. doi: 10.1002/jso.23633.
49. Granieri, S., Bonomi, A., Frassini, S., Chierici, A. P., Bruno, F., Paleino, S., … Cotsoglou, C. (2021). Prognostic impact of cytoreductive surgery (CRS) with hyperthermic intraperitoneal chemotherapy (HIPEC) in gastric cancer patients: A meta-analysis of randomized controlled trials. European Journal of Surgical Oncology, 47(11), 2757–2767. doi: 10.1016/j.ejso.2021.05.016.
50. van der Kaaij, R. T., Wassenaar, E. C. E., Koemans, W. J., Sikorska, K., Grootscholten, C., Los, M., … van Sandick, J. W. (2020). Treatment of PERItoneal disease in Stomach Cancer with cytOreductive surgery and hyperthermic intraPEritoneal chemotherapy: PERISCOPE I initial results. British Journal of Surgery, 107(11), 1520–1528. doi: 10.1002/bjs.11588.
51. Koemans, W. J., van der Kaaij, R. T., Wassenaar, E. C. E., Boerma, D., Boot, H., Sikorska, K., … van Sandick, J. W. (2021). Tumor characteristics and clinical outcome of peritoneal metastasis of gastric origin treated with a hyperthermic intraperitoneal chemotherapy procedure in the PERISCOPE I trial. Journal of Surgical Oncology, 123(4), 904–910. doi: 10.1002/jso.26366.
52. Koemans, W. J., van der Kaaij, R. T., Boot, H., Buffart, T., Veenhof, A. A. F. A., Hartemink, K. J., … van Sandick, J. W. (2019). Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy versus palliative systemic chemotherapy in stomach cancer patients with peritoneal dissemination, the study protocol of a multicentre randomised controlled trial (PERISCOPE II). BMC Cancer, 19(1), 420. doi: 10.1186/s12885-019-5640-2.
53. Cui, S.-Z. (2017). A phase III study of hyperthermic intraperitoneal chemotherapy (HIPEC) combined with systemic chemotherapy and cytoreductive surgery (CRS) in the treatment of peritoneal carcinomatosis from gastric cancer. Retrived from clinicaltrials.gov/ct2/show/NCT03179579.
54. Wang, W. (2021). A randomized controlled clinical trial of hyperthermic intraperitoneal chemotherapy for advanced gastric cancer with peritoneal metastatis. Retrived from clinicaltrials.gov/ct2/show/NCT03604614.
55. Liu, H., Li, G., Yu, J., Su, X., Sun, Y., Hu, J., … Hu, Y. (2017). CLASS-05 trial: A randomized controlled phase III trial of cytoreductive surgery + hyperthermic intraperitoneal chemotherapy (HIPEC) + systemic chemotherapy vesus systemic chemotherapy alone for patients with limited peritoneal carcinomatosis of gastric cancer. Annals of Oncology, 28(5), v263. doi: 10.1093/annonc/mdx369.149.
56. Alyami, M., Bonnot, P. E., Mercier, F., Laplace, N., Villeneuve, L., Passot, G., … Glehen, O. (2021). Pressurized intraperitoneal aerosol chemotherapy (PIPAC) for unresectable peritoneal metastasis from gastric cancer. European Journal of Surgical Oncology, 47(1), 123–127. doi: 10.1016/j.ejso.2020.05.021.
57. Casella, F., Bencivenga, M., Rosati, R., Fumagalli, U. R., Marrelli, D., Pacelli, F., … De Manzoni, G. (2022). Pressurized intraperitoneal aerosol chemotherapy (PIPAC) in multimodal therapy for patients with oligometastatic peritoneal gastric cancer: a randomized multicenter phase III trial PIPAC VEROne. Pleura Peritoneum, 7(3), 135–141. doi: 10.1515/pp-2022-0111.
58. So, J. B. Y. (2023). Bi-directional chemotherapy for peritoneal metastases. British Journal of Surgery, 110(6), 627–628. doi: 10.1093/bjs/znad061.
59. Armstrong, D. K., Bundy, B., Wenzel, L., Huang, H. Q., Baergen, R., Lele, S., … Burger, R. A. (2006). Gynecologic Oncology Group. Intraperitoneal cisplatin and paclitaxel in ovarian cancer. New England Journal of Medicine, 354(1), 34–43. doi: 10.1056/NEJMoa052985.
60. Markman, M., Rowinsky, E., Hakes, T., Reichman, B., Jones, W., Lewis, J. L. Jr., … Phillips, M. (1992). Phase I trial of intraperitoneal taxol: a Gynecoloic Oncology Group study. Journal of Clinical Oncology, 10(9), 1485–91. doi: 10.1200/JCO.1992.10.9.1485.
61. Ishigami, H., Fujiwara, Y., Fukushima, R., Nashimoto, A., Yabusaki, H., Imano, M., … Kitayama, J. (2018). Phase III Trial Comparing Intraperitoneal and Intravenous Paclitaxel Plus S-1 Versus Cisplatin Plus S-1 in Patients With Gastric Cancer With Peritoneal Metastasis: PHOENIX-GC Trial. Journal of Clinical Oncology, 36(19), 1922–1929. doi: 10.1200/JCO.2018.77.8613.
62. Ishigami, H., Tsuji, Y., Shinohara, H., Kodera, Y., Kanda, M., Yabusaki, H., … Seto, Y. (2021). Intraperitoneal Chemotherapy as Adjuvant or Perioperative Chemotherapy for Patients with Type 4 Scirrhous Gastric Cancer: PHOENIX-GC2 Trial. Journal of Clinical Medicine, 10(23), 5666. doi: 10.3390/jcm10235666.
63. Shinkai, M., Imano, M., Hiraki, Y., Momose, K., Kato, H., Shiraishi, O., … Yasuda, T. (2022). Efficacy of conversion surgery after a single intraperitoneal administration of paclitaxel and systemic chemotherapy for gastric cancer with peritoneal metastasis. Langenbecks Archive of Surgery, 407(3), 975–983. doi: 10.1007/s00423-021-02410-7.
64. Emoto, S., Ishigami, H., Hidemura, A., Yamaguchi, H., Yamashita, H., Kitayama, J., & Watanabe, T. (2012). Complications and management of an implanted intraperitoneal access port system for intraperitoneal chemotherapy for gastric cancer with peritoneal metastasis. Japanese Journal of Clinical Oncology, 42(11), 1013–9. doi: 10.1093/jjco/hys129.
65. Gwee, Y. X., Chia, D. K. A., So, J., Ceelen, W., Yong, W. P., Tan, P., … Sundar, R. (2022). Integration of Genomic Biology Into Therapeutic Strategies of Gastric Cancer Peritoneal Metastasis. Journal of Clinical Oncology, 40(24), 2830. doi: 10.1200/JCO.21.02745.
66. Kasai, S., Kuwayama, N., Motoo, Y., Kawashima, A., Matsumoto, K., Yano, S., … Yasumoto, K. (2022). Dual blockade of MET and VEGFR2 signaling pathways as a potential therapeutic maneuver for peritoneal carcinomatosis in scirrhous gastric cancer. Biochem Biophys Res Commun, 600, 80–86. doi: 10.1016/j.bbrc.2022.02.045.
Адреса для листування:
Ярема Роман Романович
79000, Львів, вул. Пекарська, 69
Львівський національний медичний університет ім. Данила Галицького, кафедра онкології і радіології
E-mail: roman.yarema@ukr.net
Correspondence:
Roman Yarema
79000, Pekarska str., 69, Lviv
Danylo Halytsky Lviv National Medical University, Department of Oncology and Radiology
E-mail: roman.yarema@ukr.net














Leave a comment