Клінічний випадок лапароскопічної симультанної резекції дорсовентрального сегмента печінки та резекції поперечної ободової кишки
Бурлака А.1,2, Скиба В.2, Земсков С.2, Микитюк А.1, Рожкова В.1, Безносенко А.1, Сорокін Б.3
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Національний медичний університет ім. О.О. Богомольця, Київ, Україна
- 3Національний університет охорони здоров’я України ім. П.Л. Шупика, Київ, Україна
Резюме. Вступ. Близько 50% пацієнтів з колоректальним раком (КРР) мають метастатичне ураження печінки, при цьому синхронні метастази виявляють у 15–20% випадків, що істотно погіршує онкологічний прогноз. Хірургічне лікування залишається золотим стандартом, а досягнення R0-резекції є пріоритетним як для первинної пухлини, так і для метастазів. У пацієнтів із лімітованим ураженням печінки та задовільним соматичним станом можливе виконання симультанних втручань. Водночас великі резекції печінки (≥3 сегментів) зазвичай проводяться поетапно через високий ризик ускладнень. Лапароскопічна резекція первинної пухлини КРР є світовим стандартом, а доцільність малих резекцій печінки (<3 сегментів) доведено в рандомізованих дослідженнях. Проте дані щодо безпеки лапароскопічних симультанних втручань при синхронних колоректальних метастазах залишаються обмеженими. Не існує уніфікованих протоколів розміщення троакарів чи положення пацієнта, які передбачають інтервенції на декількох поверхах черевної порожнини. Подібний досвід описано в публікаціях та хірургічних атласах, в яких досліджували питання трансплантації печінки малоінвазивним хірургічним доступом. Більше того, лапароскопічні втручання на верхньо-задніх сегментах печінки в сучасних гайдлайнах визначені як технічно складні та такі, що слід реалізовувати в експертних центрах. Мета. Метою цього дослідження є представлення клінічного випадку успішної лапароскопічної симультанної резекції метастазів у сегментах S7 та S4 печінки із резекцією поперечної ободової кишки. Матеріали і методи дослідження. Хірургічне втручання виконане в умовах Національного інституту раку (м. Київ) за участі мультидисциплінарної хірургічної команди. Висновки. Лапароскопічний хірургічний доступ при КРР із лімітованим метастатичним ураженням печінки може мати перевагу над відкритою хірургією.
Одержано 3.04.2025
Прийнято до друку 22.04.2025
DOI: 10.32471/clinicaloncology.2663-466X.34491
ВСТУП
Відповідно до світових даних, ½ хворих на КРР мають метастатичне ураження печінки [1], тоді як синхронні метастази в печінку (СМП) фіксують у близько 15–20% пацієнтів та вони є фактором негативного онкологічного прогнозу [2]. Останніми 4 десятиріччями хірургічне лікування вважається золотим стандартом, а досягнення R0-статусу визначено пріоритетом як для первинної пухлини, так і метастатичних вогнищ [3]. Однак питання оптимальної послідовності оперативних втручань досі обговорюється та залишає право вибору тактики в межах мультидисциплінарного розбору [4]. Доведено, що у випадках лімітованого ураження печінки та задовільного загального стану пацієнта можна розглядати можливість одномоментного хірургічного втручання [5]. Проте великі (≥3 анатомічних сегментів) резекції печінки слід реалізовувати окремим хірургічним етапом через ризик хірургічних ускладнень та смертності [6, 7].
Використання лапароскопічного хірургічного доступу з метою видалення первинних колоректальних пухлин стало стандартом в усьому світі [8]. Також у низці рандомізованих досліджень доведено онкологічну та хірургічну доцільність виконання малих (<3 анатомічних сегментів) резекцій печінки [9–11]. Тим не менш у наукових літературних даних відсутня переконлива інформація щодо ефективності й безпеки лапароскопічного підходу до симультанних резекцій при синхронному метастазуванні КРР у печінку [12, 13]. На жаль, відсутні уніфіковані рекомендації щодо розміщення троакарів або ж положення хворого на операційному столі, які передбачають інтервенції на декількох поверхах черевної порожнини. Подібний досвід демонструють публікації та хірургічні атласи, що досліджували питання трансплантації печінки малоінвазивним хірургічним доступом [14, 15]. Більше того, лапароскопічні втручання на верхньо-задніх сегментах печінки в сучасних гайдлайнах визначені як технічно складні та такі, що слід реалізовувати в експертних центрах [16–18].
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Хірургічне втручання виконане в умовах ДНП «Національний інститут раку» (м. Київ) за участі мультидисциплінарної хірургічної команди.
КЛІНІЧНИЙ ВИПАДОК
До клініки звернувся 42-річний чоловік зі скаргами на кров’янисті випорожнення протягом 2 міс, загальну слабкість і зменшення маси тіла на 5 кг. Супутні захворювання відсутні, ASA I. Спадковий анамнез не обтяжений. За результатами колоноскопії та біопсії верифіковано діагноз — аденокарцинома ободової кишки (G1–G2). Антропометричні та клінічні дані: зріст — 175 см, маса тіла — 79 кг, індекс маси тіла (ІМТ) — 25,8, артеріальний тиск — 117/67 мм рт.ст., пульс — 74 уд./хв, загальний функціональний статус (functional status — PS) — 0.
Обстеження та планування лікування. Лабораторні дослідження свідчать про анемію (еритроцити — 3,9×10⁹/л, гемоглобін — 86 г/л), підвищення рівня раково-ембріонального антигену — 28,3 нг/мл. Радіологічні дані, комп’ютерна томографія органів черевної порожнини та магнітно-резонансна томографія підтвердили наявність новоутворення поперечної ободової кишки (25×35 мм) та 2 метастатичних вогнищ у печінці — у сегментах S7 (35 мм) і S4b (26 мм) (рис. 1). Згідно з класифікацією TNM (T — tumor, «пухлина»; N — nodus, «вузол»; M — metastasis, «метастази») Американського об’єднаного комітету з боротьби проти раку (American Joint Committee on Cancer — AJCC, 8-ме видання) — стадія IVA, cT3N1M1 (HEP).
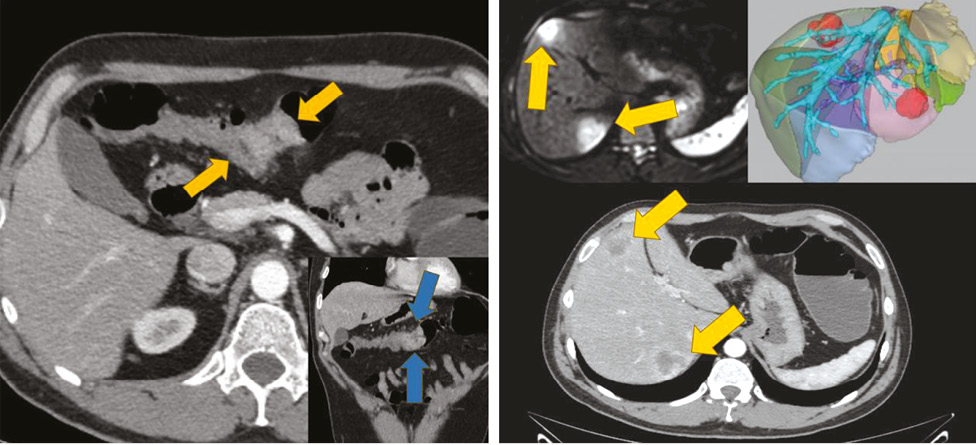
Мультидисциплінарною комісією ухвалено рішення виконати симультанну лапароскопічну анатомічну резекцію S7 та атипову резекцію S4b із резекцією поперечної ободової кишки. Передопераційна підготовка включала введення низькомолекулярних гепаринів. Профілактичну антибіотикотерапію проводили цефалоспоринами ІІІ покоління.
Інструменти: монополярна та біполярна енергія, ультразвуковий кавітатор-аспіратор, кліпатори.
Хірургічне втручання
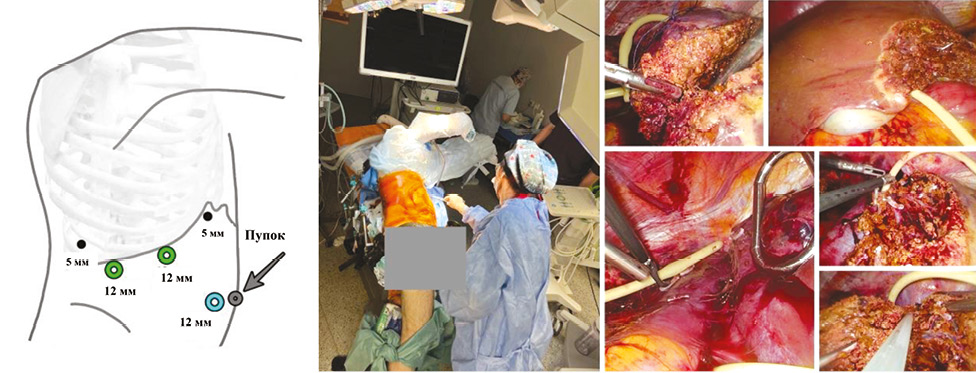
Хірургічний етап резекцій печінки. Базові принципи лапароскопічної хірургії в нашому центрі опубліковано в попередній роботі [19]. Хворого укладено в модифікованій позиції «Left Jack-knife» [20] (рис. 2). Троакари встановлені за методикою Y. Okuda, у тому числі 5 мм у IX міжребер’ї [21]. Для контролю судинного притоку крові застосовано інтермітований маневр Прінгла за методикою, що описана J.-W. Huang [22]. Мобілізація печінки передбачала пересічення правої тріангулярної, правої вінцевої та серповидної зв’язок та виконання часткового маневру «piggy-back». Селективний контроль венозного відтоку реалізували за допомогою турнікету на праву печінкову вену із адаптацією катетера Фолея 14 Fr. Проведено інтраопераційне ультразвукове дослідження для уточнення розташування метастатичних вогнищ. Трансекцію паренхіми здійснено методом «crush-clamp» із застосуванням кавітаційного аспіратора CUZA (див. рис. 2).
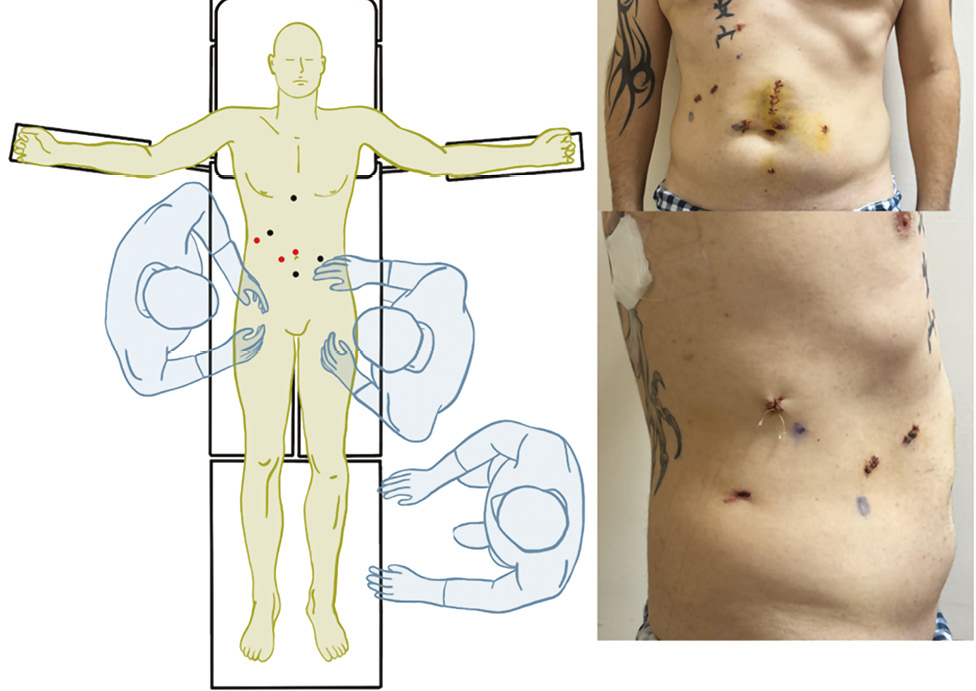
Хірургічний етап резекції попереково-ободової кишки. Пацієнта переведено в положення на спині, додатково встановлено два 5 міліметрових троакари: праворуч параумбілікально та інфраумбілікально (рис. 3). Проведено лапароскопічну резекцію поперечної ободової кишки з наступним формуванням екстракорпорального ручного анастомозу «кінець-у-кінець» між висхідною та низхідною ободовою кишкою.
Загальна тривалість операції — 345 хв, крововтрата — 150 мл, тривалість теплової ішемії при маневрі Прінгла — 28 хв.
Післяопераційний період. Ускладнення класифіковані як IIIA згідно з Clavien — Dindo. Виявлено двобічний ексудативний плеврит та рідинний колектор у площині резекції S7 печінки. Призначено амоксицилін / клавуланат (875 мг 2 р/добу, 5 діб). Анемія (Hb — 64 г/л) коригована гемотрансфузією 2 доз еритроцитарної маси. На момент виписки рівень гемоглобіну становив 108 г/л.
Гістологічне дослідження. У зразках — помірно диференційована аденокарцинома. За молекулярно-генетичним аналізом: мутація NRAS (G12X–G13D, екзон 2), MSS / MSI — стабільні, KRAS і BRAF — дикого типу. Пацієнт під спостереженням, через 3 тиж після виписного епікризу розпочато хімієтерапію за схемою CAPOX. На час публікації хворий переносить 3-й цикл.
Обговорення. Симультанна лапароскопічна хірургія при КРР із СМП є технічно складною хірургічною операцією [23]. Українська асоціація лапароскопічних хірургів визначає локалізацію метастазів у верхньо-задніх сегментах або правому венозному ядрі з високим ризиком масивних, неконтрольованих кровотеч [24, 25]. Кровотеча є однією з основних причин конверсії при резекціях у цій зоні, саме тому слід надавати пріоритет безпеці хворого [26]. Водночас точна й прецизійна робота з ізоляцією правої частки, а також використання турнікетів для контролю притоку та відтоку крові в зонах трансекції паренхіми печінки знижує ризик кровотеч [27, 28]. Під час лапароскопічної трансекції паренхіми сегмента S7 ми рекомендуємо використовувати контроль загального стовбура правої печінкової вени (RHV) за допомогою турнікету. Такий підхід дозволяє зменшити крововтрату та забезпечити впевненість команди під час трансекції.
Безперечно, лапароскопічна хірургія печінки мінімізує хірургічну травму, що сприяє менш вираженому болю та коротшому періоду перебування пацієнта в стаціонарі. Однак досвід відкритих операцій має велике значення для розуміння базових принципів безпеки, що надалі дозволяє виконувати резекції печінки через мінімально травматичний лапароскопічний доступ.
Отже, ми успішно виконали повністю лапароскопічну симультанну анатомічну резекцію сегментів S7, атипову резекцію S4b печінки, а також резекцію поперечної ободової кишки із використанням 7 троакарів із зміною положення пацієнта перед колектомією.
Обмеження. Основним недоліком публікації є лімітована серія виконаних оперативних втручань.
Згода та конфлікт інтересів. Отримано інформовану згоду. Автори заявляють про відсутність конфлікту інтересів.
ВИСНОВКИ
Лапароскопічний хірургічний доступ при КРР із лімітованим метастатичним ураженням печінки може мати перевагу над відкритою хірургією.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Väyrynen, V., Wirta, E. V., Seppälä, T., Sihvo, E., Mecklin, J. P., Vasala, K., & Kellokumpu, I. (2020). Incidence and management of patients with colorectal cancer and synchronous and metachronous colorectal metastases: a population-based study. BJS Open, 4(4), 685–692. doi: 10.1002/bjs5.50299.
2. Hedrick, T. L., & Zaydfudim, V. M. (2022). Management of Synchronous Colorectal Cancer Metastases. Surgical Oncology Clinics of North America, 31(2), 265–278. doi: 10.1016/j.soc.2021.11.007.
3. Bulisani, B. M., Leite, M. A. O., & Waisberg, J. (2024). Liver-first approach to the treatment of patients with synchronous colorectal liver metastases: a systematic review and meta-analysis. Einstein (Sao Paulo), 22, eRW0596. doi: 10.31744/einstein_journal/2024RW0596.
4. Karaoğlan, B. B., Öz, D. K., Araz, M. S., Akyol, C., & Utkan, G. (2024). Advancements in the Management of Synchronous Colorectal Liver Metastases: A Comprehensive Review of Surgical, Systemic, and Local Treatment Modalities. Current Oncology Reports, 26(7), 791–803. doi: 10.1007/s11912-024-01548-z.
5. Burlaka, A. A., Makhmudov, D. E., Lisnyi, I. I., Paliichuk, A. V., Zvirych, V. V., & Lukashenko, A. V. (2022). Parenchyma-sparing strategy and oncological prognosis in patients with colorectal cancer liver metastases. World Journal of Surgical Oncology, 20(1), 122. doi: 10.1186/s12957-022-02579-1.
6. Burlaka, A., Ryzhov, A., Ostapenko, Y., Bankovska, N., Kopchak, K., Zvirych, V., … Lukashenko, A. (2023). Twenty-year experience in liver surgery in metastatic colorectal patients: a case series study in Ukraine. Annals of Medicine and Surgery, 85(5), 1413–1419. doi: 10.1097/MS9.0000000000000619.
7. Avella, P., Vaschetti, R., Cappuccio, M., Gambale, F., Meis, L., Rafanelli, F., … Rocca, A. (2022). The role of liver surgery in simultaneous synchronous colorectal liver metastases and colorectal cancer resections: a literature review of 1730 patients underwent open and minimally invasive surgery. Minerva Surgery, 77(6), 582–590. doi: 10.23736/S2724-5691.22.09716-7.
8. Machairas, N., Di Martino, M., Primavesi, F., Underwood, P., de Santibanes, M., Ntanasis-Stathopoulos, I., … Pawlik, T. M. (2024). Simultaneous resection for colorectal cancer with synchronous liver metastases: current state-of-the-art. Journal of Gastrointestinal Surgery, 28(4), 577–586. doi: 10.1016/j.gassur.2024.01.034.
9. Chan, A. K. C., Jamdar, S., Sheen, A. J., & Siriwardena, A. K. (2018). The OSLO-COMET Randomized Controlled Trial of Laparoscopic Versus Open Resection for Colorectal Liver Metastases. Annals of Surgery, 268(6), e69. doi: 10.1097/SLA.0000000000002640.
10. Rebibo, L., Leourier, P., Badaoui, R., Le Roux, F., Lorne, E., & Regimbeau, J. M. (2019). Minor laparoscopic liver resection as day-case surgery (without overnight hospitalisation): a pilot study. Surgical Endoscopy, 33(1), 261–271. doi: 10.1007/s00464-018-6306-x.
11. Sijberden, J. P., Hoogteijling, T. J., Aghayan, D., Ratti, F., Tan, E. K., Morrison-Jones, V., … Abu Hilal, M. (2024). International consortium on Minimally Invasive Liver Surgery (I-MILS). Robotic Versus Laparoscopic Liver Resection in Various Settings: An International Multicenter Propensity Score Matched Study of 10.075 Patients. Annals of Surgery, 280(1), 108–117. doi: 10.1097/SLA.0000000000006267.
12. Sijberden, J. P., Zimmitti, G., Conci, S., Russolillo, N., Masetti, M., Cipriani, F., … Abu Hilal, M. (2023). Simultaneous resection of colorectal cancer and synchronous liver metastases: what determines the risk of unfavorable outcomes? An international multicenter retrospective cohort study. International Journal of Surgery, 109(3), 244–254. doi: 10.1097/JS9.0000000000000068.
13. Une, N., Kobayashi, S., Kudo, M., Sugimoto, M., Kitaguchi, D., Hasegawa, H., … Gotohda, N. (2024). Predictive risk factors for resection surface-related complications after laparoscopic simultaneous resection of primary colorectal tumor and synchronous liver metastases: a single-center retrospective study. Surgical Endoscopy, 38(9), 5006–5016. doi: 10.1007/s00464-024-10964-y.
14. Thiruchelvam, N., Lee, S. Y., & Chiow, A. K. H. (2021). Patient and port positioning in laparoscopic liver resections. Hepatoma Research, 7, 22. dx.doi.org/10.20517/2394-5079.2020.144.
15. Han, H. S., & Cho, J. Y. (2021). Color Atlas of Laparoscopic Liver Resection. Singapore: Springer. doi.org/10.1007/978-981-16-1546-7_1.
16. Gholami, S., Judge, S. J., Lee, S. Y., Mashayekhi, K., Goh, B. K. P., Chan, C. Y., … Kingham, T. P. (2020). Is minimally invasive surgery of lesions in the right superior segments of the liver justified? A multi-institutional study of 245 patients. Journal of Surgical Oncology, 122(7), 1428–1434. doi: 10.1002/jso.26154.
17. Perfecto, A., Gastaca, M., Prieto, M., Cervera, J., Ruiz, P., Ventoso, A., … Valdivieso, A. (2022). Totally laparoscopic simultaneous resection of colorectal cancer and synchronous liver metastases: a single-center case series. Surgical Endoscopy, 36(2), 980–987. doi: 10.1007/s00464-021-08362-9.
18. Sohrabi, C., Mathew, G., Maria, N., Kerwan, A., Franchi, T., & Agha, R. A. (2023). The SCARE 2023 guideline: updating consensus Surgical CAse REport (SCARE) guidelines. International Journal of Surgery, 109(5), 1136–1140. doi: 10.1097/JS9.0000000000000373.
19. Rozhkova, V., Burlaka, A., Lukashenko, A., Ostapenko, Y., & Bezverkhnyi, V. (2023). Laparoscopic and Open Liver Resections for Colorectal Cancer Liver Metastasis in the Ukrainian State Center. Cureus, 15(5), e38701. doi: 10.7759/cureus.38701.
20. Chen, J. C., Zhang, R. X., Chen, M. S., Xu, L., Chen, J. B., Yang, K. L., … Zhou, Z. G. (2017). Left jackknife position: a novel position for laparoscopic hepatectomy. Chinese Journal of Cancer Research, 36, 31. doi: 10.1186/s40880-017-0190-y.
21. Okuda, Y., Honda, G., Kurata, M., Kobayashi, S., Sakamoto, K., & Takahashi, K. (2015). A safe and valid procedure for pure laparoscopic partial hepatectomy of the most posterosuperior area: the top of segment 7. Journal of the American College of Surgeons, 220(3), e17–21. doi: 10.1016/j.jamcollsurg.2014.11.021.
22. Huang, J. W., Su, W. L., & Wang, S. N. (2018). Alternative Laparoscopic Intracorporeal Pringle Maneuver by Huang’s Loop. World Journal of Surgery, 42(10), 3312–3315. doi: 10.1007/s00268-018-4584-z.
23. Zarogoulidis, P., Ioannidis, A., Vagionas, A., Perdikouri, E. I., Christakidis, V., Anemoulis, M., … Sapalidis, K. (2024). Simultaneous Resection for Colorectal and Liver Metastases, new equipment and personalized medicine. Journal in cancer, 15(3), 610–614. doi: 10.7150/jca.90519.
24. Ban, D., Nara, S., Takamoto, T., Mizui, T., Yoshino, J., Esaki, M., & Shimada, K. (2021). Revisiting the role of the hepatic vein in laparoscopic liver resection. Hepatoma Research, 7, 13. doi.org/10.20517/2394-5079.2020.104.
25. Berardi, G., Igarashi, K., & Wakabayashi, G. (2019). Laparoscopic liver resection-education and training. Translational Gastroenterology and Hepatology, 4, 11. doi: 10.21037/tgh.2019.01.10.
26. Sijberden, J. P., Kuemmerli, C., Ratti, F., D’Hondt, M., Sutcliffe, R. P., Troisi, R. I., … Abu Hilal, M. (2025). Laparoscopic versus open parenchymal preserving liver resections in the posterosuperior segments (ORANGE Segments): a multicentre, single-blind, randomised controlled trial. Lancet Regional Health, 51, 101228. doi: 10.1016/j.lanepe.2025.101228.
27. Tranchart, H., O’Rourke, N., Van Dam, R., Gaillard, M., Lainas, P., Sugioka, A., … Dagher, I. (2015). Bleeding control during laparoscopic liver resection: a review of literature. Journal of Hepato-Biliary-Pancreatic Sciences, 22(5), 371–378. doi: 10.1002/jhbp.217.
28. Yang, W., Peng, Y., Yang, Y., Liang, B., Li, B., Wei, Y., & Liu, F. (2024). Caudo-dorsal approach combined with the occlusion of right hepatic vein and Pringle maneuver in laparoscopic anatomical resection of segment 7. Surgical Endoscopy, 38(6), 3455–3460. doi: 10.1007/s00464-024-10908-6.
Адреса для листування:
Микитюк Артем
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: mikityuk9797@gmail.com
Correspondence:
Artem Mykytyuk
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: mikityuk9797@gmail.com














Leave a comment