Бронхіолоальвеолярний рак легень у кожному недрібноклітинному типі
Болгова Л.С., Мед В.В., Борисюк Б.О.
Резюме. Вступ. Рак легень (РЛ) є найбільш поширеним онкологічним захворюванням у світі. Висока захворюваність і смертність від цього захворювання потребує всебічних досліджень. РЛ діагностують на пізніх стадіях, що ставить запитання визначення причин ситуації, що склалася. Одним з першочергових завдань є визначення гістогенезу РЛ, від чого залежать питання рентгенологічної, морфологічної діагностики, а відтак і ефективність лікування. Мета. Визначити ділянки бронхіолоальвеолярного РЛ у структурі недрібноклітинного типу для уточнення початку розвитку. Матеріал і методи дослідження. Вивчені серійні зрізи операційного матеріалу 30 хворих на недрібноклітинний РЛ, які обстежувалися і лікувалися в Державному некомерційному підприємстві (ДНП) «Національний інститут раку». Використали методику забарвлення гематоксиліном і еозином, Howell, Black та проводили імуногістохімічні дослідження з моноклоналами фірми DAKO — Ki-67 та ядерний антиген проліферуючих клітин (Proliferating Cell Nuclear Antigen — PCNA). Результати дослідження. Спеціальне детальне дослідження серійних зрізів препаратів від 30 хворих на недрібноклітинний РЛ дозволило визначити в усіх гістологічних препаратах ділянки бронхіолоальвеолярного раку легень (БАРЛ) і підтвердити морфологічними та імуногістохімічними показниками початок його росту з базальних клітин альвеоли. Висновки. Гістологічні дослідження серійних зрізів операційного матеріалу хворих на недрібноклітинний рак дозволило виявити у всіх препаратах ділянки типової структури БАРЛ з визначенням початку росту від базальної мембрани легень до їх центру, що підтверджено низкою морфологічних та імуногістохімічних показників і є доказовим обґрунтуванням гістогенезу РЛ зі стовбурових клітин (СК).
Одержано 20.11.2025
Прийнято до друку 3.12.2025
DOI: 10.32471/clinicaloncology.2663-466X.35065
ВСТУП
РЛ — найбільш часте онкологічне захворювання у світі [1]. Пізня діагностика і висока смертність від РЛ спонукає вчених вивчати різні аспекти цього захворювання. Одним з важливих завдань є вивчення гістогенезу РЛ, від чого залежить більш цілеспрямована рентгенологічна і морфологічна діагностика, клінічний перебіг хвороби та ефективність лікування. Відомі численні експериментальні дослідження стосовно визначення джерела розвитку РЛ, але до цього часу вчені ще не дійшли до обґрунтованого однозначного висновку про гістогенез цього надзвичайно загрозливого патологічного процесу [2]. Фіксується висока смертність — 60–70% протягом року з дня верифікації патологічного процесу [3]. Вивчаючи особливості клінічних проявів РЛ, вченим незрозуміло, чому після оперативного лікування хворих, навіть на ранній стадії розвитку пухлини, швидко настає рецидив [4, 5]. Деякі вчені згадують про те, що пухлинний вузол РЛ складається з декількох ділянок різної гістологічної структури — плоскоклітинної, залозистої, дрібноклітинної та іншої. Але автори лише констатують виявлений факт, не оцінюючи його значення [6, 7]. Одним із напрямків сучасного дослідження РЛ є визначення поширення ракових клітин повітроносними шляхами, що свідчить, як оцінюють автори, про поширеність онкологічного процесу [8]. Водночас вчені не враховують нові дані про вивчення гістогенезу РЛ [9].
Усі ці невизначені питання потребують детального вивчення початку розвитку, особливостей гістологічної структури розвиненого РЛ та розкриття низки питань про наявність і квантитативність ділянок різних гістологічних типів РЛ в одному пухлинному вузлі.
Мета. Визначити ділянки бронхіолоальвеолярного РЛ у структурі недрібноклітинного типу для уточнення початку розвитку.
МАТЕРІАЛ І МЕТОДИ ДОСЛІДЖЕННЯ
Вивчені детальні морфологічні особливості гістологічної структури РЛ різних гістологічних типів у 30 хворих, які обстежувалися і лікувалися в ДНП «Національний інститут раку» у 2023–2025 рр. У поточній морфологічній діагностиці установлено переважно залозистий РЛ у 15 хворих і переважно плоскоклітинний — у ще 15 пацієнтів. Проведені наукові дослідження гістологічних серійних зрізів операційного матеріалу всіх 30 хворих. Забарвлення гістологічних препаратів проводили гематоксиліном і еозином, за методом Папаніколау, Howell, Black та використали моноклональні антитіла фірми DАКО. Найбільш показовими для наших досліджень виявилися моноклональні антитіла Ki-67 і РCNA. Використали мікроскоп Olympus BX-41, збільшення ×100, 200, 400, 1000. Гістологічний тип РЛ встановлювали згідно з Міжнародною гістологічною класифікацією пухлин легень Всесвітньої організації охорони здоров’я (ВООЗ) [10].
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ та ОБГОВОРЕННЯ
Проведено аналіз результатів поточної гістологічної діагностики операційного матеріалу, а також детальних наукових досліджень серійних зрізів у 30 хворих на недрібноклітинний РЛ.
У групі з 15 хворих на переважно плоскоклітинний РЛ у процесі поточної діагностики визначено гістологічний тип у 6 (40%), низькодиференційований варіант — у 7 (47%), диморфний рак (плоскоклітинний і залозистий) — у 2 (13%) пацієнтів.
У групі з 15 хворих на переважно залозистий РЛ визначено гістологічний тип у 12 (80%), аденосквамозний рак — у 3 (20%) пацієнтів.
За загальними даними за 2 типами РЛ, які наразі називаються недрібноклітинними, та матеріалами 18 (60%) хворих встановлений певний гістологічний тип, а в інших 12 (40%) випадках гістологічних препаратів визначалися недрібноклітинний рак (3), плоскоклітинний незроговілий (4) і плоскоклітинний рак з ділянками залозистого типу (5).
З вищевикладеного свідчить, що недрібноклітинний РЛ у своїй структурі має окремі ділянки 2 типів РЛ і різного ступеня диференціювання, що дає можливість логічно передбачити одне джерело їх розвитку.
Спеціальне детальне дослідження серійних зрізів усіх препаратів від 30 хворих дозволило визначити ділянки, де ріст РЛ відмічався в альвеолах з характерним напрямком росту від базальної мембрани до центру, в якому часто виявлялися некротичні маси з пухлинними клітинами з усіма характерними морфологічними ознаками БАРЛ. У структурі плоскоклітинного раку виявлений солідний ріст пухлини, який заповнює альвеоли. Чітко прослідковуються окремі альвеоли, заповнені пухлинними клітинами. У таких ділянках можна фіксувати міжальвеолярні перетинки, іноді з еритроцитами в них (рис. 1, 2). Серед альвеол з пухлинним ростом відзначаються такі, що уражені раком наполовину, а також деякі альвеоли без ураження РЛ з типічним вмістом всередині альвеол пневмоцитів І типу (АТІ), макрофагів і лейкоцитів. Поруч з тим визначаються типові структури плоскоклітинного раку з різним ступенем диференціювання, ділянками фіброзу між альвеолами. Зазначені різні компоненти гістологічних ділянок у складі плоскоклітинного раку створюють складності в поточній гістологічній діагностиці при уточненні типу РЛ і ступеня його диференціювання.
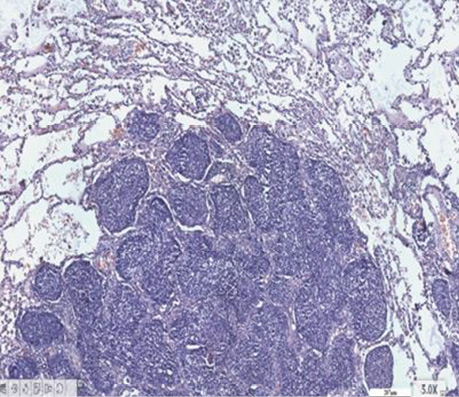
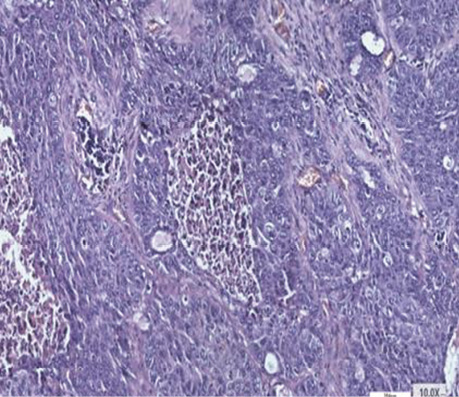
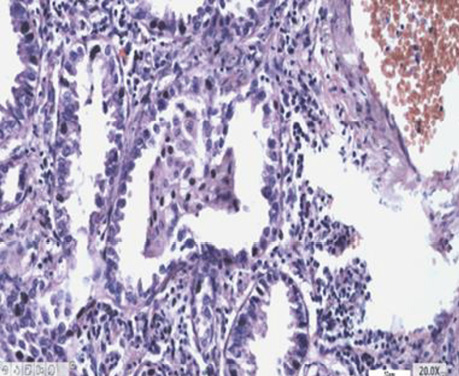
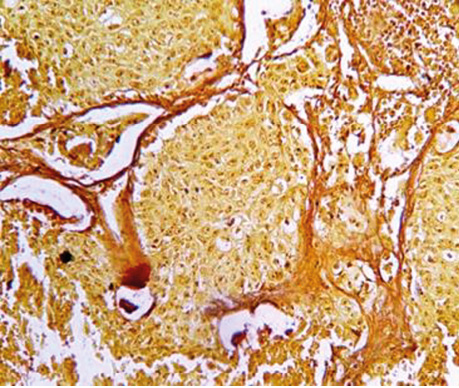
У гістологічній структурі залозистого раку виявлялися солідні ділянки росту аденокарциноми з ознаками різного ступеня диференціювання. Ідентифікувалися ділянки БАРЛ, де можна було фіксувати його ріст в альвеолах. Прослідковувалися великі альвеоли з чітко визначеним ростом РЛ в них, які заповнювали всю альвеолу з некрозом у центрі (рис. 3–6).
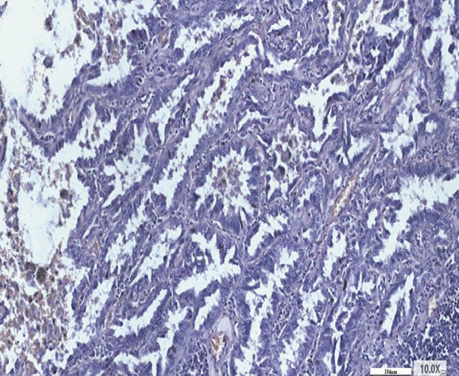
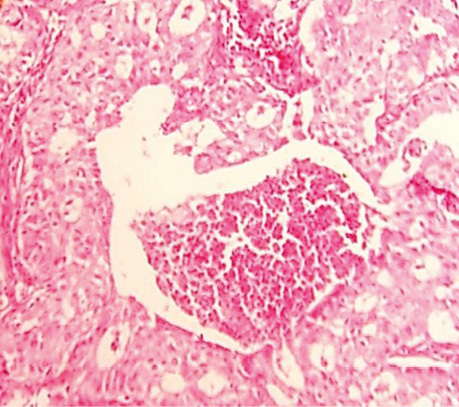
У процесі детального вивчення серійних зрізів гістологічних препаратів операційного матеріалу хворих на недрібноклітинний РЛ постійно в різній кількості виявлялися ділянки БАРЛ. Цей феномен підтверджує наявність і морфофункціональну сутність раніше установлених СК легень, які, згідно із законами біології і логіки, є і СК РЛ. Виявлений факт свідчить про початок розвитку РЛ зі СК, тобто з альвеолоцитів 2-го типу (АТІІ), яким, як доводить автор у фундаментальній монографії, характерна найбільш висока мітотична активність, а також більш швидке оновлення в процесі свого росту і функціонування порівняно з іншими епітеліальними клітинами легень [11]. Тобто АТІІ є базовими в альвеолах і, за електронномікроскопічними дослідженнями, вони найбільш реактивні, для них характерна висока проліферативна активність. З другого боку, у процесі диференціювання вони є джерелом альвеолоцитів 1-го типу (АТІ), зрілих їх форм [12].
На основі вищезгаданих фундаментальних досліджень при вивченні серійних зрізів операційного матеріалу хворих на РЛ особливу увагу ми звернули на наявність ділянок, характерних для БАРЛ за усіма клітинними ознаками і характером росту. Нами виявлено в кожному препараті переважно плоскоклітинного і переважно залозистого РЛ ділянки БАРЛ. У гістологічних препаратах залозистого РЛ такі структури траплялися часто, іноді займали великі площі з усіма характерними ознаками росту цього типу новоутворення. У гістологічних препаратах усіх хворих на переважно плоскоклітинний рак теж відмічалися ділянки БАРЛ різного розміру. Крім того, нами виявлені, не описані в медичній літературі, цікаві показові структури, коли РЛ росте в альвеолі, переповнює її, проростає базальну мембрану і солідним пластом росте в міжальвеолярному просторі (див. рис. 6). Подібне розростання пухлини може бути причиною наявності різних строкатих ділянок, що може ускладнювати визначення гістологічного типу РЛ. Патологоанатоми в процесі гістологічної діагностики РЛ не фіксують наявність ділянок БАРЛ у зв’язку з тим, що в новій Міжнародній гістологічній класифікації пухлин легень ВООЗ цей тип раку належить до підтипу залозистого РЛ, і тільки окремо виділяється вистілковий його варіант (lipidic).
Отже, детальне вивчення гістологічної структури плоскоклітинного і залозистого РЛ дозволило виявити в кожному препараті 30 хворих ділянки БАРЛ, тобто тих місць, з яких починається ріст РЛ від базальної мембрани альвеоли і продовжується до її центру. Такий напрямок росту пухлини можна оцінити за допомогою не тільки морфологічних ознак клітин, характеру їх забарвлення, але і за результатами імуногістохімічних реакцій. Використані нами моноклональні антитіла Ki-67 і PCNA, за допомогою яких можна виявити ступінь проліферації клітин, зумовили позитивну реакцію в клітинах базальних шарів і негативну в тих екземплярах, які ростуть над ними і наближалися до центру альвеол, вони були більш зрілими і з ознаками розпаду (див. рис. 5). У результаті виконаних досліджень можна констатувати, що морфологічні ознаки, напрямок росту ракових клітин в альвеолах і підтвердження їх проліферативної активності росткової зони імуногістохімічними дослідженнями дають привід вважати СК (АТІІ) істинними зародковими центрами РЛ.
ВИСНОВКИ
1. Гістологічні дослідження серійних зрізів операційного матеріалу хворих на недрібноклітинний рак дозволили виявити у всіх препаратах ділянки типової структури БАРЛ з визначенням початку росту від базальної мембрани легень до її центру, що підтверджено низкою морфологічних та імуногістохімічних показників і є доказовим обґрунтуванням гістогенезу РЛ зі СК.
2. Розвиток РЛ зі СК пояснює відомий у науковій літературі мультифокальний ріст навіть у разі первинної діагностики патологічного процесу, безсимптомний початок і пролонгацію захворювання до виникнення клінічних симптомів, коли хворий звертається по медичну допомогу, і тоді РЛ діагностують у переважній більшості на III–IV стадіях, коли уже неможливо використати повний комплекс лікувальних процедур, що зумовлює песимістичний прогноз і високу смертність від цієї патології.
3. Визначене джерело розвитку РЛ зі СК в альвеолах, які розгалужені в усій паренхімі легень і можуть бути зародком РЛ, передбачає необхідність нового підходу до рентгенологічної, морфологічної, клінічної діагностики та ефективного лікування, а також до розробки перспективних програм профілактики.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Bray, F., Laversanne, M., Sung, H., Ferlay, J., Siegel, R. L., Soerjomataram, I., & Jemal, A. (2024). Global cancer statistics 2022:GLOBOCAN estimates of Incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer Journal for Clinicians, 74(3), 229–263. doi: 10.3322/caac.21834.
2. Ferone, G., Lee, M. C., Sage, J., & Berns, A. (2020). Cells of origin of lung cancers: lessons from mouse studies. Genes & Development, 34(15–16), 1017–1032. doi: 10.1101/gad.338228.120.
3. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2025). Рак в Україні, 2023–2024. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України (Vol. 26). Кропивницький: Поліум. [Fedorenko, Z. P., Sumkina, O. V., Horokh, Ye. L., & Hulak, L. O. (2025). Rak v Ukraini, 2023–2024. Zakhvoriuvanist, smertnist, pokaznyky diialnosti onkolohichnoi sluzhby. Biuleten Natsionalnoho kantser-reiestru Ukrainy (Vol. 26). Kropyvnytskyi: Polium. Ukrainіan].
4. Yi, E., Bae, M., Cho, S., Chung, J. H., Jheon, S., & Kim, K. (2018). Pathological prognostic factors of recurrence in early stage lung adenocarcinoma. ANZ Journal of Surgery, 88(4), 327–331. doi: 10.1111/ans.14033.
5. Bains, S., Eguchi, T., Warth, A., Yeh, Y. C., Nitadori, J. I., Woo, K. M., … Adusumilli, P. S. (2019). Procedure-specific risk prediction for recurrence in Patients undergoing lobectomy or sublobar resection for small (<2 cm) lung adenocarcinoma: an international cohort analysis. Journal of Thoracic Oncology, 14(1), 72–86. doi: 10.1016/j.jtho.2018.09.008.
6. Lin, M. W., Su, K. Y., Su, T. J., Chang, C. C., Lin, J. W., Lee, Y. H., … Hsieh, M. S. (2018). Clinicopathological and genomic comparisons between different histologic components in combined small cell lung cancer and non-small lung cancer. Lung Cancer, 125, 282–290. doi: 10.1016/j.lungcan.2018.10.006.
7. Sousaa, V. M. L., & Carvalho, L. (2018). Heterogenity in Lung Cancer. Pathobiology, 85, 96–107. doi: 10.1159/000487440.
8. Travis, W. D., Eisele, M., Nishimura, K. K., Aly, R. G., Bertoglio, P., Chou, T. Y., … Asamura, H. (2024). The International Association for the Study of Lung Cancer (IASLC) Staging Project for Lung Cancer: Recommendation to Introduce Spread Through Air Spaces as a Histologic Descriptor in the Ninth Edition of the TNM Classification of Lung Cancer. Analysis of 4061 Pathologic Stage I NSCLC. Journal of Thoracic Oncology, 9(7), 1028–1051. doi: 10.1016/j.jtho.2024.03.015.
9. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., & Ponomarenko, A. A. (2022). On the origin of lung cancer development. Experimental oncology, 44(1), 17–22. doi.org/10.32471/exp-oncology.2312-8852.vol-44-no-1.17227.
10. World Health Organization (2021). Publication of the WHO Classification of Tumours (5th ed.), V. 5. Retrieved from http://www.iarc.who.int/news-events/ publication-of-the-who-classification-of-tumours-5th-edition-volume-5-thoracic-tumours/.
11. Weibel, E. R. (1970). Morphometry of human lungs. Berlin: Springer.
12. Загорулько, А. К., & Аскари, Т. А. (2002). Атлас ультраструктурной морфологии респираторного отдела легких. Симферополь: «AZ — PRESS» — «СОНАТ». [Zahorulko, A. K., & Askary, T. A. (2002). Atlas ultrastrukturnoi morfolohyy respyratornoho otdela lehkykh. Symferopol: «AZ — PRESS» —«SONAT». Ukrainіan].
Адреса для листування:
Болгова Лідія Севастянівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: bolgova2006@ukr.net
Correspondence:
Lidiya Bolgova
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: bolgova2006@ukr.net














Leave a comment