Лапароскопічний доступ у хірургічному лікуванні метастатичного ураження печінки у хворих на колоректальний рак. Наративний огляд наукової літератури, практичні рекомендації
Безверхний В.А.1, Бурлака А.А.2,3
- 1Ірпінський військовий шпиталь, Ірпінь, Україна
- 2Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 3Національний медичний університет імені О.О. Богомольця, Київ, Україна
Резюме. Метою цього огляду є аналіз сучасних доказів щодо ефективності та безпеки лапароскопічних резекцій печінки в лікуванні метастазів колоректального раку (мКРР). Проведено структурований пошук наукової літератури в PubMed за 2015–2025 рр. із включенням рандомізованих, проспективних та високоякісних ретроспективних досліджень і метааналізів. Виявлено, що лапароскопічний доступ забезпечує меншу травматичність, зниження частоти післяопераційних ускладнень на 30–50%, скорочення тривалості госпіталізації на 2–3 доби та зменшення вираженості системної запальної відповіді (зниження рівня інтерлейкіну (ІЛ) 6 на близько 40%) при збереженні онкологічної радикальності та порівняних показників 5-річної виживаності (44–45%). Особливу увагу приділено впливу кривої навчання, технічним аспектам резекцій у «верхніх» сегментах печінки, можливостям лапароскопії в повторних операціях, двоетапних стратегіях та mini-ALPPS. У світі частка лапароскопічних резекцій печінки (ЛРП) в провідних центрах досягає 35–40%, що відображає широку імплементацію методу. Отримані дані підтверджують доцільність широкого застосування лапароскопічного доступу в лікуванні мКРР за умови відповідної підготовки хірургічної команди та технічного забезпечення.
Одержано 3.12.2025
Прийнято до друку 15.12.2025
DOI: 10.32471/clinicaloncology.2663-466X.35156
ВСТУП
Колоректальний рак (КРР) є 4-ю за поширеністю причиною захворювання в Україні з 15 тис. новими випадками хвороби щороку [1]. Ця онкопатологія спричиняє синхронні метастази в печінку у ¼ випадків, тоді як метахронний прояв метастатичного захворювання реєструється до 60% за період anamnesis morbi [2]. Аналіз даних медичної літератури свідчить, що впродовж останніх десятиліть хірургічне видалення метастатичного ураження печінки мКРР сприяло найкращим онкологічним результатам, а R0-резекція залишається одним з найважливіших прогностичних факторів [2]. Тим часом малоінвазивна хірургія, яка була впроваджена в хірургічних стратегіях первинних та вторинних злоякісних новоутворень печінки, мала багато переваг [3]. Ключовим етапом у становленні методу став Louisville Statement (2008), який офіційно визнав ЛРП безпечною та відтворюваною методикою. У подальшому консенсус у Токіо (2014) розширив показання, а рекомендації Міжнародної спілки лапароскопічної хірурігії печінки (International Laparoscopic Liver Society — ILLS) (2018, 2021) закріпили поняття «малої лапароскопічної резекції» як стандарту хірургічної допомоги [4]. А після публікації серії успішних досліджень багато лікарень світу активно впроваджували ЛРП у рутинну практику [5]. Варто відзначити популяційне дослідження результатів хірургії печінки, проведене хірургічними центрами Норвегії, за допомогою якого виявлено, що відсоток лапароскопічних процедур становив 37,8%. Його було опубліковано у 2023 р. [6]. Це дослідження підтвердило переваги в короткострокових результатах, тоді як виживаність була порівнянною з відкритою хірургією печінки. А окремі рандомізовані дослідження продемонстрували економічну ефективність ЛРП порівняно з відкритою хірургією з ймовірністю до 67%. Однак українські державні хірургічні центри покладаються переважно на відкриту хірургію печінки [7]. Тому метою нашої публікації став аналіз літературних даних щодо сучасних алгоритмів застосування лапароскопічного доступу в хірургії печінки при мКРР.
Дизайн. Це наративний огляд наукової літератури, проведений шляхом систематизованого пошуку джерел у базі PubMed за період 2015–2025 рр. із включенням рандомізованих, проспективних та високоякісних ретроспективних досліджень, а також повних метааналізів. Відбір публікацій здійснювали за принципами релевантності до теми ЛРП при мКРР та відповідності сучасним хірургічним підходам (рисунок). Додатково проводився селективний аналіз робіт, що описують криву навчання, технічні аспекти лапароскопії та фактори, які впливають на онкологічні результати. Загалом структурований пошук забезпечив формування репрезентативної вибірки джерел для об’єктивної оцінки ефективності та безпеки лапароскопічного доступу.
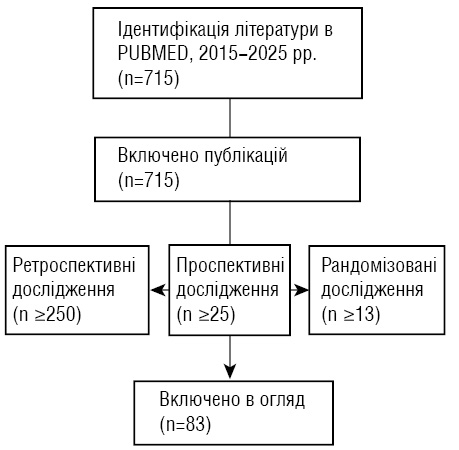
Рисунок. Блок-схема відбору публікацій для проведення аналізу
РЕЗУЛЬТАТИ
Хірургічна безпека. ЛРП обґрунтовано вважаються безпечною хірургією, що підтверджено низкою публікацій та метааналізів [8–12]. Автори досліджень пояснюють такі результати низкою технічних переваг, зокрема збільшеним зображенням, що полегшує дисекцію судинних структур, пневмоперитонеум сприяє «тампонаді» венозної кровотечі з печінки, а менший хірургічний доступ редукує хірургічний стрес [13]. Це особливо важливо для мінімізації крововтрати під час хірургії печінки з приводу мКРР та при патологічно зміненій паренхімі, синусоїдальному обструктивному пошкодженні, регенераторній вузловій гіперплазії чи стеатогепатиті печінки, що підвищують ризики [14]. Цікаво, що при ЛРП кров повністю аспірується, тому об’єм крововтрати визначається більш точно порівняно з відкритою хірургією, де часто використовують серветки [15]. Це, своєю чергою, може сприяти більш обмежувальній політиці щодо гемотрансфузій при лапароскопічних резекціях. Зменшення обсягу хірургічної травми, інтраопераційної кровотечі та потреби в заміщенні компонентів крові, зі свого боку, тісно пов’язане з післяопераційними ускладненнями [16]. Менші розрізи, що використовуються під час лапароскопії, зумовлюють менш виражений післяопераційний біль і потребу в анальгетиках у післяопераційний період [17]. Крім того, швидше відновлення функції кишечнику та раннє ентеральне харчування також має місце [18]. Останнє полегшує швидку мобілізацію та відновлення після операції, дозволяючи пацієнтам виписуватися зі стаціонару в межах 2–4-ї доби [19]. Пацієнти, які перенесли ЛРП з приводу мКРР, мали вищу післяопераційну якість життя через 1 та 4 міс порівняно з пацієнтами групи відкритої хірургії [20]. ЛРП асоціюються зі значно нижчим рівнем системної запальної відповіді, що підтверджується динамікою ключових біомаркерів, зокрема ІЛ-6 та C-реактивного білка (CРБ) [21]. Серед іншого, у рандомізованому дослідженні рівень ІЛ-6 на 1-шу післяопераційну добу після відкритої резекції печінки становив 116,2 пг/мл, тоді як у групі лапароскопії — 73,6 пг/мл (p <0,05), що відображає майже 40% зменшення цитокінового викиду [21]. Подібний ефект встановлено й для CРБ: метааналіз свідчить, що концентрація маркера на 1–2-гу добу після операції була нижчою у пацієнтів після лапароскопії зі стандартизованою різницею в середньому –0,65 (p=0,02), а на 2-гу добу –1,31 (p <0,001), що свідчить про більш м’яку гострофазову реакцію [22]. Сукупно ці дані підтверджують, що лапароскопічний доступ зменшує вираженість системного запалення та біомаркерного прояву хірургічного стресу порівняно з відкритими резекціями печінки.
Онкологічна безпека. Із розширенням показань до ЛРП однією з головних проблем був контроль краю резекції та відступу від пухлинної тканини [23]. Це було особливо важливо, оскільки при лапароскопії втрата тактильного зворотного зв’язку більше не дозволяла пальпувати щільні ураження всередині паренхіми печінки. Щоб подолати це та інші обмеження, пов’язані з лапароскопічною мобілізацією печінки, особливо задньо-верхніх сегментів, спочатку застосовувалася відеоасистована техніка [24]. Однак наявність руки в обмеженому операційному полі часто погіршувала візуалізацію під час операції. Саме інтраопераційна ультрасонографія змінила якість хірургії при лапароскопічному доступі, забезпечивши прийнятні краї резекції [25]. У більшості метааналізів автори дійшли висновку, що статус краю резекції та показники рецидивів при ЛРП не гірші, ніж при відкритому підході, а в кількох дослідженнях навіть повідомлялося про вищі показники R0-резекцій у лапароскопічних групах [26, 27].
Важливо, що більшість проспективних та рандомізованих досліджень свідчать про подібні онкологічні результати після ЛРП та відкритих резекцій [28]. У більшості метааналізів ретроспективних досліджень не виявлено значущих відмінностей у показниках кумулятивної загальної та безрецидивної виживаності між лапароскопічними та відкритими групами [29–32]. Метааналіз цих пацієнтів із 2 рандомізованих досліджень та 13 досліджень із застосуванням методу propensity-matching виявив перевагу ЛРП при мКРР у виживаності навіть через 10 років, а також у осіб літнього віку [33]. Певною мірою такі результати можна пояснити селекцією хворих, коли в ранніх дослідженнях для лапароскопічної резекції відбирали лише високоселективну когорту пацієнтів із невеликими вогнищами із локалізацією в периферичних сегментах. Крім того, ЛРП виконували переважно дуже досвідчені хірурги у високоспеціалізованих центрах. Наприклад, дослідження LapOpHuva було розпочате лише після того, як його автори виконали щонайменше 50 ЛРП та стандартизували техніку, тоді як OSLO-COMET стартувало після більш ніж 400 лапароскопічних резекцій. Хірургічний досвід і кваліфікація є незалежними предикторами загальної виживаності, тому вони могли вплинути на отримані результати [34].
Існують й інші можливі механізми, що пояснюють позитивні віддалені результати після ЛРП. Добре відомо, що переливання крові та післяопераційні ускладнення є незалежними чинниками, які впливають на виживаність, і зниження їх частоти при ЛРП могло сприяти кращим довгостроковим результатам [35]. Також ад’ювантна хімієтерапія є ключовим компонентом лікування хворих на мКРР, і пацієнти після ЛРП можуть швидше відновлюватися та розпочинати хімієтерапевтичні схеми, ніж ті, кому проведено відкриту хірургію [36].
Не можна ігнорувати й імунні механізми в контексті післяопераційного періоду. Зокрема, в експлораторному аналізі біомаркерів у дослідженні OSLO-COMET було зафіксовано, що відкрита резекція асоціюється з підвищеними рівнями прозапальних молекул, таких як хемокін HMGB-1, ІЛ-6 та фактор некрозу пухлини альфа (Tumor necrosis factor-alfa — TNF-a), що свідчить про активну системну імунну відповідь організму на хірургічну травму. Ці дані підкреслюють, що післяопераційне запалення не обмежується лише фізіологічним процесом загоєння ран, а чинить складний системний вплив на організм, включно з регуляцією імунної активності та метаболізмом тканин.
Експериментальні дані свідчать, що сигнальні шляхи запалення, які сприяють регенерації тканин і загоєнню ран після хірургічної травми, можуть стимулювати й активувати ріст «сплячих» мікрометастазів [37]. Зокрема, активація сигнальних шляхів NF-κB та STAT3 у пухлинних клітинах може підвищувати їх проліферацію і виживання, тоді як сигнальний шлях ендотеліального фактора росту (Vascular Endothelial Growth Factor — VEGF) може зумовлювати ангіогенез та формування сприятливого мікрооточення для росту віддалених осередків. Це біологічне явище було запропоноване як одне з пояснень різкого зростання частоти віддалених рецидивів після операцій при певних видах онкопатології, наприклад, раку молочної залози, а також обговорюється в контексті КРР [38].
Лапароскопічний хірургічний доступ при малих резекціях печінки. Результати рандомізованого контрольованого дослідження OSLO-COMET свідчать, що ЛРП у пацієнтів при мКРР супроводжується нижчим рівнем післяопераційних ускладнень і скороченням тривалості післяопераційного перебування в лікарні (53 проти 96 год) порівняно з відкритою резекцією печінки [27]. Автори також довели, що між групами не було різниці за крововтратою, тривалістю операції та 90-денною летальністю.
Додатковий аналіз, куди залучали лише пацієнтів із метастазами у верхньо-задніх сегментах, виявив, що пацієнти після ЛРП також мали коротший період відновлення та значно вищу якість життя в подальшому [39]. Подібні результати були опубліковані в проспективному рандомізованому дослідженні (LapOpHuva), яке напряму порівнювало результати ЛРП та відкритої резекції печінки при мКРР [28]. Відповідно до даних рандомізованих досліджень, у пацієнтів після ЛРП відзначали нижчу загальну частоту ускладнень та коротший період перебування у стаціонарі. Водночас тривалість операції, об’єм крововтрати, потреба в гемотрансфузії та рівні летальності були подібними до групи відкритих резекцій.
Дані ретроспективних досліджень свідчать, що лапароскопічний метод може мати ще більше переваг. Загальний висновок полягає в тому, що ЛРП асоціюється з меншим об’ємом крововтрати, рідшою потребою в переливанні крові, коротшою тривалістю перебування в лікарні та нижчою частотою післяопераційних ускладнень, при цьому показники смертності залишаються аналогічними до відкритих резекцій. Подібні результати були отримані й у дослідженнях, що аналізували використання ЛРП при гепатоцелюлярній карциномі, де також повідомляли про кращі короткострокові результати навіть після великих гепатектомій [40]. Цікавим є той факт, що подовження тривалості операції при ЛРП зафіксоване лише у 2 дослідженнях (на 14 та 40 хв відповідно) [41, 42].
Ми вивчили метааналіз, що включив 10 досліджень із застосуванням propensity-matching та охопив 2259 пацієнтів: серед них 980 ЛРП та 1279 відкритих резекцій [13]. Результати останнього підтвердили, що лапароскопічний підхід супроводжується меншим об’ємом крововтрати, нижчими частотою переливань крові, загальною захворюваністю та коротшим терміном перебуванням у лікарні. Водночас відмічалася дещо довша тривалість операції (середня різниця становила 39±48 хв). Однак необхідно зазначити, що в цих роботах відмічалася суттєва гетерогенність. Подібні результати наведено і в метааналізі Schiffman, що включав 8 досліджень із парним добором пацієнтів, де групи були добре збалансовані за віком, статтю, характеристиками пухлин та обсягом оперативного втручання [43].
Лапароскопічний хірургічний доступ при великих резекціях. Важливим аспектом розвитку цього напрямку стала крива навчання, яка для великих («major hepatectomy») лапароскопічних резекцій є суттєво тривалішою, ніж для малих гепатектомій: за даними J. Dekker та співавт., для досягнення стабільних онкохірургічних результатів та зменшення кількості ускладнень необхідно не менше 45–60 послідовних випадків, а для складних правобічних гемігепатектомій — інколи ≥70 резекцій [44]. Перші серії лапароскопічних «major hepatectomy», описані у 2000–2010-х роках, відзначалися тривалішими операціями та вищою частотою конверсій, однак навіть тоді вони зумовлювали знижений рівень крововтрат та прийнятний рівень ускладнень, що стало основою для швидкого впровадження техніки у провідних центрах [45]. Подальше вдосконалення методики — стандартне використання ультразвукового дисектора, енергетичних систем, судинного контролю та інтеграції флуоресцентної навігації (індоціанін зелений (Indocyanine green — ICG)) — сприяли істотному скороченню кривої навчання й підвищенню безпеки втручань [46].
Літературні дані переконливо доводять, що лапароскопічні великі резекції печінки не лише технічно здійсненні, але й забезпечують кращий профіль безпеки порівняно з відкритими втручаннями у високоселективних групах пацієнтів. Зокрема, у роботі Z.-Y. Wang та співавт. для групи ЛРП крововтрата була меншою (зважена середня різниця (Weighted Mean Difference — WMD) = −107,4; 95% довірчий інтервал (ДІ) від −179,0 до −35,7; p=0,003), післяопераційні ускладнення були нижчими (відношення шансів (Odds ratio — OR) = 0,47; 95% ДІ 0,35–0,63; p <0,0001), а тривалість перебування в лікарні була коротшою (WMD=−3,27; 95% ДІ від −4,72 до −1,81, p <0,0001) [47]. Дані проспективних аналізів підтверджують онкологічну ефективність: F. Tian та співавт. виявили, що після ЛРП 5-річна загальна виживаність становила 44,3%, що практично тотожне 44,7% після відкритої резекції, тоді як 5-річна безрецидивна виживаність зафіксована на рівні 29,9 та 33,2% відповідно [48].
Лапароскопічний доступ та ререзекція печінки. Повторне метастатичне ураження печінки при мКРР діагностують у 2/3 оперованих хворих [49]. Хоча повторна резекція (ререзекція) печінки разом із хімієтерапією забезпечує пацієнтам найвищі шанси на виживання, такі операції є технічно складними внаслідок зміненої анатомії та спайкової хвороби [50]. У низці досліджень у високоспеціалізованих центрах продемонстровано безпеку й ефективність лапароскопічної ререзекції печінки у досвідчених хірургів. Метааналіз, який включав 8 досліджень, підтвердив, що лапароскопічні ререзекції печінки можуть виконуватися без підвищення рівня ускладнень або тривалості госпіталізації порівняно з відкритими ререзекціями, навіть якщо первинну гепатектомію було проведено відкритим шляхом [51]. Дослідження, проведене у 9 європейських центрах, свідчить, що лапароскопічні ререзекції печінки асоціюються з меншими тривалістю операції, внутрішньоопераційною крововтратою та терміном перебування у стаціонарі [52]. Післяопераційна захворюваність і летальність також були подібними після лапароскопічної ререзекції печінки та відкритої операції [53]. Пацієнти, яким виконано 2-гу та 3-тю ЛРП через рецидивний мКРР, не виявили суттєвої різниці в рівнях післяопераційних ускладнень або летальності [54]. Первинна ЛРП часто призводить до мінімального утворення спайок, що значно полегшує проведення повторних операцій. Збільшене зображення під час лапароскопії та ефект розтягування спайок пневмоперитонеумом надають змогу виконати ретельний адгезіоліз і дисекцію [55]. Крім того, менший робочий простір і можливість обходу спайок без порушення візуалізації значно зменшують потребу в широкому вісцеролізі [55].
Симультанна хірургічна стратегія. Зростання досвіду у сфері малоінвазивної абдомінальної хірургії дозволило розширити межі можливого, і деякі центри навіть виконують симультанну резекцію первинних пухлин ободової кишки та метастатичної хвороби, щоб уникнути 2 великих операцій і зменшити хірургічний стрес, економічне та психологічне навантаження на пацієнта [56]. У метааналізі, який включав 10 ретроспективних досліджень, виявлено, що лапароскопічний хірургічний доступ асоціюється з меншими об’ємом внутрішньоопераційної крововтрати та потребою в переливанні крові, швидшим відновленням функції кишечнику і дієти, коротшою тривалістю післяопераційного перебування у стаціонарі, а також нижчим рівнем хірургічних ускладнень [57]. Об’єм резекції печінки під час синхронної операції є предметом дискусій. Хоча більшість хірургів схиляються до обережного підходу та рекомендують виконувати лише малі резекції печінки одночасно з колектомією, деякі автори останнім часом продемонстрували, що одночасні великі резекції печінки можуть бути виконані з результатами, референтними із етапними операціями [58]. Такі публікації лімітовані та мають значну гетерогенність, проте вони надають попередні докази безпеки та здійсненності симультанного хірургічного підходу у окремих хворих.
Двоетапні лапароскопічні гепатектомії. У випадках поширених та/або білобарних мКРР недостатній залишковий об’єм печінки є протипоказанням до хірургічної резекції. Для розв’язання цієї проблеми у 2000-х роках група авторів запропонували концепцію двоетапних резекцій печінки (ДЕР) [59]. Передбачається, що на 1-му етапі цієї стратегії виконують паренхімозберігальну хірургію в лівій частці печінки, яка має менший об’єм пухлинного ураження [60]. Контралатеральні гілки ворітної вени емболізують або хірургічним лігуванням під час 1-го етапу, або післяопераційною емболізацією під радіологічним контролем [61]. Після адекватного проміжку часу, необхідного для гіпертрофії майбутньої FLR, виконують стандартну або розширену правобічну гепатектомію на 2-му етапі. Це стало значним прогресом, оскільки дозволило пацієнтам, яких раніше вважали неоперабельними, безпечно пройти резекцію печінки та досягати 5-річної загальної виживаності на рівні 12,5–36,2% [62–64].
У серії клінічних досліджень доведено безпеку та здійсненність виконання ДЕР через лапароскопічний доступ на 1-му етапі, що дозволило мінімізувати більовий синдром, термін перебування у стаціонарі, пришвидшити ад’ювантну хімієтерапію, зменшити кількість ускладнень та знизити смертність без погіршення онкологічних результатів [65]. Другий етап операції є складнішим, оскільки технічно — це повторна гепатектомія. Хірурги стикаються з післяопераційними спайками, зміненою анатомією печінки після початкової резекції та гіпертрофією лівої частки, пошкодженням печінки внаслідок хімієтерапії та запаленням у ділянці воріт печінки після емболізації / лігації ворітної вени, що ускладнює дисекцію зони. M.A. Machado та співавт. першими описали повністю лапароскопічне виконання обох етапів [66]. Відомо про досвід лапароскопічної ДЕР, де майже 80% пацієнтів завершили 2-й етап, ці хворі мають попередньо позитивні показники виживаності [67]. Також ЛРП на 1-му етапі асоціювалися із коротшим терміном перебування у стаціонарі, а на 2-му етапі — зі значно меншими крововтратою, кількістю післяопераційних ускладнень, терміном госпіталізації та швидшим початком системного лікування. В обох групах показники загальної виживаності та виживаності без прогресування не мали достовірної відмінності, однак лапароскопічна ререзекція у випадку рецидиву виконувалася частіше у групі лапароскопічної ДЕР. Серед переваг лапароскопічних ДЕР зазначали меншу кількість спайок після лапароскопічного 1-го етапу, зменшення об’єму крововтрати завдяки пневмоперитонеуму та покращену візуалізацію операційного поля [68, 69].
Асоційоване розділення печінки та лігування портальної вени. Асоційоване розділення печінки та лігування портальної вени (Associated liver partition and portal vein ligation for Staged Hepatectomy — ALPPS) — це відносно новий напрям у хірургії печінки, що був розроблений для швидкого збільшення майбутньої культі печінки (МКП). Найпоширенішим показанням до цієї операції є резекція печінки через білобарні метастатичні ураження [70]. Метааналіз 9 ретроспективних досліджень у пацієнтів з нерезектабельними мКРР підтвердив швидшу гіпертрофію МКП при асоційованому розділенні печінки та лігуванні портальної вени порівняно зі стандартною ДЕР [64]. Водночас в іншому багатоцентровому рандомізованому контрольованому дослідженні виявлено, що ALPPS асоціюється з вищою частотою успіху резекції без відмінностей за рівнем ускладнення чи частоти R0-резекцій порівняно з двоетапною гепатектомією (Two-stage hepatectomy — TSH) [71].
Первинні успіхи хірургічної стратегії ALPPS були атенуйовані показниками високої смертності (12%), які згодом вдалося суттєво знизити завдяки ретельному відбору пацієнтів та менш агресивному підходу на 1-му етапі хірургічної стратегії [72]. Саме лапароскопічний хірургічний доступ підходу на 1-му етапі дає переваги у вигляді зменшення об’єму крововтрати, хірургічної травми та міжетапних спайок [73]. Недавній систематичний огляд 15 досліджень, які порівнювали mini-ALPPS та оперативні втручання з відкритим доступом, встановив, що в лапароскопічній групі хворі мали нижчий рівень ускладнень, а також відсутність ускладнень між 1-м та 2-м етапами, з нульовою періопераційною смертністю після обох етапів [74].
Mini-ALPPS — важлива технічна модифікація, спрямована на мінімізацію ускладнень після 1-го етапу. Вона передбачає суворе уникання мобілізації печінки, лігування портальної вени з подальшою частковою паренхіматозною трансекцією печінки лише до половини шляху до середньої печінкової вени, яку зберігають для підтримання відтоку та запобігання застою у видаленому сегменті печінки [75].
Результати свідчать, що збільшення об’єму майбутнього залишку печінки (Future Liver Remnant — FLR) становило +60% (від +18,6 до +108,1%), а медіанне збільшення функції FLR +47% (від +37 до +64%). Ба більше, ці зміни відбувалися швидше, що дозволяло успішно виконати 2-й етап операції вже протягом тижня без випадків печінкової недостатності чи смертності [76].
Ще однією інновацією стало поєднання mini-ALPPS із лапароскопічно асистованою перкутанною канюляцією нижньої брижової вени для емболізації портальної вени [75]. Навіть 2-й етап ALPPS може бути виконаний лапароскопічно: печінку повністю мобілізують, після чого здійснюють перетин притокових гліссонових ніжок та вен відтоку за допомогою ендостеплерів. Хоча ці процедури описані лише в ретельно відібраних пацієнтів, обнадійливі результати свідчать про значний потенціал для розширення показань до використання лапароскопії в хірургічному лікуванні мКРР [76].
Перспективи та обмеження лапароскопічного доступу. Незважаючи на численні переваги, пов’язані з лапароскопічним хірургічним доступом при резекціях печінки, існують обмеження, які необхідно враховувати. Вони стосуються лапароскопічної хірургії печінки незалежно від показань, і не лише при резекції колоректальних метастазів. Під час виконання ЛРП хірурги повинні пристосовуватися до каудально-краніального доступу (виду), на відміну від огляду печінки під час відкритої резекції печінки [77]. Через це візуалізація уражень у верхньо-дорсальних або латеральних сегментах може бути складною та неповною [78]. Лапароскопічні інструменти не забезпечують такої ж свободи рухів, як людська рука, тому мобілізація печінки може бути викликом. До того ж немає можливості зупинити кровотечу в цій ділянці в разі її виникнення. Незважаючи на вдосконалення, такі як використання 3D-камер із гнучкою оптикою чи різних пристроїв для візуалізації, ЛРП все ще залишаються технічно складними втручаннями із тривалою кривою навчання хірурга [79]. Більшість авторів схиляється до думки, що крива навчання для малих ЛРП коливається в межах 15–64 випадків, тоді як для «великих» резекцій потребувалося ≥50 випадків. Це за умови, що хірург добре володіє технікою лапароскопії. У Гайдлайнах консенсусу Саутгемптона (Southampton Consensus Guidelines) рекомендовано починати ЛРП лише після завершення формалізованого навчання — через стажування, курси або програми-тренінги [80]. Хірурги повинні бути впевненими у відкритій резекції печінки та просунутій лапароскопічній хірургії, перш ніж починати ЛРП. Починати слід поетапно з «малих» резекцій в антеролатеральних сегментах, перш ніж переходити до великих резекцій. Пухлини, які є дуже великими, розташовані близько до великих судин або у складних «верхніх» сегментах печінки (I, IVa, VII, VIII), слід залишати лише для досвідчених операторів. Нарешті, ці операції бажано виконувати у високоспеціалізованих центрах печінкової хірургії, де працює щонайменше два або більше хірургів, які володіють технікою ЛРП. Ще одним важливим фактором, що стримує швидке впровадження ЛРП, є вартість проведення оперативного втручання. Лапароскопічна хірургія потребує використання додаткових інструментів, які зазвичай є одноразовими. Триваліший час операції також підвищує витрати на операційну кімнату та анестезію.
Більшість авторів дійшли висновку, що після ЛРП тривалість перебування у стаціонарі є коротшою, що знижує витрати на госпітальне лікування, і, як наслідок, зафіксовані нижчі загальні витрати на подальше лікування. Одним із головних обмежень наявних досліджень щодо аналізу вартості лапароскопічних гепатектомій є те, що вони враховують лише прямі лікарняні витрати, не беручи до уваги непрямі витрати, пов’язані із втратою працездатності, поверненням до роботи, витратами на догляд. Отже, справжня економічна ефективність ЛРП може бути недооціненою, особливо якщо врахувати, що ці операції дозволяють пацієнтам швидше і легше повертатися до повсякденного життя.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Лапароскопічний доступ слід використовувати як метод вибору для малих резекцій печінки при мКРР у сегментах II, III, IVb, V та VI, оскільки він забезпечує меншу травматичність, нижчу частоту ускладнень і швидше відновлення без втрати онкологічної радикальності. Резекції в сегментах VII, VIII, IVa та великі резекції доцільно виконувати лапароскопічно лише досвідченими хірургами після проходження кривої навчання (n ≥30) із обов’язковим використанням інтраопераційної ультразвукової діагностики (УЗД).
2. У державних центрах рекомендується поетапне впровадження лапароскопічних резекцій, починаючи з простіших втручань та за умови формалізованого навчання команди, а також наявності чітких протоколів конверсії та судинного контролю.
3. Пацієнти, яким планується проведення ад’ювантної хімієтерапії, є оптимальними кандидатами для лапароскопічних резекцій, оскільки цей підхід забезпечує швидший початок системного лікування та нижчий ризик післяопераційних ускладнень.
4. Лапароскопічний етап у двоетапних стратегіях (ДЕР, mini-ALPPS) рекомендується як більш безпечний та менш травматичний, оскільки він зменшує об’єм крововтрати, частоту міжетапних ускладнень і підвищує ймовірність успішного завершення 2-го етапу.
5. Лапароскопічні ререзекції печінки мають перевагу над відкритими завдяки мінімальній потребі в широкому вісцеролізі, що зменшує об’єм крововтрати, знижує частоту ускладнень до 12–20% та забезпечує R0-резекції у 80–90% у відібраних хворих.
ВИСНОВКИ
У провідних хірургічних центрах частка ЛРП печінки стабільно збільшується і вже сягає близько 35–40%, що відображає широку міжнародну імплементацію та визнання безпеки й ефективності цього підходу. ЛРП при мКРР зумовлюють суттєві переваги: зменшення кількості післяопераційних ускладнень, крововтрати та тривалості госпіталізації, а онкологічні результати залишаються еквівалентними порівняно з відкритими втручаннями. Літературні дані підтверджують доцільність широкого використання лапароскопічного доступу в центрах із належним технічним забезпеченням та досвідом команди.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2025). Рак в Україні, 2023–2024. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 26). Кропивницький: Поліум. [Fedorenko, Z. P., Sumkina, O. V., Horokh, Ye. L., & Hulak, L. O. (2025). Rak v Ukraini, 2023–2024. Zakhvoriuvanist, smertnist, pokaznyky diialnosti onkolohichnoi sluzhby. Biuleten Natsionalnoho kantser-reiestru Ukrainy. (Vol. 26). Kropyvnytskyi: Polium. Ukrainian].
2. Burlaka, A., Zemskov, S., Bezverkhnyi, V., Rozhkova, V., Zvirych, V., Mykhailo, D., … Skyba, V. (2025). Validation of tumor burden score as a prognostic factor in colorectal cancer liver metastases patients: a retrospective analysis. Journal of Gastrointestinal Cancer, 56(1), 119. doi: 10.1007/s12029-025-01220-0.
3. Mishima, K., Wakabayashi, T., Fujiyama, Y., Alomari, M., Colella, M., & Wakabayashi, G. (2022). Resection margin status in laparoscopic liver resection for colorectal liver metastases: literature review and future perspectives. Minerva Surgical, 77(5), 428–432. doi: 10.23736/S2724-5691.22.09568-5.
4. Coelho, F. F., Kruger, J. A., Fonseca, G. M., Araújo, R. L., Jeismann, V. B., Perini, M. V., … Herman, P. (2016). Laparoscopic liver resection: Experience based guidelines. World Journal of Gastrointestinal Surgery, 8(1), 5–26. doi: 10.4240/wjgs.v8.i1.5.
5. Regmi, P., Hu, H. J., Paudyal, P., Liu, F., Ma, W. J., Yin, C. H., … Li, F. Y. (2021). Is laparoscopic liver resection safe for intrahepatic cholangiocarcinoma? A meta-analysis. European Journal of Surgical Oncology, 47(5), 979–989. doi: 10.1016/j.ejso.2020.11.310.
6. de Graaff, M. R., Klaase, J. M., de Kleine, R., Elfrink, A. K. E., Swijnenburg, R. J., Zonderhuis, M. B., … Kok, N. F. M. (2023). Practice variation and outcomes of minimally invasive minor liver resections in patients with colorectal liver metastases: a population-based study. Surgical Endoscopy, 37(8), 5916–5930. doi: 10.1007/s00464-023-10010-3.
7. Burlaka, A., Ryzhov, A., Ostapenko, Y., Bankovska, N., Kopchak, K., Zvirych, V., … Lukashenko, A. (2023). Twenty-year experience in liver surgery in metastatic colorectal patients: a case series study in Ukraine. Annals of Medicine and Surgery, 85(5), 1413–1419. doi: 10.1097/MS9.0000000000000619.
8. Maeda, T., Otsuka, Y., Okada, R., Ito, Y., Matsumoto, Y., Kimura, K., … Funahashi, K. (2023). Safety of laparoscopic liver resection for high-risk patients. Journal of Hepato-Biliary-Pancreatic Sciences, 30(12), 1283–1292. doi: 10.1002/jhbp.1370.
9. Di Benedetto, F., Magistri, P., Di Sandro, S., Sposito, C., Oberkofler, C., Brandon, E., … Mazzaferro, V. (2023). Robotic HPB Study Group. Safety and Efficacy of Robotic vs Open Liver Resection for Hepatocellular Carcinoma. JAMA Surgery, 158(1), 46–54. doi: 10.1001/jamasurg.2022.5697.
10. Shaaban Abdelgalil, M., Amer, B. E., Yasen, N., El-Samahy, M., Awad, A. K., Elfakharany, B., … Abd-ElGawad, M. (2024). Efficacy and safety of laparoscopic liver resection versus radiofrequency ablation in patients with early and small hepatocellular carcinoma: an updated meta-analysis and meta-regression of observational studies. World Journal of Surgical Oncology, 22(1), 47. doi: 10.1186/s12957-023-03292-3.
11. Liang, B., Peng, Y., Yang, W., Yang, Y., Li, B., Wei, Y., & Liu, F. (2024). Robotic versus laparoscopic liver resection for posterosuperior segments: a systematic review and meta-analysis. HPB (Oxford), 26(9), 1089–1102. doi: 10.1016/j.hpb.2024.06.003.
12. Ding, Z., Liu, L., Xu, B., Huang, Y., Xiong, H., Luo, D., & Huang, M. (2021). Safety and feasibility for laparoscopic versus open caudate lobe resection: a meta-analysis. Langenbeck’s Archives of Surgery, 406(5), 1307–1316. doi: 10.1007/s00423-020-02055-y.
13. Ciria, R., Cherqui, D., Geller, D. A., Briceno, J., & Wakabayashi, G. (2016). Comparative short-term benefits of laparoscopic liver resection: 9000 cases and climbing. Annals of Surgery, 263(4), 761–777. doi: 10.1097/SLA.0000000000001413.
14. Vauthey, J. N., Pawlik, T. M., Ribero, D., Wu, T. T., Zorzi, D., Hoff, P. M., … Abdalla, E. K. (2006). Chemotherapy regimen predicts steatohepatitis and an increase in 90-day mortality after surgery for hepatic colorectal metastases. Journal of Clinical Oncology, 24(13), 2065–2072. doi: 10.1200/JCO.2005.05.3074.
15. Nguyen, K. T., Gamblin, T. C., & Geller, D. A. (2009). World review of laparoscopic liver resection—2,804 patients. Annals of Surgery, 250(5), 831–841. doi: 10.1097/SLA.0b013e3181b0c4df.
16. de’Angelis, N., Memeo, R., Brunetti, F., Batista da Costa, J., Schneck, A. S., Carra, M. C., & Azoulay, D. (2013). Complications after laparoscopic liver resection: risk factors and management. World Journal of Gastroenterology, 5(8), 245–251. doi: 10.4240/wjgs.v5.i8.245.
17. Buell, J. F., Cherqui, D., Geller, D. A., O’Rourke, N., Iannitti, D., Dagher, I., … Chari, R. S. (2009). The international position on laparoscopic liver surgery: the Louisville Statement, 2008. Annals of Surgery, 250(5), 825–830. doi: 10.1097/sla.0b013e3181b3b2d8.
18. Spampinato, M. G., Coratti, A., Bianco, L., Caniglia, F., Laurenzi, A., Puleo, F., … Boggi, U. (2014). Perioperative outcomes of laparoscopic liver resection for hepatocellular carcinoma: a multicenter prospective study. Surgical Endoscopy, 28(10), 2973–2979. doi: 10.1007/s00464-014-3560-4.
19. Muaddi, H., Gudmundsdottir, H., & Cleary, S. (2024). Current Status of Laparoscopic Liver Resection. Advanced Surgical, 58(1), 311–327. doi: 10.1016/j.yasu.2024.05.002.
20. Fretland, Å. A., Dagenborg, V. J., Waaler Bjørnelv, G. M., Aghayan, D. L., Kazaryan, A. M., Barkhatov, L., … Andersen, M. H. (2019). Quality of life from a randomized trial of laparoscopic or open liver resection for colorectal liver metastases: the OSLO-COMET trial. British Journal of Surgery, 106(11), 1372–1380.
21. Kofler, A., Trattner, M., Mairinger, V., Urban, I., Søreide, K., Stättner, S., & Primavesi, F. (2025). The Role of Perioperative Interleukin-6 Serum Levels on Liver Dysfunction and Infectious Complications After Hepatectomy-A Systematic Review. Cancers (Basel), 17(19), 3120. doi: 10.3390/cancers17193120.
22. Weinberg, L., Lee, D. K., Gan, C., Ianno, D., Ho, A., Fletcher, L., … Karalapillai, D. (2021). The association of acute hypercarbia and plasma potassium concentration during laparoscopic surgery: a retrospective observational study. BMC Surgery, 21(1), 31. doi: 10.1186/s12893-020-01034-w.
23. Al Farai, A., Sangiuolo, F., Albaali, D., Ajoub, M., Giannone, F., Cassese, G., & Panaro, F. (2025). The Definition of the Best Margin Cutoff and Related Oncological Outcomes After Liver Resection for Hepatocellular Carcinoma: A Systematic Review. Cancers, 17, 1759. doi.org/10.3390/cancers17111759.
24. Okuno, M., Goumard, C., Mizuno, T., Omichi, K., Tzeng, C. D., Chun, Y. S., … Conrad, C. (2018). Operative and short-term oncologic outcomes of laparoscopic versus open liver resection for colorectal liver metastases located in the posterosuperior liver: a propensity score matching analysis. Surgical Endoscopy, 32(4), 1776–1786. doi: 10.1007/s00464-017-5861-x.
25. Tian, Z. Q., Su, X. F., Lin, Z. Y., Wu, M. C., Wei, L. X., & He, J. (2016). Meta-analysis of laparoscopic versus open liver resection for colorectal liver metastases. Oncotarget, 7(51), 84544–84555. doi: 10.18632/oncotarget.13026.
26. Aghayan, D. L., Kazaryan, A. M., Dagenborg, V. J., Røsok, B. I., Fagerland, M. W., Waaler Bjørnelv, G. M., … Edwin, B. (2021). OSLO-COMET Survival Study Collaborators. Long-Term Oncologic Outcomes After Laparoscopic Versus Open Resection for Colorectal Liver Metastases : A Randomized Trial. Annals of Internal Medicine, 174(2), 175–182. doi: 10.7326/M20-4011.
27. Fretland, Å. A., Dagenborg, V. J., Bjørnelv, G. M. W., Kazaryan, A. M., Kristiansen, R., Fagerland, M. W., … Edwin, B. (2018). Laparoscopic Versus Open Resection for Colorectal Liver Metastases: The OSLO-COMET Randomized Controlled Trial. Annals of Surgery, 267(2), 199–207. doi: 10.1097/SLA.0000000000002353.
28. Robles-Campos, R., Lopez-Lopez, V., Brusadin, R., Lopez-Conesa, A., Gil-Vazquez, P. J., Navarro-Barrios, Á., & Parrilla, P. (2019). Open versus minimally invasive liver surgery for colorectal liver metastases (LapOpHuva): a prospective randomized controlled trial. Surgical Endoscopy, 33(12), 926–3936. doi: 10.1007/s00464-019-06679-0.
29. Nicolás, M., Czerwonko, M., Ardiles, V., Sánchez Claria, R., Mazza, O., de Santibañes, E., … de Santibañes, M. (2022). Laparoscopic vs open liver resection for metastatic colorectal cancer: analysis of surgical margin status and survival. Langenbeck’s Archives of Surgery, 407(3), 1113–1119. doi: 10.1007/s00423-021-02396-2.
30. Notarnicola, M., Felli, E., Roselli, S., Altomare, D. F., De Fazio, M., de’Angelis, N., … Memeo, R. (2019). Laparoscopic liver resection in elderly patients: systematic review and meta-analysis. Surgical Endoscopy, 33(9), 2763–2773. doi: 10.1007/s00464-019-06840-9.
31. Guerrini, G. P., Esposito, G., Tarantino, G., Serra, V., Olivieri, T., Catellani, B., … Di Benedetto, F. (2020). Laparoscopic versus open liver resection for intrahepatic cholangiocarcinoma: the first meta-analysis. Langenbeck’s Archives of Surgery, 405(3), 265–275. doi: 10.1007/s00423-020-01877-0.
32. Chen, W., Lin, X., Wu, Z., Pan, W., Ke, Q., & Chen, Y. (2024). Laparoscopic liver resection is superior to radiofrequency ablation for small hepatocellular carcinoma: a systematic review and meta-analysis of propensity score-matched studies. Hepatology International, 18(3), 998–1010. doi: 10.1007/s12072-024-10645-x.
33. Liao, W., Li, Y., Zou, Y., Xu, Q., Wang, X., & Li, L. (2024). Younger patients with colorectal cancer may have better long-term survival after surgery: a retrospective study based on propensity score matching analysis. World Journal of Surgical Oncology, 22(1), 59. doi: 10.1186/s12957-024-03334-4.
34. Pan, L., Tong, C., Fu, S., Fang, J., Gu, Q., Wang, S., … Cai, X. (2020). Laparoscopic procedure is associated with lower morbidity for simultaneous resection of colorectal cancer and liver metastases: an updated meta-analysis. World Journal of Surgical Oncology, 18(1), 251. doi: 10.1186/s12957-020-02018-z.
35. Takase, K., Sakamoto, T., Takeda, Y., Ohmura, Y., Katsura, Y., Shinke, G., … Murata, K. (2021), Safety and efficacy of laparoscopic repeat liver resection and re-operation for liver tumor. Scienyific Reports, 11(1), 11605. doi: 10.1038/s41598-021-89864-3.
36. Kataoka, K., Mori, K., Nakamura, Y., Watanabe, J., Akazawa, N., Hirata, K., … Oki, E. (2024). Survival benefit of adjuvant chemotherapy based on molecular residual disease detection in resected colorectal liver metastases: subgroup analysis from CIRCULATE-Japan GALAXY. Annals of Oncology, 35(11), 1015–1025. doi: 10.1016/j.annonc.2024.08.2240.
37. Greten, F. R., & Grivennikov, S. I. (2019), Inflammation and Cancer: Triggers, Mechanisms, and Consequences. Immunity, 51(1), 27–41. doi: 10.1016/j.immuni.2019.06.025.
38. Nishida, A., & Andoh, A. (2025), The Role of Inflammation in Cancer: Mechanisms of Tumor Initiation, Progression, and Metastasis. Cells, 14(7), 488. doi: 10.3390/cells14070488.
39. Aghayan, D. L., Fretland, Å. A., Kazaryan, A. M., Sahakyan, M. A., & Dagenborg, V. J. (2019), Laparoscopic versus open liver resection for colorectal liver metastases located in the posterosuperior liver segments: a sub-group analysis from the OSLO-COMET RCT. HPB (Oxford), 21(11), 1485–1490. doi:10.1016/j.hpb.2019.03.358.
40. Haney, M. C., Studier-Fischer, A., Probst, P., Fan, С., Müller, С. Р., Golriz, М., … Nickel, F. (2021). А systematic review and meta-analysis of RCTs comparing laparoscopic and open liver resections. HPB (Oxford), 23(10), 1467–1481. doi: 10.1016/j.hpb.2021.03.006.
41. Moosburner, S., Kettler, C., Hillebrandt, K. H., Blank, M., Freitag, H., Knitter, S., … Raschzok, N. (2023). Minimal Invasive Versus Open Surgery for Colorectal Liver Metastases: A Multicenter German StuDoQ|Liver Registry-Based Cohort Analysis in Germany. Annals of surgery open : perspectives of surgical history, education, and clinical approaches, 4(4), e350. doi.org/10.1097/AS9.0000000000000350.
42. Yusheng, C., Lei, Z., Huizi, L., Wang, L., Huang, Y., Wu, L., … Zhang, Y. (2015). Laparoscopic vs open liver resection for colorectal liver metastases: a systematic review and meta-analysis. HPB (Oxford), 17(5), 350–356. doi: 10.1038/s41598-017-00978-z.
43. Pawlik, T. M., Olino, K., Gleisner, A. L., Torbenson, M., Schulick, R., & Choti, A. M. (2007). Preoperative chemotherapy for colorectal liver metastases: impact on hepatic histology and postoperative outcome. Journal of Gastrointestinal Surgery, 11(7), 860–868. doi: 10.1007/s11605-007-0149-4.
44. Ivanecz, A., Plahuta, I., Mencinger, M., Perus, I., Magdalenic, T., Turk, S., … Potrc, S. (2021). The learning curve of laparoscopic liver resection utilising a difficulty score. Radiology and Oncology, 56(1), 111–118. doi: 10.2478/raon-2021-0035.
45. Jia, C., Li, H., Wen, N., Chen, J., Wei, Y., & Li, B. (2018). Laparoscopic liver resection: a review of current indications and surgical techniques. Hepatobiliary Surgery and Nutrition, 7(4), 277–288. doi: 10.21037/hbsn.2018.03.01.
46. Coco, D., & Leanza, S. (2024). Narrative Review on the Use of Indocyanine Green Fluorescence in Surgical Oncology. Maedica (Bucur), 19(4), 807–815. doi: 10.26574/maedica.2024.19.4.807.
47. Wang, Z. Y., Chen, Q. L., Sun, L. L., He, S. P., Luo, X. F., Huang, L. S., … Zhong, C. (2019). Laparoscopic versus open major liver resection for hepatocellular carcinoma: systematic review and meta-analysis of comparative cohort studies. BMC Cancer, 19(1), 1047. doi: 10.1186/s12885-019-6240-x.
48. Janež, J., & Škapin, A. D. (2020). Comparison of a Five-Year Survival and Cancer Recurrence between Laparoscopically Assisted and Open Colonic Resections due to Adenocarcinoma—A Single Centre Experience. Medicina, 56, 93. doi.org/10.3390/medicina56020093.
49. Grossmann, I., Doornbos, P. M., Klaase, J. M., de Bock, G. H., & Wiggers, T. (2014). Changing patterns of recurrent disease in colorectal cancer. European Journal of Surgical Oncology, 40(2), 234–239. doi: 10.1016/j.ejso.2013.10.028.
50. Homayounfar, K., Bleckmann, A., Conradi, L. C., Sprenger, T., Lorf, T., Niessner, M., … Ghadimi, B. M. (2013). Metastatic recurrence after complete resection of colorectal liver metastases: impact of surgery and chemotherapy on survival. International Journal of Colorectal Disease, 28(7), 1009–1017. doi: 10.1007/s00384-013-1648-2.
51. Hu, L., Shi, X., Wang, A., & Zhang, F. (2025). A meta-analytic and systematic review to compare perioperative outcomes and prognosis between robotic and conventional (laparoscopic or open) liver resection in hepatocellular carcinoma cases. World Journal of Surgical Oncology, 23(1), 348. doi: 10.1186/s12957-025-03983-z.
52. Téoule, P., Dunker, N., Gölz, V., Rasbach, E., Reissfelder, C., Birgin, E., … Rahbari, N. N. (2025). What matters in laparoscopic hepatectomy for lesions located in posterosuperior segments? Initial experiences and analysis of risk factors for postoperative complications: a retrospective cohort study. Surgical Endoscopy, 39(6), 3691–3701. doi: 10.1007/s00464-025-11674-9.
53. Yang, S., Ni, H., Zhang, A., Zhang, J., Zang, H., & Ming, Z. (2025). Impact of postoperative morbidity on the prognosis of patients with hepatocellular carcinoma after laparoscopic liver resection: a multicenter observational study. Scientific Reports, 15(1), 1724. doi: 10.1038/s41598-024-85020-9.
54. Costa, P. F., Coelho, F. F., Jeismann, V. B., Kruger, J. A. P., Fonseca, G. M., Cecconello, I., … Herman, P. (2022). Repeat hepatectomy for recurrent colorectal liver metastases: A comparative analysis of short- and long-term results. Hepatobiliary Pancreatic Diseases International, 21(2), 162–167. doi: 10.1016/j.hbpd.2021.08.005.
55. Kavic, S. M., & Kavic, S. M. (2002). Adhesions and adhesiolysis: the role of laparoscopy. JSLS, 6(2), 99–109. pubmed.ncbi.nlm.nih.gov/12113430. PMID: 12113430.
56. Dittrich, L., Raschzok, N., Krenzien, F., Ossami Saidy, R. R., Plewe, J., Moosburner, S., … & Haase, O. (2025). Pushing boundaries: simultaneous minimal-invasive resection of complex colorectal liver metastases and its primary tumor. Surgical Endoscopy, 39(1), 401–408. doi: 10.1007/s00464-024-11411-8.
57. Hung, H. Y., Huang, S. H., Tsai, T. Y., You, J. F., Hsieh, P. S., Lai, C. C., … Tsai, K. Y. (2024). Comparative analysis of short- and long-term outcomes in laparoscopic versus open surgery for colorectal cancer patients undergoing hemodialysis. Langenbeck`s Archives of Surgery, 409(1), 250. doi: 10.1007/s00423-024-03440-7.
58. Ei, S., Kaizu, T., Fujiyama, Y., Igarashi, K., Nishizawa, N., Tajima, H., … Kumamoto, Y. (2025). Benefits and risks of simultaneous versus staged laparoscopic resection for colorectal cancer with synchronous liver metastases. Surgery Today. doi.org/10.1007/s00595-025-03186-9.
59. Dimitroulis, D., Tsaparas, P., Valsami, S., Mantas, D., Spartalis, E., Markakis, C., … Kouraklis, G. (2014). Indications, limitations and maneuvers to enable extended hepatectomy: current trends. World Journal of Gastroenterology, 20(24), 7887–7893. doi: 10.3748/wjg.v20.i24.7887.
60. Narita, M., Oussoultzoglou, E., Bachellier, P., Rosso, E., Pessaux, P., & Jaeck, D. (2011). Two-stage hepatectomy procedure to treat initially unresectable multiple bilobar colorectal liver metastases: technical aspects. Digestive Surgery, 28(2), 121–126. doi: 10.1159/000323822.
61. Piron, L., Deshayes, E., Escal, L., Souche, R., Herrero, A., Pierredon-Foulongne, M. A., … Guiu, B. (2017). Embolisation portale préopératoire : présent et futur. Bulletin du Cancer, 104(5), 407–416. doi: 10.1016/j.bulcan.2017.03.009. [Piron, L., Deshayes, E., Escal, L., Souche, R., Herrero, A., Pierredon-Foulongne, M. A., … Guiu, B. (2017). Portal vein embolization: Present and future. Bulletin du Cancer, 104(5), 407–416. French].
62. Korenblik, R., Heil, J., Smits, J., James, S., Olij, B., Bechstein, W. O., … Schadde, E. (2024). Liver regeneration after portal and hepatic vein embolization improves overall survival compared with portal vein embolization alone: mid-term survival analysis of the multicentre DRAGON 0 cohort. British Journal of Surgery,111(4), znae087. doi: 10.1093/bjs/znae087.
63. Dueland, S., Yaqub, S., Syversveen, T., Carling, U., Hagness, M., Brudvik, K. W., … Line, P. D. (2021). Survival Outcomes After Portal Vein Embolization and Liver Resection Compared With Liver Transplant for Patients With Extensive Colorectal Cancer Liver Metastases. JAMA Surgery, 156(6), 550–557. doi: 10.1001/jamasurg.2021.0267.
64. Díaz Vico, T., Granero Castro, P., Alcover Navarro, L., Suárez Sánchez, A., Mihic Góngora, L., Montalvá Orón, E. M., … Granero Trancón, J. E. (2023). Two stage hepatectomy (TSH) versus ALPPS for initially unresectable colorectal liver metastases: A systematic review and meta-analysis. European Journal of Surgical Oncology, 49(3), 550–559. doi: 10.1016/j.ejso.2022.11.010.
65. Zhang, L., Yang, Z., Zhang, S., Wang, W., & Zheng, S. (2020). Conventional Two-Stage Hepatectomy or Associating Liver Partitioning and Portal Vein Ligation for Staged Hepatectomy for Colorectal Liver Metastases? A Systematic Review and Meta-Analysis. Frontiers of Oncology, 10, 1391. doi: 10.3389/fonc.2020.01391.
66. Machado, M. A., Makdissi, F. F., Surjan, R. C., Kappaz, G. T., & Yamaguchi, N. (2010). Two-stage laparoscopic liver resection for bilateral colorectal liver metastasis. Surgical Endoscopy, 24(8), 2044–2047. doi: 10.1007/s00464-009-0859-7.
67. Machado, M. A., Surjan, R., Basseres, T., & Makdissi, F. (2017). Total Laparoscopic Reversal ALPPS. Annals of Surgical Oncology, 24(4), 1048–1049. doi: 10.1245/s10434-016-5620-6.
68. Nomi, T., Fuks, D., Mal, F., Ogiso, S., Gelli, M., Velayutham, V., … Gayet, B. (2016). Multicenter study of laparoscopic two-stage hepatectomy for bilobar colorectal liver metastases. Annals of Surgery, 263(1), 117–122. doi: 10.1097/SLA.0000000000001200.
69. Okumura, S., Goumard, C., Gayet, B., Fuks, D., & Scatton, O. (2019). Laparoscopic vs. open two-stage hepatectomy for bilobar colorectal liver metastases: a bi-institutional, propensity score–matched study. Surgery, 166(6), 959–966. doi: 10.1016/j.surg.2019.06.019.
70. Charalel, R. A., Sung, J., Askin, G., Jo, J., Mitry, M., Chung, C., … Madoff, D. C. (2021). Systematic Reviews and Meta-Analyses of Portal Vein Embolization, Associated Liver Partition and Portal Vein Ligation, and Radiation Lobectomy Outcomes in Hepatocellular Carcinoma Patients. Current Oncology Reports, 23(11), 135. doi: 10.1007/s11912-021-01075-1.
71. Smirnov, A., Petrova, N., Ivanov, D., & Orlov, K. (2025). Laparoscopic ALPPS procedure: A series of cases. Annals of Hepatobiliary Surgery, 29(1), 45–53. doi: 10.17116/hirurgia202502120.
72. Moris, D., Ronnekleiv-Kelly, S., & Costantini, T. (2025). Global outcomes of ALPPS: An updated systematic review and meta-analysis. Annals of Surgery, 281(2), 210–222. doi: 10.1097/SLA.0000000000006359.
73. Arend, J., Franz, M., Rose, A., March, C., Rahimli, M., Perrakis, A., … Croner, R. (2024). Robotic complete ALPPS (rALPPS) — first German experiences. Cancers, 16(5), 1070. doi: 10.3390/cancers16051070.
74. Serenari, M., Ratti, F., Guglielmo, N., Zanello, M., Mochegianni, F., Lenzi, J., … Jovine, E. (2023). Evolution of minimally invasive techniques and surgical outcomes of ALPPS in Italy: a comprehensive trend analysis over 10 years from a national prospective registry. Surgical Endoscopy, 37(12), 5285–5294. doi: 10.1007/s00464-023-10263-5.
75. Pekolj, J., Alvarez, F. A., Biagiola, D., Villegas, L., Ardiles, V., & de Santibañes, E. (2018). Totally Laparoscopic Mini-ALPPS Using a Novel Approach of Laparoscopic-Assisted Transmesenteric Portal Vein Embolization. Journal of laparoendoscopic & advanced surgical techniques. Part A, 28(10), 1229–1233. doi.org/10.1089/lap.2018.0039.
76. Ratti, F., Serenari, M., Cimino, M., Guglielmo, N., & Aldrighetti, L. (2023). Laparoscopic and robotic approaches to ALPPS: Current status and future perspectives. HPB (Oxford), 25(8), 987–996. doi: 10.1016/j.hpb.2023.05.014.
77. Endo, T., Morise, Z., Katsuno, H., Kikuchi, K., Matsuo, K., Asano, Y., & Horiguchi, A. (2022). Caudal Approach to Laparoscopic Liver Resection-Conceptual Benefits for Repeated Multimodal Treatment for Hepatocellular Carcinoma and Extended Right Posterior Sectionectomy in the Left Lateral Position. Frontiers in Oncology, 12, 950283. doi: 10.3389/fonc.2022.950283.
78. Fujiyama, Y., Wakabayashi, T., Mishima, K., Al-Omari, M. A., Colella, M., & Wakabayashi, G. (2023). Latest Findings on Minimally Invasive Anatomical Liver Resection. Cancers, 15(8), 2218. doi.org/10.3390/cancers15082218.
79. Bhayani, S. B., & Andriole, G. L. (2005). Three-Dimensional (3D) Vision: Does It Improve Laparoscopic Skills? An Assessment of a 3D Head-Mounted Visualization System. Reviews in Urology, 7(4), 211–214. PMID: 16985832; PMCID: PMC1477587.
80. Abu Hilal, M., Aldrighetti, L., Dagher, I., Edwin, B., Troisi, R. I., Alikhanov, R., … Cherqui, D. (2018). The Southampton Consensus Guidelines for Laparoscopic Liver Surgery: From Indication to Implementation. Annals of Surgery, 268(1), 11–18. doi: 10.1097/SLA.0000000000002524.
Адреса для листування:
Бурлака Антон Анатолійович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: anton.burlaka@unci.org.ua
Correspondence:
Anton Burlaka
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: anton.burlaka@unci.org.ua














Leave a comment