Трастузумаб дерукстекан у лікуванні HER2-позитивного та HER2-low (з низьким рівнем HER2) метастатичного раку грудної залози
Резюме. Трастузумаб дерукстекан у лікуванні HER2-позитивного та HER2-low (з низьким рівнем HER2) метастатичного раку грудної залозиDOI:27 листопада 2025 р. у рамках 6-го Міжнародного онкологічного конгресу відбувся Сателітний форум компанії «АстраЗенека» під назвою «Виходимо за межі: стань свідком народження інновацій в терапії раку грудної залози». Захід був присвячений обговоренню трансформаційного впливу кон’югатів антитіло — лікарський засіб (Antibody-Drug Conjugate — ADC) на стратегії лікування метастатичного раку грудної залози (мРГЗ), зокрема HER2-позитивного (+) та HER2-low підтипів. Розробка кон’югатів антитіло — лікарський засіб, зокрема трастузумаб дерукстекану (T-DXd), знаменує собою еру персоналізованої онкології, забезпечуючи суттєве покращення прогностичних показників для пацієнток. Форум підтвердив необхідність швидкої інтеграції цієї інноваційної терапевтичної опції в національні клінічні протоколи.
DOI: 10.32471/clinicaloncology.2663-466X.35221
«Мистецтво інновацій: як поява ADC змінила парадигми лікування HER2-позитивного / HER2-low мРГЗ»
 Першу доповідь, що відкрила наукову програму, представив кандидат медичних наук, хімієтерапевт, клінічний онколог Львівського онкологічного регіонального лікувально-діагностичного центру Ярослав Васильович Шпарик. Він наголосив, що винахід анти-HER2-терапії стало справжнім проривом в онкологічній практиці, особливо після впровадження моноклональних антитіл, зокрема трастузумабу, та їх комбінацій з іншими протипухлинними агентами [1–5].
Першу доповідь, що відкрила наукову програму, представив кандидат медичних наук, хімієтерапевт, клінічний онколог Львівського онкологічного регіонального лікувально-діагностичного центру Ярослав Васильович Шпарик. Він наголосив, що винахід анти-HER2-терапії стало справжнім проривом в онкологічній практиці, особливо після впровадження моноклональних антитіл, зокрема трастузумабу, та їх комбінацій з іншими протипухлинними агентами [1–5].
Водночас класичні терапевтичні підходи мали істотні обмеження: кожна наступна лінія лікування демонструвала зниження ефективності виживаності без прогресування (ВБП) захворювання унаслідок розвитку резистентності, зростання токсичності, що призводило до поступового вичерпання терапевтичних можливостей. Саме ці чинники зумовили пошук нових стратегій, здатних забезпечити триваліший контроль захворювання без прогресування.
Доповідач навів як приклад, що стандартна схема терапії першої лінії з подвійною блокадою HER2-рецепторів моноклональними антитілами поєднано з хімієтерапією (згідно зі стандартами 2010–2015 рр.) забезпечувала медіану ВБП на рівні близько 18–20 міс [4]. Однак після прогресування захворювання значна частина пацієнтів так і не змогла перейти до другої чи третьої лінії лікування через погіршення клінічного стану або розвиток метастазів у центральній нервовій системі (ЦНС) [6].
Отже, ситуація об’єктивно потребувала впровадження більш ефективних та безпечних терапевтичних інструментів. І, як підкреслив спікер, ключовим принципом має стати «не відкладати застосування більш ефективних методів лікування на більш пізні лінії, а використовувати їх якомога раніше» [6, 7].
Історія терапії HER2+ РГЗ: Де ми зараз? [8–11]
Розвиток анти-HER2-терапії при HER2+ раку грудної залози (РГЗ) є одним із найбільш яскравих прикладів еволюції персоналізованої онкологічної допомоги. За останні 4 десятиріччя стратегія лікування змінилася від базового розуміння ролі HER2 як онкогенного драйвера до створення високоспецифічних моноклональних антитіл, інгібіторів тирозинкінази та ADC. Ця динаміка чітко ілюструється у хронологічному огляді ключових етапів розвитку терапії, який дозволяє побачити, як фундаментальні відкриття поступово трансформувалися в ефективні терапевтичні інструменти та визначають сучасні стандарти лікування (таблиця).
| Період | Рік | Ключова подія / препарат | Опис |
| 1981–1990 | 1984 | Ідентифікація HER2-гена | |
| 1985 | Виявлена ампліфікація HER2 у пацієнток з РГЗ | ||
| 1991–2000 | 1998 | Трастузумаб | Перше моноклональне антитіло проти HER2, схвалене FDA та EMA (2000) для лікування HER2+ мРГЗ [12, 13] |
| 2000–2010 | 2007 | Лапатиніб | Перший інгібітор тирозинкінази, схвалений FDA та EMA (2008) для лікування HER2+ мРГЗ [14] |
| 2010–2019 | 2012 | Пертузумаб | Моноклональне антитіло проти HER2, схвалене FDA та EMA (2013) у комбінації з трастузумабом та хімієтерапією для лікування HER2+ мРГЗ [15, 16] |
| 2013 | Трастузумаб емтанзин | Перший ADC, схвалений FDA та EMA для лікування HER2+ мРГЗ [17] | |
| 2020–… | 2020–… | Трастузумаб дерукстекан | ADC наступного покоління для лікування HER2+ та HER2-low мРГЗ [18, 19] |
Примітки: HER2 — рецептор людського епідермального фактора росту 2; FDA (Food and Drug Administration) — Управління з контролю за якістю харчових продуктів і лікарських засобів США; EMA (European Medicines Agency) — Європейське агентство з лікарських засобів.
Інноваційна концепція ADC
ADC являють собою один з найсучасніших видів таргетної терапії, що поєднує дві ключові властивості: високу специфічність моноклонального антитіла до певного пухлинного антигену та потужний хімієтерапевтичний препарат. Завдяки такій комбінації ADC забезпечують вибіркову, «прицільну» доставку цитотоксичного агента безпосередньо до ракових клітин, істотно зменшуючи вплив на здорові тканини [20, 21]. Саме тому технологія ADC дозволяє підвищити терапевтичний індекс і розширити можливості лікування навіть за умов гетерогенної експресії рецептора-мішені.
Основні переваги ADC [20, 22, 23]:
- висока пухлинна специфічність. Моноклональне антитіло з високою афінністю до HER2-рецептора забезпечує точне розпізнавання та зв’язування з пухлинними клітинами;
- нижча системна токсичність. На відміну від традиційної хімієтерапії, цитостатик доставляється локально, що суттєво знижує ризик неспецифічних побічних реакцій (ПР);
- ширший терапевтичний діапазон. Завдяки феномену «ефекту свідка» (bystander effect) цитотоксична дія поширюється і на клітини з низькою експресією HER2, що дозволяє охопити ширше пухлинне мікросередовище.
Трастузумаб дерукстекан (T-DXd) — втілення сучасних можливостей ADC
Трастузумаб дерукстекан (T-DXd) є представником ADC нового покоління, спеціально розробленим для високоефективного та вибіркового впливу на клітини, що експресують HER2 [19, 24]. Моноклональне антитіло в його складі спрямовує молекулу точно до HER2-рецепторів, забезпечуючи максимально таргетну доставку цитотоксичного «навантаження» [19, 20, 21]. Однією з особливостей T-DXd є високий коефіцієнт «ліки-до-антитіла» (drug-to-antibody ratio — DAR), що становить у середньому близько 8 молекул цитотоксичного агента на 1 антитіло [25]. Це забезпечує більш інтенсивний протипухлинний ефект порівняно з ADC попередніх поколінь. Цитотоксичний компонент T-DXd — інгібітор топоізомерази I, активний метаболіт іринотекану — відзначається надзвичайно високою потужністю, відсутністю перехресної резистентності з таксанами та інгібіторами мікротрубочок, а також коротким періодом напіврозпаду, що додатково поліпшує профіль безпеки препарату [19, 20, 22, 24, 26]. Не менш важливим елементом структури є пухлинно-селективний лінкер, який залишається стабільним у плазмі крові, але розщеплюється ферментами, активними саме в пухлинних клітинах. Це гарантує, що цитотоксичний агент вивільняється лише там, де він дійсно необхідний [27–29]. Після того як ADC внутрішньо захоплюється клітиною та лінкер розщеплюється, цитотоксичний агент вивільняється та проникає у ядро пухлинної клітини, де реалізує свій ефект. Окрім того, цитостатик здатен дифундувати крізь клітинні мембрани у сусідні клітини пухлини. Такий «ефект свідка» дозволяє T-DXd знищувати клітини не лише з високою експресією HER2, але й з низьким або гетерогенним рівнем HER2. Це робить препарат особливо актуальним для лікування гетерогенних за експресією рецептору HER2 пухлин [24, 27].
T-DXd як інноваційний ADC був створений з метою подолання проблем традиційної хімієтерапії, які протягом десятиліть обмежували її клінічну ефективність. Класичні цитотоксичні препарати не мають пухлинної специфічності: вони однаково впливають як на пухлинні, так і на нормальні клітини, які швидко проліферують, що неминуче призводить до дозолімітувальної токсичності та формує вузький терапевтичний індекс. Це, своєю чергою, обмежує можливість ескалації дози й знижує ефективність лікування [27, 30].
На відміну від такого підходу, T-DXd має суттєво ширший терапевтичний індекс завдяки здатності забезпечувати ефективну й водночас високоспецифічну доставку цитотоксичного агента безпосередньо до клітин, що експресують HER2-рецептор. Така вибірковість стає можливою завдяки 2 ключовим механізмам: збільшенню селективності впливу, що дозволяє підвищувати максимальну переносиму дозу без компромісу з безпечністю, та зростанню терапевтичного потенціалу, що пов’язано зі зниженням мінімальної ефективної дози. У комбінації ці властивості забезпечують ширший діапазон експозиції з прийнятним профілем безпеки порівняно з традиційними хімієтерапевтичними агентами [27, 30].
Завдяки таким характеристикам T-DXd не лише перевершує класичні цитостатичні режими, але й відкриває нові можливості персоналізованої терапії, зокрема для пацієнтів із гетерогенною або низькою експресією HER2.
Результати первинного аналізу дослідження DESTINY-Breast03 (станом на травень 2021 р.), яке оцінювало ВБП у пацієнток із HER2+ мРГЗ, стали справжнім переломним моментом у терапії цієї категорії хворих [31, 32]. У цьому дослідженні T-DXd проявив безпрецедентну ефективність, що дослівно відзначали як «момент тріумфу» для сучасних ADC.
Порівняно зі стандартом другої лінії терапії — трастузумаб емтанзином (T-DM1) — T-DXd забезпечив 72% зниження ризику прогресування захворювання або смерті, що підтверджується відношенням ризиків (HR) = 0,28 (95% довірчий інтервал (ДІ) 0,22–0,37) та статистично значущим результатом p=7,8×10²².
Ще одним ключовим показником став аналіз медіани ВБП (мВБП):
- для T-DXd (ЕНХЕРТУ) мВБП на момент оцінки не була досягнута, але проміжний розрахунок становив 15,5 міс (діапазон 15,1–16,5);
- для T-DM1 мВБП становила лише 6,8 міс (діапазон 5,6–8,2).
Такі результати свідчать про значну терапевтичну перевагу T-DXd в якості другої лінії лікування та підкреслюють його здатність суттєво подовжувати контроль над захворюванням у пацієнток із HER2+ мРГЗ.
Результати дослідження DESTINY-Breast03, представлені на конгресі Європейського товариства медичної онкології (European Society For Medical Oncology — ESMO) 2021 р., стали переломним моментом у лікуванні HER2+ мРГЗ, закріпивши T-DXd як терапію, що має перевагу у другій лінії лікування. Результати досліджень, опубліковані у провідних наукових виданнях, таких як «The New England Journal of Medicine», підтвердили, що T-DXd «драматично ефективніший» за трастузумаб емтанзин (T-DM1) як терапія другої лінії. Це сприяло тому, що T-DXd був включений до рекомендацій ESMO як переважний варіант лікування навіть до отримання офіційного схвалення від регуляторних органів, таких як FDA та EMA [31–33].
За результатами вторинного аналізу дослідження DESTINY-Breast03, оновленого в липні 2022 р., застосування T-DXd сприяло досягненню вищих показників ВБП у пацієнток із HER2+ мРГЗ порівняно зі стандартною терапією другої лінії — T-DM1 [34]. За оцінкою Незалежного централізованого огляду (Blinded Independent Central Review — BICR), мВБП для пацієнток, які отримували T-DXd, досягла 28,8 міс (95% ДІ 22,4–37,9), що більш ніж у 4 рази перевищує мВБП для групи T-DM1 — 6,8 міс (95% ДІ 5,6–8,2). HR становило 0,33 (95% ДІ 0,26–0,43) при надзвичайно значущому статистичному показнику p <0,0001 [3–5, 31, 34]. Ці результати не лише підтвердили значну терапевтичну перевагу T-DXd у другій лінії, а й підкреслили його роль як нового стандарту таргетної терапії для пацієнток із HER2+ мРГЗ.
Результати клінічних досліджень підтверджують, що T-DXd є справжньою проривною інновацією в лікуванні РГЗ. Він демонструє суттєве подовження мВБП у другій лінії терапії HER2+ мРГЗ порівняно зі стандартним режимом — T-DM1 [3]. Для порівняння, у першій лінії терапії HER2+ мРГЗ, за даними дослідження CLEOPATRA, мВБП для комбінації пертузумаб + трастузумаб + доцетаксел становила 18,7 міс [3, 4]. У другій лінії, за даними дослідження EMILIA, мВБП для T-DM1 становила 9,6 міс [5, 31]. Таким чином, T-DXd не лише перевершує результати стандартної терапії другої лінії, але й наближається за ефективністю до показників ефективності першої лінії терапії, відкриваючи нові перспективи для оптимізації лікування пацієнток із HER2+ мРГЗ.
За оцінкою частоти об’єктивної відповіді (ЧОВ), T-DXd досяг показника 79% (n=205 / 261), що майже вдвічі перевищує ЧОВ для T-DM1 — 35% (n=92 / 263). Іншими словами, відповідь на лікування T-DXd відмічалася у близько 4 із 5 пацієнток. Крім того, T-DXd забезпечив значно вищу частоту повної відповіді (ПВ) — 21% (n=55 / 261) проти 10% (n=26 / 263) у групі T-DM1 [34]. Ці дані підкреслюють суттєву перевагу T-DXd у досягненні повної клінічної відповіді та підтверджують його ефективність у другій лінії терапії HER2+ мРГЗ.
Оновлений аналіз загальної виживаності (ЗВ) у дослідженні DESTINY-Breast03 (станом на листопад 2023 р.) підтвердив суттєву перевагу T-DXd над T-DM1 у другій лінії терапії HER2+ мРГЗ [21]. Медіана ЗВ для пацієнток, які отримували T-DXd, становила 52,6 міс (n=261), тобто понад 4 роки, тоді як медіана ЗВ для групи T-DM1 становила 42,7 міс (n=263). ВР для ЗВ становило 0,73 (95% ДІ 0,56–0,94), що статистично значуще свідчить про зниження ризику смерті на 27%.
Ці дані підтверджують стійку і клінічно значущу перевагу T-DXd, а також підкреслюють його роль як нового стандарту терапії для пацієнток із HER2+ мРГЗ у другій лінії лікування.
Ефективність T-DXd у пацієнток з метастазами в головний мозок
T-DXd проявляє значну клінічну перевагу навіть у пацієнток із метастазами в головний мозок на момент залучення в дослідження (рис. 1) [30, 32]. У цій когорті мВБП для групи ЕНХЕРТУ становила 15,0 міс (95% ДІ 9,5–20,8), що приблизно в 5 разів перевищує мВБП для групи T-DM1 — 3,0 міс (95% ДІ 1,5–6,6).
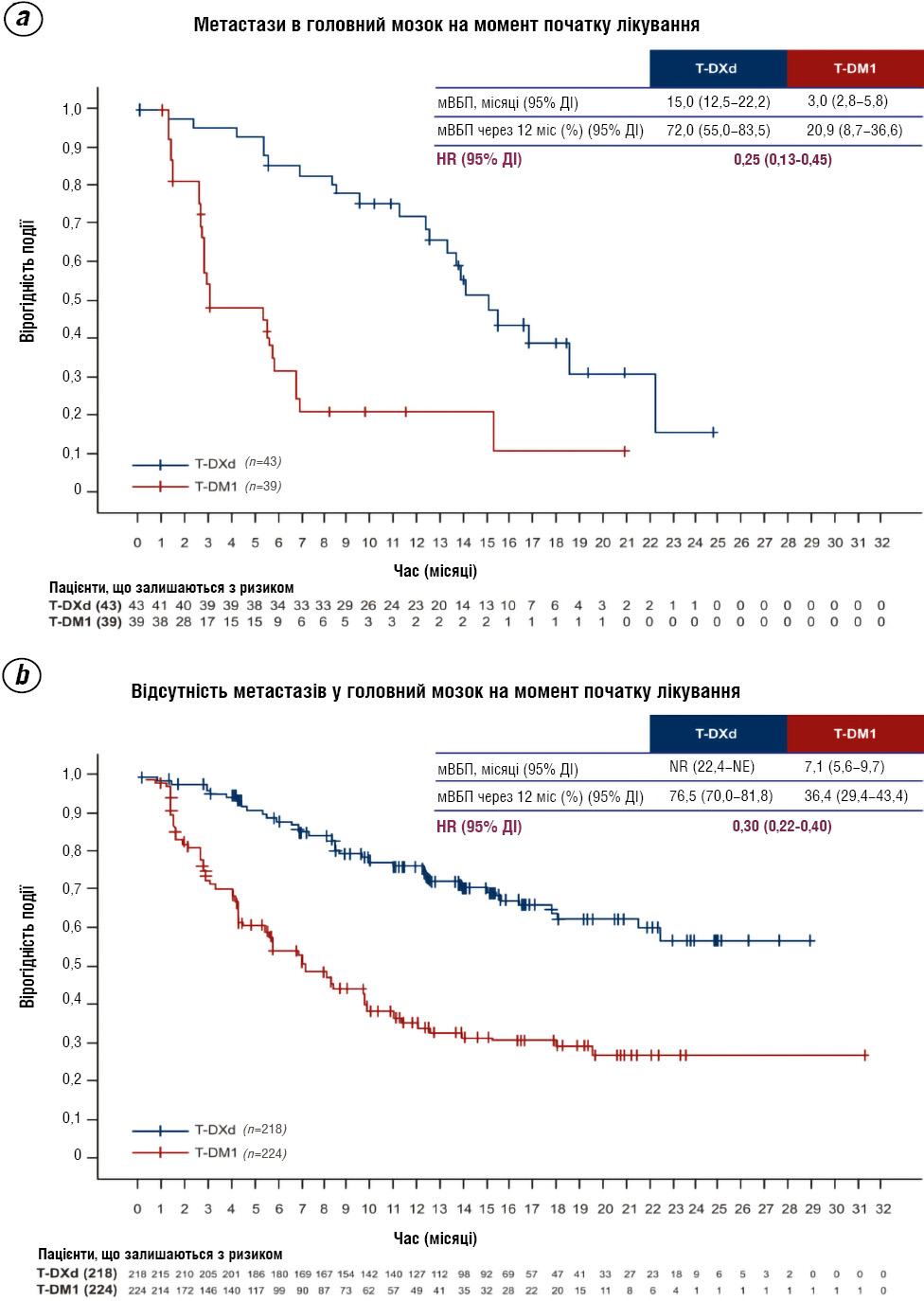
Рис 1. Криві Каплана — Меєра мВБП у пацієнток (a) з метастазами в головний мозок та (b) без них.
Примітки: NE — не оцінено; NR — не досягнуто.
Для пацієнток без метастазів у ЦНС на початковому рівні T-DXd також зумовив значущу перевагу: мВБП не було досягнено, тоді як для групи T-DM1 вона становила 7,1 міс.
Ці дані підкреслюють здатність T-DXd ефективно контролювати захворювання навіть у складних клінічних ситуаціях, включно з наявністю метастазів у ЦНС, та свідчать про його перевагу над T-DM1 у другій лінії терапії HER2+ мРГЗ. Отримані результати доводять особливу клінічну цінність T-DXd у складних підгрупах, зокрема за наявності метастазів у ЦНС [29, 34].
Профіль безпеки T-DXd у DESTINY-Breast03
У дослідженні DESTINY-Breast03 більшість поширених ПР, зафіксованих у групі T-DXd станом на липень 2022 р., були I або II ступеня тяжкості [32, 34, 35]. Найчастіше фіксувалися:
- нудота — 70%;
- блювання — 50%;
- алопеція — 40%;
- закреп — 37%;
- зниження апетиту — 29%;
- діарея — 31%;
- підвищена втомлюваність — 25%.
У наступному аналізі профілю безпеки, оновленому станом на листопад 2023 р., частота серйозних ПР залишалася стабільною, що підтверджує передбачуваність і контрольованість профілю безпеки T-DXd [20].
Для мінімізації ПР застосовувалося профілактичне або підтримувальне лікування, призначене відповідно до клінічної ситуації та внутрішніх протоколів закладів. За необхідності могла використовуватися премедикація протиблювотними засобами відповідно до стандартної медичної практики та переносимості пацієнтом.
Отже, T-DXd характеризується передбачуваним і контрольованим профілем безпеки, що робить його клінічно прийнятним для широкого кола пацієнток із HER2+ мРГЗ.
Випадки ІНСТЕРСТИЦІАЛЬНОЇ ХВОРОБИ ЛЕГЕНЬ / пневмоніту в дослідженні DESTINY-Breast03
За результатами аналізу безпеки станом на листопад 2023 р. у дослідженні DESTINY-Breast03 були зафіксовані випадки інтерстиціальної хвороби легень (ІХЛ) / пневмоніту, пов’язані із застосуванням T-DXd [21, 34, 36–38]. Загалом випадків IV або V ступеня тяжкості, асоційованих із T-DXd, не відмічалося. Більшість зафіксованих подій мали I або II ступінь тяжкості. Загальна частота всіх ступенів ІХЛ / пневмоніту у групі T-DXd становила 16,7% (n=257): I ступеня — 4,3%, II ступеня — 11,7%, III ступеня — 0,8%. Для порівняння, у групі T-DM1 (n=261) загальна частота ІХЛ / пневмоніту становила 3,4%.
Ці дані свідчать, що, хоча T-DXd асоціюється з більш високою частотою випадків ІХЛ / пневмоніту порівняно з T-DM1, більшість подій носять легкий або помірний характер, а тяжкі ускладнення залишаються рідкісними і контрольованими.
Так, T-DXd не просто представляє «ще одну» терапевтичну опцію, а справжній прорив у лікуванні, який змінює підхід до ведення метастатичного HER2+ РГЗ: від поступового «вичерпання» ліній терапії до надання пацієнткам максимально ефективного та тривалого контролю вже у другій лінії лікування [39, 40]. Сучасний статус препарату можна узагальнити так: T-DXd — це інноваційний HER2-таргетний ADC із «ефектом свідка», який допомагає долати HER2-гетерогенність і надає пацієнткам нові шанси на ефективне лікування [19, 41].
Завершуючи розгляд інноваційних можливостей T-DXd, стає очевидним, що сучасні HER2-таргетні ADC суттєво розширюють терапевтичні горизонти для пацієнток із HER2+ мРГЗ.
Ці дані логічно підводять до наступного актуального аспекту онкологічної практики — керування HER2-low мРГЗ, де нові підходи трансформують раніше усталену парадигму лікування.
Наступну доповідь «Ландшафт лікування HER2-low мРГЗ: трансформація підходів. Клінічний випадок» представила хімієтерапевтка, клінічна онкологиня Спеціалізованого мамологічного центру Анна Василівна Хмель. Історично статус HER2-рецепторів при РГЗ оцінювали бінарно — як позитивний або негативний. При цьому близько 80–85% пацієнток попередньо вважалися HER2-негативними (включно з результатами імуногістохімії (ІГХ) 0, 1+ або 2+ / гібридизацією in situ − (In Situ Hybridization — ISH)), і їм не рекомендували анти-HER2-терапію [41, 42]. Лише близько 15–20% пацієнток класифіковано як HER2+ [22]. Таким чином, раніше більшість пацієнтів не мали можливості отримати таргетну анти-HER2-терапію, що підкреслює актуальність нових стратегій для HER2-low популяції.
Незалежно від гормонального статусу, пацієнтки з HER2-негативним мРГЗ стикаються з обмеженими терапевтичними можливостями та поступовим погіршенням клінічних результатів у наступних лініях лікування. Для HR-позитивних пацієнток у першій лінії терапії мВБП становить близько 28 міс при застосуванні ендокринної терапії поєднано з інгібіторами CDK4/6 або хімієтерапією. Проте вже у другій лінії (ЕТ + mTOR-інгібітор або PI3KCA-інгібітор) мВБП знижується до близько 16 міс, а у третій лінії при призначенні хімієтерапії — до близько 6 міс. У пацієнток з HR-негативним статусом мВБП є суттєво меншою із самого початку: близько 8 міс при комбінованій терапії інгібітор PD-1 + хімієтерапія або 6 міс при монохімієтерапії у першій лінії. У другій та третій лініях лікування ВБП різко падає до близько 2 міс [43–50]. Ці дані чітко свідчать про виражену незадоволену клінічну потребу, особливо серед пацієнток, хвороба яких прогресує на тлі наявних терапевтичних схем, та підкреслюють необхідність пошуку нових ефективних підходів у лікуванні HER2-low та HER2-негативного мРГЗ.
Нова класифікація HER2 та потенціал T-DXd
У сучасній класифікації Американського товариства клінічної онкології / Коледжу американських патологів (American Society of Clinical Oncology / College of American Pathologists — ASCO / CAP) відбувається перегляд підходів до оцінки HER2-статусу, що відкриває нові терапевтичні можливості для значної частини пацієнток із РГЗ [39, 47, 48]. Близько 60% жінок, які раніше вважалися HER2-негативними, тепер ідентифікують як HER2-low, що визначається як ІГХ 1+ або ІГХ 2+ / FISH− [41]. Раніше бінарна класифікація розподіляла пацієнток на: HER2+ (~15% — ІГХ 3+ або ІГХ 2+ / FISH+) та HER2-негативні (~85% — ІГХ 0, ІГХ 1+ або ІГХ 2+ / FISH−).
Згідно з новим підходом, підгрупа HER2-low становить близько 50–60% усіх випадків, тоді як справді HER2-негативний статус (ІГХ 0) залишається лише у 25–35% пацієнток. Пацієнтки з HER2-low статусом можуть отримати клінічну користь від лікування T-DXd, що відкриває перспективу таргетної терапії для раніше не охопленої групи хворих і суттєво розширює терапевтичний ландшафт HER2-негативного РГЗ.
Рекомендації NCCN щодо T-DXd при HER2-low мРГЗ
Після дослідження DESTINY-Breast04 трастузумаб дерукстекан (T-DXd) став першим і єдиним лікарським засобом, якому надається перевага для лікування мРГЗ з низьким рівнем HER2 в настановах Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN) [40]. T-DXd рекомендовано як пріоритетний варіант системної терапії першої лінії при рецидивному нерезектабельному або мРГЗ для пацієнток з низьким рівнем експресії HER2 (ІГХ 1+ або 2+ /FISH−), які раніше отримували хімієтерапію через метастатичне захворювання або в яких розвинувся рецидив під час чи протягом 6 міс після завершення ад’ювантної хімієтерапії.
Рекомендована схема дозування:
- 5,4 мг/кг маси тіла в/в, день 1-й;
- циклічно кожен 21 день.
Дослідження DESTINY-Breast04 охоплювало 557 пацієнток (HER2-low), рандомізованих у співвідношенні 2:1 для отримання T-DXd або хімієтерапії за вибором лікаря [20, 48]. У гормон-рецептор-позитивній підгрупі T-DXd продемонстрував майже дворазове збільшення мВБП (10,1 проти 5,4 міс; HR=0,51; p <0,001) та значне подовження ЗВ (23,9 проти 17,6 міс; HR=0,69). Подібні переваги були зафіксовані й у загальній популяції HER2-low, де мВБП становила 9,9 проти 5,1 міс, а медіана ЗВ — 22,9 проти 16,8 міс відповідно. Ці результати підтверджують суттєву перевагу T-DXd над стандартною хімієтерапією незалежно від гормонального статусу.
Крім підвищення ЗВ, T-DXd забезпечив значно вищі показники ЧОВ та клінічної користі. У HR+ когорті ЧОВ досягла 52,6% для T-DXd порівняно з 16,3% для хімієтерапії, а тривалість відповіді становила 10,7 проти 6,8 міс. У HR– пацієнток об’єктивна відповідь становила 50,0 проти 16,7%, а клінічна користь — 62,5 проти 27,8% [48]. Так, T-DXd проявляє виражену терапевтичну ефективність та змінює стандарт лікування HER2-low мРГЗ, забезпечуючи статистично та клінічно значущі переваги в усіх ключових підгрупах.
ЧОВ T-DXd у пацієнтів з метастазами в головний мозок
У підгрупі пацієнток із безсимптомними метастазами в головний мозок на етапі залучення в дослідження DESTINY-Breast03, T-DXd проявив суттєво вищу ефективність щодо метастазів у головний мозок порівняно з T-DM1 [49]. ЧОВ щодо метастазів у головний мозок у групі T-DXd становила 65,7%, що майже вдвічі перевищувало показник 34,3% у групі T-DM1. Особливо показовим є те, що повну відповідь зафіксовано у 28,6% пацієнток, які отримували T-DXd, тоді як у групі T-DM1 цей показник становив лише 2,9%.
Поряд із високою ЧОВ, T-DXd також забезпечував значно вищу частоту часткових відповідей (partial response (PR)) щодо метастазів у головний мозок — 37,1 проти 31,4% у групі T-DM1. Важливо, що у підгрупі пацієнток, які отримували T-DXd, не було зафіксовано прогресування метастазів у головний мозок, тоді як у групі T-DM1 прогресування в ЦНС відзначалося у 20,0% випадків [29]. Загальний рівень контролю метастазів у головний мозок був також значно вищим для T-DXd, що підкреслює його здатність ефективно стабілізувати або зменшувати вираженість внутрішньочерепних уражень.
Отримані результати підтверджують, що T-DXd забезпечує значну активність щодо метастазів у головний мозок та може відігравати важливу роль у лікуванні пацієнток із HER2+ мРГЗ та метастазами в головний мозок, зумовлюючи значно вищі показники відповіді й контролю захворювання порівняно зі стандартною терапією T-DM1.
Детальний аналіз профілю безпеки T-DXd у дослідженні DESTINY-Breast04
У дослідженні DESTINY-Breast04 проведено детальний аналіз профілю безпеки. Основну увагу зосереджено на ПР, що відмічалися у ≥20% пацієнток. Для T-DXd зафіксовано підвищений рівень шлунково-кишкової токсичності та загальних розладів, при цьому найчастішою ПР була нудота — 73,0% (усі ступені), що значно перевищувало частоту цього явища у групі хімієтерапії (47,7%) [48].
У групі T-DXd також зареєстровані випадки ІХЛ / пневмоніту), асоційовані з лікуванням. Загальна частота підтверджених випадків становила 12,1% (n=371), переважно легкого або середнього ступеня (I ступінь — 3,5%, II ступінь — 6,5%), тяжкі випадки траплялися рідко (III ступінь — 1,3%, IV ступінь — 0%, V ступінь — 0,8%). Для порівняння, у групі хімієтерапії частота ІХЛ / пневмоніту була лише 0,6% (n=172). Медіана часу до виникнення першого епізоду у групі T-DXd становила 5,5 міс (26 днів — 31,5 міс) [19, 48, 50].
У клінічних дослідженнях за участю пацієнтів, які отримували T-DXd 5,4 мг/кг маси тіла (n=1449) при різних типах пухлин, загальна частота ІХЛ становила 12,5% [50]. Більшість випадків були легкого або середнього ступеня: I ступінь — 3,2%, II ступінь — 7,4%, III ступінь — 0,8%, випадків IV ступеня не зафіксовано, летальні випадки (V ступінь) виникли у 1% пацієнтів. Сукупний аналіз клінічних даних свідчить, що ризик ІХЛ / пневмоніту при застосуванні T-DXd є передбачуваним і піддається контролю за умови дотримання рекомендованих заходів моніторингу [50].
Щодо інших ПР у групі T-DXd, частота нудоти становила 73%, при цьому тяжкі випадки (≥III ступеня) відмічалися у 4,6% пацієнток. Подібні тенденції зафіксовані для блювання (34,0 проти 16,3% у групі хімієтерапії) та зниження апетиту (28,6 проти 16,3%). Інші часті ПР включали втомлюваність (47,7% усіх ступенів; 7,5% ≥III ступеня) та алопецію (37,7%; без випадків ≥III ступеня). Водночас T-DXd асоціювався зі значно нижчою частотою мієлосупресії порівняно з хімієтерапією: нейтропенія розвивалася у 33,2% хворих (1,9% ≥III ступеня) проти 51,2% (40,7% ≥III ступеня) у групі хімієтерапії. Аналогічно лейкопенія та анемія були менш поширені або у менш тяжкій формі у групі T-DXd (лейкопенія: 23,2 проти 31,4%; анемія: 33,2 проти 22,7%) [48]. Загалом профіль безпеки T-DXd, хоча й потребує уваги до шлунково-кишкової токсичності, має перевагу щодо гематологічної токсичності порівняно з хімієтерапією.
Клінічний випадок
На завершення доповіді А.В. Хмель представила клінічний випадок з власної практики, що ілюструє сучасні підходи до діагностики та лікування РГЗ.
Пацієнтка, 36 років, у вересні 2020 р. під час самообстеження виявила новоутворення в правій грудній залозі, через що звернулася до мамолога.
09.2020 р. — перший візит, обстеження та встановлення діагнозу
09.2020 р. Мамографія: Са правої грудної залози 11,3×8,8 мм.
09.2020 р. Ультразвукова діагностика (УЗД) грудної залози: новоутворення правої грудної залози розміром 1,5 см. Трепан-біопсія та патогістологічний висновок (ПГВ): помірно-диференційована інвазивна карцинома, PR 70%, HER2/Neu−, Ki-67 — 40%.
Діагноз: інвазивна карцинома правої грудної залози сТ1сN0cM0: ЕS 95%, PR 70%, HER2/Neu−, Ki-67 — 40%, клінічна група — 2, стадія — I.
Після слів мамолога, що потрібно «відрізати грудну залозу», пацієнтка повернулася додому і відмовилася від подальшого лікування.
(Через 1 рік і 11 міс)
08.2022 р. — розвиток мРГЗ та призначення першої лінії лікування
У серпні 2022 р. стан пацієнтки погіршився, з’явилися скарги на виражений біль у кістках скелета, зменшення маси тіла на 15 кг, відмову від їжі. Візуальне обстеження: комп’ютерна томографія (КТ) органів грудної клітки (ОГК), органів черевної порожнини (ОЧП), органів малого таза (ОМТ) без контрасту у зв’язку з високим рівнем креатиніну та погіршенням загального стану: Са правої грудної залози з метастазами в правий аксилярний лімфатичний вузол, легені. Літичні метастази в скелет. Патологічні компресійні переломи.
Перша лінія лікування: з 08.2022 до 03.2024 р.: гозерелін 3,6 мг підшкірно + летрозол 2,5 мг + палбоцикліб 125 мг з 1-го до 21-го дня.
(Через 1 рік і 7 міс)
03.2024 р. — перше прогресування та призначення другої лінії лікування
З березня 2024 р.: продовження хвороби у вигляді розвитку метастазів у печінку. Пацієнтка починає отримувати другу лінію лікування: фулвестрант 500 мг + деносумаб + гозерелін.
Через 2–3 міс 05.2024 р. — подальше прогресування за даними обстежень та призначення третьої лінії лікування.
«На жаль, пацієнтка отримала прогресування захворювання у вигляді метастазів у печінку. На той момент я не проводила біопсію печінки, адже відрізок без лікування був досить довгим, і я сподівалася, що хвора, будучи естроген-позитивною, повільно прогресуватиме. Але через 2–3 міс стан різко погіршився, виникли метастази в легені», — зазначила доповідачка.
Проведено КТ ОГК, ОЧП, ОМТ з контрастом. Висновок: стан у процесі терапії Са правої грудної залози. Порівняно з КТ від 11.2023 р. та магнітно-резонансною томографією (МРТ) від 03.2024 р. визначається негативна динаміка (прогресування захворювання) у вигляді збільшення кількості та розмірів гіповаскулярних вогнищ у печінці (метастазів) та розвиток одиничних субсолідних вузлів у паренхімі легень, потовщення інтерстиціального компонента, більш ймовірно — лімфогенний канцероматоз. Вторинне ураження кісток без динаміки від 11.2023 р. Біопсія метастазів у легені та ПГВ: метастаз помірно-диференційованої карциноми грудної залози, естрогеновий рецептор (Estrogen Receptor — ER) 60%, PR 35%, HER2/Neu +1, Ki-67 50%.
З червня 2024 р. змінено терапію на третю лінію — щотижневий паклітаксел 80 мг/м2
У липні 2024 р.: обстеження на PIK3CA-мутацію — не виявлено, BRCA тестування методом секвенування нового покоління (Next Generation Sequencing — NGS) — мутацій у генах BRCA не виявлено.
06–10.2024 р. — стабілізація захворювання на третій лінії лікування за даними обстежень
Серпень 2024 р. КТ ОГК, ОЧП, ОМТ з контрастом. Висновок: стан у процесі терапії Са правої грудної залози. У порівнянні з КТ від 20.05.2024 р. визначається позитивна динаміка у вигляді зменшення метастаз вогнищ у печінці на 32%, зменшення субсолідних вузликів у легенях, потовщення інтерстиціального компонента, що може вкладатися PR. Вторинне ураження кісток без динаміки від 05.2024.
МРТ печінки. Висновок: позитивна динаміка у вигляді зменшення розмірів вогнищ у печінці на 25%.
Пацієнтка пройшла 4 цикли АС (доксорубіцин + циклофосфамід), під час чого стан почав погіршуватися.
(Через 5 міс)
11.2024 р. — подальше прогресування за даними обстежень та призначення четвертої лінії лікування
Листопад 2024 р. КТ ОГК, ОЧП, ОМТ з контрастом. Висновок: стан у процесі терапії Са правої грудної залози. У динаміці КТ від 08.2024 р. відзначається збільшення розмірів та кількості вогнищ печінки. Субсолідні вузлики в легенях, потовщення інтерстиціального компонента, вторинне ураження кісток без істотної динаміки від 08.2024 р.
МРТ печінки. Висновок: стан у процесі поліхімієтерапії з приводу метастатичного Са правої грудної залози. Негативна МРТ-динаміка від 08.2024 р. унаслідок збільшення та розвитку нових вогнищ паренхіми печінки. Зберігається поліоссальне метастатичне ураження скелета. Прогресування процесу за критеріями RECIST 1.1.
З 1 листопада 2024 р. призначено четверту лінію лікування — капецитабін у монорежимі. Стан пацієнтки під час прийому капецитабіну був стабільний.
11.2024 — 06.2025 р. — стабілізація захворювання на четвертій лінії лікування за даними обстежень
Лютий 2025 р. КТ ОГК, ОЧП, ОМТ з контрастом. Висновок: стан у процесі терапії через Са правої грудної залози. У динаміці КТ від 11.2024 р. відзначаються зменшення розмірів вогнищ у печінці, збільшення вираженості ознак цирозу. Субсолідні вузлики в легенях, потовщення інтерстиціального компонента, вторинне ураження кісток без істотної динаміки від 11.2024 р.
(Через 5 міс)
07.2025 р. — подальше прогресування за даними обстежень та призначення п’ятої лінії лікування
Липень 2025 р. КТ ОГК, ОЧП, ОМТ з контрастом. Висновок: стан у процесі терапії через Са правої грудної залози. Негативна динаміка у КТ від 02.2025 р. за рахунок збільшення розмірів та розвитку нових вогнищ паренхіми печінки. Врешті КТ-картина без істотних змін, зокрема субсолідні вузлики в легенях, потовщення інтерстиціального компонента, вторинне ураження кісток.
Трепан-біопсія утворення печінки та ПГВ: метастаз карциноми грудної залози, ER 80%, PR 95%, HER2/Neu +1, Ki-67 10%. Онкомаркер Са 15-3: 289, 26.08.2025 р. — 202, 03.10.2025 р. — 153 — фіксується зниження рівня онкомаркера.
З 3 липня 2025 р. розпочато введення трастузумабу дерукстекану 5,4 мг/кг маси тіла 1 раз на 21 день. Пацієнтка отримала 5 циклів.
07–10.2025 р. — стабілізація захворювання на п’ятій лінії лікування за даними обстежень
Жовтень 2025 р. КТ ОГП та ОЧП, заочеревинного простору та ОМТ з контрастом. Висновок: стан у процесі терапії через Са правої грудної залози. Порівняно з КТ від 07.2025 р. фіксується зменшення таргетних вогнищ печінки на 19%, що може вкладатися в стабілізацію процесу (рис. 2). Нарешті КТ-картина без істотних змін, зокрема вузлики в легенях, потовщення інтерстиціального компонента, вторинне ураження кісток — стабілізація процесу.
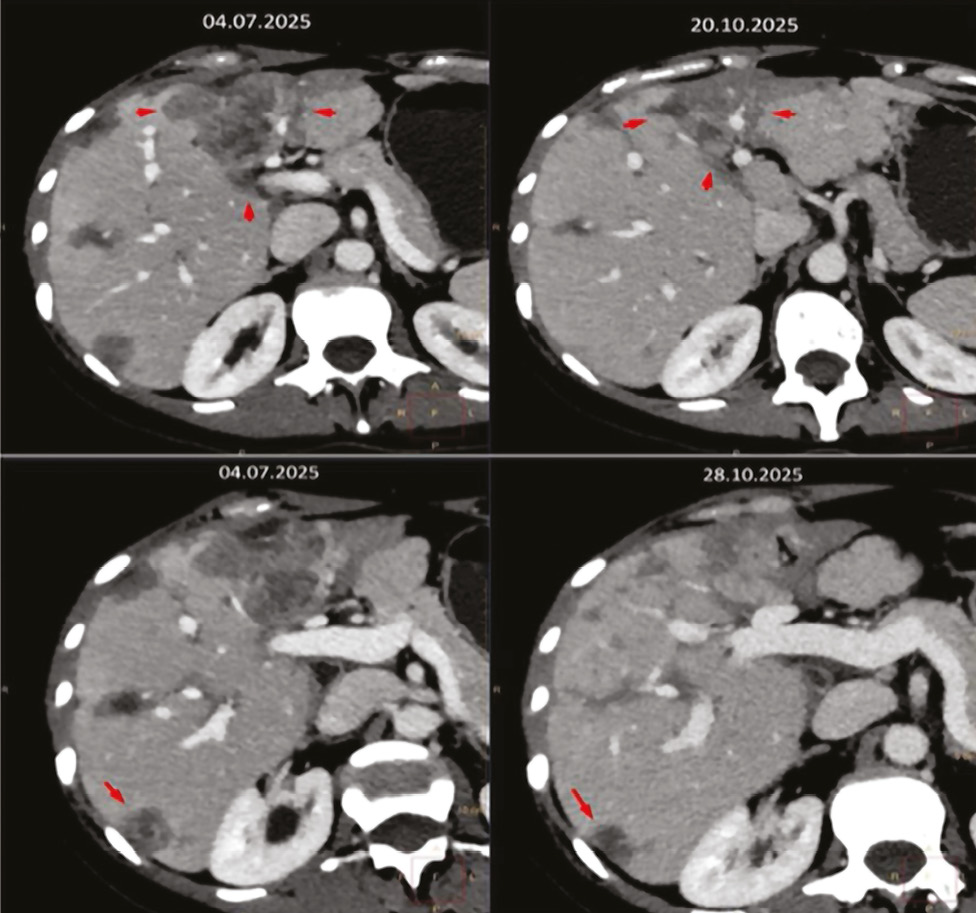
Рис. 2. Динаміка КТ ОГК та ОЧП, заочеревинного простору та ОМТ з контрастом
Діагноз: інвазивна карцинома правої грудної залози, 2020 р., сТ1сN0сМ0, 2022 р. — продовжений ріст (prolongatio morbi — Prol morbi) метастазів у легені та кістки скелета. Стан після 19.08.2022 — березня 2024 р. — гозерелін 3,6 мг підшкірно + летрозол 2,5 мг + палбоцикліб 125 мг з 1-го до 21-го дня. V Prol morbi у 2024 р. у печінку, кістки, стан після 3 ліній терапії. Prol morbi: ER 80%, PR 95%, HER2/Neu +1, Ki-67 10%. Стан після 5 циклів трастузумабу деркстекану — ІV стадія, 2 класифікаційна група.
Після призначення трастузумабу деркстекану у пацієнтки відмічалося поступове зниження рівня онкомаркерів і стабілізація метастазів. На КТ виявлено зменшення кількості та розміру печінкових метастазів на 19%, стабілізацію ураження кісток та легень. Проліферативні маркери: ER 80%, Pr 95%, HER2/Neu +1, Ki-67 10%.
«Це інноваційний препарат, який змінив підхід до лікування HER2-low мРГЗ. Він забезпечує подовження ВБП та підвищення якості життя пацієнтів. На мою думку, це один з найефективніших препаратів за останні 5 років», — підсумувала спікерка.
Цей випадок свідчить про ефективність нових цільових підходів у лікуванні HER2-low мРГЗ, які раніше класифікувалися як HER2−, і підтверджує можливість значного покращення клінічних результатів навіть у пацієнток із прогресуючим захворюванням.
Висновки
Так, ЕНХЕРТУ зумовлює значне клінічне підвищення виживаності, оскільки подовжує ВБП до 10,1 міс порівняно з 5,4 міс для ХТ (хімієтерапія за вибором лікаря (at the discretion of the doctor)) (HR=0,51; p<0,0001). Крім того, ЕНХЕРТУ значно подовжує ЗВ, досягаючи 23,9 проти 17,5 міс для ХТ (HR=0,64; p=0,003), а також підвищує ЧОВ до 52,6% порівняно з 16,3% для ХТ [19]. Це свідчить про те, що трастузумаб дерукстекан є новою таргетною терапією, яка змінює парадигму лікування HER2-low мРГЗ, раніше класифікованого як HER2−, забезпечуючи значне покращення клінічних результатів.
Євгенія Гончарук
Список використаної літератури
1. Bazell, R. (1998). Her-2: The making of Herceptin, a revolutionary treatment for breast cancer. New York, NY: Random House.
2. Harris, A. L. (1999). Her-2: The making of Herceptin, a revolutionary treatment for breast cancer (Book review). New England Journal of Medicine, 340(6), 486–487. doi: 10.1056/NEJM199902113400619.
3. Yao, M., & Fu, P. (2018). Advances in anti-HER2 therapy in metastatic breast cancer. Chinese Clinical Oncology, 7(3), 27. doi: 10.21037/cco.2018.05.04.
4. Swain, S. M., Baselga, J., Kim, S. B., Ro, J., Semiglazov, V., Campone, M., … Cortés, J. (2015). Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. New England Journal of Medicine, 372(8), 724–734. doi: 10.1056/NEJMoa1413513.
5. Verma, S., Miles, D., Gianni, L., Krop, I. E., Welslau, M., Baselga, J., … Blackwell, K. (2012). Trastuzumab emtansine for HER2-positive advanced breast cancer. New England Journal of Medicine, 367(19), 1783–1791. doi: 10.1056/NEJMoa1209124.
6. Nuzzolese, I., & Montemurro, F. (2020). Attrition in metastatic breast cancer: A metric to be reported in randomised clinical trials? Lancet Oncology, 21(1), 21–24. doi: 10.1016/S1470-2045(19)30792-2.
7. Kreutzfeldt, J., Rozeboom, B., Dey, N., & De, P. (2020). The trastuzumab era: Current and upcoming targeted HER2+ breast cancer therapies. American Journal of Cancer Research, 10(4), 1045–1067.
8. Dhritlahre, R. K., & Saneja, A. (2021). Recent advances in HER2-targeted delivery for cancer therapy. Drug Discovery Today, 26, 1319–1329. doi: 10.1016/j.drudis.2020.12.014.
9. Tripathy, D., Rugo, H. S., Kaufman, P. A., Swain, S., O’Shaughnessy, J., Jahanzeb, M., … Hurvitz, S. (2014). The SystHERs registry: An observational cohort study of treatment patterns and outcomes in patients with HER2-positive metastatic breast cancer. BMC Cancer, 14, 307. doi: 10.1186/1471-2407-14-307.
10. Ahn, S., Woo, J. W., Lee, K., & Park, S. Y. (2020). HER2 status in breast cancer: Changes in guidelines and complicating factors for interpretation. Journal of Pathology and Translational Medicine, 54(1), 34–44. doi: 10.4132/jptm.2019.11.03.
11. Drugs.com. (2025). History of Herceptin. Retrieved from: http://www.drugs.com/history/herceptin.html (accessed 26.10.2025).
12. European Medicines Agency. (2025). Herceptin: EPAR. Retrieved from: http://www.ema.europa.eu/en/medicines/human/EPAR/herceptin (accessed 26.10.2025).
13. European Medicines Agency. (2025). Tyverb: EPAR. Retrieved from: http://www.ema.europa.eu/en/medicines/human/EPAR/tyverb (accessed 26.10.2025).
14. Blumenthal, G. M., Scher, N. S., Cortazar, P., Chattopadhyay, S., Tang, S., Song, P., … Pazdur, R. (2013). First FDA approval of dual anti-HER2 regimen. Clinical Cancer Research, 19(18), 4911–4916. doi: 10.1158/1078-0432.CCR-13-1212.
15. European Medicines Agency. (2025). Perjeta: EPAR. Retrieved from: http://www.ema.europa.eu/en/medicines/human/EPAR/Perjeta (accessed 26.10.2025).
16. European Medicines Agency. (2025). Kadcyla: EPAR. Retrieved from: http://www.ema.europa.eu/en/medicines/human/EPAR/kadcyla (accessed 26.10.2025).
17. Daiichi Sankyo. (2025). Enhertu approved in the U.S. Retrieved from: daiichisankyo.us (accessed 26.10.2025).
18. AstraZeneca. (2024). Enhertu approved as first tumour-agnostic HER2-directed therapy. Retrieved from: http://www.astrazeneca.com (accessed 26.10.2025).
19. Міністерство охорони здоров’я України. (2025). Інструкція для медичного застосування лікарського засобу ЕНХЕРТУ (ENHERTU®). Київ: МОЗ України.
20. Cortés, J., Hurvitz, S. A., Im, S. A., Iwata, H., Curigliano, G., Kim, S. B., … Hamilton, E. (2024). Long-term survival analysis of the DESTINY-Breast03 trial. Nature Medicine, 30(8), 2208–2215. doi: 10.1038/s41591-024-03021-7.
21. Swain, S. M., Shastry, M., & Hamilton, E. (2023). Targeting HER2-positive breast cancer. Nature Reviews Drug Discovery, 22(2), 101–126. doi: 10.1038/s41573-022-00579-0.
22. Ogitani, Y., Hagihara, K., Oitate, M., Naito, H., & Agatsuma, T. (2016). Bystander killing effect of DS-8201a. Cancer Science, 107(7), 1039–1046. doi: 10.1111/cas.12966.
23. Tsurutani, J., Iwata, H., Krop, I., Jänne, P. A., Doi, T., Takahashi, S., … Li, B. T. (2020). Targeting HER2 with trastuzumab deruxtecan. Cancer Discovery, 10(5), 688–701. doi: 10.1158/2159-8290.CD-19-1014.
24. U.S. Food and Drug Administration. (2022). KADCYLA® prescribing information. Silver Spring, MD: FDA.
25. Nakada, T., Sugihara, K., Jikoh, T., Abe, Y., & Agatsuma, T. (2019). The latest research and development into trastuzumab deruxtecan. Chemical & Pharmaceutical Bulletin, 67(3), 173–185. doi: 10.1248/cpb.c18-00744.
26. Krop, I. E., Beeram, M., Modi, S., Jones, S. F., Holden, S. N., Yu, W., … Burris, H. A. (2010). Phase I study of trastuzumab-DM1. Journal of Clinical Oncology, 28(16), 2698–2704. doi: 10.1200/JCO.2009.26.2071.
27. Cortés, J. (2021). Trastuzumab deruxtecan in metastatic breast cancer. ESMO Congress 2021, Abstract LBA1.
28. Cortés, J., Kim, S. B., Chung, W. P., Im, S. A., Park, Y. H., Hegg, R., … Hurvitz, S. A. (2022). Trastuzumab deruxtecan versus trastuzumab emtansine. New England Journal of Medicine, 386(12), 1143–1154. doi: 10.1056/NEJMoa2115022.
29. Gennari, A., Martins-Branco, D., Trapani, D., Pentheroudakis, G., Curigliano, G., & Harbeck, N. (2025). ESMO metastatic breast cancer living guideline (v1.2). ESMO.
30. Hurvitz, S. A., Hegg, R., Chung, W. P., Im, S. A., Jacot, W., Ganju, V., … Cortés, J. (2023). Updated results from DESTINY-Breast03. Lancet, 401(10371), 105–117. doi: 10.1016/S0140-6736(22)02420-5.
31. Diéras, V., Miles, D., Verma, S., Pegram, M., Welslau, M., Baselga, J., … Gianni, L. (2017). Final overall survival results from EMILIA. Lancet Oncology, 18(6), 732–742. doi: 10.1016/S1470-2045(17)30312-1.
32. Hurvitz, S. A., Kim, S. B., Chung, W. P., Im, S. A., Park, Y. H., Hegg, R., … Cortés, J. (2024). Brain metastases analysis from DESTINY-Breast03. ESMO Open, 9(5), 102924. doi: 10.1016/j.esmoop.2024.102924.
33. Hurvitz, S. A., Hegg, R., Chung, W.-P., Im, S.-A., Jacot, W., Ganju, V., … Cortés, J. (2023). Supplementary materials for DESTINY-Breast03. Lancet, 401(10371), 105–117.
34. Daiichi Sankyo, Inc. (2024). Data on file. Tokyo: Daiichi Sankyo.
35. Linehan, A. S., Fitzpatrick, O. M., & Morris, P. G. (2021). Profile of trastuzumab deruxtecan. Breast Cancer: Dove Medical Press, 13, 151–159. doi: 10.2147/BCTT.S245024.
36. National Comprehensive Cancer Network. (2025). NCCN Guidelines®: Breast Cancer (Version 5.2025). Retrieved from: http://www.nccn.org (accessed 22.11.2025).
37. Tarantino, P., Hamilton, E., Tolaney, S. M., Cortes, J., Morganti, S., Ferraro, E., … Curigliano, G. (2020). HER2-low breast cancer. Journal of Clinical Oncology, 38(17), 1951–1962. doi: 10.1200/JCO.19.02488.
38. Wolff, A. C., Hammond, M. E. H., Allison, K. H., Harvey, B. E., Mangu, P. B., Bartlett, J. M. S., … Dowsett, M. (2018). HER2 testing in breast cancer. Journal of Clinical Oncology, 36(20), 2105–2122. doi: 10.1200/JCO.2018.77.8738.
39. Marchiò, C., Annaratone, L., Marques, A., Casorzo, L., Berrino, E., & Sapino, A. (2021). Evolving concepts in HER2 evaluation. Seminars in Cancer Biology, 72, 123–135. doi: 10.1016/j.semcancer.2020.02.016.
40. HER2 Spectrum. (2025). Unmet need. Retrieved from: http://www.her2spectrum.com/en/unmet-need (accessed 21.09.2025).
41. Yardley, D. A. (2019). MONALEESA clinical program. Future Oncology, 15(23), 2673–2686. doi: 10.2217/fon-2019-0130.
42. Sledge, G. W., Toi, M., Neven, P., Sohn, J., Inoue, K., Pivot, X., … Llombart-Cussac, A. (2017). MONARCH 2. Journal of Clinical Oncology, 35(25), 2875–2884. doi: 10.1200/JCO.2017.73.7585.
43. Martín, M., Ruiz, A., Muñoz, M., Balil, A., García-Mata, J., Calvo, L., … Mel, J. R. (2007). GEICAM trial. Lancet Oncology, 8(3), 219–225. doi: 10.1016/S1470-2045(07)70041-4.
44. Cortes, J., Cescon, D. W., Rugo, H. S., Nowecki, Z., Im, S. A., Yusof, M. M., … Schmid, P. (2020). KEYNOTE-355. Lancet, 396(10265), 1817–1828. doi: 10.1016/S0140-6736(20)32531-9.
45. Bardia, A., Hurvitz, S. A., Tolaney, S. M., Loirat, D., Punie, K., Oliveira, M., … Rugo, H. S. (2021). Sacituzumab govitecan in metastatic TNBC. New England Journal of Medicine, 384(16), 1529–1541. doi: 10.1056/NEJMoa2028485.
46. Cabel, L., Carton, M., Pistilli, B., Dalenc, F., Vanlemnens, L., Levy, C., … Lerebours, F. (2021). Outcome beyond third-line chemotherapy. The Breast, 56, 18–25. doi: 10.1016/j.breast.2021.01.006.
47. Tarantino, P., Viale, G., Press, M. F., Hu, X., Penault-Llorca, F., Bardia, A., … Curigliano, G. (2023). ESMO expert consensus on HER2-low breast cancer. Annals of Oncology, 34(8), 645–659. doi: 10.1016/j.annonc.2023.05.008.
48. Modi, S., Jacot, W., Yamashita, T., Sohn, J., Vidal, M., Tokunaga, E., … Cameron, D. A. (2022). Trastuzumab deruxtecan in HER2-low breast cancer. New England Journal of Medicine, 387(1), 9–20. doi: 10.1056/NEJMoa2203690.
49. Tsurutani, J., Jacot, W., Yamashita, T., Riaz, F., Yerushalmi, R., Im, S., … Modi, S. (2023). Subgroup analysis of patients with HER2-low metastatic breast cancer with brain metastases at baseline from DESTINY-Breast04, a randomized phase III study of trastuzumab deruxtecan versus treatment of physician’s choice. Annals of Oncology, 34(2), 388. doi.org/10.1016/j.annonc.2023.09.565.
50. Swain, S. M., Nishino, M., Lancaster, L. H., Li, B. T., Nicholson, A. G., Bartholmai, B. J., … Powell, C. A. (2022). Multidisciplinary guidance on T-DXd-related ILD. Cancer Treatment Reviews, 106, 102378. doi: 10.1016/j.ctrv.2022.102378.














Leave a comment