Гигантские опухоли внутригрудной локализации
Ганул А.В., Борисюк Б.А., Семиволос А.В., Кондрацкий Ю.Н., Шевченко А.И., Совенко В.М., Кобзев О.И., Бороров Л.В.
Резюме. Проанализированы результаты комплексного и хирургического лечения 64 пациентов с первичными и вторичными злокачественными и доброкачественными гигантскими опухолями, локализованными в грудной полости. Разработаны тактические подходы в лечении больших местно-распространенных опухолей. В клинической практике при гигантских злокачественных опухолях мы успешно применяем в неоадъювантном режиме системную химиотерапию и внутриартериальную селективную химиотерапию. При этом лечебный эффект — частичный или полный регресс опухоли — зарегистрирован у 51–88% пациентов в зависимости от гистологического варианта опухоли. Всего прооперировано 57 пациентов, из них в 21 случае опухоль носила доброкачественный характер, а в 36 — опухоль была злокачественной. Комбинированные операции выполнены 44 пациентам. Разработан алгоритм обследования больных с гигантскими внутригрудными опухолями. Оптимизированы хирургические доступы при удалении внутригрудных опухолей больших размеров в зависимости от их локализации.
Вступление
В последние годы отмечается тенденция к увеличению числа больных с первичными опухолями внутригрудной локализации. Более 80% этих опухолей представлены разными гистотипами рака [3, 6, 7]. Гораздо менее изученной в клинической онкологии и торакальной хирургии остается проблема гигантских опухолей внутригрудной локализации. К гигантским опухолям мы, как и наши коллеги, относим опухоли занимающие более половины гемиторакса, или распространяющиеся в переднее и заднее средостение одновременно [2, 3, 7]. На рис. 1 — пример гигантской опухоли.
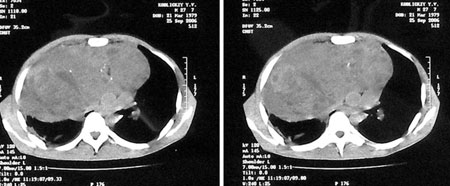
Внутригрудные гигантские опухоли — собирательное понятие, объединяющее в одну группу, по единым анатомическим границам, новообразования различного гистологического строения, клинического течения, степени злокачественности и прогноза. Материалы НИР подтверждают известные сведения о локализации и преимущественно злокачественном характере опухолей грудной полости. Соотношение злокачественных и доброкачественных новообразований составило 2:1. Определение исходной локализации процесса сильно затруднено при гигантских опухолях, когда наблюдается поражения как переднего, так и заднего средостения с распространением процесса на большую часть гемиторакса [1, 4–6, 8]. Небольшое число клинических наблюдений «в руках» одной группы исследователей и несовершенство методов визуализации не позволяет однозначно ответить на многие вопросы, касающиеся клиники, диагностики, морфологической верификации, а также выбора оптимального метода лечения данного контингента больных. Все это обусловливает разноречивость взглядов по основным вопросам данной группы заболеваний. Внедрение в последние годы современных диагностических и хирургических технологий способствовало улучшению результатов лечения больных с первичными редкими опухолями внутригрудной локализации[1, 4, 6, 8]. Однако, проблема еще далека от решения. До настоящего времени нередки случаи, когда истинный характер выявляемого рентгенологически внутригрудного патологического новообразования устанавливают только в процессе хирургического вмешательства.
Цель нашей статьи — уточнить вопросы диагностики и оценить результаты хирургического и комплексного лечения гигантских опухолей внутригрудной локализации.
Материалы и методы
Проведен анализ диагностических исследований и результатов лечения 64 больных гигантской опухолью внутригрудной локализации, которых обследовали и лечили в клинике НИР. Возраст больных колебался от 4 до 70 лет.
Длительность клинических проявлений составляла от нескольких месяцев до 5 лет. При больших опухолях, не связанных с прилежащими анатомическими образованиями, не отмечалось клинических проявлений, за исключением умеренной одышки (до 10–12% случаев). В остальных наблюдениях регистрировался медиастинальный компрессионный синдром (до 30–40% случаев, в особенности при злокачественных процессах); а также различные неспецифические симптомы (повышение температуры тела, кашель, боли и чувство сдавления за грудиной и др.). Морфологический характер опухолей указан в табл. 1.
Таблица 1 Морфологический характер опухолей
| Морфология опухоли | Количество, n (%) |
|---|---|
| Доброкачественные опухоли | 21 (32,8) |
| Тератомы | 9 (42,8) |
| Нейрогенные опухоли | 4 (19) |
| Многокомпонентные мезенхимальные опухоли без признаков малигнизации | 6 (28,6) |
| Другие | 2 (9,6) |
| Злокачественные опухоли | 43 (67,2) |
| Ангиосаркомы | 8 (18,6) |
| Многокомпонентные злокачественные мезенхимальные опухоли | 4 (9,3) |
| Злокачественные герминогенные опухоли | 12(27,9) |
| Тимомы | 8 (18,6) |
| Нейросаркомы | 4 (9,3) |
| PNET | 2 (5,9) |
| Метастазы опухолей других локализаций | 5 (11,6) |
Результаты и их обсуждение
Рентгенологически при гигантских злокачественных опухолях средостения у больных отмечалось расширение тени средостения с наличием патологической тени с нечеткими контурами. Из них у 30 (47%) пациентов тень распространялась в правый гемоторакс, у 14 (21,8%) — в левый, у 20 (31,2%) — в оба гемоторакса.
Рентгенологически у 8 больных с редкой гигантской опухолью наблюдалось тотальное гомогенное затемнение, занимавшее весь гемоторакс, у остальных — овальное или округлое образование, занимающее более половины гемоторакса. Более информативным для предоперационной диагностики гигантских редких опухолей внутригрудной локализации было КТ-исследование, проведенное всем больным. Внедрение в последние годы спиральной компьютерной томографии (СКТ), особенно с внутривенным болюсным усилением, по характеру накопления контрастного препарата позволяет изучить структуру новообразования и установить точные топографоанатомические взаимоотношения гигантских опухолей с магистральными сосудами и тем самым решать вопросы операбельности таких больных. Практически у всех больных с гигантской опухолью средостения при КТ-исследовании выявлена однородная тень с неровными контурами. Инвазия в близлежащие органы и структуры отмечалась у всех больных злокачественными новообразованиями, медиастинальная компрессия опухолью — у 32 (50%) больных. У 5 (7,8%) пациентов с редкой гигантской опухолью легких определялось наличие однородной гомогенной тени тканевой плотности с четкими ровными контурами, у 1 (16,7%) — с очагами распада.
Пункционная биопсия под контролем рентгенографии или КТ выполнена всем больных и оказалась информативной в 70% наблюдений. Осложнений не отмечено.
Всем больным с доброкачественной гигантской опухолью внутригрудной локализации произведено хирургическое вмешательство. Во всех случаях опухоль удалена.
Отдельным пунктом мы выделяем злокачественные опухоли. Все опухоли внутригрудной локализации мы считаем потенциально злокачественными. При подозрении на злокачественную опухоль обязательна морфологическая верификация диагноза с последующим иммуногистохимическим анализом, что позволяет установить не только гистологический вариант опухоли, а и степень ее дифференцировки. Обязательным считаем определение уровня опухолевых маркеров — альфа-фетопротеина (АФП), хорионического гонадотропина человека (ХГЧ) и лактатдегидрогеназы (ЛДГ). При повышении уровня опухолевых маркеров без признаков поражения яичек необходима КТ органов грудной клетки, брюшной полости и забрюшинного пространства. При морфологическом подтверждении диагноза злокачественной внутригрудной герминогенной опухоли показано проведение 4–6 курсов химиотерапии (схемы ВЕР, ВР) с последующим удалением резидуальной опухоли.
Злокачественные герминогенные опухоли в обязательном порядке нуждаются в проведении неоадъювантной полихимиотерапии независимо от размеров опухоли. В наших наблюдениях уменьшение размеров опухоли наблюдалось в более 50% пациентов. Об эффективности проведенной полихимиотерапии свидетельствует не только уменьшение размеров опухоли, а также снижение уровня опухолевых маркеров: ХГЧ и АФП, и в обязательном порядке определение в удаленной резидуальной опухоли объема жизнеспособной опухолевой массы.
Нередко наблюдают, особенно при больших опухолях, так называемый синдром доброкачественной тератомы: гибель злокачественного компонента тератобластомы и одновременное увеличение доброкачественного компонента опухоли, что клинико-рентгенологически создает впечатление неэффективности проведенной полихимиотерапии. Самостоятельное хирургическое лечение, даже при выполнении радикальной операции, зачастую приводит к обширному метастазированию опухоли. Адъювантная полихимиотерапия по эффективности уступает неоадъювантной.
При получении морфологической верификации примитивной нейроэктодермальной опухоли (primitive neuroectodermal tumor — PNET) обязательным является проведение 4 циклов полихимиотерапии (ПХТ) (схема VIDE наиболее эффективна) с последующим удалением опухоли. В отношении остальных злокачественных новообразований: рабдомиосарком, нейрогенных, мезенхимальных и др. решение о целесообразности проведения предоперационной ПХТ должно приниматься только после получения степени дифференцировки опухоли. При низкодифференцированных и недифференцированных опухолях неоадъювантная химиотерапия обязательна. При инвазивных злокачественных тимомах не зависимо от степени дифференцировки должна проводиться предоперационная ПХТ (схема ADOC).
В нашей клинике накоплен большой опыт по проведению внутриартериальной селективной полихимиотерапии при опухолях переднего средостения. Наиболее эффективной методика оказалась при злокачественных тимомах. При сравнении объема жизнеспособной опухолевой ткани удаленной опухоли переднего средостения из зоны внутриартериальной полихимиотерапии и метастаза опухоли из верхней доли легкого у одной пациентки оказалось, что опухоль в средостении некротизирована на 93%, а в метастазе опухоли объем жизнеспособных клеток составил 46%. Этот факт свидетельствует об высокой эффективности внутриартериальной полихимиотерапии.
Паллиативные оперативные вмешательства с целью декомпрессии, без верификации опухоли считаем неоправданными, поскольку они только отсрочивают специальное лечение и способствуют диссеминации опухоли.
В табл. 2 представлены результаты неоадъювантной ПХТ в зависимости от гистологического варианта опухоли.
Таблица 2 Результаты неоадъювантной ПХТ в зависимости от гистологического варианта опухоли
| Гистологический вариант опухоли | Режим | n | Эффективность (частичный или полный регресс, %) |
|---|---|---|---|
| PNET | VIDE * 4 | 4 | 86 |
| Злокачественная тимома | ADOC * 3 | 356 | 88 |
| Злокачественная многокомпонентная мезенхимома | VID * 4 | 12 | 33 |
| Ангиосаркома | VID * 4 | 135 | 65 |
| Нейросаркома | IDE * 3 | 23 | 47 |
| Тератобластомы | BEP *3 | 53 | 51 |
Как видим, предоперационная ПХТ оказалась довольно эффективной практически при всех вариантах опухолей.
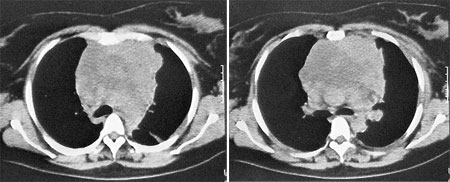
На рис. 2, 3 — пример эффективности проведенной ПХТ по схеме BEPх3 при тератобластоме средостения.

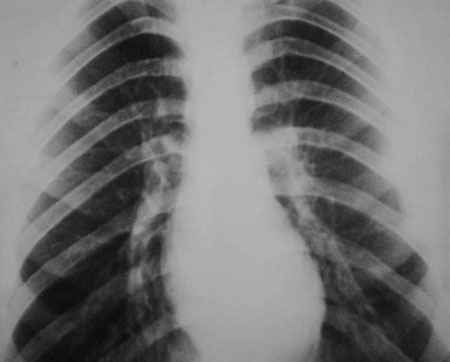
На рис. 4, 5 — пример эффективности проведенной ПХТ по схеме VIDE х 4 при PNET.
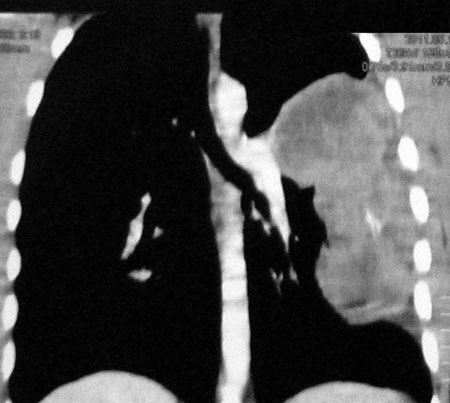
Рис. 4. Т пациента с PNET до ПХТ
Из 43 пациентов со злокачественными гигантскими опухолями внутригрудной локализации прооперировано 36 (83,7%) больных, радикальные операции выполнены 32 (88,9%), 4 (11,1%) пациентам опухоль удалена частично. Комбинированные операции выполнены 44 (83%) пациентам, простое удаление опухоли — 9 (17%) больным.
У 5 пациентов после ПХТ наблюдался полный регресс опухоли, и они продолжили консервативную терапию, 2 возрастных пациента, старше 70 лет, отказались от оперативного вмешательства.
Значительное внимание мы уделяем выбору хирургического доступа при операциях по поводу опухолей средостения. Актуальность этой проблемы связана в значительном количестве случаев с крупными новообразованиями (поперечный размер > 15 см), удаление которых при стандартной продольной стернотомии связано с техническими проблемами.
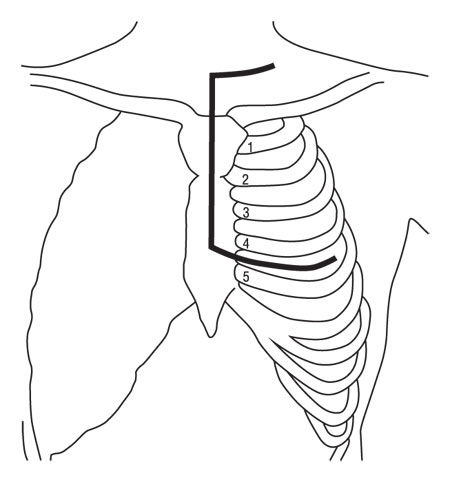
В связи с этим мы начали шире использовать чрездвуплевральный — типа «clamshell» — доступ, позволяющий радикально удалить опухоль больших размеров без осложнений. Схематически доступ представлен на рис. 6.
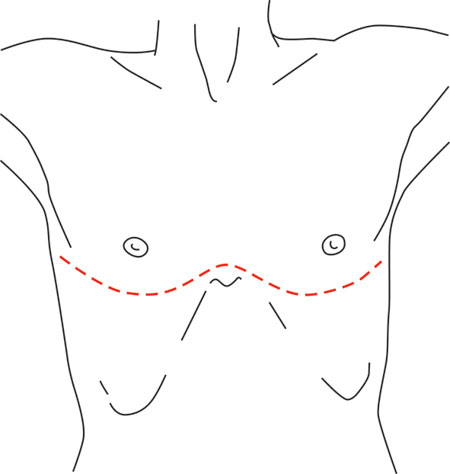
На рис. 7, 8 — практическое применение доступа.
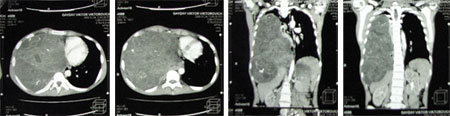
На компьютерных томограммах — пример огромной тератобластомы правого гемиторакса (рис. 9, 10).
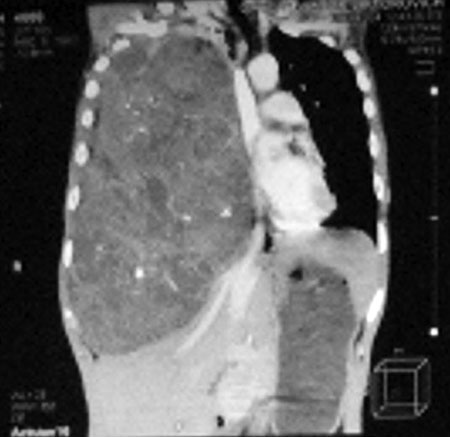
Учитывая гигантские размеры опухоли чрездвуплевральный доступ по IV межреберью с поперечным пересечением грудины (типа «clamshell») мы видоизменили и дополнили продольной стернотомией нижнего отрезка грудины и косой лапаротомией в правом подреберье.
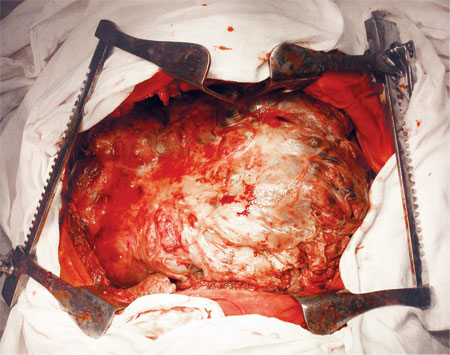
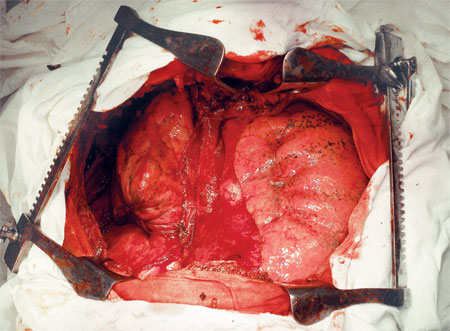
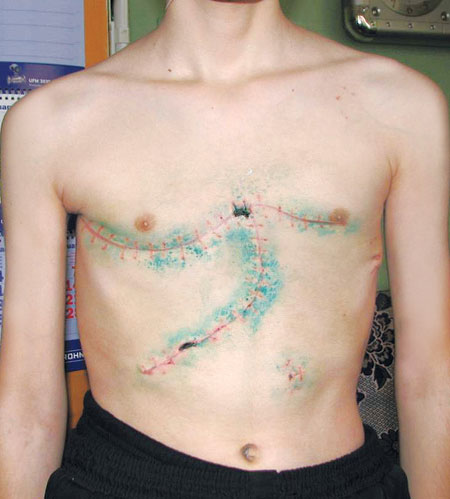
На рис. 11 представлен вид после удаления опухоли с резекцией перикарда, купола диафрагмы, нижней полой вены и пневмонэктомией справа. На рис. 12, 13 — удаленная опухоль.
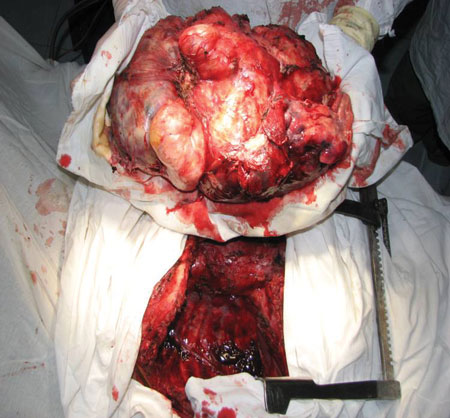
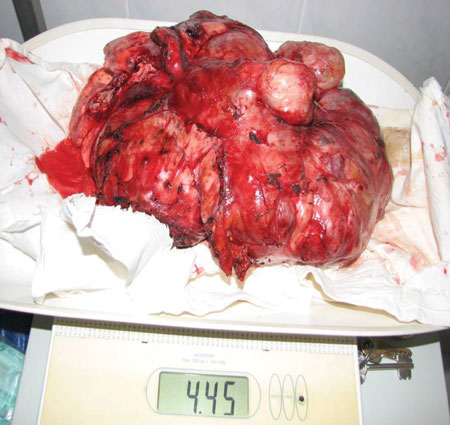
Масса опухоли — 4450 гр., масса тела пациента до операции — 37 кг.
Альтернатива при односторонней локализации опухоли — доступ типа «hemiclamshell» — комбинация продольной стернотомии с переднебоковой торакотомией (рис. 14).
Эту хирургическую тактику в последние 4 года применили у 19 пациентов (для сравнения: за все предыдущие 25 лет аналогичные доступы выполнены в 7 случаях), осложнений не было.
Рецидив опухоли отмечали у 3 (15,8%) больных, наблюдавшихся после паллиативных операций в сроки от 6 мес до 1 года. Отдаленные результаты хирургического лечения доброкачественных гигантских опухолей внутригрудной локализации хорошие, рецидивов не наблюдали.
Выводы
1. Всестороннее обследование пациентов способствует постановке достоверного диагноза и определяет резектабельность опухоли, способствует выбору адекватного метода лечения больных с гигантской внутригрудной опухолью.
2. При гигантских опухолях внутригрудной локализации оптимальным алгоритмом диагностических исследований является: рентгенография, КТ (СКТ), пункционная биопсия под контролем КТ, ВАТС, диагностическая мини-торакотомия с видеоассистированием.
3. Удаление гигантских доброкачественных внутригрудных опухолей с применением современных хирургических технологий является методом выбора при их лечении и способствует выздоровлению пациента.
4. Диагноз злокачественной опухоли должен быть в обязательном порядке подтвержден гистологически с применением иммуногистохимического исследования, что позволяет грамотно планировать специальное лечения.
5. Наиболее эффективным подходом при лечении злокачественных новообразований средостения является комплексный, где радикальному удалению опухоли способствует неоадъювантная химиотерапия. Адъювантная химиотерапия в ряде случаев позволяет улучшить выживаемость и продлевает безрецидивный период жизни пациента. Выбор цитостатиков и схем их применения обусловлен гистологической структурой опухоли.
Литература
1. Араблинский В.М. (1991) Рентгенодиагностика злокачественных неэпителиальных опухолей легкого. Вест. рентгенол., 5.
2. Давыдов М.И., Мачаладзе З.О., Полоцкий Б.Е. и др. (2008) Мезенхимальные опухоли средостения (обзор литературы). Сибирский онкологический журнал, 1(25): 64–74.
3. Давыдов М.И., Полоцкий Б.Е., Мачаладзе З.О. (2004) Гигантские опухоли средостения. Доклад на второй ежегодной Российской научно-практической конференции «Торакальная онкология». Красн. край, п. Ольгинка.
4. Ищенко Б.И., Бисенков Л.Н., Тюрин И.Е. (2001)Лучевая диагностика для торакальных хирургов. С. Петербург, 346.
5. Трахтенберг А.Х., Бирюков Ю.В., Франк Г.А. и др. (1990) Злокачественные неэпителиальные опухоли легких. Грудная и сердечно-сосудистая хирургия, 4: 42–45.
6. Трахтенберг А.Х., Вишневский А.А., Колбанов К.И., Головтеев В.В. (2003) Опухоли и кисты средостения. Материалы международной конференции «40 лет торакальной хирургии РНЦХ РАМН». М; 276—288.
7. Гагуа Р., Кучава В., Гзиришвили Л., Ломидзе З. (2005) Диагностика и результаты хирургического лечения редких гигантских опухолей внутригрудной локализации. Хирургия им. Н.И. Пирогова: 21–25.
8. Burt M., Zakowski M. (1995) Rare primary malignant neoplasms. In: Thoracic Surgery. Ed. F. Pearson, J. Deslauriers, R. Gensberg et al. USA: 807–826.
Гігантські пухлини внутрішньогрудної локалізації
Резюме. Проаналізовано результати комплексного і хірургічного лікування 64 пацієнтів з первинними та вторинними злоякісними й доброякісними гігантськими пухлинами локалізованими в грудній порожнині. Розроблені тактичні підходи при лікуванні великих місцево-поширених пухлин. У клінічній практиці при гігантських злоякісних пухлинах ми успішно застосовуємо в неоад’ювантному режимі системну і внутрішньоартеріальну селективну хіміотерапію. При цьому лікувальний ефект — часковий або повний регрес пухлини — зафіксовано в 51–88% випадків залежно від гістологічного варіанту пухлини. Всього прооперовано 57 пацієнтів, із них в 21 випадку пухлина мала доброякісний характер, а в 36 — пухлина була злоякісною. Комбіновані операції виконано 44 пацієнтам. Розроблено алгоритм обстеження хворих з гігантськими внутрішньогрудними пухлинами. Оптимізовано хірургічні доступи при видаленні внутрішньогрудних пухлин великих розмірів в залежності від їх локалізації.
Ключові слова: гігантська пухлина внутрішньогрудної локалізації, злоякісна пухлина, комплексне лікування, комбіноване лікування.
The gigantic tumor localization in thorax
Summary. The results of complex and surgical treatment of 64 patients with primary and secondary malignant and benign giant tumors localized in the chest cavity are analyzed. Tactical approaches in treating large tumors are developed. In clinical practice, with giant malignancies, we successfully employ the neoadjuvant mode system chemotherapy and intraarterial selective chemotherapy. The treatment effect is the partial or complete tumor regression is registered in 51–88% of patients, depending on the histology of the tumor. In total 57 patients were operated, of which 21 cases the tumor was non-malignant, and in 36 cases — the tumor was malignant. Combined operations are performed in 44 patients. The algorithm of examination of patients with giant intrathoracic tumors is done. Surgical approaches for removal of intrathoracic tumors of large size, depending on their location are optimized.
Key words: intrathoracic tumor, malignant tumor, combined treatment, combined operation, surgeon treatment.














Leave a comment