Неоадъювантная таргетная внутриартериальная химиотерапия местно-распространенного рака грудной железы (прецизионная технология)
Югринов О.Г., Смоланка И.И., Супруненко А.А., Досенко И.В., Ляшенко А.А.
Резюме. В качестве предоперационного этапа лечения местно-распространенного (МР) рака грудной железы (РГЖ) разработана прецизионная технология селективной внутриартериальной химиотерапии. По способу Сельдингера специальный катетер под контролем рентгеновского экрана вводили в таргетную артерию опухоли, доказательством успешного введения служило появление на экране облигатных признаков неоваскуляризации. Таргетная селективная внутриартериальная химиотерапия была проведена 68 больным МР РГЖ. Катетеризация внутренней грудной артерии выполнена у 23 пациентов при локализации опухоли в центральном секторе или внутренних квадрантах. У 16 из них таргетные сосуды представлены разветвлениями прободающей артерии. У 2 больных источником таргетных сосудов опухоли были III–IV межреберные артерии. У них прободающие артерии отсутствовали. У остальных 5 пациентов таргетные артерии опухоли представлены одновременно ветвями прободающей и задней грудной артерий. Переток крови по анастомозам из одной таргетной сосудистой системы в другую сохранялся на протяжении 1–2 сеансов мишенной химиотерапии, потом наступала «химическая» облитерация путей коллатерального кровообращения. У 17 больных имело место изолированное таргетное кровоснабжение опухоли из бассейна боковой грудной артерии. У 23 больных опухоли, происходящие из наружных квадрантов грудной железы, кровоснабжались исключительно из подлопаточной артерии. При этом в опухолевый конгломерат были вовлечены также подмышечные лимфатические узлы. Для внутриартериальной химиотерапии использовали карбоплатин в дозе 350 мг/м2, циклофосфамид — 900 мг/м2. Доксорубицин вводили внутривенно в дозе 90 мг/м2. Сочетанная внутриартериальная и системная химиотерапия состояла из 3–5 курсов, проведенных с интервалом в 3 нед.

Данные большинства исследований свидетельствуют о том, что почти половина больных раком грудной железы (РГЖ) впервые обращаются за медицинской помощью в III стадии болезни, что склоняет к предположению о наличии местно-распространенного (МР) РГЖ.
Узловой МР РГЖ относится к числу гиперваскулярных и обладает высоким ангиогенным потенциалом. Он идентифицируется при ангиографическом исследовании, что позволяет выбрать оптимальные пути транспортировки цитостатиков для проведения таргетной внутриартериальной химиотерапии.
В качестве предоперационного этапа лечения МР РГЖ разработана прецизионная технология внутриартериальной химиотерапии. По методу Сельдингера катетер под контролем рентгеновского экрана вводили в таргетный сосуд опухоли и оставляли для проведения длительной инфузии противоопухолевых препаратов.
Направленная доставка цитостатиков обеспечивает повышение локальной концентрации более чем в 10 раз по сравнению с системной химиотерапией [2, 3, 14].
Во время таргетной химиотерапии поток крови вытесняется и замещается инфузионной жидкостью. Благодаря этому исключается контакт и процесс специфического связывания цитостатиков с белками плазмы крови, что обусловливает эксклюзивный химиотерапевтический эффект первого прохождения препарата и экстракции его в опухоль [4, 6–8].
Таргетная внутриартериальная химиотерапия призвана селективно девитализировать ткани опухоли, индуцировать состояние клинической ремиссии в виде сокращения массы и объема новообразования и регионарных метастазов, понижать стадию заболевания, конвертировать нерезектабельные опухоли в резектабельные.
Эффективность предоперационной внутриартериальной химиотерапии может служить одним из критериев прогноза при МР РГЖ [1, 3, 14].
Понятие МР РГЖ включает в себя: наличие опухоли >5 см в наибольшем измерении или первичной опухоли любых размеров с прямым распространением на кожу или грудную стенку, вызывающей изъязвления, отек или сопровождающейся появлением сателлитов в грудной железе.
Материалы и методы
Таргетная внутриартериальная химиотерапия была проведена 68 больным МР РГЖ. У 25 человек диагностирована IIБ, у 29 — IIIБ и у 14 — IV стадии заболевания. Возраст больных составлял 38–63 года. У всех пациентов диагноз верифицирован при пункционной биопсии. Инфильтративная дольчатая карцинома была в 47,2% случаев, инфильтративная протоковая — в 36,1%, низкодифференцированная — в 16,7%. Катетеризация внутренней грудной артерии выполнена у 23, боковой грудной — у 17, подлопаточной — у 23 больных.
Двухкатетерная селективная химиотерапия проведена одновременно или последовательно у 5 женщин на левой стороне, у которых таргетные артерии происходили из внутренней грудной и подлопаточной артерии.
Методика и техника серийного ангиографического исследования таргетных сосудов МР РГЖ
Диагностическое исследование кровеносных сосудов грудной железы осуществляли в специальной рентгенооперационной, оснащенной усилителем рентгеновского изображения, телемониторами, цифровой системой для получения и обработки изображения таргетных сосудов в реальном времени.
Применяли армированные рентгеноконтрастные катетеры разных типов, специально предназначенные для зондирования сосудов грудной железы ряда зарубежных фирм («Terumo», «Cordis», «Cooc»).
Серийное ангиографическое исследование проводили в условиях автоматического введения рентгеноконтрастного вещества с таким расчетом, чтобы зарегистрировать изображение таргетных артерий в артериальной, капиллярной и паренхиматозной фазах контрастирования.
Применяли неионные низкомолекулярные водорастворимые йодсодержащие рентгеноконтрастные препараты — йогексол или йопромид. Количество препарата на одно введение в зависимости от диаметра катетеризированного сосуда составляло от 20 до 30 мл. Для суперселективной артериографии обычно использовали 7–10 мл препарата, введенного вручную. Скорость съемки была равна 3 кадрам в секунду.
После динамической серийной ангиографии применяли автоматический режим дигитальной субтракционной ангиографии. Ангиограммы выполняли в прямой, правой и левой косых проекциях.
Диагностическая ангиография МР РГЖ.
Алгоритм селективной катетеризации таргетных артерий
Кровоснабжение МР РГЖ проходило из ряда источников, относящихся к системам подключичной и подмышечной артерии. В условиях экспансивно растущей опухоли кровоток в регионе претерпевал существенные изменения. В частности, для обеспечения возросших потребностей в кровоснабжении опухоли-мишени доминирующее развитие приобретали те сосуды, которые территориально расположены ближе к очагу поражения, их называют еще таргетными артериями.
Для решения конкретной диагностической задачи выполняли избирательный поиск таргетных артерий в определенной последовательности. В частности, для опухолей, локализующихся в медиальных квадрантах или в центральной части органа, диагностическое исследование начинали с зондирования внутренней грудной артерии на соответствующей стороне.
Таргетную катетерную химиотерапию опухолей, локализующихся в наружных квадрантах грудной железы, проводили путем зондирования боковой грудной или подлопаточной артерии.
Если при диагностической ангиографии контрастировались дополнительные нетипичные источники кровоснабжения разросшейся опухоли, то прицельную внутриартериальную химиотерапию выполняли на основе использования техники катетеризации наивысшей грудной артерии, реберно-шейного или щитовидно-шейного ствола.
Применяли пункционную чрескожную технику катетеризации периферических сосудов. Обычно использовали правый трансфеморальный доступ. Пункцию подмышечной артерии с соответствующей стороны проводили главным образом в случае неудачного поиска выбранных артерий путем пункции бедренной артерии.
Трансфеморальная селективная катетеризация внутренней грудной артерии
Катетер F-5 «Cobra»-3 или правый коронарный JR 4,5 фирмы «Cordis» заводили в дугу аорты и продвигали на 2–3 см в подключичную артерию с соответствующей стороны. Устье внутренней грудной артерии отыскивали по передненижней полуокружности сосудистой магистрали на уровне грудино-ключичного сочленения. По проводнику катетер продвигали на глубину 3–4 см и оставляли в свободном состоянии в стволе искомого сосуда (рис. 1).
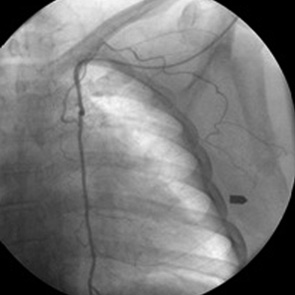
Cелективную катетеризацию правой внутренней грудной артерии выполнить сложнее из-за формирования вынужденного изгиба катетера, соответствующего кривизне плечеголовного ствола.
В сложившейся ситуации полезно использовать проводник диаметром 0,032 ˝ с длинным мягким концом и проводить поиск устья артерии в правой косой проекции (рис. 2).
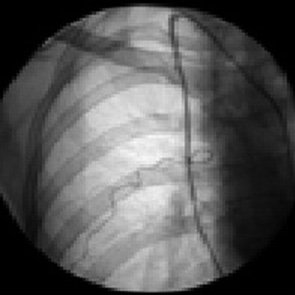
Трансфеморальная селективная катетеризация боковой грудной артерии
Катетер F-5 «Cobra»-3 «Cordis» правым трансфеморальным доступом проводили в соответствующую подключичную артерию и оставляли в дистальном ее отделе. Устье боковой грудной артерии отыскивали по нижнему контуру сосудистой магистрали на уровне переднего отрезка II ребра. При ангиографическом исследовании искомая артерия следовала косо вниз почти вдоль боковой грудной стенки и разветвлялась в тканях грудной железы и грудных мышцах (рис. 3).
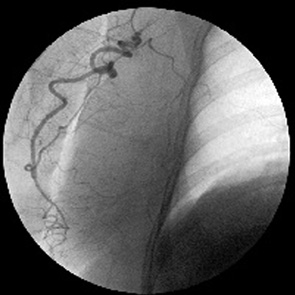
Трансфеморальная селективная катетеризация подлопаточной артерии
Подлопаточная артерия при ангиографическом исследовании в большинстве своем имела типовую рентгеноанатомию. Для ее катетеризации были пригодны те же катетеры, что и для исследования боковой грудной артерии.
Ствол подлопаточной артерии от места своего возникновения на уровне переднего отрезка III ребра почти сразу делился на 3 ветви. Две из них окружали спереди и сзади головку плечевой кости, имели восходящее направление. Третья ветвь, имеющая название задней грудной артерии, почти отвесно нисходила и затем делилась на 2 примерно равные порядковые артерии. Одна из них следовала назад и разветвлялась в области малой и большой грудных мышц. Последняя порядковая артерия направлялась круто вперед и кровоснабжала собственно ткани грудной железы (рис. 4).
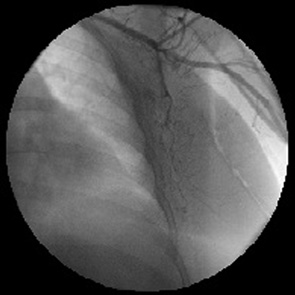
Ретроградная катетеризация подмышечной артерии
Пункцию подмышечной артерии на соответствующей стороне выполняли в ее дистальной трети. Место пункции выбирали под рентгеновским экраном в проекции нижнемедиального отдела головки плечевой кости. Рука при этом должна быть отведена на 120° и согнута в локтевом суставе. Катетер F-4 «Cobra»-3 длиной 60 см ретроградным путем по проводнику продвигали на 6–7 см в краниальном направлении и устанавливали в устье подлопаточной артерии. При контрастировании порядковых ветвей решали вопрос об оставлении выходного отдела катетера в стволе сосуда или продвижении его в заднюю грудную артерию.
Химиопрепараты и лечебный режим таргетной внутриартериальной химиотерапии МР РГЖ
Использовали карбоплатин в дозе 350 мг/м2, циклофосфамид — 900 мг/м2.
Каждый химиопрепарат разводили в физиологическом растворе в отдельном флаконе емкостью 400 мл. Инфузию цитостатиков проводили со скоростью 150–200 мл/ч с помощью автоматического дозатора лекарственных веществ в течение 2,5–3 ч.
Доксорубицин инфузировали внутривенно в дозе 90 мг/м2. Сочетанная внутриартериальная и системная химиотерапия состояла из 3–5 курсов, проведенных с интервалом в 3 нед. Мы отказались от внутриартериального введения доксорубицина из-за нежелательного везикатного воздействия на сосуды кожных покровов грудной железы.
Локальные изменения в МР РГЖ при клиническом наблюдении
При клиническом наблюдении имели место разной степени уменьшения первичной опухолевой массы, размягчение ее структуры, снижение интенсивности или исчезновение болей, расширение подкожных вен, уменьшение фиксации опухоли к тканям передней грудной стенки, сокращение величины подмышечных лимфатических узлов. Полная регрессия опухоли наступила у 13,8%, частичная — у 44,4% больных.
Осложнения и побочные эффекты внутриартериальной химиотерапии
Тошнота, рвота, потеря аппетита и другие желудочно-кишечные расстройства через 2–3 дня после лечения проявлялись у 24 больных и купировались симптоматической терапией. У 5 больных наблюдалась алопеция, у 4 — лейкопения. Пигментацию кожи и гиперестезию констатировали у 3 пациенток, через 3–5 дней симптомы исчезли.
Общая и частная ангиографическая семиотика МР РГЖ
Общая ангиографическая семиотика МР РГЖ характеризовалась полным набором специфических прямых и косвенных признаков злокачественного опухолевого поражения. При этом находили адекватное отображение почти в равной степени как признаки первичной опухоли, так и манифестные симптомы метастатического поражения регионарных лимфатических узлов.
Частная ангиографическая семиотика МР РГЖ рассматривалась на основе данных раздельного контрастирования внутренней грудной, боковой грудной и подлопаточной артерии. При этом имело место так называемое перекрестное кровоснабжение, когда в питании МР РГЖ участвовали смежные таргетные артерии, и требовалось визуализировать таргетные артерии обоих сосудистых бассейнов.
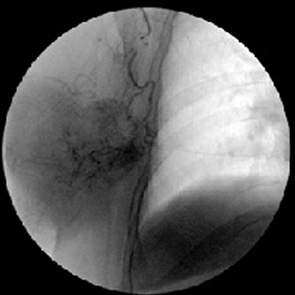
При динамическом ангиографическом исследовании таргетные артерии МР РГЖ выделялись за счет значительной гипертрофиии деформации материнских артерий и появления ярких симптомов неоваскуляризации в виде контрастирования новообразованных сосудов и окрашивания паренхимы опухолевого узла.
Незрелые патологические новообразованные сосуды были несостоятельными как в морфологическом, так и функциональном отношении. Они отличались многочисленностью, неравномерным калибром, непредсказуемым ходом, хаотическим соединением друг с другом, потерей способности к физиологическому регулированию кровотока, не реагировали на введение вазоактивных препаратов (рис. 5, 6).
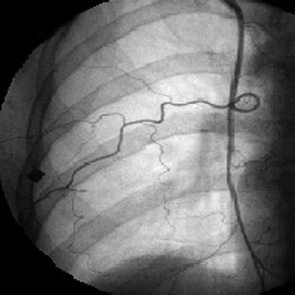
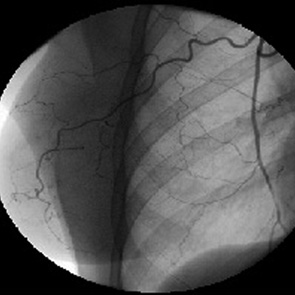
Повышенная порозность стенки новообразованных сосудов сопровождалась задержкой рентгеноконтрастного вещества в интерстициальном пространстве опухоли. В результате этого локальный кровоток становился дезорганизованным и неравномерным или наступала стагнация.
У 16 больных при исследовании внутренней грудной артерии таргетные сосуды были представлены разветвлениями прободающей (перфоративной) артерии. Она начиналась в проекции переднего отрезка II ребра и следовала косо вниз по окружности железы. На уровне концевых ветвей искомой артерии выявляли облигатные признаки неоваскуляризации (рис. 7, 8).
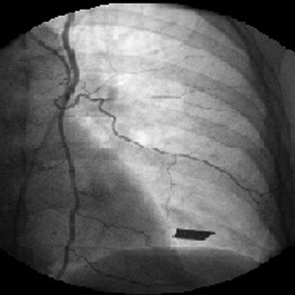
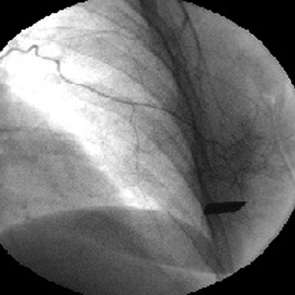
У 2 больных источником таргетных артерий были межреберные артерии. Они отходили от внутренней грудной артерии на уровне III–IV межреберья. При этом сосудистый рисунок опухоли был не менее демонстративен, чем при контрастировании перфорантных артерий. Скоротечная фаза визуализации сети новообразованных сосудов быстро сменялась фазой интенсивной имбибиции рентгеноконтрастного вещества в паренхиму новообразования (рис. 9).
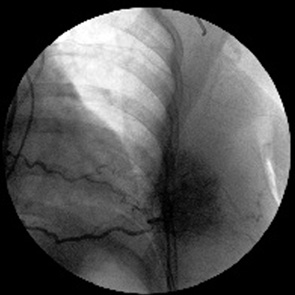
Одновременно с этим контрастировались артерио-артериальные анастомозы с другими сосудами боковой грудной стенки.
У 5 больных прободающие артерии тесно анастомозировали с ветвями подлопаточной артерии. При «тугом» контрастировании разветвлений таргетных артерий ретроградным путем заполнялась густая сеть новообразованных сосудов преимущественно из системы задней грудной артерии. Переток крови из одной таргетной сосудистой системы в другую сохранялся на протяжении 1–2 сеансов мишенной химиотерапии, потом наступала «химическая» облитерация путей коллатерального кровообращения (рис. 10).
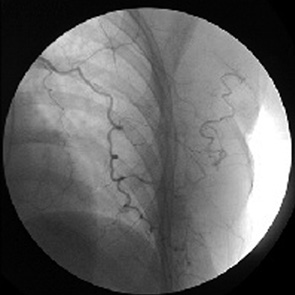
У 17 больных при серийном ангиографическом исследовании грудной железы основные изменения в ангиоархитектонике были сосредоточены в бассейне боковой грудной артерии. Искомые сосуды не следовали иерархическим образцам разветвления материнских артерий, а были сближены между собой в виде отдельных дуг по радиусу 5–6 см (рис. 11).

Появление симптомов неоваскуляризации в позднюю артериальную и паренхиматозную фазы контрастирования позволяло достоверно рассматривать их в качестве специфических мишеней для проведения таргетной дистанционной химиотерапии МР РГЖ из названного доступа.
У 23 больных МР РГЖ при локализации опухоли на границе центрального и наружного квадрантов зона «интереса» кровоснабжалась преимущественно из подлопаточной артерии. Таргетные артерии представлены ветвями задней грудной артерии. При этом характерной чертой регионарного кровообращения было одновременное появление первичной опухоли и связанных друг с другом увеличенных регионарных лимфатических узлов (рис. 12).
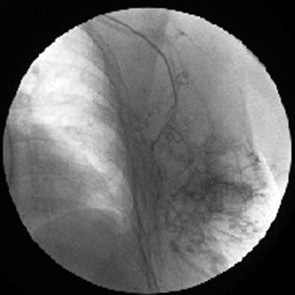
Изменение ангиоархитектоники МР РГЖ после таргетной внутриартериальной химиотерапии
После проведения индукционной внутриартериальной химиотерапии МР РГЖ на ангиограммах находили изменение ангиоархитектоники, которое мы расценили как признаки инициации острого лекарственного воздействия.
Принудительное насыщение химическими агентами МР РГЖ в момент первого прохождения через нативное сосудистое русло сопровождалось развитием и специфической микроциркуляцией.
Васкулярная мимикрия происходила преимущественно за счет утраты небольших сосудов, которые находились в коллаптоидном состоянии. При этом дезинтеграция сосудистого рисунка нарастала с увеличением размера новообразования. В нем можно было выделить на протяжении съемки отдельные очаги, участки, зоны с различной плотностью контрастирования (рис. 13, 14).
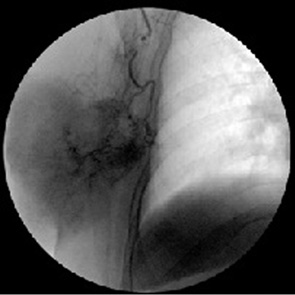
1. Эксцентричные «островки» стойкой гиперваскуляризации в местах, где сохранялись материнские сосуды.
2. Краевые гиповаскулярные участки, в которых кровоснабжение осуществлялось из редуцированных афферентных сосудов III порядка.
3. Ассиметричная аваскулярная зона, которая утратила прямые связи с афферентными сосудами.
4. Перифокальная зона, «фронт» микроциркуляции который продвигается из опухолевого ложа в направлении смежных тканей.
Обсуждение
Несомненные успехи в получении рентгеновских изображений отдельных фаз и динамики кровотока в опухолях с помощью компьютерной перфузионной томографи, таргетной компьютерной ангиографии, магнитно-резонансной томографии подтвердили наличие существенного потенциала для повышения достоверности в оценке параметров капиллярного кровообращения, транспортировки терапевтических макромолекул в процессе антинеоваскулярного и цитотоксического лечения злокачественных новообразований [5, 12, 13].
Движение терапевтических макромолекул, проникших в паравазальное пространство опухоли, происходит путем диффузии и конвекции. Значения транспортних коэффициентов определяются структурой интерстициального отдела опухоли и физико-химическими свойствами макромолекул растворенного химиопрепарата.
Экзогенно введенные терапевтические молекулы неравномерно распределяются в опухоли из-за неоднородности интерстициальной диффузии, а также за счет развития интерстициальной гипертензии [9, 10]. Повышенное интерстициальное давление жидкости может ставить под угрозу капиллярное кровообращение в опухоли и доставку химиопрепаратов в виде 3 вариантов.
1. Равновесие между капиллярным и интерстициальным давлением жидкости уменьшает конвекцию через стенку сосудов опухоли и таким образом нарушает транспортировку макромолекул химиопрепаратов.
2. Интерстициальная жидкость просачивается за пределы узла, увлекая за собой терапевтические молекулы в окружающую нормальную ткань, выводя опухоль из-под «химической атаки».
3. Трансмуральная связь между интерстициальным давлением жидкости и капиллярным давлением крови из-за высокой проницаемости новообразованных сосудов приводит к застою кровотока в опухоли без физической закупорки сосудов.
Таким образом, для увеличения интерстициальной диффузии терапевтических молекул в опухоли необходимо реализовать следующие стратегии:
- ремоделировать новообразованную сосудистую сеть опухоли и уменьшить протяженность транспортировки терапевтических макромолекул;
- снизить проницаемость стенки новообразованных сосудов и восстановить трансмуральные градиенты давления, направить поток цитостатиков через опухолевую сеть;
- возобновить кровоток в участках опухоли, лишившихся перфузии.
Понимание точной роли основных детерминантов опухолевого кровотока поможет изменить представление о сформированной микроциркуляции и путях транспортировки терапевтических молекул к таргетным опухолевым клеткам [5, 11].
Список использованной литературы
1. Бондар Г.В., Сєдаков І.Е., Шлопов В.Г. (2005) Первинно-неоперабельний рак молочної залози. Донецьк: 345.
2. Жаринов Г.М., Таразов П.Г. (1999) Регионарная внутриартериальная химиотерапия злокачественных образований. Вест. рентгенол. и радиол., 1: 48–51.
3. Лігірда О.Ф., Галахін К.О., Смоланка І.І. (2007) Модифікована хіміотерапія хворих на місцево-поширений рак молочної залози. Онкологія, 9(3): 208–216.
4. Смоланка І.І., Скляр С.Ю. (2007) Шляхи підвищення ефективності комплексного лікування хворих на рак молочної залози. Київ:192.
5. Таразов П.Г., Корытова Л.И., Шачинов Е.Г. (2011) Внутриартериальная терапия рака молочной железы. Вопросы онкологии, 57(1): 126–131.
6. Ярмоненко С.П. (2005) Новая парадигма комбинированной атиангиогенноцитотоксической терапии рака. Росс. биотерапевт. журн., 4(4): 50–58.
7. Görich I., Hasan I., Majdali R. et al. (1995) Previously Treated Locally Recurrent Breast Cancer: Treatment wits Superselektivе Intraarterial Chemotherapy locally. Radiology, 197: 199–203.
8. Görich I., Rilinger N., Sokiranski R. et al. (1996) CT-guided Intraarterial Chemotherapy in Locally Advanced Tumor. Radiology, 199: 567–570.
9. Görich I., Tomczak R., Gabelmann A. et al. (1999) Intraarterial chemotherapy in cases of brest cancer. Radiology, 39–5: 790–794.
10. Jain R.K. (2001) Normalizing tumor vasculature with anti-angiogenic therapy: a new paradigm for combination therapy. Nat. Med., 7(9): 987–989.
11. Jain R.K. (2003) Molekular regulation of vessel maturatior. Nat. Med., 9(6): 685–693.
12. Jain R.K. (2005) Normalization of tumor vascularity: an emerging concept in antiangiogenic therapy. Science, 307: 58–62.
13. Ikushima I., Korogi Y., Ishii A. et al. (2007) Superselektive arterial infusion chemotherapy for squamous cell carcinoma of the oral cavity: histopathologic effects on metastatic neck lymph nodes. Eur. Arch. Othorinolaryngol., 264(3): 269–275.
14. He J., Wang X., Guan H. et al. (2011) Clinical efficacy of local targeted chemotherapy for triple-negative breast cancer. Radiol. Oncol., 45(2): 123–128.
Неоад’ювантна таргетна внутрішньоартеріальна хіміотерапія місцево-поширеного раку грудної залози (прецизійна технологія)
Резюме. У якості передопераційного етапу лікування місцево-поширеного раку грудної залози (МП РГЗ) розроблено прецизійну технологію селективної внутрішньоартеріальної хіміотерапії. За методом Сельдінгера спеціальний катетер під контролем рентгенівського екрану вводили в таргетну артерію пухлини, доказом успішного введення слугувала поява на екрані облігатних ознак неоваскуляризації. Таргетну селективну внутрішньоартеріальну хіміотерапію проведено 68 хворим МП РГЖ. Катетеризацію внутрішньої грудної артерії виконано у 23 пацієнтів при локалізації пухлини в центральному секторі або внутрішніх квадрантах. У 16 з них таргетні судини були представлені розгалуженнями проривної артерії. У 2 хворих джерелом таргетних судин пухлини були III–IV міжреберні артерії. У них проривні артерії були відсутні. У решти 5 хворих таргетні артерії пухлини були представлені одночасно гілками проривної та задньої грудної артерій. Перетікання крові по анастомозах з однієї таргетної судинної системи в іншу зберігалося впродовж 1–2 сеансів хіміотерапії, потім наставала «хімічна» облітерація шляхів колатерального кровообігу. У 17 хворих мало місце ізольоване таргетне кровопостачання пухлини з басейну бічної грудної артерії. У 23 пацієнтів пухлини, що походять із зовнішніх квадрантів грудної залози кровопостачаються виключно з підлопаткової артерії. При цьому в пухлинний конгломерат були залучені також пахвові лімфатичні вузли. Для внутрішньоартеріальної хіміотерапії використовували карбоплатин у дозі 350 мг/м2, циклофосфамід — 900мг/м2. Доксорубіцин вводили внутрішньовенно в дозі 90 мг/м2. Поєднана внутрішньоартеріальна і системна хіміотерапія складалася з 3–5курсів, проведених з інтервалом 3 тиж.
Ключові слова: неоад’ювантна, таргетна (цільова), внутрішньоартеріальна хіміотерапія, рак грудної залози.
Neoadjuvant targeted interarterial chemotherapy for locally advanced breast cancer (precision technology)
Summary. As the pre-treatment phase locally advanced breast cancer was developed precision technology of selective intra-arterial chemotherapy. By Seldingerr’s methode special catheter controlled by X-ray screen was injected into the targeted artery tumor, proof of this is the appearance on screen of obligatory signs of neovascularization. Targeted selective intra-arterial chemotherapy was performed in 68 patients with MR BC. Catheterization of the internal thoracic artery was performed in 23 patients with tumors in the central sector or internal quadrants. In 16 of these, the targeted vessels were reported as perforating artery branching. In 2 patients, the source of the targeted vessels of the tumor were III–IV intercostal arteries. In these cases, perforating arteries were absent. In other 5 patients, the targeted artery of tumors were presented simultaneously perforating branches of the arteries and back chest. The flow of blood through the anastomoses of a targeted vascular system to the other retained for 1–2 sessions target chemotherapy, then came the «chemical» obliteration of collateral circulatory tract absorption. In 17 patients there was an isolated targeted tumor blood supply from the basin lateral thoracic artery. In 23 patients with tumors that originate from outside quadrants breast perfused exclusively of subscapular artery. In this case, in tumor conglomerate were also involved axillary lymph nodes. For intra-arterial chemotherapy using carboplatin at a dose 350 mg/m2, cyclophosphamide — 900 mg/m2. Doxorubicin injected intravenously at a dose 90 mg/m2. Combined intra and systemic chemotherapy consisted of 3–5 courses held at intervals of 3 weeks.
Keywords: neoadjuvant, targeted, interarterial chemotherapy, breast cancer.














Leave a comment