Нирково-клітинний рак
Тенденции в хирургическом лечении опухолей почек
Э.А. Стаховский, Ю.В. Витрук, О.А. Войленко, А.Э. Стаховский
Национальный институт рака, отделение пластической и реконструктивной онкоурологии, Киев, Украина
Вступление. На протяжении последних десятилетий произошли драматические изменения в диагностике и лечении почечно-клеточного рака. Внедрение лапароскопических методов, а также органосохраняющих способов лечения рака почки значительно изменили лечебные подходы. Следует отметить, что лапароскопическая нефрэктомия все чаще используется в лечебной практике, являясь показателем современного подхода, но с другой стороны — открытая или лапароскопическая нефрэктомия инвалидизирует пациента. Поэтому в последние годы возрастает роль органосохраняющих операций на почке. Они технически сложнее, рискованней и сопровождаются большим количеством осложнений по сравнению с нефрэктомией. Главный недостаток резекции почки — необходимость ее ишемизации. Особенно этот элемент необходим при лапароскопической резекции, что ограничивает ее широкое внедрение в клиническую практику.
В настоящее время разрабатываются и изучаются методики, позволяющие избежать ишемии почки во время ее резекции, усовершенствуются показания и противопоказания, разрабатываются меры профилактики осложнений. Но эти результаты еще не нашли своего полного отражения в литературе и в основном относятся к опухолям небольших размеров.
Цель исследования — анализ тенденций в оперативном лечении рака почки по данным клиники пластической и реконструктивной онкоурологии Национального института рака.
Материал и методы. Ретроспективному анализу подвергнуты клинические данные 678 пациентов с раком почки, которые находились на хирургическом лечении в клинике пластической и восстановительной онкоурологии с апреля 2008 по декабрь 2012 г. Возраст больных колебался от 19 до 82 лет (55,2±10,7). В данное исследование не включены больные с уротелиальным раком, а также с опухолями Вильмса или доброкачественными опухолями.
После комплексного клинического исследования с обязательным использованием спиральной компьютерной томографии или магнитно-ядерной томографии, определением величины опухоли по максимальному ее размеру, пациенты были подвергнуты оперативному лечению: открытой или лапароскопической нефрэктомии, либо резекции почки. Из 678 больных радикальному лечению были подвергнуты 542 (79,9%) пациента, циторедуктивные операции были выполнены в 136 (20,1%) случаях.
Результаты. Ежегодный анализ показал увеличение числа оперативных вмешательств по сравнению с первым годом: в 2008 г. прооперировано 65 больных, в 2009 — 101, в 2010 — 150, в 2011 — 179 и в 2012 — 183 пациента, что позволило установить изменения хирургической тактики в лечении рака почки на протяжении последних 5 лет. Общее количество органосохраняющих операций на протяжении 5 лет увеличилось с 15 (23,1%) в 2008 г. до 118 (64,5%) в 2012 г. (рис. 1).
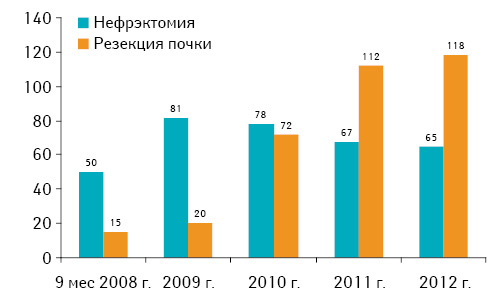
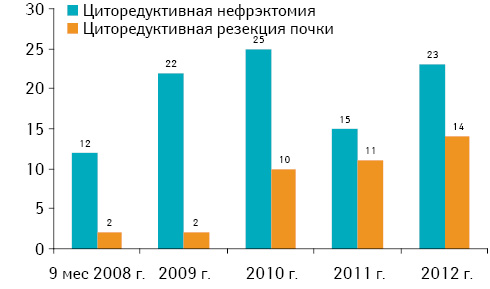
Лапароскопическую нефрэктомию более широко использовали в 2009–2010 гг. — 36 (21,7%) случаев. В последующем показания к лапароскопической нефрэктомии были пересмотрены в пользу органосохраняющей операции — резекции почки. Мы пришли к выводу, что в тех случаях, когда возможна лапароскопическая нефрэктомия, всегда можно выполнить органосохраняющую операцию — резекцию почки, даже при интраренальном расположении опухоли. Такого же принципа следует придерживаться и при выполнении циторедуктивных операций у больных метастатическим раком почки (рис. 2).
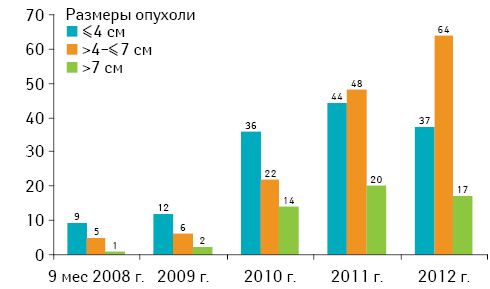
Выбор метода операции зависел от размера опухоли, ее локализации и количества сохраненной паренхимы почки. Именно оценка количества функционирующей паренхимы позволила нам расширить показания к органосохраняющим операциям при раке почки. Размер опухоли для резекции почки увеличивался от 4 до 7 см и более (рис. 3).
Органосохраняющая операция выполнялась при наличии функционирующей паренхимы >55%. В 267 (79,2%) случаях резекцию почки выполняли без ишемии. Совершенствование оперативной техники позволило уменьшить количество осложнений и внедрить методику «fast track», которая предусматривала проведение хирургического вмешательства без дренирования послеоперационной раны, под комбинированной общей и эпидуральной анестезией с возможностью длительного эффективного обезболивания на протяжении всей операции с переходом на послеоперационный период, обезболивания исключительно ненаркотическими анальгетиками, раннюю активизацию больного, что позволило сократить послеоперационный период с 8 до 3 дней (рис. 4).

Выводы. Ретроспективный анализ за последние 5 лет показывает изменения в оперативном лечении рака почки — от нефрэктомии до органосохраняющих операций. Интегральным показателем к резекции почки было наличие функционирующей паренхимы >55%. На этот показатель влияли величина опухоли и ее расположение. Внедрение современных взглядов и достижений в хирургии почки при ее опухоли позволяют сократить послеоперационный период.
Вплив різних форм раку нирок та верхніх сечових шляхів на температурну реакцію організму
Є.А. Литвинець, І.В. Білик, Р.Р. Антонів
Івано-Франківський національний медичний університет, Україна
Вступ. Підвищення температури тіла є універсальною реакцією організму на різні подразники, яка реалізується за допомогою пірогенів. У хворих на рак нирки доволі частим паранеопластичним синдромом є гіпертермія, що пояснюється здатністю пухлинних клітин зумовлювати підвищення продукування ендогенних пірогенів у вигляді гормонів та різних біологічно активних субстанцій (простагландини, простациклін та ін.). Частота симптому пірексії, за даними різних авторів, становить 6–50%.
Метою нашого дослідження було виявити закономірність виникнення підвищення температури тіла у хворих з пухлинами нирки залежно від їх гістологічної структури, а також уточнити значення симптому лихоманки при пухлинах нирок в діагностиці цього захворювання.
Матеріали і методи. Нами проведено ретроспективний аналіз історій хвороб 120 пацієнтів, яким проведено радикальне оперативне втручання в урологічному відділенні з приводу злоякісних пухлин нирок та верхніх сечових шляхів. Паранеопластична гіпертермія виявлена у 14 (11,7%) випадках. Було 4 хворих віком 40–50 років, 6 — 51–60 років, 4 — 61–70 років; із них 9 чоловіків і 5 жінок. Локалізація пухлини у лівій нирці виявлена у 9 хворих, у правій — у 5. Пацієнтів госпіталізували до стаціонару протягом 4–8 міс з моменту прояви перших клінічних симптомів і температури тіла.
Результати. Поряд з класичними симптомами новоутворень нирок та верхніх сечових шляхів, таких як гематурія, пухлина, що пальпується, та біль, лихоманку при пухлинах нирки виявляють досить часто. У всіх обстежених хворих з пірексією до операції відмічалось підвищення температури тіла, яка була в межах 37,4–38,2 °С. Лихоманка в межах 37,6–38 °С як єдиний симптом захворювання відмічена у 5 хворих, поєднання лихоманки, болю в попереку і гематурії — у 6 хворих, лихоманка і біль — у 2 хворих, лихоманка і гематурія — у 1 пацієнта. У 7 хворих з лихоманкою пухлина визначалася пальпаторно. Температура тіла у 11 хворих була в межах 37,4–38 °С, у 3 хворих відмічено її підвищення до 39 °С.
Після оперативного втручання температура тіла нормалізувалася у 12 хворих. У 2 пацієнтів температура тіла залишалася субфебрильною, пізніше у них виявлено метастази: у 1 — в легені, у 1 — в парааортальні лімфатичні вузли. При гістологічному дослідженні у 120 пацієнтів виявлені різні форми раку нирки та верхніх сечових шляхів (таблиця).
При аналізі отриманих даних встановлено, що із 89 хворих зі світлоклітинним варіантом нирково-клітинного раку, підвищення температури тіла виявлено у 11 (12,4%). Відсутня лихоманка у хворих із саркоматоїдним, папілярним варіантами та при некласифікованому нирково-клітинному раку. З 2 хворих з хромофобним гістологічним варіантом пухлини нирки гіпертермія виявлена у 1 (50%). При перехідноклітинному раку миски із 13 хворих підвищення температури тіла відмічено у 2 (15,4%).
| Гістологічні форми раку |
Кількість хворих | Наявність гіпертермії до операції | ||
|---|---|---|---|---|
| абс | % | абс | % | |
| Світлоклітинний | 89 | 74,2 | 11 | 12,4 |
| Хромофобний | 2 | 1,7 | 1 | 50 |
| Саркоматоїдний | 5 | 4,2 | – | – |
| Папілярний | 9 | 7,4 | – | – |
| Некласифікований | 2 | 1,7 | – | – |
| Перехідноклітинний | 13 | 10,8 | 2 | 15,4 |
Із 14 хворих з лихоманкою до операції у 78,6% виявлено світлоклітинний варіант, у 7,1% — хромофобний. У 14,3% випадків гіпертермія відмічена при перехідноклітинному раку миски. Відсутність підвищення температури тіла відмічено при папілярному і саркоматоїдному варіантах нирково-клітинного раку, а також при некласифікованому раку.
Висновки. За наявністю лихоманки у хворих на рак нирки та верхніх сечових шляхів можна деякою мірою передбачити гістологічну форму пухлини, що важливо в прогностичному плані. Паранеопластична гіпертермія є симптомом світлоклітинного, хромофобного варіантів нирково-клітинного раку, а також перехідноклітинного раку миски. При тривалій неуточненій гіпертермії слід провести урологічне обстеження для виключення пухлини нирки та верхніх сечових шляхів.
Индекс функционирующей почечной паренхимы как показатель для нефронсохраняющей операции при почечно-клеточном раке
А.Э. Стаховский, Ю.В. Витрук, О.А. Войленко, П.С. Вукалович, В.А. Котов, Э.А. Стаховский
Национальный институт рака, отделение пластической и реконструктивной онкоурологии, Киев, Украина
Введение. Резекция почки широко применяется в хирургии опухолей почки более 7 см в диаметре. Использование органосохраняющего подхода во многом зависит от размера опухоли, ее локализации, гистологической структуры и опыта хирурга. Однако характер изменений в пораженной почке по-разному трактуется, что усложняет выбор соответствующей хирургической стратегии в различных клинических ситуациях.
По нашему мнению, показания к органосохраняющей операции должны базироваться на количестве оставшейся функционирующей паренхимы почки на стороне поражения, а не только на размере и расположении опухоли.
Цель работы — оценить влияние объема функционирующей паренхимы почки на выбор метода хирургического лечения больных почечно-клеточным раком.
Материалы и методы. Проведен ретроспективный анализ 598 пациентов с раком почки, оперированных в нашем учреждении с апреля 2008 по сентябрь 2012 г. Для оценки изменений в почке всем больным была выполнена спиральная компьютерная томография. Количество оставшейся функционирующей паренхимы почки вычисляли по формуле (патент № 71491):
SV= (1 — [R4 · R5 · R6/ R1 · R2 · R3]) · 100%,
где SV — количество оставшейся функционирующей паренхимы почки;
R1, R2, R3 — радиус длины, ширины и толщины почки;
R4, R5, R6 — радиус длины, ширины и толщины опухолевого поражения почки.
Результаты. У 122 (20,4%) пациентов определить количество оставшейся функциональной почечной паренхимы не представлялось возможным из-за тотального поражения почки опухолью. В остальных случаях наличие функционирующей паренхимы почки определяло тактику лечения (таблица).
Таким образом, выбор метода оперативного вмешательства прямо пропорционально зависел от объема функционирующей паренхимы оперированной почки (см. таблицу). Минимальный объем функционирующей паренхимы, при котором выполнялась резекция почки, составлял 55%. Только в 35,8% случаев была выполнена нефрэктомия при наличии функционирующей паренхимы более 55%, что было обусловлено анатомическими особенностями.
Таблица. Зависимость вида оперативного вмешательства от объема функционирующей паренхимы почки на стороне поражения
| Количество функционирующей паренхимы почки, % | Радикальная нефрэктомия, n=313 (%) | Резекция почки, n=285 (%) |
|---|---|---|
| >85 | 15 (4,8) | 172 (60,4) |
| 84—70 | 34 (10,9) | 80 (28,1) |
| 55–69 | 63 (20,1) | 33 (11,6) |
| <55 | 201 (64,2) | – |
| p-value | x2=88,2; р<0,0001 | |
Выводы. Объем функционирующей паренхимы почки на стороне поражения — один из основных параметров для определения вида оперативного вмешательства при почечно-клеточном раке. Минимальный объем функционирующей паренхимы, при котором целесообразна резекция почки, составляет 55%.
Нефронзберігаючі операції у хворих на нирково-клітинний рак
С.О. Возіанов1, В.С. Сакало1, В.В. Мрачковський2, А.В. Кондратенко2, А.В. Сакало1, Ю.Ю. Куранов2, П.Г. Яковлев2, Я.В. Левчишин2
1ДУ «Інститут урології НАМН України», Київ, Україна
2Київський міський клінічний онкологічний центр, Україна
Мета — показати можливість виконання нефронзберігаючих операцій у хворих на рак нирки з розмірами пухлини >4 см.
Матеріали і методи. З 2003 по 2010 р. спостерігали 114 хворих на рак нирки, яким була виконана резекція нирки. Діагноз встановлювали за допомогою УЗД, КТ/МРТ. Доброякісні пухлини при гістологічному дослідженні виявили у 16 (14%) хворих. Ретроспективний аналіз результатів лікування проведено у 98 пацієнтів з морфологічно верифікованим нирково-клітинним раком. Частка чоловіків становила 61%, жінок — 39%. Середній вік хворих 52,8 (21–74) року. Ураження правої нирки діагностували у 31,3%, лівої — у 38,7% і двобічну пухлину — у 13,2% хворих. Середній діаметр видаленої пухлини становив 3,8 (0,8–8,9) см. Категорія Т1 встановлена у 78,5%, Т2 — у 15,3%, Т3а — у 5,2% пацієнтів. Віддалені метастази (легені, надниркова залоза) виявлені у 5, регіонарна лімфаденопатія — у 5 хворих. Виконували у більшості випадків підреберний, при двобічних пухлинах — лапаротомний доступ. У всіх випадках застосовували перетискування ниркової артерії. Середній час теплової ішемії становив 15,5 хв (12–32 хв). Резекцію виконували на відстані 0,5–1,5 см від краю пухлини. Термінове гістологічне дослідження країв резекції виконували в 66 випадках.
Результати. За ступенем анаплазії пухлини розподілялися так: G1 — 40%, G2 — 55%, G3 — 5%. Інтраопераційних ускладнень не виявлено. В післяопераційний період у 3 хворих відмічено кровотечу із зони резекції, у 2 — шлунково-кишкову кровотечу, у 42% — транзиторне підвищення рівня креатиніну, хронічну ниркову недостатність діагностували у 7 (7,2%) пацієнтів. Прогресування захворювання встановлено у 8 (8,2%) із 98 пацієнтів в середньому через 52,8 (3–96) місяця після закінчення лікування. Місцевий рецидив діагностували у 3 (2,0%) і віддалені метастази — у 6 (5,8%) хворих. В жодному випадку при позитивному краї резекції не відмічено наявності місцевого рецидиву раку нирки. Канцерспецифічне та безрецидивне 5-річне виживання хворих після резекції нирки становило 92,8 і 81,7% відповідно. Наявність віддалених метастазів суттєво зменшувала 5-річне виживання з 92,8 до 32,3%.
Висновки. Елективним показанням до виконання резекції нирки є пухлина з Т1 до 4 см в діаметрі. При більших розмірах пухлини (до 7 см) необхідний ретельний відбір пацієнтів для органозберігаючих операцій.
Онкологічні результати резекції нирки рівноцінні таким нефректомії.
Результаты открытых и лапароскопических резекций почки, выполненных по поводу почечно-клеточного рака
C.Н. Шамраев, Ю.А. Виненцов, С.А. Сохин, А.Г. Кривобок, А.Н. Кнышенко, Д.Н. Шамраева, Н.Н. Божко
Донецкий национальный медицинский университет им. Максима Горького, Украина
ДУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины», Донецк, Украина
Донецкое областное клиническое территориальное медицинское объединение, Украина
Цель исследования — оценить непосредственные результаты резекций почки, проведенных на базах кафедры урологии ДонНМУ по поводу почечно-клеточного рака (ПКР).
Материал и методы. Из 519 пациентов с ПКР, оперированных в период с января 2006 по февраль 2013 г., 114 (22%) больным выполнены резекции почки (РП). Пациенты обследованы согласно протоколам оказания медицинской помощи (приказ МЗ Украины № 554). Среди нефронсохраняющих операций 13 (11,4%) выполнено из лапароскопического трансабдоминального доступа, 101 (88,6%) — из открытого люмботомического доступа. 19 (38%) пациентам симультанно выполнены пиелолитотомия — 7, кистэктомии — 7, нефропексии — 5, адреналэктомии — 13, регионарные лимфаденэктомии (ЛАЭ) — 11. Период наблюдения составил в среднем 27±2,1 мес (от 3 до 78 мес).
Результаты. Возраст больных варьировал от 41 до 80 лет (в среднем 54,0±0,9 года). Мужчин было 51 (44,7%), женщин — 63 (55,3%). По абсолютным показаниям оперировано 5 (4,4%) пациентов: диагностирован двусторонний асинхронный рак почки в 2 случаях (контралатеральная почка удалена по поводу ПКР от 4 до 7 лет назад), еще в 2 выявлена опухоль единственной почки и в 1 — двусторонний синхронный ПКР. По относительным показаниям — 57 (50,0%), по элективным — 52 (45,6%). Распределение пациентов по стадиям: рT0 — 5 (4,4%), рT1a — 56 (49,1%), рT1b — 40 (35,1%), рT2 — 8 (7,0%), рT3a — 5 (4,4%). Метастазов в регионарные лимфоузлы не отмечено ни у одного из 11 (9,6%) пациентов, которым выполнена ЛАЭ. Категория М1 выявлена в 2 (1,8%) наблюдениях. Резекция правой почки выполнена 63 (55,3%) пациентам, левой — 51 (44,7%). Локализация опухоли в верхнем и верхушечном сегментах почки была у 32 (28,1%), в переднем — у 16 (14,0%), заднем — у 24 (21,1%), нижнем — у 42 (36,8%) больных. Диаметр опухоли в среднем составил 43±1,6 мм, в 56 (49,1%) наблюдениях ее размер превышал 4 см. Экстраренальных опухолей (>75% опухоли расположено за пределами почки) выявлено 34 (29,8%), интраренальных (>75% опухоли в пределах почки) — 20 (17,5%) экстраинтраренальных — 60 (52,7%). По виду РП: плоскостных — 30 (26,3%), клиновидных — 36 (31,2%), энуклеорезекций — 48 (42,1%); без ишемии — 14 (12,3%), с пережатием почечной артерии (время ишемии (ВИ) 28±1,2 мин) — 40 (35,1%), с пережатием артерии и вены почки (ВИ 29±1,0 мин) — 60 (52,6%), с ушиванием ЧЛС (ВИ 32±1,8 мин) — 26 (22,8%). После проведения РП дефект паренхимы у 13 (11,4%) больных ушивали в один ряд одиночными узловыми швами, у 96 (84,2%) — 2-рядным швом (1-й ряд — на дно резекции горизонтальные П-образные швы с усилением кусочками губки Суджицел, 2-й ряд — обвивной вертикальный шов на корковое вещество почки), у 5 (4,4%) — гемостаз раны почки осуществлен пластиной Тахокомба. Среди гистологических форм саркома отмечена в 1 (0,9%) случае, онкоцитома — в 5 (4,4%) (категория рТ0), ПКР — у 108 (94,7%) пациентов: светлоклеточный вариант — 102 (89,5%), темноклеточный — 6 (5,3%). Хирургический край у 1 (0,9%) больного был положительным. Интраоперационно массивная кровопотеря отмечена у 18 (15,8%) больных, гемотрансфузия проведена у 25 (21,9%). Кровопотеря в среднем составила 303±20 мл (от 100 до 1200 мл).
В ранний послеоперационный период у 14 (12,3%) пациентов диагностирован мочевой свищ: его закрытие достигнуто стентированием мочеточника у 12 пациентов и у 2 — выполнением чрескожной нефростомии. Для этих пациентов отмечен больший послеоперационный койко-день (14,4±2,6) по сравнению с больными без фистулы — 11,3±0,3 (p>0,05). Еще одной пациентке (0,9%) через 6 мес выполнена ревизия раны с иссечением некротизированных мягких тканей. Периоперационной летальности, поздних кровотечений, гнойного воспаления резецированной почки, требовавших нефрэктомий, прогрессирования хронической почечной недостаточности c проведением программного гемодиализа, а также местного рецидива ПКР не отмечено. 2 (1,75%) пациента с двусторонним синхронным ПКР имели prolongation morbi через 31 и 50 мес от начала лечения (последовательно проведены нефрэктомия и РП). Канцерспецифическая выживаемость составила 98,25%.
Выводы. Различий в конечном гемостазе после применяемых техник ушивания раны почки не отмечено. Ни одно из осложнений не привело к утрате органа. Соблюдение принципов нефронсохраняющих операций позволяет выполнять резекцию почки при размерах опухоли более 4 см и достигать хороших функциональных результатов без увеличения частоты осложнений.
Досвід виконання лапароскопічної радикальної нефректомії
С.В. Головко1, О.Ф. Савицький2
1Головний військово-медичний клінічний центр «ГВКГ»,
клініка урології, Україна
2Українська військово-медична академія, кафедра військової хірургії, Київ, Україна
Перша лапароскопічна нефектомія була виконана R. Clayman і співавторами у 1990 р. 85-річній жінці з онкоцитомою нирки. Операція тривала 6,5 год і закінчилася успішно. Рік потому M. Coptcoat і співавтори виконали лапароскопічну нефектомію хворому на нирково-клітинний рак.
Лапароскопічна нефректомія отримала широке, але далеко не повсюдне поширення, тому що лікувальна та економічна доцільність даного підходу довгі роки залишалася дискутабельною. Операції в основному виконувалися в спеціалізованих центрах. За останні кілька років ситуація істотно змінилася, що знайшло своє відображення в зростаючій кількості публікацій, які свідчать про те, що лапароскопічна нефектомія займає все більш значне місце в онкоурології.
У 2012 р. в клініці урології Головного військово-медичного клінічного центру «ГВКГ» виконано 12 лапароскопічних радикальних нефректомій з приводу світлоклітинного раку нирки (8 лівосторонніх, 4 правосторонніх). Безпосередні результати лікування в порівнянні з опублікованими даними інших авторів представлені в таблиці.
Таблиця
| Автор | Кількість хворих | Час операції, год | Крововтрата, мл | Ліжко-день | Ускладнення, % | Конверсії, % |
|---|---|---|---|---|---|---|
| P. Barret і співавт. (1998) | 72 | 2,9 | – | 4,4 | 8 | 8,4 |
| Y. Ono і співавт. (1999) | 60 | 5,2 | 255 | – | 11 | 3,4 |
| M. Dunn і співавт. (2000) | 60 | 5,5 | 172 | 3,4 | 37,7 | 1,7 |
| G. Janetschek і співавт. (2002) | 121 | 2,4 | 154 | 6,1 | 9 | 0 |
| K. Kercher і співавт. (2003) | 118 | 3,8 | 97 | 3,9 | 20,8 | 0,8 |
| В.Б. Матвеєв (2006) | 107 | 3,1 | 280 | – | 20,5 | 7,5 |
| С.В. Головко (2012) | 12 | 5,1 | 240 | 5,1 | 0 | 0 |
За даними різних авторів, лапароскопічна нефректомія має переваги над відкритою, що підтверджується скороченням перебування хворого в стаціонарі, часу реабілітації, зменшенням кількості ускладнень, зниженням потреби в аналгезії. Це є підґрунтям для подальшого розвитку та впровадження лапароскопічної нефректомії в клінічну практику.
Bone-TRAP-5b в ранней диагностике костных метастазов почечно-клеточного рака
А.Г. Дедков, Э.А. Стаховский, С.И. Бойчук, Ю.В. Витрук, А.А. Кононенко, М.В. Викарчук
Национальный институт рака, Киев, Украина
Метастазы в кости у больных почечно-клеточным раком (ПКР) отмечаются в 30–50% случаях и занимают 3-е место по частоте после метастатического поражения легких и печени. У 48% больных рак почки диагностируется в связи с наличием костных метастазов (КМ). Основными методами лечения данной категории пациентов являются использование бисфосфонатов (БФ), хирургическое лечение и лучевая терапия.
Цель исследования — определить возможность использования маркера костной резорбции — тартратрезистентной кислой фосфатазы (Bone-TRAP-5b) для ранней диагностики и мониторинга эффективности лечения КМ.
Материалы и методы. Для определения чувствительности Bone-TRAP-5b как маркера метастатического поражения костей в исследование включена группа больных ПКР с клинико-рентгенологическими проявлениями КМ (40 больных). В этой группе всем пациентам определяли содержания в крови Bone-TRAP-5b до начала лечения БФ и каждые 3 мес в процессе терапии. 2-я группа — 20 пациентов ПКР после нефрэктомии (резекции почки) без проявлений КМ с III–IV степенью морфофункционального состояния по Фурману. В этой группе также определялся уровень Bone-TRAP-5b, в зависимости от которого назначалась терапия БФ. Средний возраст в 1-й группе больных составил 56,3±1,3 года, во 2-й — 58,6±1,6. Оценка распространенности ПКР оценивалась после контрастно усиленной КТ и МРТ визуализации, остеосцинтиграфии костей скелета с 99mTc. Уровень содержания Bone-TRAP-5b в плазме крови определялся с помощью моноклональных антител методом иммуноферментного анализа.
Результаты. В 1-й группе больных повышение уровня Bone-TRAP-5b выявлено у 37 пациентов (чувствительность метода составила 92,5%). На фоне лечения БФ у 36 больных (90,0%) отмечено снижение уровня Bone-TRAP-5b, клинико-рентгенологически — стабилизация или регрессия опухолевого процесса в кости. У 4 (10,0%) пациентов, несмотря на снижение уровня Bone-TRAP-5b, отмечалась пролонгация опухолевого процесса в костях.
Во 2-й группе больных (без КМ) повышение уровня Bone-TRAP-5b отмечалось в 6 (30,0%) случаях. Этим пациентам с профилактической целью назначены БФ. Средние сроки наблюдения составили 9 мес. В настоящий момент у данной группы пациентов КМ не выявлены. Исследование продолжается.
Выводы. Учитывая высокую чувствительность Bone-TRAP-5b как маркера КМ у больных ПКР, его использование перспективно для ранней диагностики метастазов, является показанием для начала соответствующей терапии, а также для мониторинга эффективности лечения.
Періопераційні зміни імунної системи та визначення рівня простогландину Е2у хворих з пухлиною нирки
І.І. Лісний, Л.В. Клімчук, Н.М. Храновська, Е.О. Стаховський, Ю.В. Вітрук, О.А. Войленко, П.С. Вукалович, О.Е. Стаховський, О.В. Скачкова
Національний інститут раку, Київ, Україна
Пухлини нирок становлять велику групу новоутворень різної морфологічної структури, які розподіляють на добро- та злоякісні. Серед усіх злоякісних новоутворень рак нирки становить близько 3%.
Механізми протипухлинного захисту організму включають природну неспецифічну резистентність організму до пухлини, яка не має імунологічної специфічності, не вимагає попередньої імунізації, і здійснюються NK-, LАК-клітинами та макрофагами; реакції придбаного (специфічного) протипухлинного імунітету, які включають як клітинні (пов’язані з функцією Т-лімфоцитів), так і гуморальні (пов’язані з утворенням антитіл) імунні реакції, зумовлені дією специфічних пухлинних антигенів.
Хірургічна операція, анестезія, періопераційна інтенсивна терапія, біль та опіоїдні анальгетики разом порушують всі ланки протипухлинного захисту організму.
Мета — вивчити вплив препаратів для анестезії та післяопераційної аналгезії на рівень простагландину Е2 в плазмі крові та кількісний, функціональний склад лімфоцитів в периферичній крові у хворих після резекції нирок.
Матеріал і методи. У дослідження включено 50 пацієнтів з діагнозом пухлина нирок. Пацієнти були розподілені на 2 групи. Хворі 1-ї групи отримували для знеболення декскетопрофен 50 мг, 2-ї — омнопон 20 мг і 3-ї — плацебо. Препарати вводили за 24 год до операції, перед операцією та в післяопераційний період.
Оцінювали рівень простагландину E2 в плазмі крові та маркери: CD3, CD4, CD8, CD16, CD20, апоптоз, HLA-DR, цитотоксична активність, VEGF, (CD3 + ІФН-g), ФГА (CD3 + ІФН-g) за 24 год до операції, перед операцією, в кінці операції, на 3-тю добу післяопераційного періоду.
Результати та їх обговорення. Різниця в імунологічних показниках виявлена на 3-тю добу післяопераційного періоду. У групі хворих, де використовувався для аналгезії декскетопрофен, виявлено збільшення СВ3+IFN y позитивних клітин та кількість NK клітин CD56+16 у лімфоцитах. При оцінці ІПК в групі, в якій отримували омнопон, відмічено достовірне зменшення ІПА лімфоцитів периферичної крові. В групі, де отримували декскетопрофен, зафіксовано збільшення ІПА лімфоцитів. Визначався рівень простагландину Е2 в плазмі та лікворі перед операцією та через добу після оперативного втручання. У хворих, які отримували декскетрпрофен за добу до початку оперативного втручання, відмічали менший рівень болю протягом перших 2 діб після операції при порівнянні з хворими, які отримували плацебо (р=0,001). Рівень PGE2 в плазмі крові в 1-шу (р=0,061) і 2-гу добу (р=0,006) та лікворі (р=0,917) був нижчим у хворих в декскетопрофену до початку операції та через добу після операції при порівнянні із хворими, які отримували плацебо.
Висновки. За результатами нашого дослідження, використання декскетопрофену в періопераційний період сприяє формуванню та розвитку специфічної протипухлинної відповіді, посиленню функціональної активності ефекторних клітин. Не відбувається пригнічення імунних клітин хворого при використанні декскетопрофену в порівнянні з омнопоном. Введення декскетопрофену в дозі 50 мг 2 рази на добу до початку операції викликає значне зниження рівня болю в перші 2 доби післяопераційного періоду при оперативних втручаннях в онкоурології.
От открытой резекции почки к лапароскопической
С.П. Степушкин, В.П. Чайковский, Р.В. Соколенко, В.О. Новиков
КУ «Днепропетровская городская многопрофильная клиническая больница № 4 Днепропетровского областного совета», урологическое отделение № 1, Украина
Вступление. Лапароскопическая резекция почки стала хирургической техникой I линии для лечения опухолей почек до 4 см. Ее основными достоинствами являются отличные онкологические результаты вместе с сохранением почечной функции. Кроме того, это означает сокращение длительности пребывания больного в стационаре, минимальный послеоперационный болевой синдром, короткий период восстановления пациента.
Цель — представить наш опыт органосохраняющего лечения локализованного рака почки при помощи лапароскопических техник.
Материалы и методы. В нашем отделении за период с марта 2008 по февраль 2013 г. выполнено 57 резекций почки. Из них 11 — лапароскопических (с мая 2012 г.). В 49 случаях — по поводу рака почки. В таблице представлен сравнительный анализ открытой и лапароскопической резекции почки.
Результаты. Послеоперационных осложнений не выявлено. Во всех случаях после лапароскопической резекции почки морфологически подтвержден негативный край резекции почки. За период наблюдения местный рецидив отмечено у 2 пациентов с первичной опухолью Т1в и Т3а после выполнения открытой резекции почки.
| Показатели | Открытая резекция (n=46) | Лапароскопическая резекция (с мая 2012 г.) (n=11) |
|
|---|---|---|---|
| Пол пациента, n (%) | Женщины — 22 (47,4) | женщины — 6 (66,6) | |
| Мужчины — 24 (52,6) | мужчины — 5 (33,4) | ||
| Средний возраст, лет | 57 (38–79) | 54 (48–75) | |
| Сторона поражения, n (%) | Правая почка — 25 (55,2) | Правая почка — 7 (83,3) | |
| Левая — 21 (44,8) | Левая — 4 (16,7) | ||
| Локализация опухоли, n (%) | Верхняя часть — 8 (15,7) | Верхняя часть — 2 (16,6) | |
| Средняя — 18 (39,5%) | Средняя — 3 (30,4) | ||
| Нижняя — 20 (44,7) | Нижняя — 6 (53,0) | ||
| Средний диаметр опухоли, см | 3,6 (1,5–7) | 2,7 (1,5–3,5) | |
| Доброкачественные новообразования, n (%) | 7 (15,8) | 1 (0,11) | |
| ПКР, n (%) | Т 1а | 26 (63,1) | 10 (90,9) |
| Т 1в | 5 (7,9) | – | |
| Т 3а | 7 (13,1) | – | |
| Тепловая ишемия | Выполнялась в 95% случаев 17 мин (10–27) | Выполнялась в 90% случаев 27 мин (9–39) | |
| Время операции, мин | 104 (85–150) | 170 (150–220) | |
| Кровопотеря, мл | 235 (100–500) | 150 (50–400) | |
| Количество койко-дней в стационаре, сут | 9,5±6,5 | 5,5±1,5 | |
| Начало энтерального питания после операции | Через 36 ч | Через 18 ч | |
| Длительность применения анальгетиков, ч | 48–56 | 24–36 | |
Выводы. Лапароскопическая резекция почки в стадии Т1а имеет ряд преимуществ по сравнению с открытым вмешательством: малая травматичность, уменьшение сроков реабилитации больных, сокращение времени пребывания в стационаре и хороший косметический эффект. Однако при этом достоверно увеличивается время тепловой ишемии почки, что, безусловно, сказывается на послеоперационной функции оперированной почки.
Факторы прогноза при метастатическом раке почки у больных, получавших системное лечение
М.А. Надирашвили, В.В. Харченко, В.В. Серегин, Р.А. Кукурян, Р.П. Морару-Бурлеску, В.В. Родович, В.В. Осадчий
Луганский областной клинический онкологический диспансер, Луганск, Украина
Цель исследования — характеристика выживаемости больных диссеминированным раком почки — кандидатов на II линию химиотерапии.
Материалы и методы. В исследовании изучены особенности клинической картины и выживаемость 103 больных диссеминированным раком почки, получивших лечение за период 1991–2009 гг.
Результаты. Средняя продолжительность жизни составила 10,1 мес, после 1991 г. этот показатель в целом увеличился. Многофакториальный анализ показал, что с короткой продолжительностью жизни коррелировали такие клинические признаки, как низкий статус Карновского на момент начала II линии системной терапии, низкий уровень гемоглобина, высокий уровень кальция в плазме крови. В соответствии с наличием одного или более вышеперечисленных факторов была рассчитана средняя продолжительность жизни. У больных без указанных факторов риска средняя продолжительность жизни составила 21,3 мес, с одним из этих факторов — 11,5 мес, а с 2 или 3 — 5,2 мес.
Выводы. Лечение препаратами II линии химиотерапии показано больным с прогрессированием рака почки после применения в качестве I линии различных цитокинов. В соответствии с тремя указанными факторами риска можно прогнозировать выживаемость этой группы больных.
Сравнительный анализ результатов циторедуктивной резекции и циторедуктивной нефрэктомии в лечении метастатического почечно-клеточного рака
А.Э. Стаховский, О.А. Войленко, Ю.В. Витрук, П.С. Вукалович, В.А. Котов, Э.А. Стаховский
Национальный институт рака, отделение пластической и реконструктивной онкоурологии, Киев, Украина
Введение. Проведение циторедуктивной нефрэктомии (ЦН) зарекомендовало себя как стандартный метод лечения метастатического почечно-клеточного рака (ПКР). Развившаяся в последнее время тенденция органосохраняющей тактики в лечении онкологических больных позволила инициировать совершенно новое, не изученное до этого направление — циторедуктивную резекцию почки (ЦРП). Такой поход совмещает онкологический эффект циторедукции, обладая при этом преимуществами органосохраняющего лечения.
Цель работы — повышение эффективности лечения больных метастатическим ПКР путем сравнительной оценки общей выживаемости пациентов после проведения циторедуктивной нефрэктомии и циторедуктивной резекции почки.
Материалы и методы. Клиническому анализу подвергнуты 96 пациентов с метастатическим ПКР, которым в период с 2008 по 2012 г. проводилось обследование и лечение в отделении пластической и реконструктивной онкоурологии Национального института рака. Возраст больных составил (55,6±8,3) года, соотношение мужчин/женщин — 71 (74%)/25 (26%). ЦРП была проведена в 38 (40%) случаях и ЦН — в 58 (60%). Была проанализирована клиническая информация и построены графики общей выживаемости по Каплану — Мейеру. Таргетная терапия в неоадъювантном режиме использовалась у 7 (7%) пациентов для уменьшения размеров первичного очага.
Результаты. Период наблюдения больных составил от 3 до 57 мес, в среднем (16,9±9,7) мес. При сравнении групп ЦРП и ЦН не отмечено статистически достоверной разницы по возрасту ((55±9,9) против (56,1±7,1) года [p=0,5]), ECOG ((0,97±0,71) против (1,12±0,97) [p=0,25]), длительности наблюдения ((17,9±11,3 против (16,4±12,8) мес [p=0,56]), интраоперационной кровопотере ((423±188) против (383±242) мл [p=0,3]), дооперационных уровнях креатинина в крови ((0,083±0,02) против (0,091±0,02) ммоль/л [p = 0,1]) и гемоглобина ((125,5±16,2) против (124,8±23,9) г/л [p=,8]). Единственным статистически достоверным отличием среди групп была разница в размерах опухолей. Для группы ЦРП этот показатель составил (58,7±27,1) мм, а для ЦН — (81,4± 36,4) мм соответственно (p<0,001). При выборе метода лечения основное значение имел не размер опухоли, а количество функционирующей паренхимы. Наличие достаточного количества паренхимы почек при сохраненной функции позволяют в последующем использовать другие виды лечения: таргетную, иммунную, химиотерапию и т.д. Именно с целью профилактики возникновения хронической почечной недостаточности (ХПН) нами была внедрена ЦРП. Показаниями к данному виду лечения у 38 больных были:
- количество паренхимы почки на стороне поражения более 55%;
- отсутствие в анамнезе гематурии;
- отсутствие тромба в почечной вене.
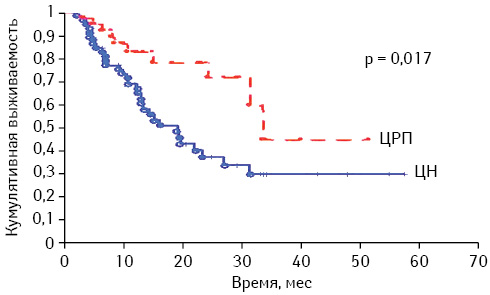
Основной задачей лечения онкологических пациентов было и остается увеличение продолжительности жизни, поэтому неизменный интерес вызывает исследование выживаемости больных метастатическим ПКР. Кривые Каплана — Мейера представлены ниже (рисунок).
Было выявлено статистически достоверное отличие в общей выживаемости пациентов среди исследуемых групп (p=0,017). Средняя 2-летняя выживаемость составила 72% для группы ЦРП и 37% для группы ЦН соответственно.
Выводы. Проведение ЦРП у больных метастатическим ПКР доказало свою эффективность в увеличении продолжительности жизни пациентов по сравнению с нефрэктомией, что в первую очередь обусловлено сохранением максимального количества функционирующей паренхимы почки, позволяющей предупредить возникновение ХПН. В свою очередь, сохранение функции почки может расширить возможности оперативного удаления метастазов, повысить эффективность и улучшить переносимость таргетной, иммунной или химиотерапии, направленной на борьбу с метастатическим заболеванием. Кроме того, отсутствие ХПН является важным фактором в снижении уровня инвалидизации пациентов и повышении качества их жизни.
Хірургічне лікування нирково-клітинного раку, ускладненого пухлинним тромбозом нижньої порожнистої вени
В.І. Русин, В.В. Корсак, А.В. Русин, С.О. Бойко
ДВНЗ «Ужгородський національний університет», Ужгород, Україна
Удосконалення різних хірургічних технік і прийомів сприяло впровадженню в клінічну практику активного оперативного лікування хворих на нирково-клітинний рак (НКР), ускладненим пухлинним тромбозом нижньої порожнистої вени (НПВ). На сьогодні не викликає сумніву доцільність та ефективність хірургічного лікування пухлинного тромбозу НПВ, хоча ще залишається ціла низка невирішених питань, пов’язаних із технічним забезпеченням виконання операції та профілактики тромбоемболії легеневої артерії, які потребують доопрацювання.
Мета роботи — удосконалити хірургічну техніку та покращити результати лікування хворих на НКР, ускладнений пухлинним тромбозом НПВ.
В дослідження включено 91 хворого на НКР, ускладнений пухлинною венозною інвазією, які були прооперовані в хірургічній клініці Закарпатської обласної клінічної лікарні ім. А. Новака у 2005–2012 рр. Серед пацієнтів було 72 чоловіки та 19 жінок. Вік хворих варіював від 31 до 79 років. Усі пацієнти мали гістологічно верифікований світлоклітинний НКР в стадії Т3–4N0–2M0, ускладнений пухлинною венозною інвазією. Рівні поширення пухлинного венозного тромбу визначали згідно із класифікацією клініки Meyo, яка включає 5 рівнів його розповсюдження. Так, 0 рівень виявлено у 37 хворих; І рівень — у 19; ІІ рівень — у 17; ІІІ рівень — у 14; IV рівень — у 4.
Радикальна нефректомія з тромбектомією із НПВ виконана з лапаротомного доступу в одній із трьох модифікацій: розширена серединна лапаротомія застосована у 36 пацієнтів (39,5%), трансабдомінальний двобічний підребровий доступ у модифікації за типом «Chevron» — у 44 (48,4%) та у модифікації за типом «Mercedes» — у 11 (12,1%). У 18 випадках при видаленні нижньокавального пухлинного тромбу ІІІ і IV рівнів поширення виконувалася мобілізація печінки і ротація її правої частки вліво за методикою «piggyback». Окрім того, проводили ретельну мобілізацію НПВ, яка забезпечує повний контроль над НПВ і дозволяє накласти турнікети чи судинні затискачі на інфраренальну ділянку НПВ, ліву чи праву ниркову вену та над верхівкою тромбу. Високі ретропечінкові чи наддіафрагмові тромби методикою «здоювання» зсували до рівня нижче головних печінкових вен.
Неповна апаратна каваплікація за розробленою нами методикою, яка полягає у створенні в НПВ у поперечному напрямку кількох симетричних каналів діаметром 5–8 мм, виконана апаратом «УКБ 15–1» у 30 (33%) випадках: у 23 — нижче ниркових вен, у 6 — вище ниркових вен і у 1 — вище печінкових вен.
У ранній післяопераційний період не виявлено випадків тромбоемболії легеневої артерії, летальності чи будь-яких порушень відтоку крові по НПВ. Рівень виконання неповної апаратної каваплікації не впливав на порушення гемодинаміки у НПВ та нирковій вені здорової нирки.
Таким чином, адекватний лапаротомний доступ, техніка ретельної мобілізації печінки і НПВ, застосування ротації правої частки печінки вліво за методикою «piggyback» дає повний контроль над НПВ. Використання методики «здоювання» високих тромбів і як завершальний етап потенційно емболонебезпечних тромбектомій — неповна апаратна каваплікація забезпечує виконання активного хірургічного лікування хворих на НКР, ускладнений пухлинною венозною інвазією.
Опыт хирургического лечения осложненных опухолей почек с применением АИК (опыт отделения)
И.Б. Щепотин, И.Н. Емец, Г.И. Климнюк, А.Й. Ижовский, О.В. Белоконь
Национальный институт рака, отделение детской онкологии, Киев, Украина
Введение. Хирургическое лечение является одним из основных этапов комбинированного лечения, радикальность которого непосредственно влияет на отдаленные результаты, продолжительность безрецидивного периода и общий уровень пятилетней выживаемости у онкобольных детей. Отдельные злокачественные опухоли у детей, наиболее часто нефробластома, характеризуются быстрым прогрессирующим ростом и обычно манифестируют при достижении значительных размеров, что приводит к явлениям кишечной непроходимости, компартмент-синдрома, признакам разрыва капсулы и кровотечения из опухоли, проявлениям острого живота и т.п. В некоторых случаях при проведении комплекса дооперационных обследований выявляют опухолевые тромбы в системе нижней полой вены, камерах сердца, что грозит летальными осложнениями для пациента и требует специальной хирургической техники с использованием аппарата искусственного кровообращения (АИК). Несмотря на большую материально-техническую затратность операции, применение АИК абсолютно оправдано в связи с улучшением результатов лечения у наиболее сложной категории пациентов и требует дальнейшего изучения.
Объект и методы исследования. За период 2010–2012 гг. было произведено 4 оперативных вмешательства у детей с нефробластомой с использованием АИК, которые получали специальное лечение согласно клиническому протоколу. Подход к данной категории больных был мультидисциплинарным, заключался в совместном проведении оперативного вмешательства двумя бригадами: первыми начинали кардиохирурги, проводили стернотомию, подключали АИК путем поочередного канюлирования ушка правого предсердия и легочной артерии; на втором этапе проводили удаление опухоли. Оперативное вмешательство проводили в условиях полной гепаринизации пациента c контролем показателей гемостаза детским трансфузиологом с использованием аппарата «Cell Saver». Распределение больных по морфологическому типу следующее: трое пациентов находились на хирургическом лечении с монолатеральной нефробластомой (все с бластемным типом опухоли), один с двусторонней опухолью Вильмса. У всех больных диагноз верифицирован гистологически путем пункционной биопсии под УЗ-контролем системой «Fust Cut». На этапе неоадъювантной полихимиотерапии у двух больных с монолатеральной нефробластомой и одного больного с двусторонней опухолью Вильмса диагностирована первичная рефрактерность опухоли.
Результаты и их обсуждение. При анализе данных лучевых методов диагностики максимальный размер опухоли составил 11,5–25 см.
При выполнении УЗДГС у больного с правосторонней монолатеральной нефробластомой выявлен опухолевый тромб, фиксированный к стенке правого предсердия.
Отбор больных с нефробластомой для оперативного вмешательства с использованием АИК проводили по следующим критериям:
- наличие огромной симптомной осложненной опухоли;
- предполагаемая значительная интраоперационная кровопотеря;
- наличие опухолевого тромба в правом предсердии.
Все оперативные вмешательства при нефробластомах выполнены в объеме радикальной нефрэктомии, в одном случае симультанно проведена операция удаления новообразования правого предсердия с резекцией его стенки.
Оперативное вмешательство проводили не позднее 2–2,5 нед после окончания неоадъювантной полихимиотерапии. Средняя продолжительность операции составила 175±23 мин; объем кровопотери: 320±20 мл.
Ранние послеоперационные осложнения развились у 3 больных: у 1 — послеоперационный панкреатит, у 2 — явления гастростаза, у 1 — лимфорея, которые купированы консервативно.
Послеоперационный период в среднем составил 9,5 койко-дня. Новообразование в правое предсердие было гистологически верифицировано как «белый» тромб. Адъювантную полихимиотерапию начинали согласно клиническому протоколу лечения по результатам послеоперационного патогистологического заключения в сроки от 7 до 14 дней.
Выводы. Таким образом, с учетом анализа данных зарубежных источников литературы считаем, что использование АИК в хирургии осложненных солидных опухолей почек у детей показано при наличии тромба в системе нижней полой вены выше устья печеночных вен; наличии опухолевого тромбоэмбола в полостях сердца; угрозе разрыва псевдокапсулы и значительной интраоперационной кровопотере; необходимости выполнения симультанного кардиохирургического вмешательства при пороках сердца, и позволяет выполнять сложные хирургические вмешательства с минимальным риском летальных интраоперационных осложнений. Несмотря на большую материально-техническую затратность операции, применение АИК абсолютно оправдано в связи с улучшением результатов лечения у наиболее сложной категории пациентов и требует дальнейшего изучения.
Результаты хирургического лечения больных почечно-клеточным раком с опухолевым тромбозом правого предсердия
Ю.В. Думанский, В.К. Гринь, C.Н. Шамраев, А.С. Кузнецов, С.И. Комиссаров
Донецкий национальный медицинский университет им. Максима Горького, Украина
ДУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины», Донецк, Украина
Донецкое областное клиническое территориальное медицинское объединение, Украина
Цель работы — оценить результаты хирургической техники радикальной трансабдоминальной нефрэктомии и каво-атриальной тромбэктомии с применением искусственного кровообращения (ИК).
Материал и методы исследования. Анализированы результаты лечения 476 больных почечно-клеточным раком (ПКР) за период 2004–2012 гг., из которых 31 (6,5%) пациент с тромбозом крупных магистральных сосудов. Мужчин было 19 (61,3%), женщин — 12 (38,7%), (соотношение 1,6:1). Согласно отсутствию или наличию опухолевой инвазии правого предсердия больные разделены на 2 группы: 17 (54,8%) и 14 (45,2%) больных соответственно. Пациенты обследованы согласно протоколам оказания медицинской помощи (приказ МЗ Украины № 554).
Результаты. Средний период наблюдения составил 43,6±5 мес. У пациентов 1-й группы выявлена патологическая стадия ПКР Т3bN0–1M0–1V+G1–4, 2-й группы — Т3с-4N0–1M0–1V+G2–4. Хирургическое лечение выполнено всем больным 1-й группы и 10 (62,5%) 2-й группы: 4 больных воздержались от предложенной тактики лечения. Неоперированные пациенты 2-й группы погибли на фоне prolongatio morbi через 3–6 мес. Периоперационные данные больных исследуемых групп не отличались по объему удаленной опухоли почки, клинико-лабораторным показателям, частоте гемотрансфузий, ранних осложнений и медиане выживания. Средний возраст пациентов — 65±4 и 50±5 лет, время операции — 95±30 и 380±80 мин, объем кровопотери — 270±30 и 720±60 мл, восстановление общего состояния больного — 1,5±0,5 и 4,7±1,1 сут, длительность послеоперационного койко-дня — 7±2 и 14±3 сут, были достоверно лучше в 1-й группе, p<0,05 (таблица). В 3 (9,7%) случаях инфильтрация опухолевым тромбом нижней полой вены требовала резекции ее стенки. Периоперационная летальность в 1-й группе отсутствовала, во 2-й группе среди оперированных пациентов составила 30%: причиной смерти послужило развитие острого синдрома диссеминированного внутрисосудистого свертывания (1), тромбоэмболии легочной артерии (1) и диссеминации онкопроцесса (1). Морфологическое исследование подтвердило во всех случаях наличие опухолевой ткани внутри тромба.
Выводы. Применение агрессивной хирургической техники радикальной трансабдоминальнрой нефрэктомии и кавоатриальной тромбэктомии с ИК является эффективным лечением больных с ПКР и III уровнем интракавальной опухолевой инвазии.
Хирургическое лечение опухолей почек с внутривенозным распространением в ретропеченочный и наддиафрагмальный отделы нижней полой вены
Д.В. Щукин1, В.Н. Лесовой1, И.М. Антонян2, В.В. Бублик1, Г.Г. Хареба1
1Харьковский национальный медицинский университет, Украина
Харьковский областной центр урологии и нефрологии им. В.И. Шаповала, Украина
Харьковская медицинская академия последипломного образования, Украина
Введение. Удаление ретропеченочных и супрадиафрагмальных опухолевых тромбов нижней полой вены (НПВ) в большинстве случаев представляет собой сложную техническую задачу и зачастую требует использования технологий искусственного кровообращения (аппарат искусственного кровообращения (АИК), остановка циркуляции с глубокой гипотермией, вено-венозное шунтирование). Мы проанализировали собственный опыт хирургического лечения пациентов данной группы.
Материал и методы. В ретроспективное исследование включены 14 пациентов. У 8 из них опухолевые тромбы достигали ретропеченочного сегмента НПВ до уровня устьев главных печеночных вен, у 4 — наддиафрагмального отдела НПВ и у 2 — правого предсердия. Правосторонние опухоли выявлены в 8 случаях, левосторонние — в 6. Средние размеры почечных новообразований составляли 89,4 мм, инвазия опухоли в жировую клетчатку отмечена в 8 из 14 наблюдений. АИК использовали только у 1 больного с массивным тромбом в правом предсердии, еще у 1 пациента с тромбом в интраперикардиальном отделе НПВ применялось веновенозное шунтирование. Все операции проведены из доступа «шеврон» или трехлучевого разреза. Срединная стернотомия использована в одном случае. 13 пациентов подверглись конвенциональной и piggyback-мобилизации печени. Доступ к супрадиафрагмальной части НПВ был необходим у 10 больных и осуществлялся со стороны брюшной полости путем циркулярного отделения НПВ от сухожильного центра диафрагмы (7 пациентов) или Т-образного разреза диафрагмы кпереди от отверстия НПВ (3 пациента) без вскрытия перикарда. Пальцевое смещение верхушки тромба ниже устьев главных печеночных вен осуществлялось у 8 из 14 пациентов. Инвазия опухолевого тромба в стенку полой вены выявлена у 4 (28,6%) больных.
Результаты. Время операции варьировало в диапазоне 160–380 мин (в среднем 228 мин). Объем кровопотери составлял 1500–8800 мл (в среднем 3500 мл). Периоперационная летальность не превышала 21,4% (3 из 14 больных). Пациент с массивным тромбом в правом предсердии, оперированный с помощью АИК, умер через 4 ч после операции из-за коагулопатии и массивного кровотечения. У 2 пациентов интраоперационная смерть была связана с сердечной недостаточностью и кровотечением. Контроль верхнего конца тромба был возможен у всех 13 пациентов, когда операция проводилась без АИК. Доступ к супрадиафрагмальной части НПВ через брюшную полость не сопровождался значительными осложнениями (травма правого диафрагмального нерва или кровотечение из поврежденных диафрагмальных вен) ни в одном из наблюдений. При этом Т-образная диафрагмотомия выполнялась значительно легче и быстрее, чем циркулярный доступ. Пальцевое смещение верхушки тромба ниже устьев главных печеночных вен стало возможным в 6 из 8 случаев, что было связано с инвазией опухоли с стенку НПВ на уровне ее ретропеченочного отдела.
Выводы. Результаты нашего исследования продемонстрировали, что ретропеченочные и супрадиафрагмальные опухолевые тромбы часто сопровождаются инвазией в стенку НПВ, что может существенно ограничивать подвижность тромба при его удалении. Мобилизация печени и доступ к супрадиафрагмальной части НПВ через брюшную полость является эффективным и безопасным дополнением к хирургической технике венакаватромбэктомии без использования АИК. Т-образная диафрагмотомия представляет собой легкий и эффективный подход к проведению турникета вокруг супрадиафрагмальной части НПВ.
Ускладнення резекції нирки при лікуванні нирково-клітинного раку
О.А. Войленко, П.С. Вукалович, Ю.В. Вітрук, О.Е. Стаховський, В.А. Котов, Е.О. Стаховський
Національний інститут раку, відділення пластичної та реконструктивної онкоурології, Київ, Україна
Впровадження в медичну практику нових методів діагностики та контролю ефективності лікування сприяють виявленню онкологічних захворювань на ранніх стадіях. Це підвищує інтерес до розробки органозберігаючого підходу в лікуванні онкологічної патології. Резекція нирки на сьогодні стала бажаною альтернативою радикальній нефректомії при нирково-клітинному раку (НКР), однак висока частота ускладнень обумовлює стримане ставлення хірургів до її проведення.
Мета роботи — підвищити ефективність лікування пацієнтів з локалізованим НКР шляхом аналізу ускладнень при проведенні резекції нирки та розробки заходів їх профілактики.
Матеріал і методи. Ректоспективному клінічному аналізу підлягали 316 хворих на НКР, яким у період з 2008 по 2012 р. проведено резекцію нирки. Чоловіків 203 (64,2%), жінок 113 (35,6%). Вік хворих — 19–78 років (54,2±11,2). Однобічне пухлинне ураження діагностовано у 288 (91,1%), двобічне — у 20 (6,3%), пухлина підковоподібної нирки — у 4 (1,3%), пухлина єдиної нирки — у 4 (1,3 %) хворих. У 309 (97,8%) випадках виконана однобічна резекція нирки, у 4 (1,3%) — двобічна, у 3 (0,9%) — симультанна резекція з однієї сторони та нефректомія — з іншої. Операція в усіх випадках проводилась трансабдомінальним доступом.
Діагностичні заходи включали вивчення скарг, анамнезу, об’єктивного обстеження, лабораторних аналізів, КТ з болюсним підсиленням. Визначення функціонального стану нирок проводилося за допомогою динамічної нефросцинтиграфії.
Результати. Інтраопераційні ускладнення виникли у 55 (17,4%) хворих. В одному випадку (0,3%) під час операції було травмовано селезінку, що стало показанням до проведення спленектомії. Крововтрата як ускладнення враховувалась при рівні >500 мл і відмічена в 54 (17,1%) випадках, що потребувало переливання компонентів крові в 7 (2,2%) випадках. Об’єм крововтрати мав прямо пропорційну залежність від розмірів пухлини і прогресивно збільшувався з 321,2±146,3 мл при розмірі пухлини <4 см до 426,2±198,2 мл при розмірі більше 7 см (р<0,01).
Післяопераційні ускладнення виникли у 25 (7,9%) хворих. Найбільш частим ускладненням післяопераційного періоду була сечова нориця, яка виявлена у 9 (2,8%) пацієнтів і напряму корелювала із розміром пухлини. В 1 випадку за наявності тривалої сечової нориці виникла стриктура сечоводу в ділянці мисково-сечовідного сегмента з розвитком гідронефрозу, що в подальшому потребувало хірургічної корекції.
Післяопераційна кровотеча діагностована у 8 (2,5%) хворих, яка у 4 (1,3%) була купірувана консервативними засобами, у 3 (0,9%) виконано повторне оперативне втручання (прошивання паренхіми), а ще в 1 (0,3%) — нефректомія.
Гнійно-септичні ускладнення відмічали рідко: пієлонефрит діагностований в 7 (2,2%) випадках, нагноєння післяопераційної рани — в 4 (1,3%). При двобічних пухлинах нирки оперативне втручання виконували в один етап (4 — двобічна резекція нирки, 3 — резекція нирки з одного боку та нефректомія з іншого). В післяопераційний період у всіх хворих відмічали тимчасове погіршення функції нирок, та у 3 (42,9%) хворих з єдиною ниркою відмічено загострення хронічної ниркової недостатності, яка була купірувана протягом 2–3 діб без використання гемодіалізу.
Висновки. Найчастішим інтраопераційним ускладненням резекції нирки є крововтрата, яка відмічена у 54 (17,1%) хворих, що потребувало переливання компонентів крові лише в 7 (2,2%) випадках. Виявлено прямо пропорційну залежність об’єму крововтрати від розмірів пухлини (р<0,01). Післяопераційні ускладнення при резекції нирки діагностовано у 25 (7,9%) хворих. Найчастішим ускладненням післяопераційного періоду була сечова нориця, яка виявлена у 9 (2,8%) пацієнтів, що напряму корелювала із розмірами пухлини та відмічалася в 1 (0,7%), 5 (3,5%) та 3 (9,0 %) випадках відповідно при стадії Т1а, Т1в та Т2.














Leave a comment