Огляд науково-практичного семінару «Профілактика та лікування ускладнень хіміотерапії (гепатотоксичність)» для онкологів, які проводять хіміотерапію
Губарева Г.О., Філоненко К.С., Алексик О.М.
Резюме. Проведення сучасної хіміотерапії (ХТ) дозволило суттєво підвищити шанси хворих онкологічного профілю на одужання. Проте негативним наслідком інтенсифікації ХТ є збільшення кількості побічних ефектів протипухлинних лікарських засобів. Підтвердженням актуальності цієї теми стало проведення у Києві у квітні 2014 р. одразу двох семінарів, присвячених питанням профілактики та лікування різних побічних ефектів ХТ. На першому семінарі «Медикаментозні ураження печінки, індуковані хіміотерапією», який відбувся 16 квітня, під егідою Національного інституту раку, були висвітлені найбільш актуальні питання гепатотоксичності. Родзинкою семінару стало його проведення у форматі телемосту, який об’єднав онкологів та гематологів Києва, Львова, Донецька, Харкова, Запоріжжя, Дніпропетровська, Полтави, Одеси, Ужгорода, Вінниці, Луганська та Черкас. Дайджест присвячений висвітленим у доповідях ключовим питанням розвитку, профілактики та лікування гепатотоксичності.

Проведення сучасної хіміотерапії (ХТ) дозволило суттєво підвищити шанси хворих онкологічного профілю на одужання. Пацієнти зі злоякісними новоутвореннями багатьох локалізацій, які раніше вважалися невиліковними, нині можуть розраховувати на суттєвий успіх у подоланні раку. Підвищення ефективності сучасної ХТ досягнуто завдяки інтенсифікації режимів лікування. Проте негативним її наслідком є збільшення кількості побічних ефектів протипухлинних лікарських засобів. Наявність ускладнень ХТ може стати завадою в досягненні максимальної лікувальної дії застосовуваних режимів, а отже, питання профілактики та своєчасного усунення токсичних проявів ХТ стає одним із найбільш актуальних для онкологів України та світу.
Підтвердженням цього стало проведення у Києві у квітні 2014 р. одразу двох семінарів, присвячених проблемам профілактики та лікування різних побічних ефектів ХТ. На першому семінарі «Медикаментозні ураження печінки, індуковані хіміотерапією», який відбувся 16 квітня, було висвітлено найбільш актуальні питання хіміотерапевтичної гепатотоксичності (ГТ). Обговорення проведено під егідою Національного інституту раку (НІР). Родзинкою семінару став його формат телемосту, який об’єднав онкологів та гематологів Києва, Львова, Донецька, Харкова, Запоріжжя, Дніпропетровська, Полтави, Одеси, Ужгорода, Вінниці, Луганська та Черкас.
У прямому включенні з Риму (Італія) доктор медичних наук Бруно Вінченці (Bruno Vincenzi) з Університетського госпіталю БіоМедико (Campus Bio-Medico University), один із провідних спеціалістів у галузі вивчення ГТ, поділився найсучаснішими знаннями та власним досвідом у цій царині з українськими лікарями.
Свою доповідь Б. Вінченці розпочав з огляду особливостей функціонування печінки у пацієнтів з онкологічним захворюванням та факторів ризику розвитку печінкової токсичності. Низка чинників, пов’язаних із наявністю злоякісного утворення, може впливати на розвиток ГТ. Так, ураження печінки пухлиною, наявність захворювань печінки, інфекцій, паранеопластичних синдромів, розвиток тромбозу ворітної вени, проведення ХТ та прийом препаратів терапії супроводу можуть призвести до виникнення проявів ГТ.
Оцінку факторів ризику появи ГТ слід проводити ще до початку ХТ: це може допомогти спрогнозувати розвиток ускладнень, спричинених таким лікуванням, а отже, своєчасно призначити профілактичну терапію. Серед найбільш вивчених чинників ризику варто виділити:
- токсичний потенціал препаратів;
- ураження печінки пухлиною;
- наявність захворювань печінки, особливо вірусних гепатитів;
- системні супутні захворювання;
- наявність шкідливих звичок (тютюнопаління та вживання алкоголю);
- ожиріння, похилий вік, жіноча стать;
- прийом значної кількості медикаментозних засобів.
Велике значення мають генетичні фактори, які зумовлюють особливості метаболізму лікарських засобів. Нещодавно вченими було визначено роль поліморфізму алелей HLA (human leucocyte antigen — людський лейкоцитарний антиген) в індукції розвитку ГТ у пацієнтів онкологічного профілю (Spraggs C. et al., 2011), однак прогностична цінність цього дослідження поки що обмежена.
У наступній частині своєї доповіді Б. Вінченці перейшов до висвітлення різних видів і механізмів ураження печінки під час проведення ХТ. Відомо, що власне онкологічне захворювання здатне несприятливо впливати на функціонування клітин печінки за рахунок підвищення рівня цитокінів, вивільнення значної кількості вільних радикалів тощо. Так, декілька років тому опубліковано дані експериментального дослідження, що продемонстрували інгібування цитохрому Р450 під впливом онкопатології, що в свою чергу може спричинити медикаментозне ураження печінки (Сharles K.A. et al., 2006). Окрім того, продемонстровано, що продукція інтерлейкіну (IL)-6, який пов’язаний з розвитком гострої фази запалення, може модулювати активність цитохрому Р450. Серед інших шляхів розвитку ГТ варто виділити гепатоцелюлярний некроз, холестаз, стеатоз, дуктальний фіброз.
Доповідач нагадав, що, крім найбільш відомих маркерів ураження печінки, як-то рівень трансаміназ, лужної фосфатази, гамма-глутамінтрансферази та білірубіну, — слід враховувати такі параметри, як гіпертрофія печінки, зниження рівня альбуміну сироватки крові, інтенсивність кровотоку у ворітній вені тощо. Необхідно пам’ятати, що у близько 3% пацієнтів аномальними є вихідні показники трансаміназ. Співвідношення рівнів підвищених аланінамінотрансферази (АлАТ) та лужної фосфатази визначає тип ураження печінки. Так, у випадку, коли це співвідношення >1 : 5, можна стверджувати про гепатоцелюлярний тип, у межах від 1 : 5 до 1 : 2 — змішаний, а при показнику <1 : 2 — холестатичний тип ураження печінки.
Надалі Б. Вінченці перейшов до обговорення токсичного потенціалу хіміотерапевтичних засобів. До хіміопрепаратів, що характеризуються найбільшою ГТ, належать гемцитабін, капецитабін, флуороурацил, цисплатин, оксаліплатин, іматиніб та ін. Кожен із препаратів має свої особливості механізму розвитку ГТ та її проявів. Найчастіше ураження печінки проявляються при терапії оксаліплатином, іринотеканом, гемцитабіном, флуороурацилом та доксорубіцином. Найтяжчі ураження печінки розвиваються при лікуванні пазопанібом (навіть можуть бути фатальними), а також гефітинібом, іринотеканом та оксаліплатином. Терапія капецитабіному у 20% випадків ускладнюється ГТ, яка проявляється підвищенням трансаміназ і білірубіну. ГТ флуороурацилу пов’язана з обструкцією синусоїдальних капілярів або дилатаційним синдромом. Терапія гемцитабіном у 60%випадків може бути асоційована з підвищенням рівня аспартатамінотрансферази (АсАТ), АлАТ та білірубіну (Carlini P. et al., 2006). Прояви ГТ під час лікування оксаліплатином трапляються майже у 80% випадків.
Надзвичайно цікавою ознакою ГТ — новим маркером цього ускладнення — є спленомегалія. M.J. Overman та співавтори у дослідженні, опублікованому у 2010 р., зазначили, що при цьому відбувається синусоїдальне ураження органа. Коли таке ураження досягає 50%, розвивається тромбоцитопенія, яку вже після 12 міс персистенції спленомегалії реєструють у 13% хворих. За свідченням авторів дослідження, якщо під час попередніх курсів ХТ виникала ГТ, подальше проведення ХТ також може супроводжуватися токсичними проявами з боку печінки.
Профілактика розвитку ГТ, на думку Б. Вінченці, показана усім пацієнтам, що отримують лікування оксаліплатином. У решти хворих терапію ГТ слід розпочинати при підвищенні рівня трансаміназ. Серед препаратів, які можна застосовувати для профілактики та лікування ГТ, автор назвав адеметіонін, N-ацетилцистеїн, препарати есенціальних фосфоліпідів. Утім беззаперечним лідером, ефективність якого доведено у численних клінічних дослідженнях, є адеметіонін. Цей препарат має декілька механізмів позитивного впливу на організм людини. Серед них:
- відновлення рівня глутатіону;
- попередження ушкодження мембран гепатоцитів;
- нормалізація проникності мембран гепатоцитів;
- попередження розвитку печінкової енцефалопатії при цирозі печінки.
Завдяки цьому реалізуються детоксикаційний, антиоксидантний, холеретичний, холекінетичний, антидепресивний, нейропротекторний та регенеративний ефекти. Так, у дослідженні B. Vincenzi et al. (2011) на прикладі пацієнтів з колоректальним раком, які отримували ХТ, показано, що у хворих, яким лікування проводили на фоні введення адеметіоніну, відзначено нижчий рівень ГТ, менші інтервали між курсами ХТ (11% проти 47% у досліджуваній та контрольній групах відповідно) та редукцію доз хіміопрепаратів (3% проти 18% відповідно).
Наприкінці виступу доповідач наголосив, що скрупульозна оцінка факторів ризику розвитку ГТ дуже важлива для прогнозування ускладнень ХТ та призначення профілактичного лікування, що дасть можливість своєчасно та у повному обсязі провести заплановане хіміотерапевтичне лікування, а отже, досягти його очікуваної ефективності. Визначення традиційних маркерів ГТ недостатньо для повноцінної діагностики токсичних уражень печінки. Адеметіонін на сьогодні є найбільш ефективним препаратом для профілактики та лікування ГТ.
Після завершення доповіді лікарі усіх регіонів, що брали участь у телеконференції, змогли поставити нагальні питання доктору Б. Вінченці. Обговорення, під час якого експерт надав вичерпні відповіді та коментарі щодо ГТ ХТ, тривало понад годину.
Керівник науково-дослідного відділення ХТ солідних пухлин НІР, доктор медичних наук Любов Андріївна Сивак розглянула причини, механізми розвитку, профілактику та лікування ГТ. Доповідач наголосила на тому, що хіміопрепарати мають невисоку селективність, що сприяє розвитку різних типів токсичності. Побічні ефекти ХТ можуть значно впливати на інтенсивність лікування, а отже, і на його ефективність. За даними клінічних досліджень, ГТ виникає у 10–80% випадків.
Різні групи препаратів можуть мати різні механізми токсичного впливу на печінку. Зокрема, алкілуючі агенти (циклофосфамід, іфосфамід, хлорамбуцил) можуть призводити до розвитку центролобулярного або перипортального пошкодження, викликати холестаз. На фоні холестазу може розвиватися запалення. Антиметаболіти (флуороурацил, 6-меркаптопурин, метотрексат, гемцитабін) асоційовані з венооклюзійною хворобою, холестазом та прямим цитотоксичним пошкодженням гепатоцитів. Похідні нітрозосечовини викликають виснаження внутрішньопечінкових запасів глутатіону, що в свою чергу підвищує ризик окислювального ураження печінки. Застосування протипухлинних антибіотиків (доксорубіцин, блеоміцин, мітоміцин тощо) призводить до пошкодження мембран гепатоцитів та утворення вільних радикалів. Інтерферони та інтерлейкіни індукують активацію Т-кілерів та цитокінів, а також чинять пряму токсичну дію на клітини печінки. Гормональне лікування (тамоксифен, антиандрогени) може спричинити розвиток холестазу. Таргетна терапія в низці випадків асоціюється з синусоїдальною дилатацією (King P.D. et al., 2001).
Діапазон клінічних проявів медикаментозних уражень печінки різноманітний: від невеликого підвищення рівня амінотрансфераз, яке не супроводжується розвитком клінічної симптоматики, до стрімкого розвитку гепатитів і цирозу печінки. Клінічні прояви ГТ можуть бути схожими з такими майже усіх захворювань печінки.
У наступній частині своєї доповіді Л.А. Сивак перейшла до класифікації уражень печінки згідно зі шкалою токсичності Всесвітньої організації охорони здоров’я, яка виділяє 4 ступеня ГТ. Вона наголосила, що при розвитку ГТ III–IV ступеня вираженості, коли констатують значне погіршення самопочуття, виникає загроза для життя хворого, з’являються потреби коштовного симптоматичного лікування, відстрочування прийому або зниження доз хіміопрепаратів.
Надалі доповідач перейшла до висвітлення основних завдань усунення проявів ГТ. Лікування має включати заходи впливу на всі патологічні процеси, які виникають у печінці, а саме:
- профілактику руйнування гепатоцитів шляхом стабілізації їх мембран і попередження накопичення ліпідів в їх цитоплазмі;
- зниження ступеня запальних та імунологічних реакцій та нормалізацію окисно-відновного балансу в гепатоцитах;
- пригнічення надмірної продукції колагенових волокон шляхом впливу на процеси фіброгенезу.
Наразі для поліпшення функції печінки застосовують препарати природного походження — есенціальні фосфоліпіди, амінокислоти та їх деривати, вітаміни, вітаміноподібні препарати тощо. Але вищезгаданим вимогам найбільше відповідає гепатопротекторний препарат адеметіонін. У випадках тяжкої ГТ можливе призначення глюкокортикостероїдів.
Адеметіонін являє собою фізіологічний метаболіт, дефіцит якого відзначають при всіх патологічних станах печінки, у тому числі при медикаментозній ГТ у хворих онкологічного профілю. Адеметіоніну властива висока швидкість відповіді на терапію. За даними G. Fiorelli (1999), при застосуванні адеметіоніну печінки в добовій дозі 800 мг внутрішньовенно впродовж 15 днів у пацієнтів (n=640) з цирозом біохімічна відповідь на терапію вже на 7-му добу була відмічена у 43% хворих, а після закінчення курсу — у 62%. Крім того, у 69% осіб проведене лікування викликало зменшення астенізації та свербіння шкіри.
У відкритому рандомізованому дослідженні, в якому брали участь пацієнти зі стеатогепатитом, показано, що при застосуванні адеметіоніну упродовж 4 міс перорально в добових дозах 1200 або 800 мг (у 3 прийоми) відповідно, до кінця курсу ефективність терапії виявилася зіставною. У той самий час у групі пацієнтів, у яких застосовували адеметіонін у дозі 1200 мг, клінічний ефект наставав швидше. Досягнутий ефект зберігався в обох групах протягом 6 міс після закінчення лікування, що свідчить про пролонговану дію препарату.
Насамкінець Л.А. Сивак ще раз наголосила на важливості вчасного виявлення, профілактики та раннього лікування ГТ.
Керівник науково-дослідного відділення ад’ювантних методів лікування НІР, кандидат медичних наук Ганна Олександрівна Губарева представила результати науково-дослідної роботи, проведеної у 2011–2013 рр. на базі науково-дослідних відділень ад’ювантних методів лікування та ХТ солідних пухлин НІР.
Робота була присвячена вивченню прогностичних факторів розвитку ускладнень ХТ у хворих на рак грудної залози (РГЗ), розробці заходів їх запобігання та лікування з урахуванням клініко-лабораторних чинників прогнозу токсичності. За її словами, ХТ отримують 85,4% пацієнток із РГЗ. Нині найпоширенішою схемою ХТ є схема FAC (флуороурацил, доксорубіцин, циклофосфамід), що за токсичністю зіставна з більшістю схем ХТ, які застосовують в онкології. Відомо, що токсичність консервативного лікування РГЗ суттєво підвищується зі збільшенням кількості отримуваних препаратів, однак рівень об’єктивної відповіді на лікування при призначенні багатокомпонентних схем зростає. На думку дослідників, визначення прогностичних факторів ризику розвитку токсичності ХТ, які дозволять її спрогнозувати, може суттєво поліпшити результати лікування.
У дослідження було включено 146 хворих на РГЗ у І–ІV стадії віком від 27 до 72 років (середній вік 49,8±9,8 року). Усім пацієнткам проведено 4–6 курсів ХТ за схемою FAC (усього 778 курсів). Прояви токсичності ХТ досліджували на 7-й, 14-й та 21-й день кожного курсу ХТ за критеріями NCI-СТС V 3.0 (National Cancer Institute — Common Toxicity Criteria Version 3.0). Проведено понад 2 тис. комплексних досліджень.
У результаті багатофакторного аналізу визначено, що серед основних типів токсичності ХТ були гематологічна (1,6%), гастроінтестинальна (74,3%), кардіоваскулярна (9,8%) та печінкова (16,1%). Домінували прояви помірного І–ІІ ступеня токсичності. Окрім клініко-лабораторних факторів ризику, також вивчено генетичні чинники, у тому числі генотипи генів GSTP1 та MTHFR.
Виявилося, що гастроінтестинальна токсичність (ГІТ) частіше виникала у хворих віком <50 років (100% порівняно з 66% у пацієнтів у віці >50 років; р<0,001). Кардіоваскулярну токсичність (КВТ) із більшою частотою відзначали в осіб віком >50 років (90% порівняно з 16% у хворих віком <50 років; р<0,001). Печінкова токсичність розвинулася у 26% хворих із І–ІІ стадією та у 77% — з ІІІ–ІV; КВТ — у 42 та 84% пацієнтів відповідно (р<0,001). Печінкова токсичність виникла у 21% хворих із супутньою патологією та 77% — без неї; КВТ — у 41 та 74% пацієнтів відповідно (р<0,001). ГІТ реєстрували у 50% хворих, які отримали <3 курсів ХТ, та у 87% осіб, яким проведено >3 курсів ХТ (р<0,001). КВТ виникла у 44 та 79% хворих відповідно (р<0,001). У пацієнтів, які були носіями G/G генотипу гена GSTP1, ГІТ розвинулася у 88,9% порівняно з хворими, які були носіями генотипу А/G (41,9%) та А/А (46,9%) (р<0,04). Генотип гена MTHFR був пов’язаний із розвитком КВТ і гематологічної токсичності. КВТ зареєстровано у 36,5% хворих із генотипом Т/Т і С/Т та 9,1% — із генотипом С/С (р<0,01). Гематологічну токсичність відзначено у 20% пацієнтів із генотипом С/Т та 3% — із С/С (р<0,04).
Щодо печінкової токсичності ХТ, то з’ясувалося, що статистично достовірно на її розвиток впливають такі фактори, як вік пацієнтки >50 років (r=0,37; р<0,05); наявність хронічних хвороб печінки та жовчовивідних шляхів (r=0,32; р<0,05); обсяг попереднього спеціального лікування, у тому числі проведення >3 курсів ХТ (r=0,39; р<0,05); ініціальний рівень АлАТ (r=0,41; р<0,05), АсАТ (r=0,39; р<0,05) та загального білірубіну (r=0,45; р<0,05) (рисунок).
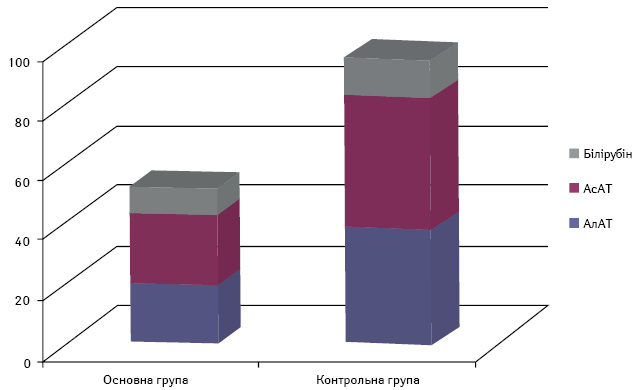
Рисунок. Прояви токсичності у досліджуваних групах
На основі цих факторів визначено групу хворих із високим ризиком проявів токсичності ХТ. У цій групі частота виникнення та ступінь токсичних ефектів були значно вищими. Так, ГІТ зареєстровано у 80,5% випадків, ГТ — у 45,9%, КВТ — у 39,2%, а гематологічну токсичність — у 36,5%.
Для кожного з видів токсичності розроблено алгоритм профілактики токсичних проявів та лікування ускладнень. Таким чином, в основу алгоритму профілактики та лікування ГТ покладено вплив на різні механізми її розвитку (таблиця). Пацієнтів групи високого ризику розвитку ГТ рандомізовано на дві гілки: ті, що отримували профілактичне лікування ГТ (дослідна група), та ті, що його не отримували (контрольна група).
Таблиця. Алгоритм профілактики та лікування ГТ
| Ознаки | Лікування |
| Підвищення рівня сироваткових АлАТ, АсАТ ≤5 норм, нормальний рівень білірубіну | Есенціальні фосфоліпіди по 2 капсули 2–4 рази на день до нормалізації рівня біохімічних показників, але не менше 2 тиж |
| Підвищення рівня сироваткових АлАТ, АсАТ ≤5 норм, рівень білірубіну вищий у ≥1,5 раза | Преднізолон 30 мг/добу — 1-й тиждень, 20 мг/добу — 2-й тиждень; 10 мг/добу — 3-й тиждень. Урсодезоксіхолева кислота 10–15 мг/кг/добу з 1-го тижня впродовж ≥2 міс |
| Підвищення рівня сироваткових АлАТ, АсАТ у ≥5 разів або наявність ознак Hy’s Rule* | Відміна ХТ. Преднізолон 60–30 мг/добу з поступовим зниженням дози. Адеметіонін 400 мг внутрішньовенно 5 діб, потім 400 мг 2 рази на добу per os до нормалізації біохімічних показників |
*Правило Гая — прогностичний індикатор тяжкого медикаментозного ураження печінки.
Застосування вказаного алгоритму профілактики ГТ у дослідній групі дозволило значно знизити рівень проявів ГТ. Так, в основній групі прояви ГТ виявлено у 39,2% проти 75,0% у контрольній (p<0,05). Крім того, ступінь проявів токсичності в основній групі був нижчим, тобто III ступінь ГТ, при якому необхідною була б редукція доз хіміопрепаратів, реєстрували виключно в контрольній групі (n=7; 12,9%; p<0,05).
Внаслідок зниження токсичності ХТ була забезпечена можливість уникнути редукції доз препаратів та відтермінувати подальші курси ХТ. У сукупності з проведенням профілактичного лікування та зниженням рівня інших видів токсичності в дослідній групі вдалося отримати вищий рівень об’єктивних відповідей на терапію (47,7% порівняно з 29,4% у контрольній групі).
Підсумовуючи свою доповідь, Г.О. Губарева ще раз підкреслила, що застосування профілактичної гепатотропної терапії дозволяє значно знизити ризик розвитку ГТ у хворих, що отримують ХТ, попередити розвиток постхіміотерапевтичних змін у структурі печінки, покращити перенесення ХТ та якість життя хворого. А це, в свою чергу, дозволяє дотриматися інтенсивності запланованої терапії, а значить, досягти вищої ефективності лікування.
Отже, під час семінару було висвітлено питання патогенезу, факторів ризику розвитку ГТ. Кожен із доповідачів продемонстрував виключну важливість профілактики та лікування ГТ, що в цілому може вплинути на ефективність лікування хворого онкологічного профілю. Активність аудиторії, що полягала у значній кількості питань за темами доповідей, обговоренні теми семінару, проілюструвала високу зацікавленість онкологів і гематологів аспектами профілактики та лікування ГТ. Таким чином, за результатами семінару підтверджено актуальність теми ГТ у пацієнтів з онкопатологією як одного з найбільш частих та серйозних ускладнень ХТ, а також значну потребу у проведенні аналогічних заходів та поглибленні знань щодо ведення пацієнтів, які мають прояви хіміотерапевтичної токсичності.
Обзор научно-практического семинара «Профилактика и лечение осложнений химиотерапии (гепатотоксичность)» для онкологов, которые проводят химиотерапию
Национальный институт рака, Киев
Резюме. Проведение современной химиотерапии (ХТ) позволило существенно повысить шансы больных онкологического профиля на выздоровление. Впрочем, отрицательным последствием интенсификации ХТ является увеличение количества побочных эффектов противоопухолевых лекарственных средств. Подтверждением актуальности этой темы стало проведение в Киеве в апреле 2014 г. сразу двух семинаров, посвященных вопросам профилактики и лечения различных побочных эффектов ХТ. На первом семинаре «Медикаментозные поражения печени, индуцированные химиотерапией», который состоялся 16 апреля под эгидой Национального института рака, освещены наиболее актуальные вопросы гепатотоксичности. Изюминкой семинара стало его проведение в формате телемоста, который объединил онкологов и гематологов Киева, Львова, Донецка, Харькова, Запорожья, Днепропетровска, Полтавы, Одессы, Ужгорода, Винницы, Луганска и Черкасс. Дайджест посвящен представленным в докладах ключевым вопросам развития, профилактики и лечения гепатотоксичности.
химиотерапия, гепатотоксичность, профилактика, лечение, АсАТ, АлАТ.
Адреса:
Філоненко Катерина Сергіївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: ksfilonenko@yahoo.com














Leave a comment