Органозберігаючі методи лікування ранніх форм раку прямої кишки
Шелыгин Ю.А., Кашников В.Н., Еропкин П.В. , Пересада И.В.
Резюме. Результати місцевого лікування початкових форм раку Тis-1N0G1-2 <3 см у діаметрі зіставні щодо онкологічної ефективності з брюшинно-промежинними втручаннями. Метод безгазової трансанальної ендохірургії (ТЕХ) дозволяє видаляти пухлини через операційний ректоскоп із використанням стандартного набору лапароскопічних інструментів, а також виявляє низьку травматичність і збереження функції. При локалізації новоутворень у нижньоампулярному відділі також можливе використання трансанального видалення пухлин (ТАВП) методом Parks. ТЕХ і ТАВП — ефективні органозберігаючі методи лікування хворих із початковими формами раку прямої кишки.
Резюме. Результаты местного лечения начальных форм рака Тis-1N0G1-2 <3 см в диаметре сопоставимы по онкологической эффективности c брюшно-промежностными вмешательствами. Метод безгазовой трансанальной эндохирургии (ТЭХ) позволяет удалять опухоли через операционный ректоскоп с использованием стандартного набора лапароскопических инструментов, а также обладает низкой травматичностью и сохранением функции. При локализации новообразований в нижнеампулярном отделе также возможно использование трансанального иссечения опухолей (ТАИО) методом Parks. ТЭХ и ТАИО — эффективные органосохраняющие методы лечения больных с начальными формами рака прямой кишки.
Актуальность
Наиболее распространенными методами лечения при раке прямой кишки остаются трансабдоминальные вмешательства, связанные с полным или частичным удалением прямой кишки, и нередко — запирательного аппарата.
От 8,6 до 21% больных с впервые выявленным заболеванием данной локализации составляют пациенты с начальными стадиями рака [1, 6, 9]. Результаты местного удаления начальных форм рака Тis-1 с высокой степенью дифференцировки G1-2, без поражения параректальных лимфатических узлов N0 сопоставимы по онкологической эффективности с брюшно-промежностными вмешательствами. Местное удаление подобных новообразований выполняется в 13,3–47,3% наблюдений [2, 3, 13].
Доступность для местного удаления новообразований дистальных отделов прямой кишки способствовала развитию различных методик трансанального иссечения опухолей (ТАИО). Наибольшую распространенность получил метод Паркса.
В начале 80-х годов ХХ ст. G. Buess предложил метод трансанальной эндомикрохирургии (ТЭМ), сочетающий в себе, в отличие от трансабдоминальных способов лечения, возможность малоинвазивного удаления новообразований, располагающихся в прямой кишке выше зубчатой линии, низкую травматичность и сохранение функции анального жома [4, 10, 13]. В Государственном научном центре колопроктологии Минздравсоцразвития РФ (Москва, Российская Федерация) в 1999 г. разработан безгазовый вариант этого метода — трансанальное эндомикрохирургическое (ТЭХ) удаление новообразований прямой кишки.
В представленном материале отражен опыт органосохраняющего лечения начальных форм рака прямой кишки, накопленный в ФГУ «ГНЦ колопроктологии Минздравсоцразвития РФ».
Статистика
Статистическую обработку данных проводили с использованием программных пакетов Microsoft Excel и GraphPad Online. Количественные показатели сравнивались при помощи одностороннего критерия Манна – Уитни. Для сравнения качественных показателей применялись критерии χ и двусторонний тест Фишера. Статистически значимые различия в показателях — при p<0,05.
Материалы и методы
С 1999 по 2011 г. в ФГУ «Государственный научный центр колопроктологии Минздравсоцразвития РФ» по поводу начальных форм рака прямой кишки методами безгазовой ТЭХ и ТАИО оперировано 103 пациента (45 мужчин и 58 женщин).
Показаниями к данным операциям послужили опухоли с высокой степенью дифференцировки, ограниченные мышечным слоем кишечной стенки, при отсутствии признаков поражения параректальных лимфатических узлов по данным эндоректального ультразвукового исследования (УЗИ) и компьютерной томографии. При ТЭХ-удалении обязательным условием служило расположение опухоли ниже тазовой брюшины.
Методом ТЭХ (1-я группа) оперировано 84 пациента. Опухоли располагались на расстоянии от 1 до 13 см (4,8±2,4 см) от зубчатой линии, а размер колебался от 0,8 до 6 см (2,7±1,2 см), в 77,4% наблюдений основание опухоли было широкое. ТАИО (2-я группа) выполнено 19 пациентам, новообразования локализовались от уровня зубчатой линии до 5 см (2,1±1,6 см), размерами от 1,2 до 7 см (3,5±1,6 см), у 52,6% больных 2-й группы основание опухоли было суженое (табл. 1).
| Показатель | ТЭХ (n=84) | ТАИО (n=19) | р |
|---|---|---|---|
| Возраст, лет | 62,1±11,5 | 62,4±9,5 | 0,4644 |
| Расстояние от зубчатой линии, см |
4,8±2,4 | 2,1±1,6 | <0,0001 |
| Размер опухоли, см |
2,7±1,2 | 3,5±1,6 | 0,0330 |
| Основание опухоли |
– | – | – |
| широкое | 65 (77,4%) | 10 (52,6%) | 0,0149 |
| суженое | 19 (32,6%) | 9 (47,4%) | 0,0149 |
Положение больных на операционном столе зависело от расположения новообразований по окружности стенки прямой кишки. При локализации по задней полуокружности (57 (55,4%) из 103 наблюдений) оперативное вмешательство выполнялось в литотомической позиции, по передней (у 33 (32,0%) из 103 пациентов) — в положении «на животе», на боковых стенка прямой кишки (у 13 (12,6%)) — на стороне поражения (рис. 1).
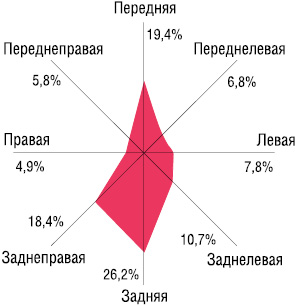
Предоперационный комплекс обследований включал в себя пальцевое ректальное исследование, ректороманоскопию, колоноскопию, проктографию, УЗИ брюшной полости, малого таза, исследование ректальным датчиком, компьютерную томографию и патоморфологическое исследование.
Результаты
Длительность оперативных вмешательств в 1-й группе больных составила в среднем 55,8±20,8 (25–120) мин, что было достоверно больше (р=0,0002), чем во 2-й группе, где среднее время операций составило 38,9±16,8 (20–90) мин. Интраоперационная кровопотеря колебалась при ТЭХ-удалении от 10 до 180 мл (в среднем — 49,5±28,4 мл), а при ТАИО — от 20 до 130 мл (в среднем — 42,5±34,2 мл) (р=0,2381) (табл. 2).
У 1 больного выполнена конверсия ТЭХ на ТАИО, поскольку выделение новообразования по окружности привело к увеличению его подвижности и вывихиванию через анальный канал.
| Показатель | ТЭХ (n=84) | ТАИО (n=19) | р |
|---|---|---|---|
| Длительность, мин | 55,8±20,8 | 38,9±16,8 | 0,0002 |
| Кровопотеря, мл | 49,5±28,4 | 43,5±34,2 | 0,1381 |
Ни в одном случае не было конверсии в переднюю или брюшно-анальную резекцию прямой кишки. Более того, в 1 наблюдении после лапаротомии и ревизии органов брюшной полости установлено, что опухоль локализуется ниже уровня тазовой брюшины, размерами до 2,5 см в диаметре, на подвижном по отношению к стенке кишки основании, расположена по задней стенки кишки, в доступной для выполнения органосохраняющей операции зоне, в связи с чем план операции был изменен и вместо низкой передней резекции прямой кишки выполнено ТЭХ-удаление опухоли.
Интраоперационных осложнений не было.
При исследовании операционных препаратов у 17 (20,2%) из 84 пациентов 1-й группы установлен диагноз carcinoma in situ, у 52 (61,9%) — аденокарцинома рТ1G1-2, у 4 (4,8%) — рТ1G3, у 10 (11,9%) — рT2G1-2 (табл. 3). Еще у 1 (1,2%) больной (Т0G1), с верифицированной дооперационно высокодифференцированной аденокарциномой, в удаленном препарате опухолевых клеток не выявлено, что связано с проведенным курсом предоперационной химиолучевой терапии СОД (суммарная очаговая доза) 26 Гр, флуороурацил — 2,5 г.
И, наконец, у 71-летней пациентки, перенесшей 4 эндоскопические полипэктомии по поводу тубулярно-ворсинчатой опухоли и ее рецидивов, только после ТЭХ-удаления рецидива новообразования выявлена слизистая аденокарцинома, прорастающая все слои кишечной стенки pT3G3 (1,2 %).
При патоморфологическом исследовании удаленных новообразований во 2-й группе больных carcinoma in situ выявлена в 6 (31,6%) наблюдениях, в 9 (47,4%) случаях — аденокарцинома рТ1G1-2, в 2 (10,5%) — рТ1G3, и по 1 (5,3%) наблюдению — рT2G1 и pT3G3 (табл. 3).
препаратов (n=103)
| Метод | pT in situp=0,3976 | pT0-1p=0,8380 | pT2p=0,6859 | pT3р=0,3462 | |||
|---|---|---|---|---|---|---|---|
| G1 | G2 | G3 | G1 | G2 | G3 | ||
| ТЭХ (n=84) | 17 | 9 | 43 | 4 | 1 | 9 | 1 |
| ТАИО (n=19) | 6 | 4 | 5 | 2 | 1 | – | 1 |
Среднее расстояние от края опухоли до границы резекции в удаленных препаратах у пациентов 1-й группы составило 0,8±0,3 см (0,4–1,5 см). Во 2-й группе больных этот параметр в среднем составил 0,7±0,3 см (0,2–1,2 см).
Осложнения в послеоперационный период развились у 4 (4,8%) больных 1-й группы. В 2 случаях возникла рефлекторная задержка мочеиспускания, купированная медикаментозной стимуляцией. Еще в 2 случаях возникли воспалительные осложнения. В 1 наблюдении у 48-летнего больного на 3-й день после ТЭХ-удаления полиповидного рака по передней стенке прямой кишки выявлен инфильтративный парапроктит. На фоне дезинтоксикационной и антибиотикотерапии, ирригации ампулы прямой кишки антисептиками симптомы воспаления купированы, формирования стомы не потребовалось. Во втором — у пациентки в возрасте 72 лет с опухолью pТ1G2, расположенной по передней полуокружности, после ТЭМ-удаления новообразования без восстановления целостности стенки прямой кишки, возникла обширная флегмона предбрюшинной и околопузырной клетчатки, что явилось причиной генерализованного сепсиса. Лечебные мероприятия (массивная антибиотикотерапия, дезинтоксикационная терапия, лапаротомия, вскрытие и дренирование флегмоны, двуствольная колостомия) не имели успеха, и больная умерла на 5-й день после вмешательства на фоне септического шока и полиорганной недостаточности. Таким образом, послеоперационная летальность в 1-й группе пациентов составила 1,2%.
В группе 19 больных, перенесших ТАИО, выявлено 2 (10,5%) послеоперационных осложнения у мужчин в возрасте 81 года и 72 лет: в первом случае отмечена задержка мочеиспускания, а во втором — воспаление параректальной клетчатки. Проведенная консервативная терапия позволила справиться с этими осложнениями (табл. 4).
| Характер осложнений | Рефлекторная задержка мочи | Воспалительный инфильтрат | Флегмона, сепсис |
|---|---|---|---|
| ТЭХ (n=84) | 2 (2,4%) | 1 (1,2%) | 1 (1,2%) |
| ТАИО (n=19) | 1 (5,3%) | 1 (5,3%) | – |
Средний послеоперационный койко-день в 1-й группе больных составил 7,4±2,3 (3–16) дня, а во 2-й группе — 7,6±2,8 (4–16) дня (p=0,4586).
В группе больных, перенесших ТЭХ, 7 (77,8%) пациентам из 9 с опухолями рТ2G2 и 2 (4,8%) из 42 с рТ1G2, с выявленной лимфовенозной инвазией рака, в послеоперационный период проведена химиолучевая терапия СОД 38–50 Гр, флуороурацил — 5 г. Следует отметить, что все эти 9 пациентов наблюдаются в сроки от 4 до 106 мес без признаков возврата заболевания. Еще у 1 больной в возрасте 71 года, с тяжелыми сопутствующими заболеваниями (менингиома левой лобной доли, ишемическая болезнь сердца, стенокардия напряжения, атеросклероз аорты, сосудов головного мозга), с аденокарциномой pT3G3, также проведен курс послеоперационной химиолучевой терапии.
Во 2-й группе больных послеоперационная лучевая терапия проведена у 1 больной с аденокарциномой рТ2G2.
Наблюдение пациентов, перенесших органосохраняющие методы лечения рака, проводилось по стандартной схеме: первый осмотр через 2 нед после вмешательства, для контроля репаративных процессов в области операции, в дальнейшем каждые 3 мес на протяжении 1 года, затем — через 6 мес, в последующем — через 1 год. При каждом осмотре проводилось пальцевое исследование и ректороманоскопия, УЗИ ректальным датчиком и колоноскопия каждые 6 мес, контролировался уровень онкомаркеров: РЭА и СА 19-9.
Отдаленные результаты прослежены у 75 (90,4%) из 83 больных 1-й группы и у 100% пациентов — 2-й группы.
В 1-й группе у 15 больных с новообразованиями pTis и у 9 больных с опухолями рТ2, в том числе и у 7 пациентов, перенесших послеоперационную лучевую терапию, не выявлено рецидивов заболевания при медиане прослеженности 21,8 (от 4 до 106) мес.
Медиана наблюдения 49 пациентов с опухолями pТ1 составила 22 (от 1 до 109) мес. Рецидивы рака через 16 и 19 мес были выявлены у 2 (4,1%) из 49 больных. Одному 85-летнему пациенту выполнена брюшно-анальная резекция прямой кишки с колостомой, с последующей лучевой терапией СОД 48 Гр, он продолжает наблюдаться без признаков рецидива 31 мес после повторной операции. Второй пациент в возрасте 84 лет вновь отказался от предложенной экстирпации прямой кишки и умер спустя 4 мес от генерализации заболевания.
Актуриальная безрецидивная 5-летняя выживаемость для 11 пациентов, перенесших ТАИО с новообразованиями рТ1, составила 100%, а для 49, перенесших ТЭХ — 93,7% (рис. 2).
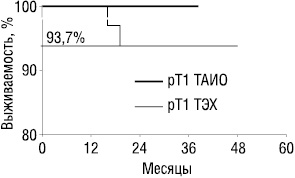
Следует отметить, что у подавляющего большинства больных перенесенное вмешательство не оказало существенного влияния на функцию держания. Однако у 2 (3,4%) из 83 пациентов 1-й группы в возрасте 72 и 76 лет в течение 2–3 мес после вмешательства отмечено недержание жидкого стула. Еще у 1 пациента была отмечена многомоментная дефекация. Во всех случаях не потребовалось дополнительной коррекции и в течение 3 мес после операции эти симптомы прошли самостоятельно.
Обсуждение
Трансабдоминальное удаление органа при раке прямой кишки остается операцией выбора [4, 10]. Однако функциональные результаты этих вмешательств далеки от удовлетворительных. Так, от 25 до 60% пациентов после радикальных операций отмечают нарушения мочеиспускания, сексуальную дисфункцию, ощущение неполного опорожнения и недержание кишечного содержимого [12, 14].
Местные рецидивы в первые 5 лет после тотальной мезоректумэктомии возникают в 1,4% наблюдений при опухолях Т1N0М0, а при Т2N0М0 — достигает 6,5% [10].
По данным мировой литературы при соблюдении определенных критериев — опухоли, ограниченные подслизистым слоем (Т1), без поражения параректальных лимфатических узлов N0, с высокой степенью дифференцировки (G1-2), диаметром не более 3 см — возможно местное удаление ранних форм рака прямой кишки [3, 10, 12], что сопоставимо с представленными в нашем исследовании данными.
По данным ряда исследователей, при локальном удалении опухолей по сравнению с трансабдоминальными вмешательствами, отмечается снижение периоперационных осложнений в 2–3 раза [4, 8, 10, 13]. В то же время некоторые авторы отмечают, что кровотечения в ближайший послеоперационный период после ТЭМ развиваются в 3,7–9,1% наблюдений, свищи и абсцессы полости малого таза возникают в 1,7–4,1%, а летальность достигает 1,4% [2, 3, 8].
Публикации, посвященные результатам ТЭМ при раке прямой кишки, демонстрируют уровень рецидивов заболевания от 0 до 26% при рТ1, достигая 35,4% при рТ2, значительно возрастая при наличии лимфо-венозной инвазии опухоли и глубокой инфильтрации подслизистого слоя стенки кишки [2–4, 10, 11]. Актуриальная 5-летняя безрецидивная выживаемость после экономных методов хирургического лечения при опухолях низкого риска Т1 сопоставима с радикальными операциями и составляет 91,4%, что подтверждают и данные нашего исследования (93,7%) [10]. Рецидивы заболевания возникают в среднем через 13–18 мес, а повторные операции позволяют достичь 5-летней кумулятивной выживаемости, составляющей 92–100% при Т1 и 78–84% — при Т2 [3, 7, 11]. Для снижения риска развития рецидивов, особенно при рТ2, ТЭМ дополняют адъювантными методами лечения, с хорошими отдаленными результатами: по сообщению S.D. Duek и соавторов не отмечено ни одного рецидива в группе больных, перенесших послеоперационную лучевую терапию при рТ2, в то же время у пациентов, отказавшихся от рекомендованного лечения, возврат заболевания выявлен в 50% случаев [5].
Заключение
Органосохраняющие трансанальные методики при лечении рака прямой кишки в стадии Тis-1N0M0 оправданы, поскольку сопровождаются низким уровнем осложнений, незначительными нарушениями эвакуаторной функции и функции анального держания.
Возможность применения трансанальных экономных вмешательств при распространенности опухолей Т2N0М0, с проведением в послеоперационный период адъювантной химиолучевой терапии, является предметом для дальнейших исследований. В настоящее время такой подход, очевидно, оправдан у больных с тяжелой сопутствующей патологией.
литература
1. Чисов В.И., Старинский В.В. (2011) Злокачественные новообразования в России в 2010 году. Москва, с. 17–18.
2. Baatrup G., Breum B., Qvist N. et аl. (2009) Transanal endoscopic microsurgery in 143 consecutive patients with rectal adenocarcinoma: results from a Danish multicenter study. Colorectal Dis., 11(3): 270–275.
3. Bach S.P., Hill J., Monson J.R.T. et аl. (2009) A predictive model for local recurrence after transanal endoscopic microsurgery for rectal cancer. British J. Surgery, 96: 280–290.
4. De Graaf E.J., Doornebosch P.G., Tollenaar R.A. et аl. (2009) Transanal endoscopic microsurgery versus total mesorectal excision of T1 rectal adenocarcinomas with curative intention. Eur. J. Surg. Oncol., 35 (12): 1280–1285.
5. Duek Simon D., Issa Nidal, Hershko Dan D. et аl. (2008) Outcome of Transanal Endoscopic Microsurgery and Adjuvant Radiotherapy in Patients with T2 Rectal Cancer. Dis. Colon. Rectum., 51: 379–384.
6. Floyd N.D., Saclarides T.J. (2006) Transanal Endoscopic Microsurgical Resection of pT1 Rectal Tumors. Dis. Colon. Rectum., 49(2): 164–168.
7. Hahnloser D., Wolff B.G., Larson D.W. et аl. (2005) Immediate Radical Resection After Local Excisionof Rectal Cancer: An Oncologic Compromise? Dis. Colon. Rectum., 48: 429–437.
8. Lee W., Lee D., Choi S. et аl. (2003) Transanal endoscopic microsurgery and radical surgery for T1 and T2 rectal cancer. Surg. Endosc., 17: 1283–1287.
9. Nascimbeni R., Burgart L.J., Nivatvongs S. et аl. (2002) Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis. Colon. Rectum., 45(2): 200–206.
10. Ptok H., Marusch F., Meyer F. et аl. (2007)Oncological Outcome of Local vs Radical Resection of Low-Risk pT1 Rectal Cancer. Arch Surg., 142 (7): 649–654.
11. Stipa F., Burza A., Lucandri G. et аl. (2006) Outcomes for early rectal cancer managed with transanal endoscopic microsurgery. A5-year follow-up study. Surg. Endosc., 20: 541–545.
12. Temple L.K., Bacik J., Savatta S.G. et al. (2005) The development of a validated instrument to evaluate bowel function after sphincter-preserving surgery for rectal cancer. Dis. Colon. Rectum., 48: 1353–1365.
13. You Y.N., Baxter N.N., Stewart A. et al. (2007) Is the increasing rate of local excision for stage I rectal cancer in the United States justified?: a nationwide cohort study from the National Cancer Database. Ann. Surg., 245(5): 726–733.
14. Wallner C., Lange M.M., Bonsing B.A. et al. (2008) Causes of fecal and urinary incontinence after total mesorectal excision for rectal cancer based on cadaveric surgery: a study from the Cooperative Clinical Investigators of the Dutch total mesorectal excision trial. J. Clin. Oncol., 26: 4466–4472.














Leave a comment