Досвід виконання резекцій печінки у хворих на метастатичний колоректальний рак
Колеснік О.О., Бурлака А.А., Лукашенко А.В., Приймак В.В., Волк М.О., Жуков Ю.О., Лаврик Г.В.
Резюме. Медіана виживаності хворих на колоректальний рак із синхронним метастатичним ураженням печінки (сМ-КРР) без хірургічного лікування перебуває в межах 6–12 міс, застосування сучасної хіміотерапії може підвищити виживаність пацієнтів до 19 міс. Досі залишається дискусійним алгоритм лікування цих хворих, зокрема ефективність та безпека одномоментних резекцій з приводу первинної пухлини та віддалених синхронних метастазів. Матеріали досліджень базуються на вивченні результатів лікування 125 пацієнтів із сМ-КРР (рТ1-4N0-2M1 — при раку ободової кишки та рТ1-3N0-2M1 — при раку прямої кишки), яким виконано одномоментне (група І) чи двоетапне (група ІІ) хірургічне лікування за період із 2008 по 2015 р. на базі науково-дослідного відділення пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку. Сумарний рівень післяопераційних ускладнень, зареєстрованих за 30-денний період, становив 30,6 та 25,0% у хворих груп І та ІІ відповідно (р=0,51). Загальна 5-річна кумулятивна виживаність пацієнтів із сМ-КРР, які перенесли R0-резекцію з приводу первинної пухлини та синхронних метастазів у печінці, становила 42 та 35% відповідно для груп І та ІІ (p=0,73). Медіана гіпертрофії ділянок залишкової паренхіми печінки у хворих групи асоційованого розділення печінки та лігування ворітної вени досягла 68%. Резекція печінки при сМ-КРР залишається єдиним методом, який дозволяє достовірно покращити віддалені результати лікування хворих на метастатичний КРР, незалежно від хірургічної тактики. Хірургічне лікування із застосуванням асоційованого розділення печінки та лігування ворітної вени знижує ризики гострої печінкової недостатності при розширених резекціях печінки у хворих на КРР із білобарним метастатичним ураженням печінки.
 Вступ
Вступ
За даними Національного канцер-реєстру, в Україні колоректальний рак (КРР) посідає 3–4-те місце у структурі смертності від злоякісних новоутворень [1]. Найчастіше органами-мішенями метастатичного ураження при КРР є печінка та легені. У 50% хворих на КРР виявляють метастази в печінці, в ⅓ випадків метастазування в печінку є синхронним з первинною пухлиною. Згідно з даними світових статистичних відомств, 80–90% пацієнтів із IV стадією КРР мають нерезектабельні форми метастатичного ураження печінки [2]. Медіана виживаності таких хворих без хірургічного лікування перебуває в межах 6–12 міс, застосування сучасної хіміотерапії може підвищити виживаність до 19 міс. Активний розвиток гепатобіліарної хірургії дозволив суттєво розширити показання до хірургічного лікування при метастатичному колоректальному раку (мКРР). Упродовж останніх 20 років здійснено суттєвий перегляд критеріїв резектабельності печінки при метастатичному ураженні [3]. На сьогодні такі критерії, як кількість метастазів у печінці, наявність позапечінкового ураження, необхідність резекції великих судин і суміжних органів, є відносними обмеженнями в плануванні оперативного лікування. Основною проблемою печінкової хірургії у цій когорті є брак залишкової паренхіми печінки (ЗПП) при численних білобарних метастазах. Гостра печінкова недостатність залишається одним із найбільших ризиків розвитку ускладнень та смертності в ранній післяопераційний період при розширених (великих) гемігепатектоміях [4]. Однак певних хірургічних успіхів досягнуто в цієї категорії хворих шляхом впровадження методик двоетапних резекцій печінки, а також застосування методів прискорення гіпертрофії ЗПП. Таким чином, безпосередні та віддалені результати хірургічного лікування хворих з великими ураженнями печінки є найбільш дискусійним питанням. Запропоновані новітні методики потребують застосування ресурсів наукових розробок, досвіду хірургів та онкологів з метою оптимізації хірургічного лікування в умовах двоетапних резекцій при мКРР [5].
Об’єкт і методи дослідження
Матеріали досліджень базуються на вивченні результатів лікування 125 хворих на метастатичний колоректальний рак із синхронним ураженням печінки (сМ-КРР) (рТ1–4N0–2M1 — при раку ободової кишки та рТ1–3N0–2M1 — при раку прямої кишки), яким виконано одномоментне (група І) чи двоетапне (група ІІ) хірургічне лікування за період із 2008 по 2015 р. на базі науково-дослідного відділення пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку. Ця робота має характер проспективного одноцентрового рандомізованого дослідження.
У групах порівняння всі хворі отримували сумарно 6 курсів поліхіміотерапії (ПХТ) у режимі FOLFOX-6. У пацієнтів із раком прямої кишки проводили передопераційну променеву терапію на ділянку первинної пухлини прямої кишки (2,0 Гр × 15 разів). У випадку прогресування захворювання на фоні проведення хіміотерапії резекцію печінки пацієнтам групи ІІ не виконували.
Протоколи хірургічного лікування хворих з ураженнями товстої кишки та печінки описано нами в попередніх публікаціях [6, 7].
Результати та їх обговорення
Порівняння ефективності одномоментного та двоетапного хірургічного підходу при сМ-КРР
Серед 125 пацієнтів, включених у дослідження, чоловіків було 71 (56,8%), а жінок — 54 (43,2%). Вік контингенту коливався в діапазоні від 27 до 73 років та становив у середньому 55±0,43 року. Групи порівняння не мали статистично значущої різниці за віковим показником (p=0,85). Групи також не відрізнялися за статевим розподілом: чоловіків — 36 (58,1%) та 35 (55,6%), а жінок — 26 (41,9%) і 28 (44,4%) у групах І та ІІ відповідно (p=0,85).
Середній вік чоловіків становив 55,5±0,76 та 55,8±0,77 року у групах І та ІІ відповідно, тоді як серед жінок цей показник перебував у межах 58,5±0,88 і 54±0,19 року відповідно для груп І та ІІ.
Групи порівняння були репрезентативними за поширеністю онкологічного процесу. Усі хворі на сМ-КРР мали IV стадію раку, у більшості пацієнтів первинні пухлини інфільтрували субсерозну оболонку стінки кишечнику без інвазії у суміжні органи чи структури (Т3) — 29 (46,8%) та 30 (47,6%) (р=0,87) або поширювалися за межі серозної оболонки кишечнику (Т4) — 24 (38,7%) та 27 (42,8%) відповідно для груп І та ІІ (р=0,76). Первинні пухлини Т1–2 виявили у 9 (14,5%) та 6 (9,5%) пацієнтів у групах І та ІІ відповідно (р=0,77). У групі І ураження регіонарних лімфатичних вузлів (pN1 та pN2) зареєстровано відповідно у 24 (38,7%) та 6 (9,7%) пацієнтів. Ці дані статистично не відрізнялися від результатів у групі ІІ — 29 (46,0%) та 10 (15,8%) відповідно для pN1 (р=0,55) та pN2 (р=0,72).
Під час проходження хіміотерапії у пацієнтів зареєстровано прогресування хвороби, зокрема в групі І — у 19 (30,6) хворих. У групі ІІ відмічали подібну тенденцію до прогресування пухлинного процесу в осіб, які перенесли резекцію товстого кишечнику та проходили неоад’ювантну ПХТ (n=15; 23,8%). Однак у групі ІІ прогресування на фоні проведення ад’ювантної ПХТ констатували достовірно рідше — у 2 (3,2%) пацієнтів (p<0,001). Таким чином, у групах І та ІІ зареєстровано достовірну різницю за показником повного завершення запланованого хірургічного лікування — у 62 (100%) та 48 (76,2%) відповідно (р<0,001).
Аналіз хірургічного лікування в групах виявив достовірну різницю за кількістю виконаних великих резекцій печінки (видалення ≥3 сегментів) — 23 (37,2%) та 29 (60,4%) у групах І та ІІ відповідно (р=0,03). Однак попарне зіставлення за типом оперативного втручання не виявило відмінностей між групами. Зокрема в групі ІІ було виконано більше нестандартних трисегментектомій — 5 (10,4%), тоді як у групі І — 3 (4,8%) (р=0,3). Також у групі двоетапних резекцій виконали 2 (4,2%) резекції 2 центральних секцій (мезогепатектомії), тоді як у групі І таких операцій не проводили взагалі (р=0,1). Розширені правобічні гемігепатектомії виконували у 10 (16,2%) та 15 (31,3%) випадках відповідно в групах І та ІІ (р=0,06).
Сумарний рівень післяопераційних ускладнень, зареєстрованих за 30-денний період, становив 30,6 та 25,0% у хворих груп І та ІІ відповідно (р=0,51) (табл. 1). Варто відзначити, що серед усіх ускладнень найбільш загрозливою була недостатність швів товстокишкового анастомозу — у 3 (4,8%) випадках у І групі, а в групі ІІ її не зареєстровано (р=0,12). За шкалою Clavien — Dindo групи І та ІІ не мали достовірної різниці за ступенем тяжкості післяопераційних ускладнень — у більшості хворих виявлено ІІІа ступінь (р=0,56).
Таблиця 1. Результати хірургічного лікування хворих на сМ-КРР, які отримували комбіновані (І група) та двоетапні (ІІ група) резекції з приводу сМ-КРР (категоріальні змінні представлено з відповідними відсотковими значеннями)
| Показник | Усього хворих(n=110) | Група I(n=62) | Група II(n=48) | р | |||
| n | % | n | % | n | % | ||
| Статус країв резекції печінки | |||||||
| R0 | 106 | 96,4 | 59 | 95,2 | 47 | 97,9 | 0,45 |
| R1 | 4 | 3,6 | 3 | 4,8 | 1 | 2,1 | 0,45 |
| Усі післяопераційні ускладнення | 31 | 28,2 | 19 | 30,6 | 12 | 25,0 | 0,51 |
| Абсцес черевної порожнини чи малого таза |
4 | 3,6 | 2 | 3,2 | 2 | 4,2 | 0,8 |
| Недостатність товстокишкового анастомозу |
3 | 2,7 | 3 | 4,8 | − | − | 0,12 |
| Гостра печінкова недостатність | 10 | 9,2 | 7 | 11,3 | 3 | 6,2 | 0,36 |
| Рідинні відмежування черевної порожнини чи малого таза | 11 | 10,0 | 5 | 8,1 | 6 | 12,5 | 0,44 |
| Інші | 3 | 2,7 | 2 | 3,2 | 1 | 2,1 | 0,7 |
| Післяопераційна летальність | 4 | 3,6 | 3 | 4,8 | 1 | 2,1 | 0,45 |
| Рівень післяопераційних ускладнень за шкалою Clavien — Dindo | |||||||
| Grade II | 5 | 4,5 | 3 | 4,8 | 2 | 4,2 | 0,8 |
| Grade IIIa | 15 | 13,6 | 7 | 11,3 | 8 | 16,7 | 0,4 |
| Grade IIIb | 5 | 4,5 | 4 | 6,5 | 1 | 2,1 | 0,3 |
| Grade IVa | 6 | 5,5 | 5 | 8,1 | 1 | 2,1 | 0,2 |
| Grade V (смерть) | 4 | 3,6 | 3 | 4,8 | 1 | 2,1 | 0,4 |
У ІІ групі враховано результати лікування 48 пацієнтів, які завершили обидва хірургічні етапи.
На момент проведення аналізу нашого дослідження загальна 5-річна кумулятивна виживаність хворих на сМ-КРР, які перенесли R0-резекцію з приводу первинної пухлини та синхронних метастазів у печінці, становила 42 та 35% відповідно для груп І та ІІ (p=0,73) (рис. 1).
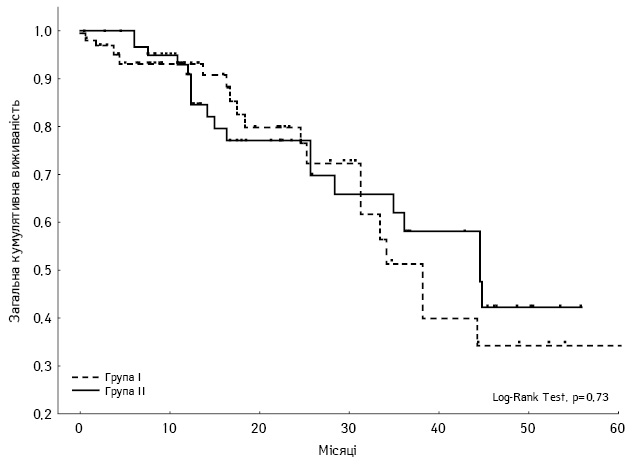
Рис. 1. Загальна 5-річна кумулятивна виживаність хворих на сМ-КРР у групах І та ІІ (Log-Rank Test, p=0,73)
Отже, опрацьовані нами найновіші світові та вітчизняні наукові праці показали, що близько 50% хворих із резектабельними формами КРР мають синхронні віддалені метастази в печінці [8]. Класичний підхід із використанням відстроченої резекції печінки після резекції первинної пухлини сМ-КРР з метою застосування тривалої хіміотерапії піддали сумніву через високу гепатотоксичність препаратів платини та іринотекану, які входять до складу режимів ПХТ. Крім того, не отримано доказів І рівня про ефективність неоад’ювантної ПХТ перед резекцією печінки у хворих з резектабельними формами сМ-КРР.
Останніми роками в більшості країн світу прагнуть зменшити витрати на охорону здоров’я, що, у свою чергу, також є своєрідним стимулом до відмови від традиційного двоетапного підходу до хірургічного лікування хворих із резектабельними формами сМ-КРР. Тому на сьогодні вкрай актуальним питанням є оцінка можливості та показань до одномоментних резекцій у хворих із сМ-КРР з метою оптимізації хірургічних алгоритмів лікування та досягнення максимального економічного ефекту. Отримані результати власних досліджень підтверджуються широкомасштабним метааналізом останніх років [9], а рівень післяопераційних ускладнень та смертності є зіставним з референтними значеннями відомих хірургічних центрів світу [10–12].
Результати двоетапних резекцій печінки (асоційоване розділення печінки та лігування ворітної вени — АРП-ЛВВ)
Вікова медіана групи АРП-ЛВВ (n=3) становила 60 років. Медіана часового проміжку між хірургічними етапами АРП-ЛВВ — 10±1 добу. Характеристику хірургічних втручань у хворих із двоетапними резекціями печінки подано в табл. 2. У 2 клінічних випадках виконано класичну двоетапну резекцію АРП-ЛВВ, а в 1 — з приводу сМ-КРР — комбіновану резекцію сигмоподібної кишки із розширеною правобічною гемігепатектомією на Sg 4b. У жодному клінічному випадку після 1-го та 2-го етапів при АРП-ЛВВ не зареєстровано гострої печінкової недостатності.
Таблиця 2. Характеристика хірургічних втручань при АРП-ЛВВ
| Пацієнти | Обсяг резекції | Частка ЗПП, % |
Частка гіпертрофії ЗПП, % |
Інтервал між етапами АРП-ЛВВ, діб |
| 1-й | Комбінована резекція сигмоподібної кишки із правобічною гемігепатектомією, розширеною на Sg 4 | 30 | 68 | 11 |
| 2-й | Розширена правобічна гемігепатектомія на Sg 4 | 38 | 54 | 9 |
| 3-й | Розширена правобічна гемігепатектомія на Sg 4, тотальна каудальна лобектомія (Sg 1) | 15 | 86 | 10 |
У дослідженні, проведеному H.J. Schlitt та співавторами [13], дотримувалися 8–10-денного інтервалу перед виконанням 2-го етапу з видалення ураженої частки печінки, а інші дослідники витримували 7 [5] чи 12 [9] діб між етапами резекції. Ми застосовували 9–11-денну перерву між завершенням 1-го та початком 2-го хірургічного етапу резекції печінки. На момент проведення аналізу було успішно виконано 3 резекції печінки з АРП-ЛВВ, в одному клінічному випадку об’єм ЗПП становив 15%, у інших хворих — ≥30%. Медіана відсоткових часток гіпертрофії у хворих групи АРП-ЛВВ становила 68%. У деяких дослідженнях автори демонструють можливість виконання атипових резекцій ЗПП при АРП-ЛВВ з приводу білобарних метастазів, однак ми не проводили таких операцій.
Здійснено аналіз найближчих і віддалених результатів лікування. Медіана спостереження за пацієнтами групи АРП-ЛВВ становила 10±2,5 міс. Ми не зареєстрували смертності в 30-денний післяопераційний період і не виявили ускладнень, які могли б загрожувати життю. У групі АРП-ЛВВ у 2 хворих діагностовано правобічний реактивний плеврит і рідинне відмежування в зоні резекції печінки, які усували консервативним шляхом. При АРП-ЛВВ медіана перебування хворих на стаціонарному лікуванні становила 25±5 ліжко-днів.
На рис. 2 продемонстровано клінічний випадок пацієнтки К., 60 років, яка була госпіталізована з діагнозом: Cr сигмоподібної кишки pT4pN1M0, G2, комбіноване лікування (2013 р.), prolongacio morbi (mts hepar Sg 14b, 5–8); 6 курсів ПХТ (FOLFOX-6, ефект — стабілізація), ІІ клінічна група. За даними спіральної комп’ютерної томографії (СКТ)-волюметрії та магнітно-резонансної томографії, у хворої були множинні метахронні вогнища в правій частці печінки, одне з яких поширювалося на Sg 4b; також виявлено метастаз в Sg 1 (рис. 2, а). Пацієнтці запланували двоетапну з АРП-ЛВВ резекцію печінки, об’єм ЗПП становив близько 15%. Хвора успішно перенесла обидва етапи хірургічного лікування (рис. 2, б). Обсяг оперативного втручання включав розширену правобічну гемігепатектомію з атиповою резекцією Sg 4b і тотальну каудальну лобектомію (Sg 1). За даними СКТ-волюметрії, на 9-ту добу після першого етапу АРП-ЛВВ вдалося досягти 86% гіпертрофії ЗПП (Sg 2, 3, культя Sg 4) (рис. 2, в).
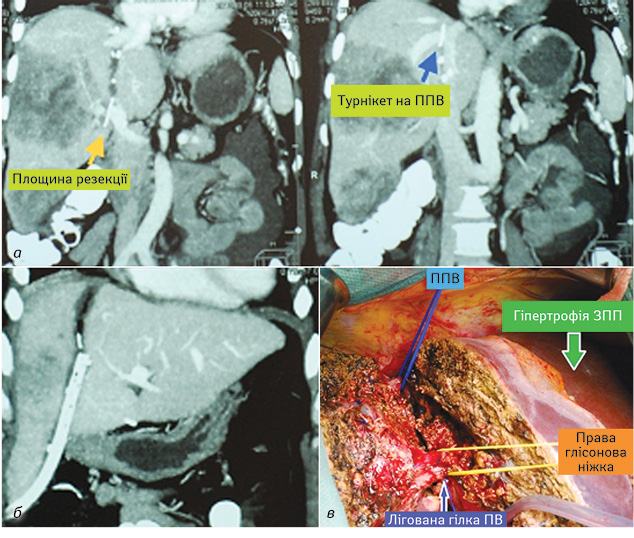
Рис. 2. Хвора К., 60 років: а) СКТ на 9-ту добу після 1-го етапу АРП-ЛВВ; б) вигляд операційного поля під час 2-го етапу АРП-ЛВВ (розширена правобічна гемігепатектомія на Sg 4, тотальна каудальна лобектомія (Sg1)); в) гіпертрофія ЗПП становила 86% від свого початкового об’єму. ПВ — портальна вена; ППВ — права печінкова вена
Отже, завдяки новітній хірургічній тактиці з використанням АРП-ЛВВ зменшується частка пацієнтів, які раніше не підлягали хірургічному лікуванню. Ми переконані, що підвищені ризики, пов’язані з технічною складністю виконання АРП-ЛВВ, є допустимими у зв’язку зі збільшенням кількості хворих на мКРР, у яких виконали видалення метастатичних вогнищ у печінці.
Висновки
Резекція печінки при сМ-КРР залишається єдиним методом, який дозволяє достовірно покращити віддалені результати лікування хворих на мКРР, незалежно від хірургічної тактики.
Хірургічне лікування із застосуванням АРП-ЛВВ знижує ризики гострої печінкової недостатності при розширених резекціях печінки у хворих на КРР із білобарним метастатичним ураженням печінки.
Список використаної літератури
1. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2013) Рак в Україні, 2011–2012. Захворюваність, смертність, показники діяльності онкологічної служби. Під ред. І.Б. Щепотіна. Бюл. Нац. канцер-реєстру України, 14: 124 с.
2. NCCN Guidelines colon cancer. Version 2.2015 (http://www.tri-kobe.org/nccn/guideli-
ne/colorectal/english/colon.pdf).
3. Adams R.B., Aloia T.A., Loyer E. et al. (2013) Selection for hepatic resection of colorectal liver metastases: expert consensus statement. HPB (Oxford), 15: 91–103.
4. Rahbari N.N., Garden O.J., Padbury R. et al. (2011) Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery, 149: 713–724.
5. Knoefel W.T., Gabor I., Rehders A. et al. (2013) In situ liver transection with portal vein ligation for rapid growth of the future liver remnant in two-stage liver resection. Br. J. Surg., 100: 388–394.
6. Щепотин И.Б., Колесник Е.А., Лукашенко А.В. и др. (2014) Хирургическое лечение метастатического рака прямой кишки с синхронным поражением печени. Клин. онкол., 1 (13): 6–11.
7. Щепотін І.Б., Колеснік О.О., Лукашенко А.В. та ін. (2014) Поєднання in-situ розділення печінки та лігування ворітної вени у хворих на колоректальний рак з метастатичним ураженням печінки. Клін. хірургія, 11: 8–13.
8. Minagawa M., Yamamoto J., Miwa S. et al. (2006) Selection criteria for simultaneous resection in patients with synchronous liver metastasis. Arch. Surg., 141: 1006–1012.
9. Reddy S.K., Pawlik T.M., Zorzi D. et al. (2008) Simultaneous resections of colorectal cancer and synchronous liver metastases: a multi-institutional analysis. An. Surg. Oncol., 14(12): 3481–3491.
10. Thelen A., Jonas S., Benckert C. et al. (2007) Simultaneous versus staged liver resection of synchronous liver metastases from colorectal cancer. Int. J. Colorectal. Dis., 22(10): 1269–1276.
11. Adam R. (2007) Colorectal cancer with synchronous liver metastases. Br. J. Surg., 94: 129–131.
12. Nordlinger B., Guiguet M., Vaillant J.C. et al. (1996) Surgical resection of colorectal carcinoma metastases to the liver: a prognostic scoring system to improve case selection, based on 1568 patients. Cancer, 77: 1254–62.
13. Schlitt H.J., Schnitzbauer A.A., Lang S.A., Lang H. (2013) The ALPPS procedure for extended indications in liver surgery: an old finding applied in surgical oncology. Ann. Surg., 257(6): 27.
Опыт выполнения резекций печени у больных метастатическим колоректальным раком
Национальный институт рака, Киев
Резюме. Медиана выживаемости больных колоректальным раком с синхронным метастатическим поражением печени (сМ-КРР) без хирургического лечения находится в пределах 6–12 мес, применение современной химиотерапии может повысить выживаемость до 19 мес. До сих пор остается дискуссионным алгоритм лечения пациентов с данной патологией, в том числе эффективность и безопасность одномоментных и двухэтапных резекций по поводу первичной опухоли и отдаленных синхронных метастазов. Материалы исследований базируются на изучении результатов лечения 125 больных сМ-КРР (рТ1–4N0–2M1 — при раке ободочной кишки и рТ1–3N0–2M1 — при раке прямой кишки), которым выполнено одномоментное (группа I) или двухэтапное (группа II) хирургическое лечение за период с 2008 по 2015 г. на базе научно-исследовательского отделения опухолей органов брюшной полости и забрюшинного пространства Национального института рака. Суммарный уровень послеоперационных осложнений, зарегистрированных за 30-дневный период, составил 30,6 и 25,0% у пациентов групп I и II соответственно (р=0,51). Общая 5-летняя кумулятивная выживаемость больных сМ-КРР, перенесших R0-резекцию по поводу первичной опухоли и синхронных метастазов в печени, составила 42 и 35% соответственно для групп I и II (p=0,73). Медиана гипертрофии участков остаточной паренхимы печени у больных группы ассоциированного разделения печени и лигирования воротной вены составила 68%. Резекция печени при сМ-КРР остается единственным методом, который позволяет достоверно улучшить отдаленные результаты лечения пациентов с метастатическим КРР, независимо от хирургической тактики. Хирургическое лечение с применением ассоциированного разделения печени и лигирования воротной вены снижает риск острой печеночной недостаточности при расширенных резекциях печени у больных КРР с билобарным метастатическим поражением печени.
метастатический колоректальный рак, in situ split, синхронные метастазы, двухэтапные резекции печени.
Адреса:
Бурлака Антон Анатолійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: nir.burlaka@gmail.com














Leave a comment