Прогностична роль PD-L-лігандів при лімфомі Ходжкіна
Новосад О.І., Скрипець Т.В., Скачкова О.В., Храновська Н.М., Крячок І.А.
Резюме. Дослідження імунотерапії при онкологічних захворюваннях проводяться протягом останніх 20 років. Існує система інгібіторних механізмів — чекпоїнтів (англ. checkpoints), які впливають на активацію імунної відповіді. Оскільки більшість чекпоїнтів функціонують за рахунок взаємодії ліганд — рецептор, головною стратегією протипухлинної терапії є використання нових моноклональних антитіл. За останні роки в цьому напрямі досягнуто значних результатів. Рецептор запрограмованої смерті 1 (PD-1) та його ліганди (PD-L1/2) відіграють важливу роль у пухлино-індукованій імунній супресії та високо оцінені щодо використання їх в розробці імунотерапевтичних препаратів.

Вступ
Імунотерапевтичні підходи до лікування пацієнтів з онкологічними захворюваннями поглиблено досліджуються протягом останніх років у різних вузьких напрямах. Таке поняття, як сигнальні шляхи, включає рецептор запрограмованої смерті 1 (programmed cell death 1 — PD-1) та його ліганди (PD-L1/2), які відіграють важливу роль у пухлино-індукованій імунній супресії та високо оцінені щодо використання їх в розробці імунотерапевтичних препаратів [1].
Відомо, що PD-L1 і PD-L2 здатні інгібувати проліферацію Т-клітин, викликати їх апоптоз чи анергію, пригнічувати продукцію цитокінів і хемокінів. Вважають, що PD-L2 контролює активацію Т-клітин у лімфоїдних органах та експресується лише на активованих макрофагах і дендритних клітинах, тоді як PD-L1 міститься на макрофагах, дендритних клітинах, ендотеліальних клітинах серця, β-клітинах підшлункової залози, гліальних клітинах та пригнічує функцію периферичних Т-клітин. PD-1-механізм деактивації Т-лімфоцитів полягає у підвищеному синтезі білків клітиною пухлини, які зв’язуються із рецепторами PD-1 на поверхні Т-лімфоцитів та запускають процес деактивації імунної системи. Також PD-l експресується не лише на активованих Т-клітинах, а й на В-клітинах і на клітинах мієлоїдного ряду, що свідчить про ширший спектр функцій у регуляції роботи імунної системи [2]. Багато досліджень демонструють та пов’язують функцію цих рецепторів з імунологічною толерантністю. Інгібітори рецептора PD-1 сприяють розвитку потужної імунної відповіді за рахунок Т-лімфоцитів та знищенню пухлини.
Перші клінічні дослідження препарату MDX-1106, який пізніше отримав назву ніволумаб, розпочалися у 2010 р. [3]. У I фазі дослідження взяли участь 39 пацієнтів із колоректальним раком, раком передміхурової залози та нирки, метастатичною меланомою, недрібноклітинним раком легені. Уже на цьому етапі інгібітори PD-l показали значний протипухлинний ефект та безпечний профіль застосування. Для деяких солідних пухлин та гемобластозів гіперекспресія PD-L1 асоціюється з несприятливим прогнозом перебігу захворювання, зокрема резистентністю до лікування та швидким прогресуванням хвороби [4, 5].
Пухлини, які експресують PD-L1, частіше за все агресивні та мають несприятливий прогноз перебігу патологічного процесу. Анти-PD-1 і анти-PD-L1-агенти мають хороший профіль безпеки і, як результат, сприяють тривалій відповіді при різних формах раку, в тому числі меланомі, раку нирки і раку легені, навіть після припинення лікування. Роль цих агентів наразі оцінюється, особливо при гемобластозах, окремо або в комбінації з іншими методами лікування, як інгібіторів, так і у вигляді таргетної або цитотоксичної хіміотерапії [6–9].
Основне завдання при проведенні терапії з приводу онкогематологічних захворювань — досягнути гарної відповіді та довготривалої ремісії за умов прийнятної ремісії. Пошуки нових можливостей імунотерапії для мінімізації токсичності стали досить популярними в останні роки [10, 11]. Імунотерапія з використанням моноклональних антитіл у терапевтичних протоколах сприяла значному підвищенню загальної виживаності пацієнтів. В-клітинна неходжкінська лімфома стала прикладом успішної концепції імунохіміотерапії. Незважаючи на це, ще досі залишається деяка частка пацієнтів, які є рефрактерними до терапії або у яких діагностують ранній рецидив після проведеної терапії.
PD-1/PD-L1 патогенетичні шляхи беруть участь у розвитку імунної депресії в злоякісних пухлинах, тому вважаються перспективними терапевтичними мішенями. Проведені клінічні дослідження показали, що біомаркер PD-1 може бути предиктором відповіді на анти-PD-1/PD-L1-терапію при різних онкологічних захворюваннях, а також стати новою стратегією для покращення результатів лікування, тому багато науковців із нетерпінням очікують подальших результатів завершених і поточних досліджень.
Об’єкт і методи дослідження
В основу роботи покладено аналіз безпосередніх та віддалених результатів комплексного лікування 49 хворих на лімфому Ходжкіна (ЛХ), які перебували на лікуванні у відділенні хіміотерапії гемобластозів Національного інституту раку. Діагнози пацієнтів верифіковано за даними морфологічного, цитологічного, імуногістохімічного досліджень біопсійного матеріалу лімфатичних вузлів або іншого вогнища ураження за Міжнародною клініко-морфологічною класифікацією Всесвітньої організації охорони здоров’я (2008).
Методика визначення рівня експресії PD-L-лігандів. Для стабілізації РНК біоптату поміщали в мікропробірки, які містять 0,3 мл RNA-later («Ambion», США). Матеріал, призначений для виділення РНК, зберігали при температурі 2–8 °С протягом 1 доби, після чого його використовували або зберігали при −70 °С довготривало.
Для виділення тотальної РНК із дендритних клітин методом кислотно-фенольної екстракції використовували тест-набір для полімеразної ланцюгової реакції (ПЛР) «Рибо-золь» («Амплисенс», Росія). Для роботи з РНК використовували одноразові стерильні пластикові матеріали, які мають спеціальні маркування «RNase-free», «DNase-free». Отриманий зразок РНК готовий до обробки ДНКазою та проведення реакції зворотної транскрипції. Обробка виділеної РНК ДНКазою необхідна для позбавлення від геномної ДНК, яка може бути джерелом хибних результатів. Для обробки виділеної РНК ДНКазою використовували реактиви DNase, DNase-buffer («Ambion», США) та IRNase-inhibitor («Applied Bіosystems», США), проводили за протоколом виробника. Концентрацію РНК визначали методом спектрофотометрії за допомогою спектрофотометра Nano Drop 1000 («Thermo Fisher Scientific», США) та доводили зразок РНК до концентрації 200 нг/мкл.
Після цього РНК була готова до реакції зворотної транскрипції.
Для проведення реакції зворотної транскрипції використовували ПЛР-тест-набір «Реверта-L-100» («Амплисенс», Росія). Отриману в результаті реакції зворотної транскрипції комплементарну ДНК (кДНК) для наступного виконання ПЛР розводили в 2 рази ДНК-буфером (до 20 мкл розчину кДНК додають 20 мкл ДНК-буфера). кДНК може зберігатися протягом 2–3 тиж при температурі 4 °С, до 1 року при температурі −20 °С та довготривало при температурі −70 °С. Використаний пластиковий посуд (пробірки, наконечники) знезаражували в спеціальному контейнері, який містить дезінфікуючий 5% розчин хлораміну або 1Н розчин соляної кислоти.
Рівень експресії генів мембранних білків визначали за допомогою методу кількісної ПЛР з детекцією результатів у режимі реального часу на приладі 7500 Real-Time PCR Systems («Applied Bіosystems», США) з використанням специфічних праймерів та асиметричного ціанінового катіонного флюорохрому SYBRGreen (С32Н37N4S) з піком поглинання λmax=488 нм та флюоресценції λmax=522 нм, який має високу афінність до дволанцюгової ДНК. SYBRGreen, що міститься у розчині ПЛР, зв’язується з дволанцюговою ДНК, тим самим підвищуючи рівень флюоресценції пропорційно до накопичення продукту ПЛР.
Послідовності праймерів були підібрані з використанням програми Primer Express Software v3.0 фірми «Applied Bіosystems» (США) та синтезовані фірмою «Applied Bіosystems» (США). Послідовність праймерів для PDL-1: прямий праймер — TCAATGCCCCATACAACAAA, зворотний праймер –TGCTTGTCCAGATGACTTCG; PDL-2: прямий праймер — GTACATAATAGAGCATGGCAGCA, зворотний праймер — CACCTTTTGCAAACTGGCTGT.
Для проведення ПЛР використовували такий температурний режим:
- 2 хв при температурі 50 °C;
- ампліфікація: початок ампліфікації при температурі 94 °С — 8 хв, накопичення ампліфікаційного продукту протягом 45 циклів при температурі 94 °С — 15 с, 55 °С — 15 с, 72 °С — 30 с;
- дисоціація (розділення отриманих продуктів за температурою плавлення): при температурі 95 °С — 15 с, 60 °С — 30 с, 95 °С — 15 с.
Для контролю рівня експресії мРНК досліджуваних цитокінів та хемокінів вимірювали експресію мРНК гліцеральдегід-3-фосфатдегідрогенази (GAPDH). Після закінчення реакції ампліфікації проводили облік одержаних результатів згідно з рекомендаціями фірми — виробника приладу. Рівень експресії генів цитокінів оцінювали за допомогою методу ΔΔCt з нормуванням щодо експресії контрольного гена.
Результати
Дослідна група становила 49 хворих на ЛХ, які перебували на лікуванні у відділенні хіміотерапії гемобластозів Національного інституту раку, серед них 28 (57,1%) жінок та 21 (42,9%) чоловік. Вік пацієнтів коливався від 18 до 64 років (у середньому 32,8±8,9 року).
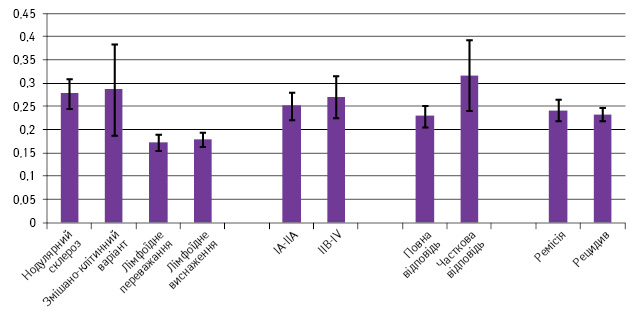
Пацієнтів розподілено за стадіями захворювання таким чином: ІА–IIA та III–IV стадії — верифіковано по 23 випадки, IIB стадія — діагностовано лише у 3 хворих.
За морфологічним варіантом ЛХ переважав нодулярний склероз — 18 (36,7%) випадків, змішаноклітинний варіант діагностовано у 8 (16,3%) пацієнтів, лімфоїдне виснаження — у 3 (6,1%) хворих, лімфоїдне переважання — у 5 (10,2%) випадках, не встановлено варіанта — у 15 (30,6%) пацієнтів.
Пацієнти отримали лікування за схемами ABVD або BEACOPP-14/esc як терапію першої лінії та променеву терапію.
Серед 49 пацієнтів із ЛХ рівень загальної відповіді на терапію першої лінії становив 93,9% (n=47). Повної та часткової відповіді досягли у 73,5% (n=36) та 22,4% (n=11) хворих відповідно (р>0,05). Прогресування захворювання після терапії зареєстровано у 4,0% (n=2) пацієнтів. Серед пацієнтів, які досягли повної відповіді, рецидив захворювання зареєстровано у 25,0% (n=9) випадків (діапазон спостереження становив 12–36 міс; медіана — 24 міс).
Встановлено, що рівень експресії PD-L1 значно вищий при варіанті нодулярного склерозу ЛХ та у пацієнтів із пізніми стадіями захворювання (p=0,12) (рис. 1).
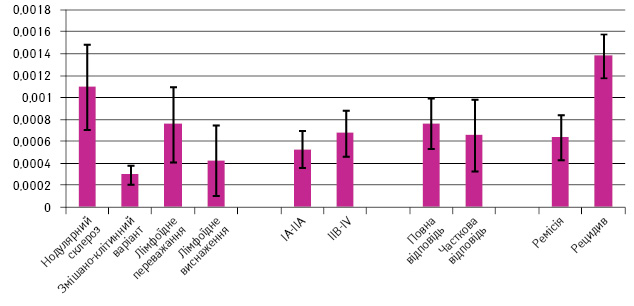
У 26,5% хворих на ЛХ не виявлено експресії PD-L1.
За результатами дослідження не виявлено залежності рівня експресії PD-L2 від гістологічного варіанта ЛХ, стадії захворювання та прогнозу (рис. 2).
ROC-аналіз показав, що експресія PD-L1 у пухлині — це важливий маркер, який асоціюється з клінічним прогнозом перебігу захворювання для пацієнтів із ЛХ (Se=87,5%; Sp=64,5%; AUC=0,75; p=0,002). Виявлено, що висока експресія PD-L1 впливає на рівень безрецидивної виживаності у пацієнтів із ЛХ. Трирічна безрецидивна виживаність у хворих з високою та низькою (або взагалі відсутньою) експресією PD-L1 становила 66,6% проти 85,1% відповідно (р<0,0054).
Висновки
Отримані дані дозволяють стверджувати, що високу експресію маркера PD-L1 слід вважати додатковим фактором ризику несприятливого перебігу ЛХ. Дотепер біомаркери не враховували як прогностичні критерії при визначенні групи ризику при ЛХ, однак отримані дані свідчать про доцільність включення характеристик пухлини як нових факторів для оцінки прогнозу перебігу захворювання.
Список використаної літератури
1. Disis M.L. (2010) Immune regulation of cancer. J. Clin. Oncol., 28(29): 4531–4538.
2. Greenwald R.J., Freeman G.J., Sharpe A.H. (2005) The B7 family revisited. Annu. Rev. Immunol., 23: 515–548.
3. Brahmer J.R. (2010) Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates. J. Clin. Oncol., 28(19): 3167–3175.
4. Thompson R.H., Dong H., Lohse C.M. et al. (2007) PD-1 is expressed by tumor-infiltrating immune cells and is associated with poor outcome for patients with renal cell carcinoma. Clin. Cancer Res., 13(6): 1757–1761.
5. Muenst S., Schaerli A.R., Gao F. et al. (2014) Expression of programmed death ligand 1 (PD-L1) is associated with poor prognosis in human breast cancer. Breast Cancer Res. Treat., 146(1): 15–24.
6. Vesely M.D., Kershaw M.H., Schreiber R.D. et al. (2011) Natural innate and daptive immunity to cancer. Annu. Rev. Immunol., 29: 235–271.
7. Dunn G.P., Bruce A.T., Ikeda H. et al. (2002) Cancer immunoediting: from immunosurveillance to tumor escape. Nat. Immunol., 3(11): 991–998.
8. Drake C.G., Jaffee E., Pardoll D.M. (2006) Mechanisms of immune evasion by tumors. Adv. Immunol., 90: 51–81.
9. Dong H., Strome S.E., Salomao D.R. et al. (2002) Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat. Med., 8(8): 793–800.
10. Francisco L.M., Sage P.T., Sharpe A.H. (2010) The PD-1 pathway in tolerance and autoimmunity. Immunol. Rev., 236: 219–242.
11. Thompson R.H., Dong H., Lohse C.M. et al. (2007) PD-1 is expressed by tumor infiltrating immune cells and is associated with poor outcome for patients with renal cell carcinoma. Clin. Cancer Res., 13(6): 1757–1761.
Прогностическая роль PD-L-лигандов при лимфоме Ходжкина
Национальный институт рака, Киев
Резюме. Исследования иммунотерапии при онкологических заболеваний проводятся на протяжении последних 20 лет. Существует система ингибиторных механизмов — чекпоинтов (англ. checkpoints), которые влияют на активацию иммунного ответа. Так как большинство чекпоинтов функционируют за счет взаимодействия лиганд — рецептор, главной стратегией противоопухолевой терапии является использование новых моноклональных антител. Рецептор запрограммированной смерти 1 (PD-1) и его лиганды (PD-L1/2) играют значительную роль в опухоль-индуцированной иммунной супрессии и высоко оценены в использовании их для разработки новых иммунотерапевтических препаратов.
лимфома Ходжкина, PD-L-лиганды, прогноз.
Адреса:
Новосад Ольга Ігорівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-10-90
E-mail: novosad.o.ua@gmail.com














Leave a comment