Покращення якості життя хворих на рак грудної залози, які отримують антрациклінвмісну поліхіміотерапію
Аскольський А.В., Сивак Л.А., Шевчук Л.А., Майданевич Н.М., Верьовкіна Н.О.
Резюме. Відомо, що застосування доксорубіцину асоціюється з ризиком пошкодження міокарда, порушенням діастолічної та систолічної функції лівого шлуночка і, відповідно, погіршенням якості життя пацієнтів. У рекомендаціях Європейського товариства кардіологів (ESС) допускається можливість застосування інгібіторів ангіотензинперетворювального ферменту (АПФ) і блокаторів бета-адренорецепторів для профілактики кардіотоксичності доксорубіцину. Мета дослідження полягала в покращенні якості життя хворих на рак грудної залози, які отримують антрациклінвмісну поліхіміотерапію (ПХТ), шляхом застосування стандартизованої низькодозової кардіопротекторної терапії інгібіторами АПФ і блокаторами бета-адренорецепторів. У дослідження включено 100 пацієнток, яким показано застосування 6 циклів стандартної антрациклінвмісної ПХТ у рамках комплексного лікування за радикальною програмою. В основну групу увійшли 50 пацієнток, які отримали ПХТ за схемою FАC разом з використанням терапії супроводу (еналаприл 2,5 мг перорально двічі на добу та карведилол 6,25 мг перорально двічі на добу), в контрольну — 50 пацієнток, яким призначили таку саму схему ПХТ, але без терапії супроводу. До початку спеціального лікування, на етапах ПХТ і через 3 міс після останнього циклу у пацієнток обох груп здійснили комплексне обстеження серцево-судинної системи і оцінку якості життя з використанням опитувальника EQ-5D. Встановлено, що якість життя хворих на рак грудної залози, які отримували кардіопротекторну терапію на фоні антрациклінвмісної ПХТ, була кращою на 9,1% порівняно з групою контролю.

Вступ
Остання чверть століття розвитку сучасної медицини пройшла під гаслом забезпечення пацієнту реалізації його прав. Женевська Декларація Всесвітньої медичної асоціації визначає основний постулат лікаря: «Здоров’я мого пацієнта — моя головна турбота», а у Міжнародному кодексі медичної етики зазначено: «Лікар повинен діяти виключно в інтересах хворого, призначаючи лікування, що може негативно вплинути на фізичний та розумовий стан хворого». Відповідно, метою лікарської практики є збереження та відновлення здоров’я людини не тільки у фізичному та психологічному аспектах, а і в соціальному [1].
Всесвітня організація охорони здоров’я (ВООЗ) визначає термін «здоров’я» як стан повного фізичного, психічного та соціального благополуччя. Формулюючи визначення (1957 р.), робоча група експертів ВООЗ мала на увазі якісний стан людського організму, що забезпечує його адекватне функціонування в існуючих соціальних умовах та умовах довкілля. Вищенаведене сприяло впровадженню в сучасні медичні дослідження терміна «якість життя» (ЯЖ), під яким необхідно розуміти (у найзагальніших рисах) здатність кожного індивідуума повноцінно функціонувати в суспільстві відповідно до свого соціального становища та отримувати задоволення від життя [2].
Наразі немає однозначного підходу до оцінки ЯЖ, що включає в себе інтегральний аналіз ефективності лікування за показниками фізичного, емоційного та соціального статусу хворого. N. Wenger і співавтори [3] запропонували характеризувати медичні аспекти ЯЖ, виходячи з трьох компонентів: функціональної здатності, сприйняття свого стану та проявів захворювання. Функціональна здатність — можливість реалізувати соціальну, розумову та емоційну функції, створювати економічну забезпеченість у повсякденному житті. За сприйняттям оцінюються погляди пацієнта та його судження про цінність для нього компонентів функціональної здатності, серед яких першочергове значення мають загальний стан здоров’я, рівень добробуту та задоволення життям. Третьою, безсумнівно важливою, характеристикою ЯЖ є прояви основного захворювання, ускладнень та супутніх патологій, вираженість яких зменшується чи які зникають (змінюються) у результаті застосування лікування.
Існує достатньо розроблених методик оцінки ЯЖ. Найбільш прості та розповсюджені з них — це шкали ВООЗ та Карновського. Перші дослідження впливу захворювань на людину та її професійну діяльність проведено при обстеженні населення в Австралії та Ірландії в 1851–1891 рр. У 1947 р. професор Колумбійського університету (Columbia University), США, D.А. Karnofsky вперше запропонував нефізіологічні методи оцінки параметрів перебігу раку; він проаналізував вплив хіміотерапії на фізичні аспекти ЯЖ неоперабельних хворих онкологічного профілю [4]. Ці дві шкали оцінки ЯЖ є найбільш загальними і не враховують, які ж саме фактори призвели до такого стану цього показника.
Інші методи оцінки ЯЖ мають більш цілеспрямований характер та можуть бути розподілені на неспецифічні (що використовуються незалежно від нозологічної форми захворювання) та специфічні (для обстеження пацієнтів з певною патологією).
Найбільш відомі неспецифічні анкети (опитувальники) для вивчення ЯЖ: «Sickness Impact Profile» («Профіль впливу захворювання»), «Nottingham Health Profile» («Ноттінгемський профіль здоров’я»), «General Well-Being Questionnaire» («Опитувальник оцінки загального благополуччя»), «Overall Quality of Life Scale» («Узагальнена шкала оцінки якості життя»), «Quality of Life Index» («Індекс якості життя») [5].
Специфічні анкети — група спеціальних опитувальників для вивчення ЯЖ. Спеціальні опитувальники сфокусовані на конкретній нозологічній формі. Вони дозволяють зафіксувати зміни в ЯЖ пацієнтів, що виникли за відносно короткий проміжок часу. Такими опитувальниками є: Міннесотський опитувальник «Життя з серцевою недостатністю», «Heart Patients Psychological Questionnaire» («Психологічний опитувальник для кардіологічних хворих»), опитувальник «Якість життя хворих з аритмією», Шкала якості при діабеті (DQOL), 20-Item Asthma Questionnaire (AQ20) — короткий опитувальник для дослідження ЯЖ у хворих на бронхіальну астму.
Наразі створено декілька сотень методик, за якими досліджують різні аспекти ЯЖ, релевантного здоров’ю. З метою систематизації діяльності вивчення ЯЖ в 1995 р. у Франції створено MARI Research Institute, який координує дослідження в цьому напрямі, затверджує розроблені опитувальники і рекомендує їх до застосування. Опитувальники мають відповідати суворим критеріям, повинні бути: універсальними, надійними, чутливими, відтвореними, простими у використанні, стандартизованими, оцінними [6].
Більшість дослідників вважають, що перевага має бути надана специфічним опитувальникам для пацієнтів. Вдалим винятком із цього є опитувальник EORTC-30 для пацієнтів онкологічного профілю з розробленими доповненнями для цілої низки нозологічних форм злоякісних утворень (рак яєчника, грудної залози, шлунка, лімфома Ходжкіна тощо) [7]. Такий підхід до побудови інструмента досліджень має перевагу перед іншими відомими тестами, оскільки поєднує вивчення впливу неспецифічних (характерних для багатьох захворювань) та специфічних проявів хвороби на ЯЖ пацієнтів.
Мета дослідження — покращити ЯЖ хворих на рак грудної залози (РГЗ), які отримують антрациклінвмісну поліхіміотерапію (ПХТ), шляхом застосування стандартизованої низькодозової кардіопротекторної терапії інгібіторами ангіотензинперетворювального ферменту (АПФ) і блокаторами β-адренорецепторів.
Об’єкт і методи дослідження
Для досягнення поставленої мети в дослідження включили 100 жінок із вперше виявленим РГЗ II або ІІІ стадії, яким було показане комплексне лікування за радикальною програмою. Згідно з чинними стандартами Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO), всім пацієнткам призначали стандартну неоад’ювантну та/або ад’ювантну ПХТ, променеву терапію, оперативне лікування, гормонотерапію при люмінальних типах РГЗ. Загалом кожна хвора отримала 6 циклів ПХТ за стандартною схемою FАС (циклофосфамід 500 мг/м2 у перший день циклу внутрішньовенно, доксорубіцин 50 мг/м2 у перший день циклу внутрішньовенно, 5-флуороурацил 500 мг/м2 у перший день циклу внутрішньовенно, інтервал між циклами — 3 тиж). Таким чином, після завершення 6 циклів кумулятивна доза доксорубіцину у всіх пацієнток становила 300 мг/м2. Усім хворим виконано радикальне оперативне лікування (мастектомію або квадрантектомію чи секторальну резекцію з лімфаденектомією) і променеву терапію на гамма-терапевтичному апараті «THERATRON» (сумарна вогнищева доза 40–42 Гр).
Усі хворі до першої процедури надали письмову згоду на участь у дослідженні та пройшли подвійну сліпу рандомізацію 1:1 за методом «конвертів». Рандомізацію здійснювали з урахуванням правої й лівої локалізації РГЗ, зважаючи на різний ушкоджувальний вплив променевої терапії в рамках комплексного лікування. Програма дослідження була схвалена комісією з біоетики Національного інституту раку. Вік пацієнток на момент включення в дослідження становив 30–69 років, середній вік — 52,61±0,8 року.
В основну групу увійшли пацієнтки, які отримали хіміотерапевтичне лікування (неоад’ювантна, ад’ювантна ПХТ) за схемою FАC разом з інгібітором АПФ еналаприлом 2,5 мг перорально двічі на добу та блокатором β-адренорецепторів карведилолом 6,25 мг перорально двічі на добу (n=50), в контрольну — хворі, яким призначили таку саму схему ПХТ, але без терапії супроводу (n=50). Досліджувані препарати застосовували щоденно протягом 3 тиж після кожного циклу ПХТ. Таким чином, терапія супроводу завершувалася через 3 тиж після останнього циклу ПХТ. У періопераційний період, а також під час застосування променевої терапії перелічені лікарські засоби не призначали.
Електрокардіограму (ЕКГ) реєстрували з використанням діагностичного комплексу CARDIO (ТОВ «MIDA», Україна) до початку ПХТ, перед другим, четвертим, шостим циклами і через 3 міс після завершення ПХТ. Здійснювали стандартні вимірювання тривалості інтервалів та амплітуди зубців ЕКГ. Коригований інтервал Q–T оцінювали за формулою Базетта:
QTc = QT/√R−R.
Подовження інтервалу Q–T діагностували у випадку, якщо тривалість Q–Tс перевищувала 460 мс.
Трансторакальну ехокардіографію (ехоКГ) виконували до лікування, перед шостим циклом ПХТ та через 3 міс спостереження за стандартною методикою на ультразвуковому сканері NEMIO XG («Toshiba Medical System Corporation», Японія). Визначали параметри систолічної та діастолічної функції лівого шлуночка. Інтерпретацію показників та діагностику типів діастолічної дисфункції (ДД) лівого шлуночка здійснювали за рекомендаціями робочої групи Європейського кардіологічного товариства (European Society of Cardiology — ESC) [8].
Виявлені кардіоваскулярні побічні ефекти ПХТ оцінювали за шкалою загальних критеріїв оцінки побічних ефектів Common Terminology Criteria for Adverse Events (СTC AE) v. 4.0 [9].
ЯЖ хворих на РГЗ визначали за Європейським опитувальником оцінки якості життя (European Quality of Life Questionnaire — EQ-5D). Анкетування проводили до початку ПХТ та через 3 міс після завершення лікування.
Кожен компонент у версії EQ-5D розділено на 3 рівні залежно від ступеня вираженості показника (відсутність проблеми, незначна проблема або значна проблема). Комбінування рівнів за п’ятьма компонентами дозволяє отримати 243 варіанти «стану здоров’я». Наприклад, відсутність проблем у компонентах «рухливість», «самообслуговування», «активність у повсякденному житті» і наявність незначних проблем у критеріях «біль або дискомфорт», «занепокоєння або депресія» визначаються як унікальний варіант «стану здоров’я» з такими параметрами, які характеризують кожен із п’яти складових.
Отримані дані використано як в рамках індивідуального моніторингу, так і для виявлення відмінностей між групами пацієнтів у нашому дослідженні.
Математичну обробку отриманих результатів виконували з використанням стандартного статистичного пакета STATISTICA 8.0.
Результати дослідження
За результатами клінічного обстеження хворих синусову тахікардію й артеріальну гіпертензію зареєстровано відповідно у 16 і 22% учасниць контрольної групи. Такі зміни не є специфічними проявами кардіотоксичності доксорубіцину і, очевидно, пов’язані з інтоксикаційним синдромом на фоні ПХТ. У пацієнтів основної групи на фоні щоденного застосування терапії супроводу вищезазначені кардіотоксичні прояви ПХТ виникали достовірно (р<0,05) рідше.
Застосування алгоритму кардіопротекторної терапії супроводу асоціювалося в основній групі з достовірно нижчими показниками середніх значень артеріального тиску і частоти серцевих скорочень, ніж у групі контролю (р<0,05). Проте клінічно значущої артеріальної гіпотензії чи брадикардії в основній групі не зафіксовано.
Відповідно до результатів нашого дослідження, частота виникнення на ЕКГ таких патологічних змін, як зменшення амплітуди комплексів QRS, депресія сегмента S–T на 1 мм і більше, поява блокад ніжок пучка Гіса, достовірно не відрізнялася в обох групах, що свідчить про неспецифічний характер цих змін. Більшу увагу приділено вивченню динаміки інтервалу Q–T. Так, у контрольній групі довжина інтервалу Q–Tc збільшувалася з кожним наступним циклом ПХТ, залишаючись у межах норми протягом всього періоду спостереження у 37 (74%) хворих, досягла збільшення I ступеня у 10 (20%) пацієнток і II ступеня — у 3 (6%). Пік подовження інтервалу Q–Tc відмічали через місяць після введення останньої дози доксорубіцину. З огляду на дані кореляційного аналізу та терміни виникнення подовження інтервалу Q–Tc I і II ступеня у 13 (26%) пацієнток можна розглядати як ранні ознаки кардіотоксичності доксорубіцину. В основній групі реєстрували подовження інтервалу Q–Tc лише I ступеня і тільки у 5 (10%) пацієнток, що свідчить про ефективність застосування алгоритму кардіопротекторної терапії.
У нашому дослідженні зменшення фракції викиду лівого шлуночка (ФВЛШ) I ступеня спостерігали лише в однієї пацієнтки контрольної групи, причому воно не супроводжувалося появою клінічних ознак серцевої недостатності. Також не виявлено статично достовірної різниці між середніми значеннями ФВЛШ у пацієнтів обох груп на всіх етапах обстеження. Слід зауважити, що виявлено тенденцію (p=0,07) до зниження ФВЛШ у контрольній групі через 3 міс після введення останньої дози доксорубіцину. Важливе значення мають результати оцінки діастолічної функції серця, зміни якої можуть передувати зниженню ФВЛШ і формуванню клінічних проявів серцевої недостатності. Отримані результати свідчать про виникнення доклінічної ДД серця 1-го типу при малих кумулятивних дозах доксорубіцину через 3 міс після останньої дози препарату. За даними ехоКГ, перед шостим циклом ПХТ у 9 (18%) пацієнток контрольної групи діагностували ДД 1-го типу. Через 3 міс після введення останньої дози доксорубіцину виявлено 6 нових випадків розвитку ДД 1-го типу та підтверджено її наявність у всіх 9 попередньо виявлених. В основній групі встановлено всього 5 (10%) випадків ДД 1-го типу, що свідчить про кардіопротекторний вплив низьких доз еналаприлу і карведилолу.
Отже, за результатами клініко-інструментального обстеження, при застосуванні терапії супроводу в основній групі відмічали значуще зниження частоти виникнення синусової тахікардії, артеріальної гіпертензії, патологічного подовження інтервалу Q–Tc, ДД 1-го типу (табл. 1).
Таблиця 1. Серцево-судинні прояви кардіотоксичності ПХТ в основній і контрольній групах
| Прояви кардіотоксичності ПХТ |
Контрольна група (n=50) |
Основна група (n=50) | p |
| Синусова тахікардія (протягом усього дослідження) | 8 | 2 | <0,05 |
| Артеріальна гіпертензія (протягом усього дослідження) | 11 | 1 | <0,05 |
| Патологічне подовження Q–Tc через 3 міс після ПХТ | 13 | 5 | <0,05 |
| ДД 1-го типу через 3 міс після ПХТ | 15 | 5 | <0,05 |
ЯЖ оцінювали у хворих основної та контрольної груп за відповідями на запитання опитувальника до початку лікування (рис. 1).
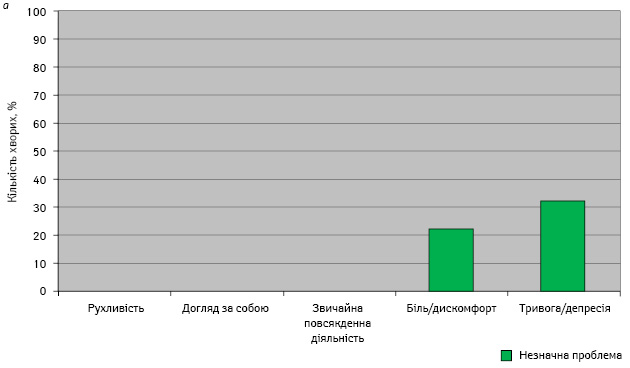
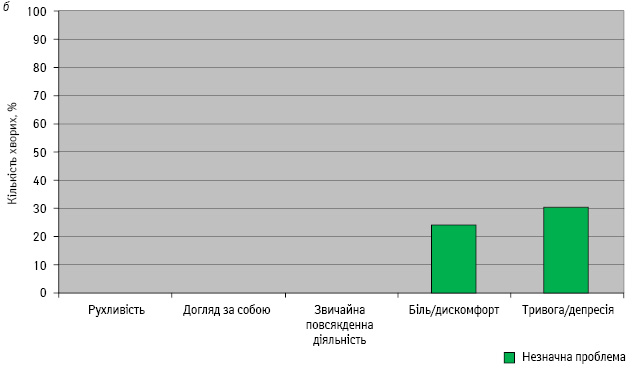
У жодної пацієнтки основної та контрольної груп до лікування рухливість, догляд за собою, звичайна повсякденна діяльність не були порушеними.
Біль та дискомфорт були незначною проблемою у 22% хворих основної та 24% — контрольної групи.
Тривогу та депресію до початку лікування фіксували у 32% пацієнток основної та 30% — контрольної групи.
Характеристику проблем у хворих основної та контрольної груп після завершення лікування подано на рис. 2.
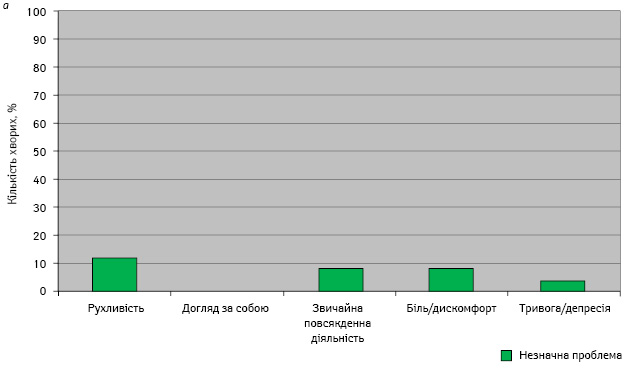
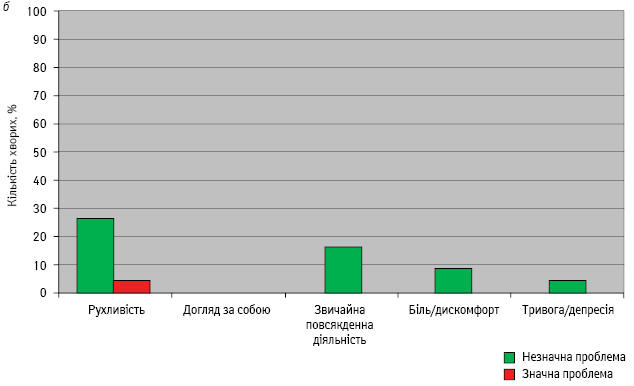
В основній групі після завершення терапії відмічено незначне зниження рухливості у 12% хворих та у 26% пацієнтів — у контрольній групі. Крім того, у 4% учасників контрольної групи зниження рухливості виявилося значною проблемою. Порушення можливості виконання звичайної повсякденної діяльності зафіксували у 8% хворих основної групи та 16% — контрольної. Біль та дискомфорт незначної інтенсивності з однаковою частотою відмічали в обох групах у 8% пацієнток. Тривога та депресія після закінчення лікування розвинулися у 4% хворих основної та контрольної груп.
Значення оцінки загального статусу здоров’я до та після лікування в основній та контрольній групах представлено на рис. 3.
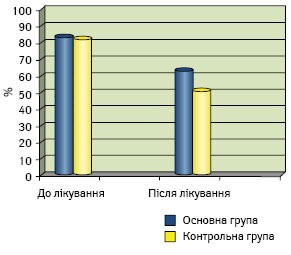
До початку лікування у хворих основної групи кількісна оцінка статусу здоров’я становила 83,2±1,1%, після проведення терапевтичних заходів — 62,5±0,7%. Тоді як у пацієнток контрольної групи кількісна оцінка статусу здоров’я до початку лікування становила 82,1±1,2%, після терапії — 52,3±0,8%. Таким чином, ЯЖ пацієнток основної групи через 3 міс після завершення ПХТ виявилася достовірно (р<0,001) кращою порівняно групою контролю за рахунок менших проблем з рухливістю і повсякденною діяльністю.
Обговорення результатів
ЯЖ пацієнток основної та контрольної груп оцінювали двічі (до лікування та через 3 міс після введення останньої дози доксорубіцину) за допомогою опитувальника EQ-5D. Цей опитувальник призначений для вивчення ЯЖ хворих і здорових людей у некомерційних цілях. Опитувальник оцінює статус здоров’я на підставі 5 компонентів, пов’язаних з такими аспектами життя, як: рухливість, самообслуговування, активність у повсякденному житті, біль або дискомфорт, неспокій або депресія. Отримання інформації про ЯЖ хворого до початку лікування і після його закінчення з подальшим порівнянням з популяційної нормою забезпечує стандартизацію оцінки ефективності лікування.
Інтегральним показником оцінки ЯЖ за цим опитувальником є значення кількісної оцінки загального стану здоров’я у відсотках, де 100% — це найкращий стан, який може уявити собі пацієнт, а 0% — найгірший. За даними табл. 2, ЯЖ значуще знизилася у пацієнток обох груп після проведеного комплексного лікування за радикальною програмою, що, очевидно, більшою мірою пов’язано з різними видами токсичності ПХТ і променевої терапії.
Таблиця 2. Середні значення кількісної оцінки загального статусу здоров’я (M±m, %) до та після ПХТ в основній і контрольній групах
| Термін обстеження | Основна група (n=50) | Контрольна група (n=50) | р |
| До лікування | 83,2±1,1 | 82,1±1,2 | р>0,05 |
| Через 3 міс після останнього циклу ПХТ | 62,5±0,7 | 52,3±0,8 | р<0,001 |
Однак середнє значення кількісної оцінки загального статусу здоров’я в основній групі було достовірно вищим, ніж у контрольній (р<0,001). При аналізі спектра та частоти симптомів у досліджуваних хворих встановлено, що ЯЖ пацієнток в основній групі була вищою за рахунок менших проблем з рухливістю і повсякденною діяльністю. Таким чином, можна говорити про те, що застосування кардіопротекторної терапії супроводу покращує ЯЖ хворих на РГЗ, які отримують антрациклінвмісну ПХТ у рамках комплексного лікування за радикальною програмою.
Висновки
1. ЯЖ значуще (р<0,001) погіршилася у пацієнток обох груп після проведеного комплексного лікування за радикальною програмою.
2. Загальна оцінка статусу здоров’я в основній групі після лікування знизилася на 20,7%, а в контрольній — на 29,8%. Тобто, ЯЖ хворих на РГЗ, які отримували кардіопротекторну терапію на фоні антрациклінвмісної ПХТ, була кращою на 9,1% порівняно з групою контролю.
Список використаної літератури
1. Der-Martirosian C., Kritz-Silverstein D., Barrett-Connor E. (2010) Five-year stability in associations of health-related quality of life measures in community-dwelling older adults: The Rancho Bernardo Study. Qual. Life Res., 19(9): 1333–1341.
2. Sangha O., Stucki G., Liang M.H. et al. (2013) The Self-Administered Comorbidity Questionnaire: A new method to assess comorbidity for clinical and health services research. Arthritis Rheum., 49(2): 156–163.
3. Wenger N.K., Mattson M.E., Furberg C.D., Elinson J. (1984) Assessment of quality of life in clinical trials of cardiovascular therapies. Am. J. Cardiol., 54(7): 908–913.
4. Karnofsky D.A., Abelmann W.H., Craver L.F., Burchenal J.H. (1948) The use of the nitrogen mustards in the palliative treatment of carcinoma — with particular reference to bronchogenic carcinoma. Cancer, 1(4): 634–656.
5. Senkus Е., Kyriakides S., Ohno S. et al. (2015) Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 26 (5): v8–v30.
6. Kotronoulas G., Kearney N., Maguire R. et al. (2014) What is the value of the routine use of patient-reported outcome measures toward improvement of patient outcomes, processes of care, and health service outcomes in cancer care? A systematic review of controlled trials. J. Clin. Oncol., 32: 1480–1501.
7. Chu D., Popovic M., Chow E. et al. (2014) Development, characteristics and validity of the EORTC QLQ-PR25 and the FACT-P for assessment of quality of life in prostate cancer patients. J. Comp. Eff. Res, 3(5): 523–531.
8. Plana J., Galderisi M., Barac A. et al. (2014) Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur. Heart J. Cardiovasc Imaging, 15: 1063–1093.
9. Trotti A., Colevas A., Setser A. et al. (2008) CTCAE v 4.0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin. Radiat. Oncol., 13 (3): 176–181.
Улучшение качества жизни больных раком грудной железы, получающих антрациклинсодержащую полихимиотерапию
Национальный институт рака, Киев
Резюме. Известно, что применение доксорубицина ассоциируется с риском повреждения миокарда, нарушением диастолической и систолической функции левого желудочка и, соответственно, ухудшением качества жизни пациентов. В рекомендациях Европейского общества кардиологов (ESC) допускается возможность применения ингибиторов ангиотензинпревращающего фермента (АПФ) и блокаторов бета-адренорецепторов для профилактики кардиотоксичности доксорубицина. Цель исследования заключалась в улучшении качества жизни больных раком грудной железы, получающих антрациклинсодержащую полихимиотерапию (ПХТ), путем применения стандартизированной низкодозовой кардиопротекторной терапии ингибиторами АПФ и блокаторами бета-адренорецепторов. В исследование включено 100 пациенток, которым показано применение 6 циклов стандартной антрациклинсодержащей ПХТ в рамках комплексного лечения по радикальной программе. В основную группу вошли 50 пациенток, получивших ПХТ по схеме FАC вместе с использованием терапии сопровождения (эналаприл 2,5 мг перорально дважды в сутки и карведилол 6,25 мг перорально дважды в сутки), в контрольную — 50 пациенток, которым назначили такую же схему ПХТ, но без терапии сопровождения. К началу специального лечения, на этапах ПХТ и через 3 мес после последнего цикла у пациенток обеих групп провели комплексное обследование сердечно-сосудистой системы и оценку качества жизни с использованием опросника EQ-5D. Установлено, что качество жизни больных раком грудной железы, получавших кардиопротекторную терапию на фоне антрациклинсодержащей ПХТ, было выше на 9,1% по сравнению с группой контроля.
качество жизни, рак грудной железы, антрациклины, кардиотоксичность, профилактика.
Адреса:
Аскольський Антон В’ячеславович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: +38 (044) 257-93-64
E-mail: anton.askolsky@gmail.com














Leave a comment