Прогностичне значення функціональних параметрів ПЕТ-КТ при первинній медіастинальній В-великоклітинній лімфомі
Крячок І.А.1, Степанішина Я.А.1, Кметюк Я.В.2, Гур’янов В.Г. 3
- 1Національний інститут раку, Київ
- 2Всеукраїнський центр радіохірургії Клінічної лікарні «Феофанія», Київ
- 3Національний медичний університет імені Богомольця, Київ
Резюме. В останні роки доведено клінічну цінність використання позитронно-емісійної томографії в поєднанні з комп’ютерною томографією в процесі лікування хворих з різними варіантами лімфопроліферативних захворювань. У цій роботі доведено прогностичне значення метаболічного об’єму пухлини та загального гліколізу пухлинної маси, визначених до початку лікування, у хворих на первинну медіастинальну В-великоклітинну лімфому.

ВСТУП
В останні роки досягнуто значного успіху в лікуванні пацієнтів з первинною медіастинальною В-великоклітинною лімфомою (ПМВКЛ), особливо з часу застосування комбінації антрациклінвмісних режимів поліхіміотерапії (ПХТ) та анти-СD20 моноклонального антитіла (ритуксимаб) [1, 2]. Однак у частини хворих пухлина все ж залишається рефрактерною до терапії першої лінії, а у разі розвитку рецидиву, що найчастіше трапляється в перші 12–24 міс після завершення лікування, захворювання характеризується надзвичайною агресивністю, і відповідь на лікування не перевищує 25% [3–5].
Специфічних факторів прогнозу при ПМВКЛ немає. Як прогностичну модель використовують стандартний міжнародний прогностичний індекс (international prognostic index — IPI), але його роль при цьому варіанті лімфоми обмежена. Вік-адаптований показник (aaIPI) при ПМВКЛ прогностичного значення також не має [6]. Існує декілька публікацій, які базуються на ретроспективному аналізі прогностичної ролі деяких клінічних характеристик (вік старше 40 років, великий об’єм пухлинної маси, пізні стадії, підвищений рівень лактатдегідрогенази) [7–9], але прогностичного значення жодного з перерахованих факторів у проспективних дослідженнях не підтверджено. Таким чином, на сьогодні інтерес вчених спрямований на пошук надійних чинників прогнозу, що дозволило б в майбутньому застосовувати ризик-адаптовану терапію хворих на ПМВКЛ.
Позитронно-емісійна томографія, інтегрована з комп’ютерною томографією (ПЕТ-КТ), — радіологічний метод, що поєднує в собі можливість розмежування анатомічних структур і метаболічної активності пухлинної та здорової тканин. Цей метод на сьогодні займає провідне місце в діагностиці та оцінці відповіді на терапію у пацієнтів з агресивними лімфомами.
У низці робіт уже доведено [10] та все ще вивчається прогностичне значення ПЕТ-КТ у хворих на лімфому Ходжкіна. Згідно з чинними настановами з лімфоми Ходжкіна тактика лікування базується на даних ініціальної ПЕТ-КТ, а ризик-адаптований підхід передбачає інтенсифікацію або деескалацію терапії, що проводиться на основі результатів проміжної ПЕТ-КТ. У публікаціях [11–13] досліджено прогностичне значення метаболічного об’єму пухлини (metabolic tumor volume — MTV), зокрема, підкреслено зв’язок з виживаністю без прогресування. Цим даним суперечать результати Adams та співавторів (2015), де доведено переваги в прогнозуванні перебігу дифузної B-великоклітинної лімфоми шляхом застосування IPI порівняно з даними ПЕТ-КТ. Згідно з інформацією [14] MTV не пов’язаний з прогнозом при ПМВКЛ, однак в публікації йдеться про проведення проміжної ПЕТ-КТ для раннього аналізу відповіді пухлини на терапію. Прогностичне значення MTV та загального гліколізу пухлини (total lesion glycolisys — TLG) висвітлено в роботі міжнародної групи з вивчення екстранодальних лімфом IELSG. Згідно з попередніми даними високий рівень MTV та TLG асоціюється з нижчим показником виживаності цієї категорії хворих.
Об’єкт і методи дослідженняМета дослідження полягала у визначенні прогностичної цінності кількісних параметрів ПЕТ-КТ, проведеній перед початком лікування у пацієнтів з ПМВКЛ. Проаналізовано дані 34 хворих, яким вперше було встановлено діагноз ПМВКЛ, що отримували лікування в Національному інституті раку з 2010 по 2014 р. Усі пацієнти отримували ПХТ за схемою R-CHOP (ритуксимаб в комбінації з циклофосфамідом, доксорубіцином, вінкристином, преднізолоном) або R-da-EPOCH (ритуксимаб в поєднанні з циклофосфамідом, безперервною інфузією доксорубіцину, етопозиду, вінкристину, а також преднізолоном з ескалацією доз відповідних препаратів). Консолідуюча променева терапія із сумарною вогнищевою дозою 30–36 Гр була проведена у більшості пацієнтів.
Протокол проведення ПЕТ-КТ та оцінювані параметри
Усі дослідження були виконані з використанням сканера Siemens Biograph PET/CT. Пацієнтам заборонялося їсти і пити солодкі напої мінімум 6 год до обстеження. Безпосередньо перед введенням радіофармпрепарату (РФП) вимірювали рівень глюкози в крові, щоб упевнитися, що він менше ніж 200 мг/дл. Сканування проводили приблизно через 60 хв після введення РФП. Введена активність розраховувалася відповідно до рекомендацій Європейської Асоціації ядерних медиків (FDG PET/CT EANM procedure guidelines for tumor imaging: version 2.0) і становила 555–925 MBq залежно від індексу маси тіла пацієнта. Сканування за протоколом «усе тіло» включало об’єм від основи черепа до верхньої третини стегон (6–7 «позицій лежачи» залежно від індексу маси тіла). Параметри сканування КТ для корекції атенуації: 120-keV, 11-100-mAs (залежно від індексу маси тіла), колімація по 5 мм, pitch — 0,75. Реконструйовані зображення переглядалися незалежно двома радіологами на робочій станції Siemens Multimodality Workplace в спеціалізованому програмному пакеті (Syngo TrueD; Siemens Medical Solutions) в аксіальній, сагітальній та корональній площинах. Кількісні параметри ПЕТ визначали в кожного пацієнта на етапі ініціального дослідження. При всіх дослідженнях розглядали такі характеристики, як: стандартизована величина накопичення РФП — SUVmax, її середнє значення — SUVmean та MTV. MTV вираховували на основі порогового значення SUVmax — 20%. TLG розраховували як суму добутку SUVmean і MTV всіх виявлених вогнищ у пацієнта:
TLG = ∑[SUVmean • MTV].
Аналіз результатів дослідження проводили в пакеті статистичного аналізу MedCalc v. 17.2 (MedCalc Software Inc, Broekstraat, Belgium, 2017 р.). Для отримання кількісних показників розраховували середнє значення (M) та стандартне відхилення показника (±SD), для якісних — частоту показника (%). При порівнянні значень показників використано непараметричний критерій W-Вілкоксона, при зіставленні трьох груп використовували непараметричний критерій Крускала — Волліса і критерій Данна для множинних порівнянь. Критичний рівень значимості у всіх випадках прийнято за 0,05.
Для аналізу факторів, пов’язаних із ризиком несприятливого перебігу захворювання, використано метод побудови та аналізу логістичних моделей регресії, відбір значущих факторів ризику проводили методом покрокового включення/виключення факторних ознак (Stepwise method). Для оцінки якості моделей використано метод побудови та аналізу кривих операційних характеристик (receiver operating characteristic curve — ROC-кривих). Оцінку якості прогнозування проводили за показниками площі під ROC-кривою (area under curve — AUC), чутливості, специфічності, прогностичності позитивного (positive predictive value — PPV) і негативного результатів тесту (negative predictive value —NPV) та відповідні 95% довірчі інтервали (95% ДІ).
Результати та їх обговоренняУ досліджуваній групі хворих переважали пацієнти жіночої статі (67,6%). Вік хворих становив 19–48 років (середнє значення 31,5 року). Близько ⅔ пацієнтів на момент встановлення діагнозу мали ранню І–ІІ стадію патологічного процесу, однак при цьому у половини хворих поперечний розмір пухлини середостіння перевищував 10 см. Усі пацієнти отримували антрациклінвмісні режими ПХТ в комбінації з анти-СD20 моноклональним антитілом (ритуксимабом). Характеристики хворих представлено в табл. 1.
| Характеристика хворих(n=37) | n (%) |
| Середній вік, M±SD, років | 31,6±7,4 |
| Молодше 60 років | 37 (100) |
| Жінки | 25 (67,6) |
| ECOG 0–1 | 28 (76,7) |
| ECOG ≥2 | 9 (24,3) |
| В-симптоми | 14 (37,8) |
| Велика пухлинна маса | |
| Максимальний поперечний розмір >10 см | 19 (51,4) |
| Екстранодальні ураження ≥1 | 8 (21,6) |
| Ураження кісткового мозку | 0 (0) |
| Стадія Ann Arbor І–ІІ | 26 (70,3) |
| Стадія Ann Arbor III–IV | 11 (29,7) |
| Підвищений рівень лактатдегідрогенази | 20 (54,1) |
| IPI низький/проміжний ризик | 26 (70,3) |
| IPI проміжний-високий/високий | 11 (29,7) |
| Схема ПХТ R-CHOP | 12 (32,5) |
| Схема ПХТ R-daEPOCH | 25 (67,5) |
| Променева терапія на зону середостіння | 31 (83,8) |
По завершенню 6 курсів ПХТ 32 хворим було проведено ПЕТ-КТ, решті пацієнтів — КТ. У 20 (54,1%) хворих досягнуто повної відповіді (ПВ), підтвердженої ПЕТ-КТ, тобто редукція пухлинної маси за критеріями Cheson 2007 становила >75%, та у 15 з них метаболічна активність резидуальної пухлин не перевищувала 1–3 бали за критеріями Deauville (тобто накопичення РФП не вище, ніж в печінці). У 13 (35,1%) пацієнтів зафіксовано часткову відповідь (ЧВ) на терапію, у 5 з них залишкове накопичення РФП вище печінкового пулу (4 бали за Deaiuville). У 4 розвинулося прогресування під час проведення терапії, та у 3 з тих, що мали ЧВ після 3-го курсу ПХТ, виник ранній рецидив. Таким чином, у 7 пацієнтів із досліджуваної групи простежувався несприятливий прогноз. 5 (13%) хворих померли в термін від 6 до 14 міс з дати закінчення лікування (3 — внаслідок рецидиву в центральній нервовій системі та 2 — від прогресування пухлини в середостінні, печінці).
Проведено аналіз вихідних параметрів ПЕТ-КТ у хворих, які досягли ПВ, ЧВ, та у тих, що не відповіли на терапію.
При проведенні аналізу статистично значущої відмінності показника SUVmax для пацієнтів із різною відповіддю на лікування не виявлено (табл. 2).
| Показник | M±SD | Рівень значущості відмінності між групами, p | ||
| ПВ (n=20) | ЧВ (n=10) | ПЗ (n=7) | ||
| SUVmax, од. | 22,3±8,3 | 19,4±4,2 | 18,4±3,6 | 0,63 |
| MTV, мл | 429±265 | 1100±538 | 1838±577 | <0,001 |
| TLG, мл | 4390±3970 | 10 260±4370 | 13 210±2380 | <0,001 |
Для порівняння використано критерій Крускала — Волліса, апостеріорне порівняння проводили за критерієм Данна. Тут і далі: ПЗ — прогресування під час терапії або ранній рецидив.
Відмінність від групи ПВ статистично значуща (p<0,05).
Відмінність від групи ЧВ статистично значуща (p<0,05).
Відмінність від групи ПЗ статистично значуща (p<0,05).
Виявлено збільшення (p<0,001) показника MTV у пацієнтів, які не відповіли на проведену терапію, порівняно з тими хворими, у яких на фоні лікування було досягнуто ПВ та ЧВ. При проведенні аналізу встановлено, що найбільше середнє значення показника наявне у пацієнтів з ПЗ (відмінність від груп ПВ та ЧВ статистично значуща; p<0,05), найнижче значення MTV — у пацієнтів із ПВ на терапію (відмінність від груп ЧВ та ПЗ статистично значуща; p<0,05).
Також виявлено збільшення (p<0,001) показника TLG у хворих із незадовільною відповіддю на лікування за даними контрольних ПЕТ-КТ та КТ. Встановлено, що найнижче середнє значення показника досягнуто у пацієнтів із ПВ (відмінність від груп ЧВ та ПЗ статистично значуща; p<0,05), однак статистично значущої різниці між групами ЧВ та ПЗ не виявлено.
У 30 із досліджуваних пацієнтів досягнуто ремісії захворювання, що триває від 32 до 59 міс протягом спостереження. Проведено порівняння функціональних параметрів ПЕТ-КТ при ініціальному дослідженні для хворих, які досягли стійкої ремісії, з групою ПЗ (табл. 3).
| Показник | M±SD | Рівень значущості відмінності між групами, p | |
| Стійка ремісія (n=30) | ПЗ (n=7) | ||
| SUVmax, од. | 21,3±7,2 | 18,4±3,6 | 0,48 |
| MTV, мл | 653±490 | 1838±577 | <0,001 |
| TLG, мл | 6410±4940 | 13 210±2380 | 0,003 |
Для порівняння використано критерій W-Вілкоксона.
Відмінність від групи стійкої ремісії статистично значуща (p<0,05).
Відмінність від групи ПЗ статистично значуща (p<0,05).
При проведенні аналізу не виявлено відмінності середнього значення показника SUVmax в групах пацієнтів зі стійкою ремісією та ПЗ (p=0,48). Встановлено, що в групах хворих із несприятливим перебігом захворювання середнє значення показників MTV і TLG вище, ніж в групі пацієнтів, які досягли стійкої ремісії (p<0,001 та p=0,003 відповідно).
У табл. 4 наведено результати порівняння параметрів ПЕТ-КТ хворих, які живі понад 32 міс з дати встановлення діагнозу та померли внаслідок прогресування ПМВКЛ при терміні спостереження до 14 міс.
| Показник | M±SD | Рівень значущості відмінності між групами, p |
|
| Живі (n=32) | Померли (n=5) | ||
| SUVmax | 21,3±6,9 | 17,2±3,6 | 0,18 |
| MTV мл | 698±506 | 2027±584 | 0,001 |
| TLG мл | 6770±4970 | 13 680±2690 | 0,008 |
Для порівняння використано критерій W-Вілкоксона.
Відмінність від групи живих статистично значуща (p<0,05).
Відмінність від групи померлих статистично значуща (p<0,05).
За параметром SUVmax групи хворих, що живі та померли внаслідок прогресування захворювання, не відрізнялися (p=0,18). Інші показники (MTV, TLG) були статистично значуще (p<0,05) вищими у пацієнтів, що загинули від прогресування лімфоми.
Таким чином, проведений аналіз свідчить про можливість використання показників MTV і TLG для прогнозування ризиків прогресування та смерті.
Прогнозування ризику прогресуванняДля прогнозування ризиків було використано метод побудови та аналізу логістичних моделей регресії.
Для прогнозування ризику прогресування як фактори аналізували показники: MTV, TLG, вік старше 40 років, два і більше екстранодальних ураження, пізня стадія, чоловіча стать та ECOG ≥2.
Для відбору чинників, пов’язаних із ризиком прогресування, у багатофакторній логістичній моделі регресії було використано метод покрокового включення/виключення факторних ознак (поріг включення p<0,1 та виключення p>0,3). Після відбору ознак залишився лише один фактор ризику — показник MTV. Модель, побудована на цій факторній ознаці, адекватна: χ=16,9 при DF=1; p<0,001. Виявлено, що при зростанні показника MTV ризик прогресування підвищується (p=0,005; відношення шансів (ВШ) 1,4; 95% ДІ 1,1–1,7) на кожні 100 мл зростання MTV.
На рис. 1 наведено криву операційних характеристик цього тесту.
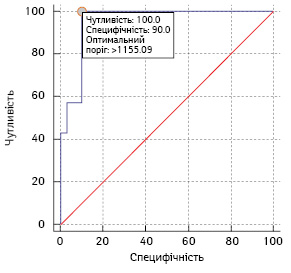
AUC становить 0,95 (95% ДІ 0,83–1,00), що свідчить про високі прогностичні характеристики тесту.
Вибір оптимального порогу для тесту проводився за Younden Index, критичний поріг MTVcrit=1156 мл. У випадку, якщо MTV ≥1156 мл, прогнозується високий ризик прогресування захворювання. Для вибраного порогу чутливість тесту становить 100% (95% ДІ 59–100), специфічність — 90% (95% ДІ 73,5–97,9), PPV=70% (95% ДІ 44,4–87,2) і NPV= 100%.
У 27 пацієнтів вихідний показник MTV коливався в межах від 119 до 1155 мл, усі вони по завершенню терапії досягли ПВ або ЧВ. Найдовший термін спостереження в цій групі становить 59 міс, найкоротший — 32 міс. При медіані спостереження 33,2 міс ознак захворювання в цій групі не відмічено. 10 пацієнтів досліджуваної групи на момент встановлення діагнозу ПМВКЛ мали показник MTV ≥1156 мл, у 7 (70%) з них було зафіксовано ПЗ, що свідчить на користь наведеної прогностичної моделі.
Прогнозування ризику летального випадкуДля прогнозування ризику летального випадку як фактори аналізували ті самі показники, що й при аналізі ризику прогресування: MTV, TLG, вік >40, два і більше екстранодальних ураження, пізня стадія, чоловіча стать та ECOG ≥2.
Після відбору ознак (Stepwise method при порозі включення p<0,1 та виключення p>0,3) залишився лише один фактор ризику — показник MTV. Модель, побудована на цій факторній ознаці, адекватна: χ²=15,5 при DF=1; p<0,001. Виявлено, що при зростанні показника MTV ризик смерті від захворювання підвищується (p=0,009; ВШ=1,4; 95% ДІ 1,1–1,8) на кожні 100 мл зростання MTV.
На рис. 2 наведено криву операційних характеристик цього тесту.
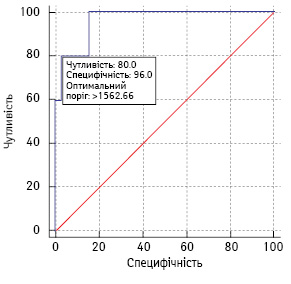
AUC становить 0,96 (95% ДІ 0,84–1,00), що свідчить про високі прогностичні характеристики тесту.
Оптимальний поріг тесту MTVcrit становив 1563 мл. У випадку, якщо MTV ≥1563 мл, прогнозується високий ризик смерті хворого. Для вибраного порогу чутливість тесту сягала 80% (95% ДІ 28,9–99,5), специфічність — 96,9% (95% ДІ 83,8–99,9), PPV=80% (95% ДІ 35,6–96,7) і NPV=96,9% (95% ДІ 84,3–99,4).
Із 6 хворих, у яких при ініціальній ПЕТ-КТ MTV сягав та перевищував 1562,7 мл, 4 померли від прогресування лімфоми. Усі летальні випадки сталися під час проведення терапії або через >12 міс після її завершення. У 3 із цих 4 пацієнтів зареєстровано прогресування пухлинного процесу в центральній нервовій системі.
Нещодавно опубліковано результати дослідження міжнародної групи з вивчення екстранодальних лімфом IELSG 26 [9], в якому також оцінювали прогностичну цінність параметрів ПЕТ-КТ. У роботі [6] як прогностично значущі виділено параметри MTV та TLG при оцінці кожного окремо, що підтверджується результатами нашого дослідження. Однак при багатофакторному аналізі, що проводився в описаному дослідженні, статистично значуще гірші показники виживаності мали пацієнти з високим рівнем TLG. У нашій роботі основну прогностичну цінність доведено стосовно MTV. Слід зауважити, що ці два показники певною мірою взаємозалежні. Важливо підкреслити також і те, що в роботі IELSG 26 проводили оцінку даних більшої кількості хворих (103 пацієнти). SUVmax, як згідно з нашими результатами, так і відповідно до даних IELSG 26, з прогнозом перебігу ПМВКЛ не пов’язаний.
ВисновкиНа основі опрацьованих нами даних є підстави стверджувати, що стандартизована величина накопичення РФП (SUVmax) не має прогностичної цінності, та її значення у хворих із різним перебігом ПМВКЛ не відрізняється. При моноваріантному аналізі встановлено зв’язок показників MTV та TLG з прогнозом перебігу захворювання. Однак при мультифакторному аналізі (при врахуванні також стандартних клінічних факторів ризику) прогностично значущим виявився лише MTV до початку лікування. Згідно з проведеним нами аналізом прогностично сприятливим є показник MTV <1156 мл, значення MTV вище вказаного рівня асоціюється з частим розвитком рефрактерності та прогресування захворювання попри проведення ритуксимабвмісної терапії; чутливість тесту становила 100% (95% ДІ 59–100), специфічність — 90% (95% ДІ 73,5–97,9).
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Savage K., Al-Rajhi N., Voss N. et al. (2006) Favorable outcome of primary mediastinal large B cell lymphoma in a single institution: The British Columbia experience. Ann. Oncol., 17(1): 123–130.
2. Rieger M., Osterborg A., Pettengell R. et al. (2011) Primary mediastinal B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab. Results of the Mabthera International Trial Group study. Ann. Oncol., 22(3): 664–670.
3. Bishop P.C., Wilson W.H., Pearson D. (1999) CNS involvement in primary mediastinal large B-cell lymphoma. J. Clin. Oncol., 17(8): 2479–2485.
4. Rosenwald A., Wright G., Leroy K. et al. (2003) Molecular diagnosis of primary mediastinal B cell lymphoma identifies a clinically favorable subgroup of diffuse large B cell lymphoma related to Hodgkin lymphoma. J. Exp. Med., 198(6): 851–862.
5. Kuruvilla J., Pintilie M., Tsang R. (2008) Salvage chemotherapy and autologous stem cell transplantation are inferior for relapsed or refractory primary mediastinal large B-cell lymphoma compared with diffuse large B-cell lymphoma. Leuk. Lymphoma., 49(7): 1329–1336.
6. Ceriani L., Martelli M., Zinzani P.L. et al. (2015) Utility of baseline 18FDG-PET/CT functional parameters in defining prognosis of primary mediastinal (thymic) large B-cell lymphoma. Blood, 126(8): 950–956.
7. Aoki T., Izutsu K., Suzuki R. (2013) Novel prognostic model of primary mediastinal large B-cell lymphoma (PMBL): a multicenter cooperative retrospective study in Japan. ASH Ann. Meet. Abstr., 122(21): 638.
8. Zinzani P.L., Martelli M., Bertini M. (2002) Induction chemotherapy strategies for primary mediastinal large B-cell lymphoma with sclerosis: a retrospective multinational study on 426 previously untreated patients. Haematologica, 87(12): 1258–1264.
9. Savage K.J., Monti S., Kutok J.L. (2003) The molecular signature of mediastinal large B-cell lymphoma differs from that of other diffuse large B-cell lymphomas and shares features with classical Hodgkin lymphoma. Blood, 102(12): 3871–3879.
10. Andrew M., Kostakoglu L. (2015) The role of FDG-PET in defining prognosis of Hodgkin lymphoma for early-stage disease. Blood, 124(1): 3356–3364.
11. Sasanelli М., Meignan М., Haioun С. et al. (2016) Pretherapy metabolic tumour volume is an independent predictor of outcome in patients with diffuse large B-cell lymphoma. Eur. J. Nucl. Med. Mol. Imaging., 57(5): 728–734.
12. Mikhaeel N.G., Smith D., Dunn J.T. et al. (2016) Combination of baseline metabolic tumour volume and early response on PET/CT improves progression-free survival prediction in DLBCL. Eur. J. Nucl. Med. Mol. Imaging., 43: 1209–1219.
13. Cottereau A.S., Lanic Н., Mareschal S. et al. (2016) Molecular Profile and FDG-PET/CT Total Metabolic Tumor Volume Improve Risk Classification at Diagnosis for Patients with Diffuse Large B-Cell Lymphoma. Clin. Cancer Res., 22: 3801–3809.
14. Schöder H., Zelenetz A.D., Hamlin Р. et al. (2016) Prospective study of 3ʹ-deoxy-3ʹ-18F-fluorothymidine PET for early interim response assessment in advanced-stage B-cell lymphoma. J. Nucl. Med., 57(5): 728–734.
Прогностическое значения параметров ПЭТ-КТ при первичной медиастинальной В-крупноклеточной лимфоме
Национальный институт рака, Киев
Всеукраинский центр радиохирургии Клинической больницы «Феофания», Киев
Национальный медицинский университет мени А.А. Богомольца, Киев
Резюме. В последние годы доказана клиническая ценность использования позитронно-эмиссионной томографии в сочетании с компьютерной томографией в процессе лечения больных с различными вариантами лимфопролиферативных заболеваний. В данной работе доказано прогностическое значение метаболического объема опухоли и общего гликолиза опухолевой массы, определенных до начала лечения, у больных первичной медиастинальной В-крупноклеточной лимфомой.
первичная медиастинальная В-крупноклеточная лимфома, ПЭТ-КТ, метаболический объем опухоли, общий гликолиз опухоли.
Адреса:
Степанішина Яна Анатоліївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: yankastep@gmail.com














Leave a comment