Імуногістохімічні та молекулярно-генетичні особливості дифузних астроцитарних пухлин III–IV ступеня злоякісності
Яковцова И.И., Чертенко Т.М., Данилюк С.В., Долгая О.В.
Резюме. Визначення гістологічних та молекулярних ознак пухлин центральної нервової системи є обов’язковим, згідно з ВООЗ, для встановлення точного діагнозу та формування прогнозу. Метою цієї роботи були виявлення фенотипічних особливостей дифузних астроцитарних пухлин III–IV ступеня злоякісності та визначення їх прогностичної цінності. Задля цього нами були вивчені медичні картки стаціонарних хворих на анапластичну астроцитому та гліобластому і відібраний їх післяопераційний матеріал (55 випадків), який розподілено на групи первинних пухлин та рецидивів. Фенотипічні особливості вивчені за допомогою імуногістохімічного дослідження з використанням маркерів: GFAP, NSE, anti-IDH1R132H. Для встановлення додаткових мутацій в ізоцитратдегідрогеназі-1 (IDH1) проведено молекулярно-генетичне дослідження. Серед первинних пухлин гліобластоми IDH1mt становили лише 1%. Зате в групі рецидивів їх частка була аж 20%, переважно за рахунок випадків віддалених рецидивів. Крім цього, в групі первинних пухлин ми виявили 5 гліосарком, 2 гігантоклітинні гліобластоми та 1 гліобластому з примітивним нейрональним компонентом. Усі ці пухлини дали рецидив протягом року. Нам не вдалося довести прогностичного значення мутації IDH1R132H (критерій Фішера =0,175; р>0,05). Однак при вивченні додаткових мутацій в IDH1 ми встановили, що мутація IDH1SNP асоційована з анапластичними астроцитомами (критерій Фішера =0,00755; p<0,05) та, вірогідніше за все, була пов’язана з більш пізніми рецидивами у пацієнтів (U-критерій Манна — Уїтні =36,5; pточне=0,043; p<0,05).
Резюме. Определение гистологических и молекулярных особенностей опухолей центральной нервной системы, согласно ВОЗ, является обязательным для установления точного диагноза и формирования прогноза. Целью этой работы были выявление фенотипических особенностей диффузных астроцитарных опухолей III–IV степени злокачественности и определение их прогностической ценности. Для этого нами изучены медицинские карты стационарных больных с анапластическими астроцитомами и глиобластомами и собран их послеоперационный материал (55 случаев), который распределили на группы первичных опухолей и рецидивов. Фенотипические особенности опухолей изучены гистологическим и иммуногистохимическим методом с использованием маркеров: GFAP, NSE, anti-IDH1R132H. Для выявления дополнительных мутаций в изоцитратдегидрогеназе-1 (IDH1) проведено молекулярно-генетическое исследование. Среди первичных опухолей глиобластомы IDH1mt составляли всего 1% выборки. Зато в группе рецидивов их доля достигала целых 20%, преимущественно за счет подгруппы отдаленных рецидивов. Кроме этого, в группе первичных опухолей мы выявили 5 глиосарком, 2 гигантоклеточные глиобластомы и 1 глиобластому с примитивным нейрональным компонентом. Все эти опухоли дали рецидив в течение года. Нам не удалось доказать связь мутации IDH1R132H с благоприятным прогнозом (критерий Фишера = 0,175; р>0,05). Однако при анализе дополнительных мутаций в IDH1 мы выявили, что мутация IDH1105GGTSNP ассоциирована с анапластическими астроцитомами (критерий Фишера =0,00755; p<0,05) и, вероятнее всего, может быть связана с более поздними рецидивами у пациентов (U-критерий Манна — Уитни =36,5; pточное=0,043; p<0,05).
Получено 20.09.2018
Принято в печать 27.09.2018
Введение
Диффузные астроцитарные опухоли высокой степени злокачественности и глиобластомы в частности относятся к самым распространенным первичным внутримозговым опухолям среди взрослого населения [5]. Согласно классификации опухолей центральной нервной системы 2016 г., определение гистологических и молекулярных свойств опухолей важно для точного установления диагноза и формирования прогноза [3]. Хотя на сегодня стандартная схема лечения всех диффузных глиом III–IV степени злокачественности достаточно однотипна, в мире ведется ряд клинических исследований по разработке более специфического лечения для разных фенотипов опухолей [2, 6]. Особое внимание уделяется изучению тканевой гипоксии и мутациям в ферментах тканевого дыхания, таких как изоцитратдегидрогеназа-1 (IDH1) и -2. Уже доказана важная прогностическая роль мутации IDH1R132H для диффузных астроцитарных и олигодендроглиальных опухолей у взрослых [3]. Влияние же других мутаций в этом ферменте все еще остается предметом исследования и является перспективным как в диагностическом, так и в прогностическом плане [1, 4, 7, 8].
Цель — изучение фенотипических особенностей диффузных астроцитарных опухолей III–IV степени злокачественности и определение их прогностической ценности.
Объект и методы исследования
Общие характеристики исследуемых групп
Для анализа фенотипических особенностей диффузных астроцитарных опухолей высокой степени злокачественности нами отобрано 30 блоков с постоперационным материалом пациентов, впервые прооперированных по поводу данных опухолей, и 25 блоков с постоперационным материалом пациентов, прооперированных повторно после пройденной стандартной химио- и лучевой терапии. Далее сформировано 4 подгруппы. Группа впервые возникших опухолей делилась на 2 подгруппы:
- 15 случаев опухолей, которые дали рецидив в течение года после операции;
- 15 случаев опухолей без рецидива или летального исхода в течение года после операции.
Группа рецидивов тоже делилась на 2 подгруппы:
- 15 случаев рецидивов от пациентов из 1-й подгруппы;
- 10 случаев рецидивов, развившихся через 3 года и более после первого оперативного вмешательства.
Подгруппы 1 и 2 были выделены для возможного выявления благоприятных прогностических маркеров для пациентов. Подгруппа 3 выделена для оценки опухолевой трансформации после стандартной химио- и лучевой терапии у пациентов. Подгруппа 4 сформирована для выявления возможных различий между быстро и медленно рецидивирующими опухолями и для оценки прогноза.
Критериями включения пациентов в группы, помимо диагноза, были пригодность материала для проведения иммуногистохимического и молекулярно-генетического исследования и наличие сведений о пациенте в течение года и более после операции. Блоки отобраны за период с 2007 по 2016 г. в патоморфологических отделениях Харьковской областной клинической больницы и Харьковской городской клинической больницы № 7. Дополнительно у пациентов изучались медицинские карты стационарного больного. Проанализированы такие параметры, как: пол, возраст, гистологическое заключение, локализация опухолевого процесса. Подробная информация об отобранном материале представлена в таблице.
| Признак | Группа | |||
| 1 (первичные опухоли, давшие рецидив в течение года) | 2 (первичные опухоли без рецидива в течение года) | 3 (рецидивы от пациентов из группы 1) | 4 (отдаленные рецидивы) | |
| Пол | ||||
| М | 9 (60%) | 9 (60%) | 9 (60%) | 6 (60%) |
| Ж | 6 (40%) | 6 (40%) | 6 (40%) | 4 (40%) |
| Возраст (M±σ) | 50,13±10,86 | 56,2±12,295 | 51±10,66 | 45,5±10,78 |
| Локализация опухоли | ||||
| Лобные доли | 5 (33%) | 9 (60%) | 5 (33%) | 7 (70%) |
| Другая супратенториальная локализация | 10 (67%) | 6 (40%) | 10 (67%) | 3 (30%) |
| Grade (степень злокачественности) | ||||
| III | 1 (7%) | 3 (20%) | 1 (7%) | 0 (0%) |
| IV | 14 (93%) | 12 (80%) | 14 (93%) | 10 (100%) |
| Мутация IDH1R132H | ||||
| Есть | 2 (13%) | 1 (7%) | 2 (13%) | 3 (30%) |
| Нет | 13 (87%) | 14 (93%) | 13 (87%) | 7 (70%) |
| Мутация IDH1SNP | ||||
| Есть | 3 (20%) | 4 (27%) | 4 (27%) | 6 (60%) |
| Нет | 12 (80%) | 11 (73%) | 11 (73%) | 4 (40%) |
| Мутация IDH1R132C | ||||
| Есть | 0 (0%) | 1 (7%) | 0 (0%) | 1 (10%) |
| Нет | 15 (100%) | 14 (93%) | 15 (100%) | 9 (90%) |
Иммуногистохимическоеисследование
Иммуногистохимическое исследование проводилось с использованием непрямого пероксидазно-антипероксидазного метода. Все этапы проведения иммуногистохимической реакции осуществлялись согласно протоколу Dako для ручного метода иммуногистохимического исследования.
В качестве первичных антител использовались моноклональные и поликлональные антитела: GFAP antibody clone ASTRO6, 1:200 (ThermoScentific, США), NSE antibody polyclonal, 1:500 (ThermoScentific, США), anti-IDH1R132H antibody clone HMab-1, 1:50 (MERCK, Германия). Дополнительно ядра клеток окрашивали с помощью гематоксилина Майера. Для проверки маркеров использовали рекомендованные производителями внешние и внутренние позитивные и негативные контроли. Оценку реакции GFAP, IDH1R132H и NSE проводили качественным методом, то есть оценивали наличие экспрессии маркера в ткани опухоли и силу экспрессии. Для микрофотографий использовали микроскоп ZEISS Primo Star и камеру ZEISS Axiocam ERc 5. Все фотографии делались при одинаковых условиях освещения. Для более точной оценки микрофотографий использовали программу Adobe Photoshop, Version 2015.1.2.
Молекулярно-генетическое исследование
Для выявления типа дополнительных мутаций в IDH1 в исследуемых опухолях произведено молекулярно-генетическое исследование. Выделение ДНК проводили с использованием набора QIAGEN, Valencia, CA. Изучение праймеров IDH1 экзон 4: 5′-ACGTTGGATGGGCTTGTGAGTGGATGGGTA-3′ и 5′-ACGTTGGATGGCAAAATCACATTATTGCCAAC-3′ проводили методом полимеразной цепной реакции на анализаторе Biorad. Исследование проводилось в BioBank Association of Ukraine.
Статистическая обработка
Для анализа количественных показателей мы применяли методы математической статистики. Определяли среднее арифметическое, среднее квадратическое отклонение. Оценку связи между признаками производили при помощи точного критерия Фишера и χПирсона. В отдельных случаях был рассчитан U-критерий Манна — Уитни. Для описания качественных характеристик мы использовали экстенсивный показатель (%). Расчеты выполняли с помощью пакета Microsoft Excel 2010. Статистическую обработку результатов исследования проводили по общепринятым методикам с использованием пакета Statistica 10.0.
Результаты
В группе первичных опухолей все анапластические астроцитомы имели фенотип IDH1wt. Глиобластомы делились на три IDH1mt (рис. 1, а) и 23 IDH1wt (рис. 1, б). Иммуногистохимическое исследование с GFAP и NSE дало возможность выявить особые подвиды среди глиобластом: 5 глиосарком (рис. 2), 2 гигантоклеточные глиобластомы (рис. 3) и отдельный паттерн глиобластомы — глиобластома с примитивным нейрональным компонентом (рис. 4). Из трех выделенных нами глиобластом IDH1mt лишь одна не дала рецидива в течение года (клинический анамнез заболевания до операции — 1 год). Из 4 анапластических астроцитом рецидив в течение года развился в 1 случае. Из 23 глиобластом IDH1wt 12 опухолей дали рецидив в течение года и 11 — нет. Все гигантоклеточные глиобластомы и глиобластома с примитивными нейрональными комплексами дали рецидив в течение года.
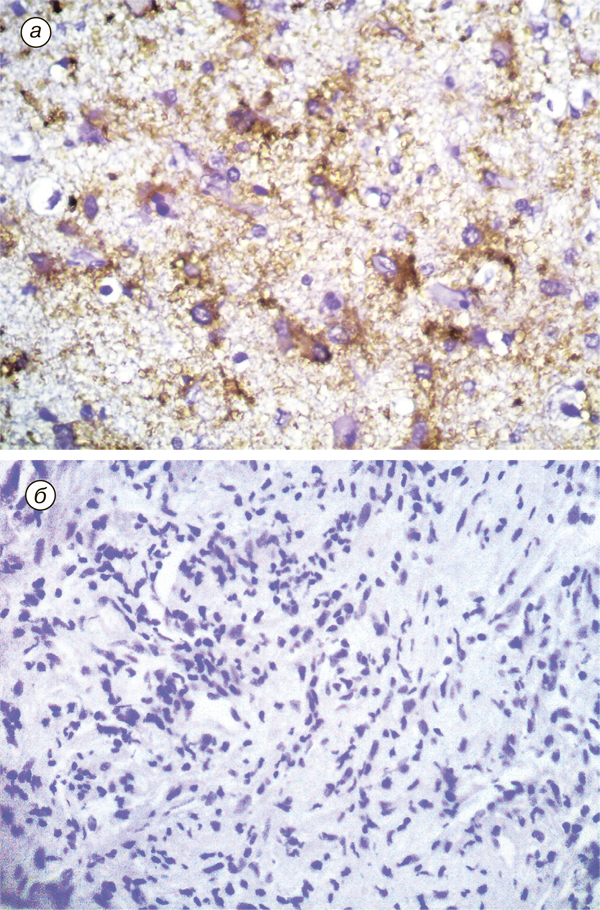
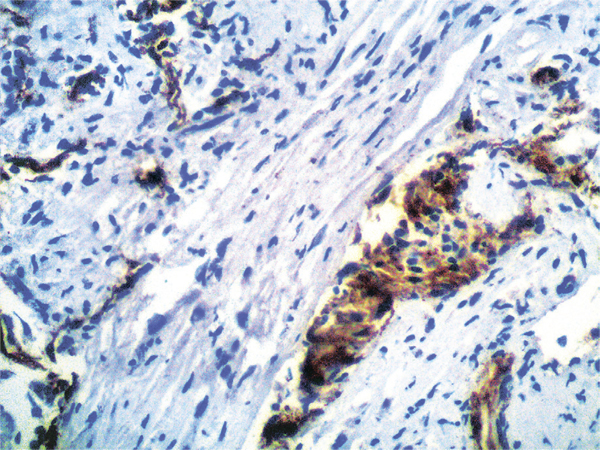
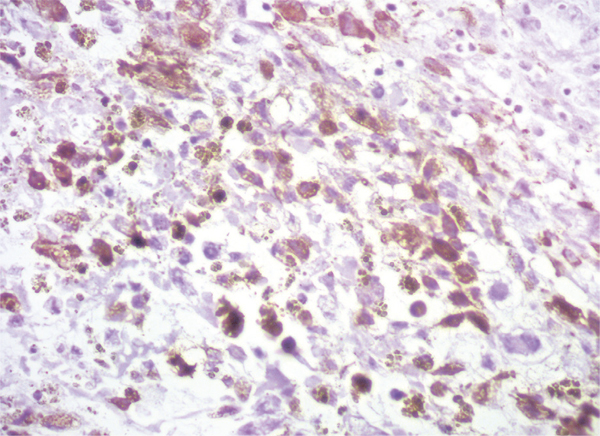
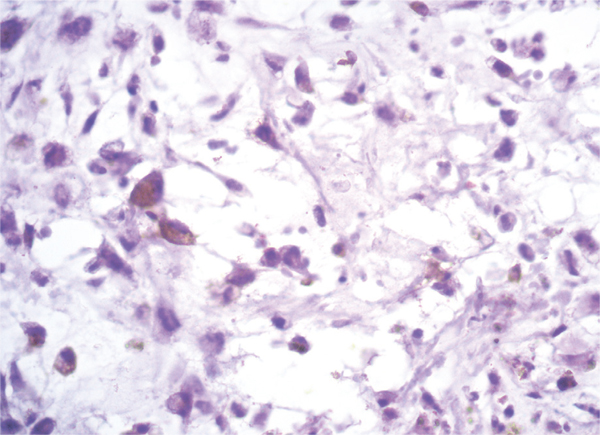
В группе поздних рецидивов (рецидив более чем через 3 года после первой операции) было 3 глиобластомы IDH1mt и 7 глиобластом IDH1wt.
К сожалению, в нашем исследовании нам не удалось подтвердить прогностическое значение мутации IDH1R132H, так как количество случаев, в которых была выявлена эта мутация, было мало. При сравнении мутации IDH1R132H в группах с ранними и поздними рецидивами точный критерий Фишера составил 0,175 (р>0,05).
Отдельно мы изучили вторую по частоте мутацию в IDH1 [1], а именно мутацию в кодоне 105 — IDH1SNPи мутацию, ассоциированную с синдромом Ли — Фраумени, — IDH1R132C. Среди впервые выявленных опухолей мутация IDH1SNPвстречалась в 4 анапластических астроцитомах и 2 глиобластомах IDH1wt. В случаях продолженного роста при поздних рецидивах она была в 6 глиобластомах IDH1wt, при этом безрецидивный период при этих опухолях в случае, когда первичной опухолью была анапластическая астроцитома (3 случая), составил 8 лет и более, в случаях сомнительного диагноза (анапластическая астроцитома или глиобластома), — 3 года. При продолженном росте в течение года после операции было всего 4 глиобластомы с мутацией IDH1SNP. При этом одна глиобластома сменила свой фенотип с IDH1mt, дополнительно приобретя мутацию IDH1SNP. Мутация IDH1R132C отмечалась лишь в одной глиобластоме, которая не дала рецидива в течение года, и в одной глиобластоме из группы поздних рецидивов (рецидив через 3 года). Однако из-за малого количества выявленных случаев было принято решение не оценивать влияние этой мутации на прогноз.
Для оценки влияния мутации IDH1105GGTSNPна фенотип мы изучили дополнительно анамнез пациентов со случаями продолженного роста, имеющих отдаленный рецидив и мутацию IDH1SNP. Если у пациента с мутацией в качестве первичной опухоли была анапластическая астроцитома, то мы относили его к группе анапластических астроцитом, если же это была глиобластома — то к группе глиобластом. Далее впервые выявленные опухоли и группа поздних рецидивов (точнее их клинический анамнез с учетом мутации) были объединены вместе и был рассчитан точный критерий Фишера. При оценке влияния мутации IDH1SNPна фенотип выявлено, что данная мутация ассоциирована с анапластическими астроцитомами (точный критерий Фишера =0,00755; p<0,05).
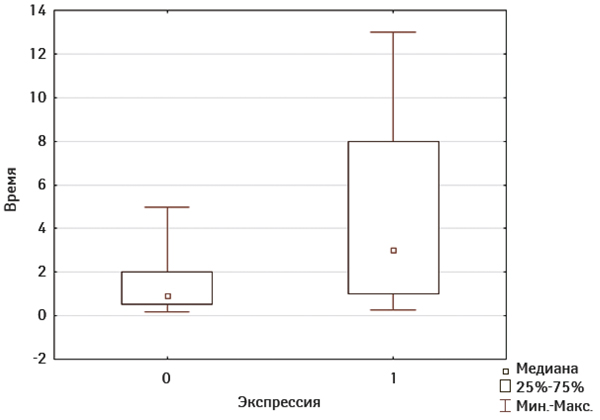
Мы оценили, имеет ли какое-то прогностическое значение мутация IDH1SNP. Для этого произведены сравнения в зависимости от наличия или отсутствия мутации между группами, давшими рецидив в течение года, и группами без такого рецидива. Однако это сравнение не показало статистической значимости мутации (χ=0,186 при р=0,666 (р>0,05)). Тогда дополнительно, для более точной оценки значимости мутации IDH1SNPдля прогноза, мы провели сравнение между группами ранних и поздних рецидивов. Для этого произведено ранжирование по времени между первой операцией и рецидивом (рис. 5) и рассчитан U-критерий Манна — Уитни (U=36,5; pточное=0,043; p<0,05), что свидетельствует о наличии связи между мутацией и более благоприятным прогнозом. Однако, учитывая, что показатели лишь незначительно меньше критического p, а при сравнении в первой группе с помощью χ статистически значимой связи не установлено, эти показатели требуют дополнительной проверки на более крупных выборках.
Обсуждение
Четкое определение фенотипа диффузных астроцитарных опухолей важно, так как от него зависит прогноз, а иногда и будущее лечение пациента, поэтому врачу важно уметь отличать различные виды глиобластом [2, 3, 6].
Полученные нами данные относительно распространенности мутации IDH1R132H трудно интерпретировать из-за малого количества наблюдений в выборках. Так, в группе впервые выявленных опухолей она составляла всего 1% выборки, что в целом не противоречит данным ВОЗ [3], но при этом в группе рецидивов она составляла 20% (такой высокий процент связан с тем, что большая часть опухолей IDH1mt была в подгруппе отдаленных рецидивов).
Отсутствие статистической значимости мутации IDH1R132H для прогноза связана, вероятно, с малым количеством наблюдений в выборке, что косвенно подтверждается наличием относительно высокого процента в группе отдаленных рецидивов и свидетельствует о клиническом значении признака. Из классификации ВОЗ 2016 г. нам известно, что опухоли с мутацией IDH1R132H имеют более благоприятный прогноз [3].
Выявленная связь мутации IDH1SNPс анапластическими астроцитомами совпадает с данными, полученными G. Acquaviva и соавторами при анализе итальянской когорты пациентов [1] и X.W. Wang — при анализе немецких и французских когорт [8].
В нашем исследовании выявлено прогностическое значение мутации IDH1SNP при сравнении групп с продолженным ростом (хотя часть исследователей утверждают, что данная мутация свидетельствует о более плохом прогнозе [8], в то время как другие авторы такой связи не отмечают [1]).
Выводы
1. Глиобластомы являются неоднородной группой опухолей. Выявление их особых подвидов может быть полезно как при подборе более эффективной стратегии лечения, так и для формирования прогноза.
2. Мутация IDH1R132H является клинически значимой при формировании прогноза течения заболевания, хотя ее статистическую значимость в нашей выборке нам подтвердить не удалось.
3. Мутация IDH1SNPассоциирована с анапластическими астроцитомами (точный критерий Фишера =0,00755; p<0,05) или с глиобластомами, которые развились из анапластических астроцитом. Разработка иммуногистохимического маркера для определения данного вида мутации в будущем могла бы быть полезной для более точного установления степени злокачественности опухоли и ее фенотипа в сомнительных случаях.
4. Мутация IDH1SNP,по нашим данным, может быть связана с более отдаленными рецидивами опухоли у пациентов (U=36,5; pточное=0,043; p<0,05).
Список использованной литературы
1. Acquaviva G., Visani M., de Biase D. et al. (2018) Prevalence of the single-nucleotide polymorphism rs11554137 (IDH1105GGT) in brain tumors of a cohort of Italian patients. Scientific Reports, 8: 4459. http://doi.org/10.1038/s41598-018-22222-y
2. Bush N.A.O., Chang S.M., Berger M.S. (2016) Current and future strategies for treatment of glioma. Neurosurgical Review, 40(1): 1–14. doi: 10.1007/s10143-016-0709-8
3. Louis D., Perry A., Reifenberger G. et al. (2016) The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathologica, 131(6): 803–820. https://doi.org/10.1007/s00401-016-1545-1
4. Lu V.M., McDonald K.L. (2018) Isocitrate dehydrogenase 1 mutation subtypes at site 132 and their translational potential in glioma. CNS Oncol., 7(1): 41–50. doi: 10.2217/cns-2017-0019
5. Ostrom Q.T., Gittleman H., Liao P. et al. (2017) CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2010–2014. https://doi.org/10.1093/neuonc/nox158
6. Paolillo M., Boselli C., Schinelli S. (2018) Glioblastoma under siege: an overview of current therapeutic strategies. Brain Sciences, 8(1): 15. http://doi.org/10.3390/brainsci8010015
7. Stancheva G., Goranova T., Laleva M. (2014) IDH1/IDH2 but not TP53 mutations predict prognosis in Bulgarian glioblastoma patients. BioMed. Res. Int., 9. https://doi.org/10.1155/2014/654727
8. Wang X.W. (2013) Prognostic impact of the isocitrate dehydrogenase 1 single-nucleotide polymorphism rs11554137 in malignant gliomas. Cancer, 119: 806–813. https://doi.org/10.1002/cncr.27798
Чертенко Таисия Николаевна
61045, Харьков, просп. Московский, 195
E-mail: taisiachertenko@gmail.com
Correspondence:
Chertenko Taisiia
195 Moskovsky ave., Kharkiv 61045
E-mail: taisiachertenko@gmail.com














Leave a comment