Перший досвід використання суперселективної рентгенваскулярної емболізації та інтраопераційної флуоресцентної візуалізації у хірургічному лікуванні локалізованого раку нирки
Думанський Ю.В. 1, Д’яченко А.М.2, Решетняк С.О.2, Фрейгофер М.В.2
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Комунальний заклад «Клінічний онкологічний диспансер», Дніпро
Резюме. Частота виявлення локального раку нирки становить від 40 до 60% у порівнянні із загальною кількістю виявлених новоутворень нирки. Тактика хірургічного лікування при локальному раку нирки, метод доступу, необхідність виконання теплової ішемії під час резекції, незважаючи на великий світовий досвід, залишаються остаточно не визначеними. Застосування сучасних методів діагностики — комп’ютерної томографії, ангіографії на передопераційному етапі — відіграє ключову роль у найточнішому визначенні локації пухлини в нирці, вивченні архітектоніки судин нирки, що дозволяє виконувати функціонально більш щадну операцію. Мета. Оптимізувати хірургічне лікування хворих з локальним раком нирки з використанням на передопераційному етапі суперселективної рентгенваскулярної емболізації та інтраопераційної флуоресцентної візуалізації в режимі інфрачервоної ділянки спектра з використанням індоціаніну зеленого (Indocyanine green). Матеріали і методи. Проводилося спостереження 2 хворих із локальним нирково-клітинним раком. Алгоритм обстеження та лікування був наступним: в обох випадках пухлини нирки було виявлено випадково під час профілактичної ультразвукової діагностики. У подальшому обом хворим виконано комп’ютерну томографію з внутрішньовенним посиленням для вивчення архітектоніки судин нирок в артеріальну фазу та визначення судини нирки, що підлягала емболізації. У якості наступного етапу лікування хворим було проведено ретроперитонеоскопічну резекцію нижнього полюсу нирки (ZERO ishemia) з визначенням кордонів резекції за допомогою інтраопераційної флуоресцентної візуалізації в режимі інфрачервоної ділянки спектра з використанням індоціаніну зеленого. Результати. 2 хворим на локальний нирково-клітинний рак виконано ретроперитонеоскопічну резекцію нирки (ZERO ishemia) з використанням інтраопераційної флуоресцентної візуалізації в режимі інфрачервоної ділянки спектра за допомогою індоціаніну зеленого. На передопераційному етапі хворим виконувалася суперселективна рентгенваскулярна емболізація. Під час операції та раннього післяопераційного періоду ускладнень не зареєстровано. Час операції становив в першому випадку 74 хв, у другому — 68 хв. Рівень інтраопераційної крововтрати в обох випадках склав близько 50 мл. Час знаходження в стаціонарі — 3 дні. В обох випадках при морфологічному дослідженні у хворих морфологічно верифікований світлоклітинний нирково-клітинний рак (pT1cN0M0R0G2). Висновки. За попередніми даними, використання суперселективної рентгенваскулярної емболізації та інтраопераційної флуоресцентної візуалізації у хірургічному лікуванні локалізованого раку нирки у порівнянні зі стандартним методом хірургічного лікування має переваги.
Одержано: 07.08.2019
Прийнято до друку: 01.10.2019
DOI: 10.32471/clinicaloncology.2663-466X.40.23130
ВСТУП
Нирково-клітинний рак (НКР) становить 2–3% серед усіх злоякісних пухлин. Загалом протягом останніх двох десятиріч відмічається щорічне підвищення частоти виникнення НКР як у Європі, та і у світі загалом. Частота захворюваності серед чоловіків у 1,5 раза вища, ніж серед жінок. Пік захворюваності припадає на вік 60–70 років [1]. Етіологічні фактори включають такі складові способу життя, як куріння, надмірна маса тіла, підвищений артеріальний тиск [2]. У 2017 р. загальна кількість нових випадків НКР в Україні становила 4776 випадків, при цьому від вказаної хвороби померло 1944 осіб. Незважаючи на покращення методів діагностики цієї патології, високу частоту (56,6%) локального раку нирки, у 16,5% хворих серед виявлених у 2018 р. відмічали III, а у 21,9% — IV стадію захворювання. Наведені дані свідчать про те, що підвищення ефективності лікування НКР лежить у площині використання, з одного боку, адекватних методів діагностики (ультразвукове дослідження (УЗД) та комп’ютерна томографія (КТ)), а з іншого — нових максимально сприятливих і радикальних методів корекції [3].
Систематичний огляд досліджень, присвячених застосуванню передопераційної суперселективної емболізації сегментарних ниркових судин при хірургічному лікуванні локального раку нирки, засвідчує можливість та доцільність використання цієї методики. Це дозволяє не виконувати традиційну інтраопераційну селективну або неселективну теплову ішемію, що супроводжується ризиком травматизації судин під час дисекції та негативно впливає на ниркову функцію у подальшому після припинення ішемії [4–11].
Аналіз літературних джерел показує, що натепер уже з’явилися дані щодо можливих переваг використання інтраопераційної флуоресцентної візуалізації в режимі інфрачервоної ділянки спектра, що впливає на ступінь інтраопераційної візуалізації та наочності кордонів при резекції нирки [12–16].
Об’єкт та методи дослідження
Проведено аналіз хірургічного лікування 2 хворих із локальним НКР. Хворі були оперовані на базі КЗ «Клінічний онкологічний диспансер» Дніпропетровської обласної ради».
Комплекс діагностичних досліджень був наступним: в обох випадках пухлини нирки були виявлено випадково під час профілактичного УЗД. У подальшому в обох випадках хворим виконано КТ з внутрішньовенним посиленням для вивчення архітектоніки судин нирок в артеріальну фазу. В обох випадках було діагностовано наявність пухлинного новоутворення нижнього полюсу нирки 5 см та 2,5 см, визначено нижньополярну артерію: в одному випадку — сегментарну, у іншому — субсегментарну, що живить частину нирки з пухлиною (рис. 1).
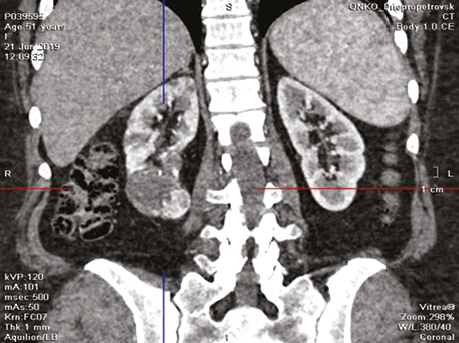
У якості наступного етапу обом хворим виконано рентгенваскулярну суперселективну емболізацію інтервенційним радіологом в одному випадку сегментарної у другому — субсегментарної артерії, що живить частину нирки з пухлиною. Для емболізації використовувалися спіралі Nester (Cook). Ускладнень під час та після радіологічної інтервенції не зареєстровано.
У подальшому, безпосередньо перед операцією, обом хворим повторно виконано КТ з внутрішньовенним контрастуванням. В обох випадках визначено повну селективну ішемію ділянки нирки, що підлягала резекції (рис. 2, 3).
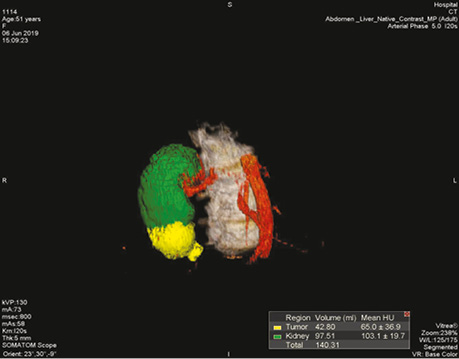
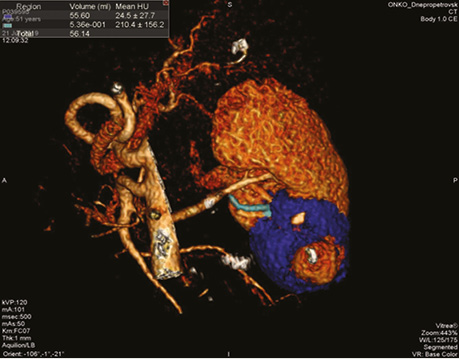
Хворим під ендотрахеальним наркозом проведено ретроперитонеоскопічну резекцію нижнього полюсу нирки (ZERO ishemia) з визначенням кордонів резекції за допомогою інтраопераційної флуоресцентної візуалізації в режимі інфрачервоної ділянки спектра з використанням індоціаніну зеленого.
Аналіз ранніх післяопераційних ускладнень проводили відповідно до класифікації Клав’єна — Діндо [17]. Алгоритм діагностичних заходів та критерії морфологічної верифікації застосовували згідно з рекомендаціями National Comprehensive Cancer Network (NCCN), European Association of Urology (EAU).
Результати
Нами за останній час 2 хворим на локальний НКР виконано ретроперитонеоскопічну резекцію нирки (ZERO ishemia) з використанням інтраопераційної флуоресцентної візуалізації в режимі інфрачервоної ділянки спектра за допомогою індоціаніну зеленого. На передопераційному етапі хворим виконували суперселективну рентгенваскулярну емболізацію. В обох випадках хворі були жінками. Вік хворих був 66 та 51 рік.
Під час операції та раннього післяопераційного періоду ускладнень не зареєстровано. Час операції становив у першому випадку — 74 хв, у другому — 68 хв. Рівень інтраопераційної крововтрати в обох випадках становив близько 50 мл. Час знаходження в стаціонарі — 3 дні. В обох випадках при морфологічному дослідженні у хворих морфологічно верифіковано світлоклітинний НКР (pT1cN0M0R0G2).
Обговорення
Два наведених нами випадки з певною часткою достовірності дозволяють нам рекомендувати переваги цієї хірургічної методики та використання передопераційної рентгенваскулярної емболізації. При використанні описаного вище алгоритму лікування раку нирки застосування теплової ішемії зі всіма можливими ризиками та наслідками стає недоцільним. Невиправданою також видається інтраопераційна оцінка хірургічних кордонів з використанням cito-діагностики, беручи до уваги, що при такій методиці кордони резекції встановлюються заздалегідь, а не інтраопераційно, що мінімізує наявність позитивних «хірургічних країв». Також рівень крововтрати при цій методиці мінімальний, що сприяє більш швидкому відновленню хворих у післяопераційний період. Слід також зазначити, що, враховуючи доступ (ретроперитонеоскопічний), у хворих після операції був практично відсутній больовий синдром, обидві хворі потребували введення нестероїдних протизапальних препаратів тільки в першу добу. Незважаючи на те що на результати лікування це ускладнення особливого впливу не чинить, слід зазначити, що практично відсутня можливість виникнення троакарних кил. При виконанні цього алгоритму хірургічного лікування хворих на локальний рак нирки у всіх випадках не відзначено жодних післяопераційних порушень моторики шлунково-кишкового тракту, які б потребували медикаментозної корекції.
Висновки
За попередніми даними, використання суперселективної рентгенваскулярної емболізації та інтраопераційної флуоресцентної візуалізації у хірургічному лікуванні локалізованого раку нирки у порівнянні зі стандартним методом хірургічного лікування має переваги. Автори цієї роботи вбачають перспективність продовження вивчення та впровадження запропонованого алгоритму обстеження та лікування хворих на локальний рак нирки.
Список використаної літератури
- European Network of Cancer Registries. Eurocim version 4.0. European incidence database V2.3, 730 entity dictionary (2001), Lyon.
- Lipworth, L., Tarone, R. E., & McLaughlin, J. K. (2006). The epidemiology of renal cell carcinoma. J Urol, 186(6), 2353–2358. dоі: 10.1016/j.juro.2006.07.130.
- Horan, J. J., Robertson, C. N., Choyke, P. L. Frank, J. A., Miller, D. L., Pass, H. I. & Linehan, W. M. (1989). The detection of renal carcinoma extension into the renal vein and inferior vena cava: a prospective comparison of venocavagraphy and magnetic resonance imaging. J Urol, 142, 943–948. dоі: 10.1016/s0022-5347(17)38948-6.
- Jia, Z., Li, X. S., Zhang, C. J., Yang, K. W., Peng, D., Yang, J. H.,… Zhou, L. Q. (2017). The impact to operation safety of preoperative renal artery embolization for management of diameter≥10 cm renal cell carcinoma. Zhonghua Wai Ke Za Zhi, 55(10), 738–741. doi: 10.3760/cma.j.issn.0529-5815.2017.10.004.
- Provenza, G., Sparagna, A., Cunsolo, G. V., Tierno, S. M., Centanini, F., Bellotti, C., & Mezzetti, G. (2013). Renal artery embolization in a gross kidney neoplasm. G Chir, 34(9–10), 263–266.
- Heng‐Li Shen, Shih‐Chieh Chueh, Ming‐Kuen Lai, Chen‐Han Welfred Wu, Chun‐Chieh Huang, Yuk‐Ming Tsang,… Hong‐Jeng Yu (2008). Balloon occlusion of the renal artery in laparoscopic partial nephectomy. Int J Urol, 15(11), 967–970. doi: 10.1111/j.1442-2042.2008.02158.x.
- Lin, P. H., Terramani, T. T., Bush, R. L., Keane, T. E., Moore, R. G., & Lumsden, A. B. (2003). Concomitant intraoperative renal artery embolization and resection of complex renal carcinoma. J Vascular Surgery, 38(3), 446–450. doi: 10.1016/s0741-5214(03)00429-4.
- Kalman, D., & Varenhorst, E. (1999). The role of arterial embolization in renal cell carcinoma. Scand J Urol Nephrol, 33(3), 162–170. doi: 10.1080/003655999750015934.
- Bakal, C. W., Cynamon, J., Lakritz, P. S., & Sprayregen, S. (1993). Value of preoperative renal artery embolization in reducing blood transfusion requirements during nephrectomy for renal cell carcinoma. J Vasc Interv Radiol, 4(6), 727–731. doi: 10.1016/s1051-0443(93)71958-2.
- Popov, S. V., Guseinov, R. G., Martov, A. G., & Muratov, T.M. (2017). Biomarkers of acute hypoxia-reoxygenation injury to nercycites during laparoscopic resection of renal parenchyma. Urologiia, 6, 120–125.
- Volpe, A., Blute, M. L., & Ficarra, V. (2015). Renal Ischemia and Function After Partial Nephrectomy: A Collaborative Review of the Literature. European Urology, 68(1), 61–74. doi: 10.1016/j.eururo.2015.01.025.
- Tobis, S., Knopf, J., Silvers, C., Yao, J., Rashid, H., Wu, G., & Golijanin, D. (2011). Near infrared fluorescence imaging system for laparoscopic partial nephrectomy. J Urol, 25(6), 9606–9613. doi: 10.1016/j.juro.2011.02.2701.
- Ferroni, M. C., Sentell, K., & Abaza, R. (2018). Current Role and Indications for the Use of Indocyanine Green in Robot-assisted Urologic Surgery. Eur Urol Focus, 4(5), 648–651. doi: 10.1016/j.euf.2018.07.009.
- Hekman, M. C. H., Rijpkema, M., Langenhuijsen, J. F., Boerman, O. C., Oosterwijk, E., & Mulders, P. F. A. (2018). Intraoperative Imaging Techniques to Support Complete Tumor Resection in Partial Nephrectomy. Eur Urol Focus, 4(6), 960–968. doi: 10.1016/j.euf.2017.04.008.
- Bjurlin, M. A., McClintock, T. R., & Stifelman, M. D. (2015). Near-infrared fluorescence imaging with intraoperative administration of indocyanine green for robotic partial nephrectomy. Curr Urol Rep, 16(4), 20. doi: 10.1007/s11934-015-0495-9.
- Mitsui, Y., Shiina, H., Arichi, N., Hiraoka, T., Inoue, S., Sumura, M.,… Igawa, M. (2012). Indocyanine green (ICG)-based fluorescence navigation system for discrimination of kidney cancer from normal parenchyma: application during partial nephrectomy. Int Urol Nephrol, 44(3), 753–759. doi: 10.1007/s11255-011-0120-x.
- Dindo, D., Demartines, N., & Clavien, P. A. (2004). Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg, 240(2), 205–213. doi: 10.1097/01.sla.0000133083.54934.ae.
Первый опыт использования суперселективной рентгенваскулярной эмболизации и интраоперационной флуоресцентной визуализации в хирургическом лечении локального рака почки
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
КУ «Клинический онкологический диспансер», Днепр
Резюме. Частота определения локального рака почки составляет от 40 до 60% в сравнении с общим количеством впервые выявленных новообразований почки. Тактика хирургического лечения при локальном раке почки, метод доступа, необходимость выполнения тепловой ишемии во время резекции, несмотря на большой мировой опыт, остаются окончательно не определенными. Применение современных методов диагностики — компьютерной томографии, ангиографии на предоперационном этапе — играет ключевую роль в наиболее точном определении локации опухоли в почке, изучении архитектоники сосудов почки, что позволяет выполнять функционально более щадящую операцию. Цель. Оптимизировать хирургическое лечение пациентов с локальным раком почки с использованием на предоперационном этапе суперселективной рентгенваскулярной эмболизации и интраоперационной флуоресцентной визуализации в режиме инфракрасной области спектра с использованием индоцианина зеленого (Indocyanine green). Материалы и методы. Проводилось наблюдение двух пациентов с локальным почечно-клеточным раком. Алгоритм исследования и лечение были следующими: в обоих случаях опухоли почки были выявлены случайно во время профилактической ультразвуковой диагностики. В дальнейшем обоим пациентам выполнена компьютерная томография с внутривенным усилением для изучения архитектоники сосудов почки в артериальную фазу и определения сосудов почки, которые подлежали эмболизации. В качестве следующего этапа лечения пациентам была проведена ретроперитонеоскопическая резекция нижнего полюса почки (ZERO ishemia) с определением границ резекции при помощи интраоперационной флуоресцентной визуализации в режиме инфракрасного участка спектра с использованием индоцианина зеленого. Результаты. 2 больным c локальным почечно-клеточным раком выполнена ретроперитонеоскопическая резекция почки (ZERO ishemia) с использованием интраоперационной флуоресцентной визуализации в режиме инфракрасного участка спектра при помощи индоцианина зеленого. На предоперационном этапе больным выполняли суперселективную рентгенваскулярную эмболизацию. Во время операции и раннего послеоперационного периода осложнений не зарегистрировано. Время операции составило в первом случае 74 мин, во втором — 68 мин. Уровень интраоперационной кровопотери в обоих случаях составил около 50 мл. Время нахождения в стационаре — 3 дня. В обоих случаях при морфологическом исследовании у больных морфологически верифицирован светлоклеточный почечно-клеточный рак (pT1cN0M0R0G2). Выводы. По предварительным данным, использование суперселективной рентгенваскулярной эмболизации и интраоперационной флуоресцентной визуализации в хирургическом лечении локализованного рака почки в сравнении со стандартным методом хирургического лечения имеет преимущества.
локализованный рак почки, ретроперитонеоскопическая резекция, индоцианин зеленый, суперселективная рентгенваскулярная эмболизация сосудов почки.
Адреса:
Решетняк Сергій Олександрович
49094, Дніпро, вул. Космічна, 21
Комунальний заклад «Клінічний онкологічний діспансер»
E-mail: rewetnyak2011@gmail.com
Correspondence:
Reshetniak Sergii
Dnipro Regional Oncological Centre
21 Kosmichna Str., Dnipro 49094
E-mail: rewetnyak2011@gmail.com














Leave a comment