Перспективи лікування перитонеального карциноматозу раку шлунка. Наративний огляд наукової літератури
Пепенін М.О.1, Кондрацький Ю.М.1, Добржанський О.Ю.1, Колесник А.В.1, Городецький А.В.1, Копчак К.В.1, Земсков С.В.2
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Національний медичний університет ім. О.О. Богомольця, Київ, Україна
Резюме. Мета огляду: систематизувати сучасні дані щодо підходів до лікування перитонеального карциноматозу (ПК) раку шлунка (РШ), а також окреслити перспективи інтеграції інтраперитонеальної хімієтерапії, зокрема внутрішньочеревної аерозольної хімієтерапії під тиском (Pressurized intraperitoneal aerosol chemotherapy — PIPAC), у клінічну практику в Україні. Об’єкт дослідження. Клінічні та експериментальні джерела, присвячені лікуванню перитонеально дисемінованого РШ, з акцентом на локорегіонарні підходи. Методи. Проведено наративний огляд сучасної медичної літератури, включно з міжнародними клінічними рекомендаціями Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN), Міжнародної групи з онкопатології поверхні очеревини (Peritoneal Surface Oncology Group International — PSOGI), Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO)), результатами клінічних досліджень. Особливу увагу приділено індексам перитонеального канцероматозу (Peritoneal cancer index — PCI) і повноти циторедукції (completeness of cytoreduction — CC), ролі діагностичної лапароскопії, оцінці перитонеальної регресії (peritoneal regression grading score — PRGS), методам локорегіонарної терапії (гіпертермічній внутрішньоочеревинній хімієтерапії (Hyperthermic intraperitoneal chemotherapy — HIPEC), PIPAC, неоад’ювантній інтраперитонеальній та системній хімієтерапії (Neoadjuvant intraperitoneal-systemic chemotherapy — NIPS). Результати. Встановлено, що системна хімієтерапія залишається золотим базисом лікування ПК РШ, однак її ефективність обмежена через плазмоперитонеальний бар’єр. Використання внутрішньочеревної хімієтерапії — як у вигляді HIPEC після циторедуктивної хірургії, так і у формі багаторазової PIPAC — зумовлює обнадійливі результати. Рандомізовані дослідження небагаточисельні (DRAGON-01), але підтверджують доцільність бідирективної терапії (поєднання системної та інтраперитонеальної хімієтерапії) для підвищення загальної виживаності, і навіть досягнення конверсії в резектабельному процесі. PIPAC відзначається безпекою, низькою токсичністю, повторюваністю та можливістю застосування навіть у пацієнтів з високим PCI. Індекс PRGS виявився інформативним інструментом для прогнозування ефективності лікування. З огляду на потенціал PIPAC його подальше дослідження та поступове впровадження в Україні є обґрунтованим та необхідним. Висновки. ПК при РШ є складною проблемою, яка потребує комплексного підходу в лікуванні. Комбіновані стратегії, що включають системну, інтраперитонеальну хімієтерапію та хірургію, у ретельно відібраних пацієнтів можуть підвищити виживаність. PIPAC — перспективна опція з доведеною безпекою, яка потребує подальшої інтеграції в українську онкологічну практику.
Одержано 16.04.2025
Прийнято до друку 2.05.2025
DOI: 10.32471/clinicaloncology.2663-466X.34391
ВСТУП
РШ залишається однією з провідних причин смертності від злоякісних новоутворень у світі з особливо високою захворюваністю в країнах Східної Азії, Східної Європи та України [1]. Близько 40% пацієнтів на момент встановлення діагнозу вже мають метастатичне ураження, і одним із найчастіших шляхів дисемінації є поширення пухлинних клітин на очеревину — ПК. Останніми десятиріччями стандарти лікування перитонеальної дисемінації значно підвищилися в контексті поглиблення знань і розуміння захворювання. На сьогодні відомо про 3 основні патерни перитонеального метастазування (трансмезотеліальний, транслімфатичний та поверхневого росту) залежно від біології злоякісних потенціалів та морфологічної характеристики вільних перитонеальних ракових клітин, класичної концепції оцінки ПК, що походить від РШ, прийнято вважати, що це, найімовірніше, місцевопрогресуючий, ніж системний стан [2].
Наявність ПК визначає вкрай несприятливий прогноз: медіана виживаності при проведенні лише системної хімієтерапії становить близько 9–11 міс [3].
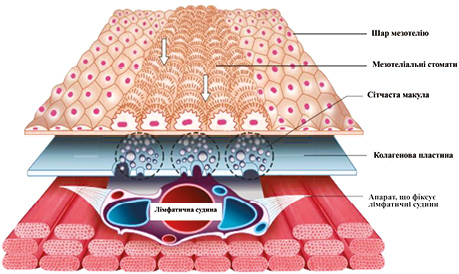
Обмежена ефективність системної хімієтерапії пояснюється існуванням плазмоперитонеального бар’єра, який через свою комплексну будову (рис. 1) ускладнює проникнення великих молекул цитостатиків в очеревину та безпосередньо черевну порожнину [4]. Крім того, ПК часто супроводжується асцитом, кишковою непрохідністю, кахексією, що значно погіршує якість життя хворого та обмежує можливості агресивного лікування [5].
Сьогодні паліативна системна хімієтерапія залишається основним методом лікування поширеного РШ відповідно до сучасних настанов (NCCN, ESMO) [7, 8]. Проте при ПК активно вивчаються локорегіонарні методи доставки хімієпрепаратів безпосередньо до черевної порожнини. До них належать:
- HIPEC, що виконується одноразово після циторедуктивної хірургії [9];
- NIPS із застосуванням внутрішньочеревного паклітакселу через імплантований порт [10];
- PIPAC, що дозволяє багаторазово і безпечно доставляти препарати у вигляді аерозолю під час лапароскопії [11].
Особливої уваги заслуговує методика PIPAC, яка вперше була застосована у 2013 р. й довела свою технічну безпеку, можливість повторного застосування, контроль за ефективністю (через повторювані біопсії очеревини) та перспективи для поєднання із системною хімієтерапією [11].
У нещодавно завершеному багатоцентровому дослідженні DRAGON-01 виявлено переконливі докази того, що комбінація системної хімієтерапії із внутрішньочеревним паклітакселом суттєво підвищує загальну виживаність пацієнтів із ПК РШ — до 19,4 міс [12]. Аналогічно в дослідженнях з використанням PIPAC у першій лінії терапії поєднано із системною хімієтерапією зафіксовано медіану виживаності до 20 міс, що наближає цю патологію до хронічного перебігу [13].
Лікування перитонеальних метастазів за допомогою поєднання системної хімієтерапії, циторедуктивних хірургічних процедур (cytoreductive surgery — CRS) та гіпертермічної або аерозольної внутрішньочеревної хімієтерапії досягло багатонадійних результатів у лікуванні ПК РШ, що може допомогти ретельно відібраним пацієнтам [14, 15]. Проте, попри обнадійливі результати, локорегіонарні методи лікування ще не є стандартом і потребують подальших досліджень. Відсутність рандомізованих випробувань, гетерогенність пацієнтських груп та відмінності в хімієтерапевтичних режимах ускладнюють інтерпретацію результатів. Так, необхідна критична оцінка доказової бази з урахуванням сучасних настанов, що і є предметом цього огляду.
МЕТА
Проаналізувати сучасні терапевтичні стратегії лікування ПК РШ та обґрунтувати доцільність застосування інтраперитонеальної хімієтерапії, зокрема PIPAC, як ефективного й безпечного компонента мультимодального підходу до лікування цієї категорії пацієнтів.
ОБʼЄКТ І МЕТОДИ
Ця робота — наративний огляд наукової літератури. Джерела відбиралися за допомогою пошуку в базах даних PubMed / MEDLINE за ключовими словами: «gastric cancer», «peritoneal carcinomatosis», «intraperitoneal chemotherapy», «PIPAC», «HIPEC», «NIPS». Основну увагу приділено результатам проспективних і рандомізованих досліджень (PHOENIX-GC, DRAGON-01), серіям випадків і фазам II клінічних досліджень із використанням PIPAC, систематичним оглядам та метааналізам (до 2025 р. включно), клінічним настановам NCCN, ESMO, PSOGI. До аналізу включено лише англомовні та україномовні публікації з чітко описаними критеріями залучення та лікувальними протоколами. Не розглядалися роботи без даних щодо виживаності або без кількісної оцінки ефективності.
РЕЗУЛЬТАТИ
У пацієнтів з ПК РШ менш сприятливий прогноз, ніж при інших локалізаціях метастазування. Стандартна паліативна хімієтерапія (наприклад FOLFOX, XELOX, FLOT, препарати платини + фторпіримідини ± імунотерапія) забезпечує медіану загальної виживаності (Overall Survival — OS) близько 9–11 міс [3]. Частота хірургічних конверсій залишається низькою (~30–35%) [10].
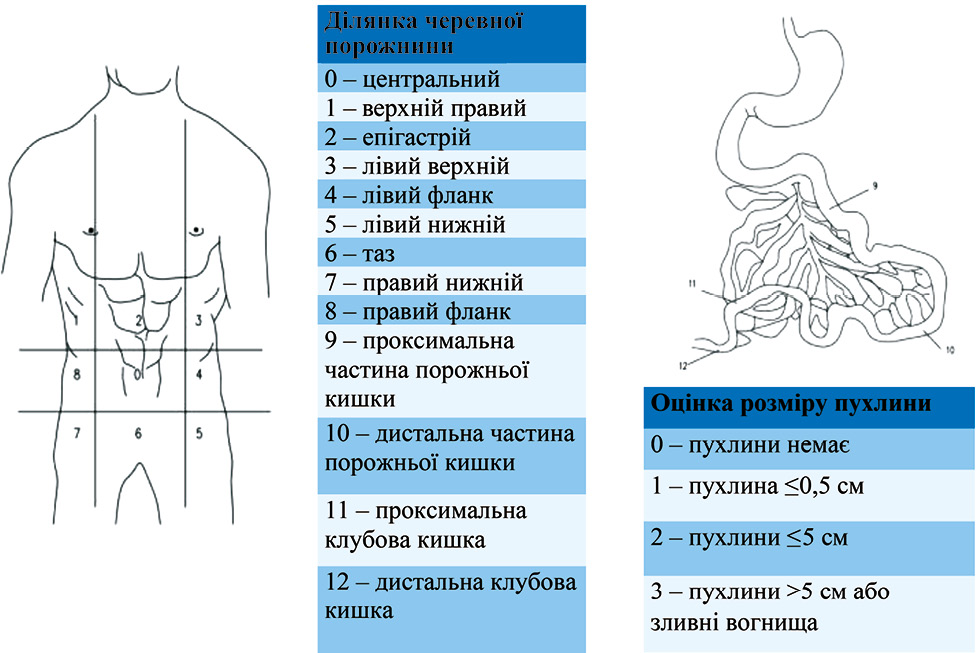
Найбільш важливим для оцінки ПК РШ є проведення діагностичної лапароскопії з метою адекватного виявлення та оцінки перитонеальних пухлинних вузлів, що впливає на розуміння та перспективи для кожного випадку окремо. Адекватна оцінка PCI та CC мають вирішальне значення та вплив на вибір подальшого обсягу та тактики лікування захворювання.
Система класифікації PCI розподіляє черевну порожнину на 9 секторів, а тонку кишку — на 4 додаткові сектори. Оцінка поширеності ураження в кожному секторі підсумовується для визначення загальної картини (рис. 2).
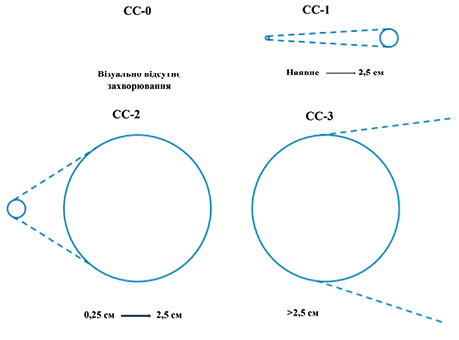
CC слугує важливим прогностичним критерієм виживаності пацієнтів з ПК РШ. Цей показник оцінюється перед та після завершення циторедуктивної операції. Класифікація розрізняє повну циторедукцію (CC-0 або CC-1) і неповну (CC-2 або CC-3) (рис. 3). Оцінка СС-0 вказує на відсутність видимого вторинного ураження очеревини в операційному полі, тоді як оцінка СС-1 означає, що після циторедукції залишаються вузли розміром <2,5 см. CC-2 позначає вузли розміром від 2,5 до 5 см, а CC-3 — вузли розміром >5 см або конгломерат нерезектабельних пухлинних вузлів у будь-якій ділянці черевної порожнини або таза. CC-1 вважається повною циторедукцією, якщо проводиться періопераційна внутрішньочеревна хімієтерапія, оскільки вважається, що вузли є проникними для хімієтерапії.
При діагностуванні синхронного морфологічно верифікованого ПК РШ початковим стандартом лікування є системна хімієтерапія, за якої через 6 міс має слідувати МСКТ-рестадіювання та розгляд питання про візуалізацію на second-look діагностичній лапароскопії. У разі збереження РСІ <10 стабільного перебігу захворювання, відсутності позаочеревинного та віддаленого метастатичного ураження і задовільного стану здоров’я деякі пацієнти можуть отримати перевагу в загальній та безрецидивній виживаності після проведення CRS із внутрішньочеревною хімієтерапією [17, 18] (рис. 4).
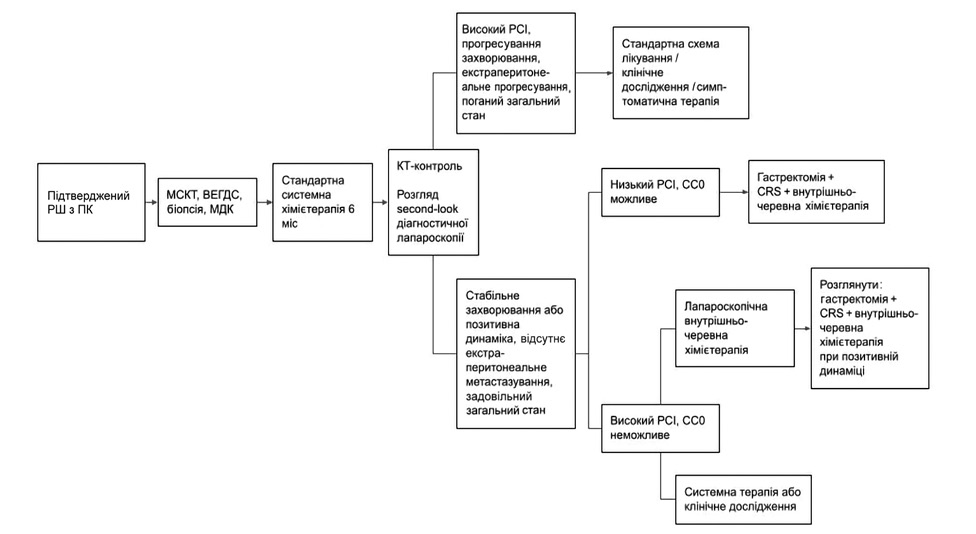
Рис. 4. Чиказький консенсус щодо злоякісних новоутворень очеревини: лікування ПК РШ
Примітки: МСКТ — мультиспіральна компʼютерна томографія; ВЕГДС — відеоезофагогастродуоденоскопія; МДК — мультидисциплінарний консиліум.
На жаль, не існує стандартизованого підходу до CRS для пацієнтів з ПК РШ. Однак було виявлено кілька незалежних прогностичних факторів OS. За результатами метааналізу, циторедукція СС0 є незалежним предиктором OS пацієнтів, які проходять ПХТ та HIPEC через ПК РШ. Циторедукція СС-0 порівняно з циторедукцією СС-1 асоціюється з вищими показниками 1- та 3-річної виживаності (88,9 vs 41,2%; 63,6 vs 6,1%; медіана (m) OS 27,7 vs 15,0 міс; відношення ризиків (Hazard ratio — HR) = 0,54; p=0,003) [19].
Y. Yonemura та співавт. виявили, що повна циторедукція можлива у 91% пацієнтів з PCI ≤6, але тільки у 42% пацієнтів з індексом PCI ≥7 [2]. Перснеподібноклітинний РШ, який загалом має менш сприятливий прогноз, також призводить до незадовільних результатів у пацієнтів з ПК РШ, яким виконують CRS з HIPEC. В одному з досліджень повідомлялося про 72% повної циторедукції, 46% ускладнень і значно нижчу середню виживаність у хворих, у яких не досягнуто повної циторедукції.
Обсяг гастректомії в основних дослідженнях різнився. У серії з 107 пацієнтів Y. Yonemura та співавт. 68% хворим виконано тотальну гастректомію, а 32% — субтотальну гастректомію. У рандомізованому дослідженні X.J. Yang та співавт. 24% пацієнтів у групах CRS і HIPEC виконали тотальну гастректомію, а 76% — субтотальну гастректомію. У жодному з досліджень не виявлено, що об’єм гастректомії є незалежним предиктором виживання [14]. Хоча регіональні практики лімфаденектомії (D1 / D2 / D3) відрізняються між східною та західною популяціями при резектабельному РШ, даних щодо пацієнтів з ПК РШ, які перенесли CRS та HIPEC, бракує.
Втім, враховуючи дані китайського метааналізу, НІРЕС з профілактичною метою після радикальної гастректомії, тобто для пацієнтів з предикторами високого ризику перитонеальної дисемінації (T4a-b, N1-3, M1(cyt+) PCI 0), але без неї як такої, виявлено статистично достовірне підвищення показників виживаності: 1-річна виживаність становила 88,7% у групі HIPEC проти 73,6% у контрольній групі (відношення шансів (Odds ratio — OR) = 5,10; 95% довірчий інтервал (ДІ) 1,41–18,45; p=0,01), 3-річна — 59,2 проти 43,7% (OR=2,07; 95% ДІ 1,43–2,99; p <0,001), а 5-річна — 50,3 проти 39,0% відповідно (OR=1,96; 95% ДІ 1,27–3,04; p=0,003). HIPEC достовірно знижувало частоту загального рецидиву пухлини (OR=0,41; 95% ДІ 0,29–0,59; p <0,001) та перитонеального рецидиву (OR=0,24; 95% ДІ 0,13–0,42; p<0,001). При цьому частота серйозних ускладнень не відрізнялася між групами за більшістю показників, однак відзначено підвищений ризик розвитку ниркової недостатності (OR=2,44; 95% ДІ 1,12–5,28; p=0,02) та легеневої недостатності (OR=6,03; 95% ДІ 3,08–11,80; p <0,001), що потребує ретельного відбору пацієнтів для цієї технології [19] (табл. 1).
| Показник | Група, % | Статистична значущість |
|
| HIPEC | контроль | ||
| 1-річна виживаність |
88,7 | 73,6 | НR=5,10; 95% ДІ 1,41–18,45; p=0,01 |
| 3-річна виживаність |
59,2 | 43,7 | НR=2,07; 95% ДІ 1,43–2,99; p <0,001 |
| 5-річна виживаність |
50,3 | 39,0 | НR=1,96; 95% ДІ 1,27–3,04; p=0,003 |
| Перитонеальний рецидив |
7,6 | 29,4 | НR=0,24; 95% ДІ 0,13–0,42; p <0,001 |
Методика CRS+HIPEC передбачає максимальну циторедукцію з подальшим одноразовим інтраперитонеальним введенням підігрітих хімієпрепаратів. При досягненні повної циторедукції (CC-0 та R0) у ретроспективних серіях фіксується mOS від 15 до 30 міс залежно від поширеності ураження. Безрецидивна виживаність без прогресування (disease-free survival — DFS) у цій популяції оцінюється в межах 7–11 міс, що свідчить про тривалий контроль хвороби у залучених пацієнтів. Водночас процедура супроводжується високою токсичністю: тяжкі післяопераційні ускладнення (стадія ≥III за Clavien — Dindo (табл. 2) виникають у 20–30% хворих, а госпітальна летальність сягає 3–5% [20, 21].
| Ступінь | Опис |
| Ступінь І | Будь-яке відхилення звичайного післяопераційного ведення без необхідності фармакологічної, хірургічної, ендоскопічної корекції або радіологічних інтервенцій. Дозволяється: антиеметики, антипіретики, діуретики та електроліти, анальгетики. Фізіотерапія. |
| Ступінь ІІ | Потребує фармакологічної корекції препаратами, не зазначеними в першому пункті. До нього належать також гемотрансфузія, антибіотикотерапія та парентеральне харчування |
| Ступінь ІІІ
a) b) |
Потребує хірургічного, ендоскопічного або радіологічного втручання:
втручання під регіонарною або місцевою анестезією втручання під загальним знеболенням |
| Ступінь IV
a) b) |
Ускладнення, яке загрожує життю та потребує інтенсивної терапії:
з дисфункцією одного органа мультиорганна дисфункція |
| Ступінь V | Смерть |
Комбінований підхід із застосуванням внутрішньочеревного паклітакселу через імплантовану перитонеальну порт-систему поєднано із системною хімієтерапією вивчався в Японії в багатоцентровому рандомізованому дослідженні PHOENIX-GC [10]. У цьому дослідженні 183 пацієнти з підтвердженим ПК РШ були рандомізовані у 2 групи: NIPS — експериментальна група (внутрішньочеревний паклітаксел + S-1), контрольна група (в/в цисплатин + S-1). mOS у групі NIPS становила 17,7 міс проти 15,2 міс у контрольній групі (р=0,080; HR=0,72), тобто є клінічно значущою, але статистично незначущою різницею. Частка хірургічних резекцій після лікування у групі NIPS становила 43%, з них 72% були R0-резекціями, що відповідає 31% пацієнтів від загальної кількості в цій групі. Не менш важливим показником стала частота регресії асциту та симптоматичного поліпшення стану — понад 60%.
Попри те що дослідження не досягло статистичної значущості щодо основної кінцевої точки, воно стало підґрунтям для подальших досліджень із внутрішньочеревним паклітакселом, зокрема DRAGON-01 (Китай), результати якого були переконливішими, і водночас ці результати реально екстраполювати на європейську та українську популяцію, оскільки пацієнти отримували аналогічну схему системної поліхімієтерапії.
DRAGON-01 — це рандомізоване багатоцентрове дослідження III фази, що охоплювало лише осіб з первинним ПК РШ. Усього до дослідження залучено та рандомізовано 184 пацієнтів (n=92 в кожній групі). Середній PCI в обох групах був приблизно однаковий (NIPS середній PCI — 15,0±6,1; група контролю — 14,8±6,4). У групі NIPS застосовували внутрішньочеревний паклітаксел (40 мг/м², щотижнево, через порт-систему) у комбінації з FOLFOX, тоді як контрольна група отримувала тільки FOLFOX. mOS в експериментальній групі (NIPS) становила 19,4 міс порівняно з 13,9 міс у контрольній групі (HR=0,66; p=0,0056). Частота клінічного регресу асциту — 60,9% у NIPS проти 35,6% у контрольній групі (p <0,01). Однорічна виживаність досягла 69,6 проти 54,1% відповідно. Частка хірургічних резекцій — 50,7% у групі NIPS проти 35,1% у контрольній; R0-резекція серед прооперованих — 80,4% (n=37 з 46) у групі NIPS та 32 (34,8%) пацієнти з контрольної групи були прооперовані, з них 22 (68,8%) особи досягли R0-резекції [12].
Отже, результати PHOENIX-GC підтвердили безпеку і потенційну ефективність внутрішньочеревного паклітакселу, а DRAGON-01 посилило доказову базу на користь стратегії NIPS у лікуванні ПК.
PIPAC-OPC2 — це проспективне мультицентрове дослідження, проведене в Італії та Франції, в якому оцінювалися ефективність та безпека бідирективної поліхімієтерапії — поєднання системної хімієтерапії з PIPAC — у лікуванні пацієнтів із синхронним ПК, зумовленим РК [13].
У дослідження залучено 54 пацієнтів, яким проводили щонайменше 1 процедуру PIPAC поєднано із системною хімієтерапією першої лінії (здебільшого платина + фторпіримідини). Середній PCI становив 14 (діапазон 2–30). Загалом хворі отримували від 1 до 4 сеансів PIPAC з оцінкою відповіді за Шкалою оцінки перитонеальної регресії (Peritoneal Regression Grading Score — PRGS) (табл. 3, рис. 5) [22]. mOS становила 19,6 міс, 1-річна виживаність — 53%, гістологічна регресія пухлини (PRGS ≤2) після ≥2 процедур досягнута у 54,5% пацієнтів, конверсія в хірургію після PIPAC відбулася у 26% (n=14) хворих, з яких 78,6% (n=11) досягли R0-резекції, хімієтерапевтична токсичність ≥III ступеня (CTCAE) виникла лише у 3,7% осіб, летальність — 0%.
| Ступінь | Пухлинні клітини | Ознаки регресії |
| PRGS 1 — повна відповідь | Відсутні пухлинні клітини | Рясний фіброз та/або ацелюлярні скупчення муцину та/або некроз за типом інфаркту |
| PRGS 2 — виражена відповідь | Невелика кількість пухлинних клітин (ізольовані або малі скупчення) | Фіброз та/або ацелюлярні скупчення муцину та/або некроз за типом інфаркту переважають над пухлинними клітинами |
| PRGS 3 — помірна відповідь | Переважання пухлинних клітин | Пухлинні клітини переважають над фіброзом та/або ацелюлярними скупченнями муцину та/або некрозом за типом інфаркту |
| PRGS 4 — відсутність відповіді | Пухлинні клітини добре помітні (при найменшому збільшенні) | Відсутні ознаки регресії |
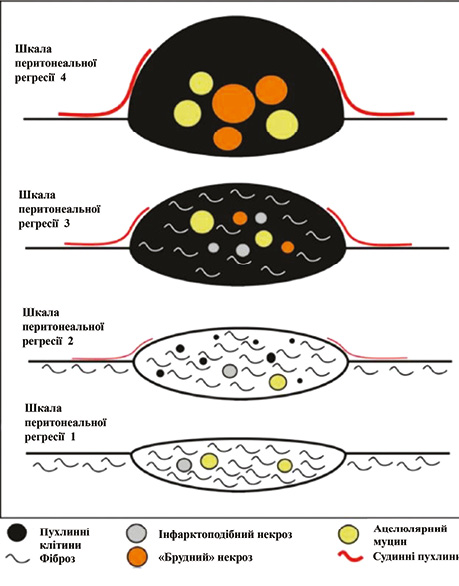
Дослідження PIPAC-OPC2 свідчить, що комбіноване проведення PIPAC і системної хімієтерапії в першій лінії лікування синхронного ПК РШ є не лише клінічно ефективним, але й має сприятливий профіль безпеки. Це робить його перспективною опцією в мультимодальному лікуванні хворих з ПК РШ.
ОБГОВОРЕННЯ
Лікувальна тактика ПК РШ залишається однією з найбільш дискусійних тем сучасної онкології. Попри еволюцію системних схем лікування, виживаність цієї категорії пацієнтів залишається незадовільною, що зумовлює потребу в дослідженні альтернативних або додаткових терапевтичних стратегій.
У даних сучасних клінічних досліджень зафіксовано, що локорегіонарні методи, такі як HIPEC, NIPS та PIPAC, потенційно здатні посилити контроль над перитонеальним компонентом захворювання, підвищити частоту хірургічної резектабельності та сприяти подовженню виживаності.
HIPEC в профілактичному сетингу вражає своєю ефективністю, а при адекватній циторедукції забезпечує вищу виживаність, однак супроводжується високим рівнем ускладнень і системної токсичності, тому є доцільним лише у ретельно відібраних пацієнтів із низьким PCI.
Своєю чергою, проведення NIPS, зокрема на основі внутрішньочеревного паклітакселу, зумовило переконливі результати, сягнувши статистично значущого подовження mOS, зростання частоти R0-резекцій та клінічного контролю асциту при низькій системній токсичності.
На цьому тлі PIPAC постає як перспективна альтернатива, що поєднує мінімальну інвазивність, можливість багаторазового застосування, контроль відповіді за PRGS та потенціал для комбінування із системною терапією. У дослідженнях PIPAC-OPC1/2 зафіксовано, що навіть у пацієнтів із середнім PCI (≈14) mOS перевищувала 19 міс, а частка R0-резекцій після лікування досягала 26%, що є порівнянним із результатами DRAGON-01. При цьому частота ускладнень залишалася низькою, а переносимість — високою, що особливо важливо для ослаблених або передлікованих пацієнтів.
Ще однією перевагою PIPAC є можливість об’єктивної оцінки ефективності лікування за допомогою PRGS — гістологічного інструменту, що дозволяє стандартизувати підхід до моніторингу відповіді на терапію. Це критично важливо при ухваленні рішень щодо хірургічного втручання або зміни лікувальної тактики.
Попри обнадійливі результати, слід підкреслити, що досі не існує великомасштабних рандомізованих досліджень, які б порівнювали PIPAC з іншими локорегіонарними методами або системною терапією в першій лінії. Очікувані результати PIPAC VEROne та PROPHYLOCHIP-PIPAC можуть дати відповіді щодо місця методу в алгоритмах лікування.
Отже, накопичена клінічна база свідчить про потенційну роль PIPAC як елемента мультимодального підходу, що може бути використаний у пацієнтів з обмеженим перитонеальним ураженням (PCI ≤15) без обструктивних ускладнень поєднано із системною хімієтерапією з метою підготовки до хірургічного втручання або контролю симптомів у неоперабельних хворих.
ВИСНОВКИ
ПК від РШ залишається клінічною проблемою з несприятливим прогнозом і обмеженими терапевтичними можливостями в межах стандартної системної хімієтерапії.
Локорегіонарні методи, зокрема HIPEC і NIPS, демонструють потенціал до підвищення виживаності та частоти хірургічних R0-резекцій, однак потребують ретельного відбору пацієнтів через високий ризик ускладнень або технічні обмеження.
Техніка PIPAC зарекомендувала себе як безпечний, повторюваний і перспективний метод з високим рівнем гістологічної відповіді, низькою токсичністю та можливістю оцінки ефективності лікування в динаміці.
Результати клінічних досліджень (зокрема PIPAC-OPC2) свідчать, що застосування PIPAC у першій лінії лікування в комбінації із системною терапією може бути порівняно ефективним з такими стратегіями, як NIPS, за умови належного відбору пацієнтів.
Для остаточного визначення місця PIPAC у сучасних клінічних настановах необхідні результати рандомізованих контрольованих досліджень.
На цьому етапі PIPAC можна розглядати як компонент мультимодального лікування, доцільний у пацієнтів з помірним PCI (≤15), збереженим загальним станом та без критичних ускладнень з метою консолідації відповіді, підвищення якості життя та можливої хірургічної конверсії.
Інформація щодо конфлікту інтересів. Автори рукопису заявляють про відсутність потенційних або явних конфліктів інтересів, повʼязаних з цією роботою.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Cancer Today — Global Cancer Observatory — IARC. Retrieved from gco.iarc.fr/today/en.
2. Yonemura, Y., Canbay, E., Li, Y., Coccolini, F., Glehen, O., Sugarbaker, P. H., … Mahtem, H. (2016). A comprehensive treatment for peritoneal metastases from gastric cancer with curative intent. European Journal of Surgical Oncology, 42, 1123–1131. doi.org/10.1016/j.ejso.2016.03.016.
3. Thomassen, I., van Gestel, Y. R., van Ramshorst, B., Luyer, M. D., Bosscha, K., Nienhuijs, S. W., … de Hingh, I. H. (2014). Peritoneal carcinomatosis of gastric origin: a population-based study. Annals of Surgical Oncology, 21(4), 1130–1137. doi.org/10.1002/ijc.28373.
4. Solab, W., Hetzel, A., Nadiradze, G., Sagynaliev, E., & Reymond, M. A. (2012). Description of a novel approach for intraperitoneal drug delivery and the related device. Surgical Endoscopy, 26(7), 1849–1855. doi: 10.1007/s00464-012-2148-0.
5. Yonemura, Y., Canbay, E., Endou, Y., Ishibashi, H., Mizumoto, A., Li, Y., Sugarbaker, P. H. (2015). Comprehensive treatment for the peritoneal metastasis from gastric cancer. World Journal of Surgical Procedures, 5(2), 187–197. doi: 10.5412/wjsp.v5.i2.187.
6. Yonemura, Y. (2020). Mechanisms of Peritoneal Metastasis Formation. In O. Glehen, A. Bhatt (Ed.) Pathology of Peritoneal Metastases. Singapore: Springer.
7. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Gastric Cancer Version 2.2025 — April 4, 2025 NCCN.org. Retrieved from http://www.nccn.org/guidelines/category_1.
8. Lordick, F., Carneiro, F., Cascinu, S., Fleitas, T., Haustermans, K., Piessen, G., … & Smyth, E. C. (2022). Gastric cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology, 33(10), 1005–1020. doi: 10.1016/j.annonc.2022.07.004.
9. Badgwell, B., Ikoma, N., Murphy, M. B., Wang, X., Estrella, J., Roy-Chowdhuri, S., … Ajani, J. (2021). A phase II trial of cytoreduction, gastrectomy, and hyperthermic intraperitoneal perfusion with chemotherapy for patients with gastric cancer and carcinomatosis or positive cytology. Annals of Surgical Oncology, 28, 258–264. doi: 10.1245/s10434-020-08739-5.
10. Ishigami, H., Fujiwara, Y., Fukushima, R., Nashimoto, A., Yabusaki, H., Imano, M., … Kitayama, J. (2018). Phase III trial comparing intraperitoneal and intravenous paclitaxel plus S-1 versus cisplatin plus S-1 in patients with gastric cancer with peritoneal metastasis (PHOENIX-GC trial). Journal of Clinical Oncology, 36(19), 1922–1929. doi: 10.1200/JCO.2018.77.8613.
11. Jansen-Winkeln, B., Eberth, J., Moulla, Y., Mehdorn, M., Niebisch, S., Schierle, K., … Thieme, R. (2023). Pressurized intraperitoneal aerosol chemotherapy (PIPAC) in patients with peritoneal surface malignancies (PSM): a prospective single-center registry study. Journal of Cancer Research and Clinical Oncology, 149(3), 1331–1341. doi: 10.1007/s00432-022-04517-w.
12. Chao, Y. (2025). Intraperitoneal and intravenous paclitaxel plus S-1 versus intravenous paclitaxel plus S-1 in gastric cancer patients with peritoneal metastasis: Results from the multicenter, randomized, phase 3 DRAGON-01 trial. JCO, 43, 327–327. doi: 10.1200/JCO.2025.43.4_suppl.327.
13. Graversen, M., Detlefsen, S., Ainsworth, A. P., Fristrup, C. W., Knudsen, A. O., Pfeiffer, P., … Mortensen, M. B. (2023). Treatment of Peritoneal Metastasis with Pressurized Intraperitoneal Aerosol Chemotherapy: Results from the Prospective PIPAC-OPC2 Study. Annals of Surgical Oncology, 30(5), 2634–2644. doi: 10.1245/s10434-022-13010-0.
14. Yang, X. J., Huang, C. Q., Suo, T., Mei, L. J., Yang, G. L., Cheng, F. L., … Li, Y. (2011). Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase III randomized clinical trial. Annals of Surgical Oncology, 18(6), 1575–1581. doi: 10.1245/s10434-011-1631-5.
15. Bonnot, P. E., Piessen, G., Kepenekian, V., Decullier, E., Pocard, M., Meunier, B., … Glehen, O. (2019). FREGAT and BIG-RENAPE Networks. Cytoreductive Surgery With or Without Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer With Peritoneal Metastases (CYTO-CHIP study): A Propensity Score Analysis. Journal of Clinical Oncology, 37(23), 2028–2040. doi: 10.1200/JCO.18.01688.
16. Sugarbaker, P. H. (2010). Cytoreductive Surgery and Perioperative Intraperitoneal Chemotherapy: An Ongoing Research Effort. In D. Alberts, M. Clouser, L. Hess (Ed.). Intraperitoneal Therapy for Ovarian Cancer. Berlin, Heidelberg: Springer. doi.org/10.1007/978-3-642-12130-2_10.
17. Chicago Consensus Working Group (2020). The Chicago Consensus on peritoneal surface malignancies: Management of gastric metastases. Cancer, 126(11), 2541–2546. doi: 10.1002/cncr.32868.
18. Shinkai, M., & Imano, M. (2022). The clinical effect of conversion surgery for advanced gastric cancer patients with peritoneal metastasis. Journal of Gastrointestinal Oncology, 13(5), 2169–2177. doi: 10.21037/jgo-21-431.
19. Zhuang, X., He, Y., & Ma, W. (2022). Prophylactic hyperthermic intraperitoneal chemotherapy may benefit the long-term survival of patients after radical gastric cancer surgery. Scientific Reports, 12(1), 2583. doi: 10.1038/s41598-022-06417-y.
20. Chia, C. S., Seshadri, R. A., Kepenekian, V., Vaudoyer, D., Passot, G., & Glehen, O. (2016). Survival outcomes after cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis from gastric cancer: a systematic review. Pleura Peritoneum, 1(2), 67–77. doi: 10.1515/pp-2016-0010.
21. Dindo, D., Demartines, N., & Clavien, P. A. (2004). Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Annals of Surgery, 240(2), 205–213. doi: 10.1097/01.sla.0000133083.54934.ae.
22. Solass, W. (2020). Peritoneal Regression Grading Score (PRGS) for Therapy Response Assessment in Peritoneal Metastasis. In O. Glehen, A. Bhatt, (Ed.). Pathology of Peritoneal Metastases. Singapore: Springer. doi.org/10.1007/978-981-15-3773-8_9.
Адреса для листування:
Пепенін Микита Олексійович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: mykyta.pepenin@unci.org.ua
Correspondence:
Mykyta Pepenin
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: mykyta.pepenin@unci.org.ua














Leave a comment