РЕЦИДИВИ ГРАНИЧНИХ ПУХЛИН ЯЄЧНИКА
Свінціцький В.С.1, Воробйова Л.І.1, Клименко Е.С.2
Резюме. Проведено аналіз результатів лікування 106 хворих на граничні пухлини яєчника (ГПЯ). Отримані результати свідчать про достатньо сприятливий перебіг захворювання у пацієнтів з ГПЯ І стадії. Рецидиви виникали в різні терміни після хірургічного лікування: від 1 до 12 років. Доведено, що сонографія в сполученні з визначенням маркера СА125 в сироватці крові хворих є надійним методом діагностики рецидивів ГПЯ.

Вступ
Граничні пухлини яєчника (ГПЯ), або так звані пухлини потенційно низького ступеня злоякісності, виділені в самостійну категорію епітеліальних новоутворень у Міжнародній гістологічній класифікації ВООЗ і становлять 8–16% у структурі усіх неоплазій яєчника [1–3]. При відносно сприятливому перебігу, ГПЯ мають злоякісний потенціал — можуть рецидивувати і метастазувати, причому небезпека генералізації пухлинного процесу існує протягом подальших 10 і більше років [4–6].
Матеріали та методи
Проведено лікування та клінічне спостереження 106 хворих на ГПЯ І стадії: 1-ша група (82 хворих), яким проведено стандартне хірургічне втручання (пангстеректомія), середній вік хворих — 38,9±4,5, та 2-га група (24 хворих), середній вік — 30,3±5,5, яким проведено органозберігаючі хірургічні втручання.
Відбір хворих на ГПЯ для органозберігаючого лікування проводився за такими критеріями:
- ураження тільки одного яєчника (стадія Іа);
- капсула пухлини не ушкоджена розривом;
- відсутні пухлинні розростання на поверхні яєчника;
- відсутні пухлинні клітини в асцитичній рідині або у змивах черевної порожнини, малого таза, діафрагми, печінки, заочеревинних лімфатичних вузлів при терміновому цитологічному дослідженні;
- розмір пухлин не перевищував 10 см.
Метод хірургічного втручання з метою проведення органозберігаючої операції полягав у наступному: після розтину черевної порожнини шляхом серединної лапаротомії виконували ретельний огляд її органів і тканин. Далі проводили процедуру хірургічного стадіювання, етапи якого викладено вище. Якщо не виявлено розповсюдження пухлинного процесу по парієнтальній і вісцеральній очеревині та відсутні пухлинні клітини у змивах черевної порожнини (діагностували шляхом термінового цитологічного дослідження змивів), ми вважали, що стадія захворювання відповідає градації Т1аN0M0. У разі ураження лише одного яєчника проводили однобічне видалення придатків матки на боці ураження та біопсію контралатерального яєчника, резекцію сальника з терміновим інтраопераційним морфологічним дослідженням.
З метою своєчасного виявлення рецидиву хвороби усі пацієнтки після закінчення первинного лікування перебували під динамічним спостереженням у консультативній поліклініці Національного інституту раку. Комплексне обстеження, крім клінічного огляду, обов’язково включало сонографію органів малого таза з використанням піхвового та абдомінального датчиків, кольорове допплерівське картування, дослідження концентрації в сироватці крові пухлинного маркера СА125 у динаміці, а за необхідності — додаткові методи дослідження (рентгенографія органів грудної клітки, комп’ютерна томографія).
Результати та їх обговорення
Із 82 хворих групи І вибули з-під спостереження 3, а 79 простежені протягом 1−16 років після завершення первинного лікування. Із 79 хворих прогресування пухлинного процесу діагностовано у 16 (20,2%), з яких у 10 (12,6%) хворих виконана операція в традиційному обсязі, у 6 (7,5%) — після органозберігаючого лікування.
Моніторинг рівнів СА125 після лікування 82 хворих на ГПЯ було проведено у 73 (89,0%), з яких у 13 (17,8%) виявлено підвищення концентрації СА125 і діагностовано рецидив хвороби. Підвищення концентрації маркера зафіксовано за 2–8 міс до появи клінічних ознак прогресування хвороби у 25,0% випадків (у 3 хворих із 13). Середні значення СА125 у хворих з рецидивами ГПЯ були високими і становили 354,0±22,7 од/мл.
Рецидиви виникли у 16 хворих у різні строки після хірургічного лікування: частіше пізні — від 14 до 12 років спостереження — у 7 (43,8%) хворих; до року — у 1 (6,3%) хворої; від 1 року до 6 — у 6 (37,6 ) хворих. Тобто рецидиви у хворих на ГПЯ упродовж всього терміну спостереження виникали у період від 1 до 12 років (таблиця).
Таблиця Частота і термін виникнення рецидивів у хворих на ГПЯ групи І після стандартного хірургічного лікування
| Діагноз | Термін виникненнярецидиву, роки | Кількість хворих | |
|---|---|---|---|
| n | % | ||
| ГПЯ | < 1 | 1 | 6,3 |
| 1–3 | 3 | 18,8 | |
| 3–5 | 3 | 18,8 | |
| 5–12 | 7 | 43,8 | |
| > 12 | 2 | 12,3 | |
| Всього | 16 | 100,0 | |
У групі ІІ з 24 пацієнток, що перенесли органозберігаюче хірургічне втручання, віддалені результати відомі у 23 (95,7%). Рецидиви пухлини після органозберігаючих програм лікування виявлено у 3 (13,0%) із них в термін від 5 до 11 років. Метастазування у великий сальник діагностовано у 1 (4,3%) хворої.
Прогресування хвороби у хворих І та ІІ груп виявлялося масивною дисемінацією по черевній порожнині, метастазуванням у заочеревинні лімфатичні вузли. Відзначено більш агресивний перебіг у хворих на серозні ГПЯ, оскільки більшість рецидивів виникали в строки до 5 років після закінчення первинного лікування, а також частіше у хворих з двобічним ураженням яєчника, ніж при муцинозних ГПЯ.
Прогресування основного процесу за типом локорегіонарного рецидиву констатоване у 4 (25%), дисемінація по очеревині, ускладнена полісерозитом, — у 6 (37,5%) із 16 хворих групи І. При муцинозних ГПЯ найчастішим проявом прогресування пухлинного процесу був розвиток псевдоміксоми.
Локорегіонарний рецидив у великому сальнику діагностовано у 2 із 6 хворих, яким не проводили оментектомію під час первинного лікування. У пацієнток після виконання операції в традиційному обсязі з оментектомією метастазування в куксу великого сальника виникло лише в 1 хворої.
Локальні рецидиви ГПЯ після операцій стандартного обсягу (двобічна аднексектомія з видаленням матки та резекцією великого сальника) виникають у ділянці малого таза із залученням сусідніх органів. Після органозберігаючих операцій (однобічна аднексектомія, резекція яєчника) ріст пухлини відбувається переважно в залишковій тканині оперованого яєчника з наступним поширенням на матку та суміжні тканини.
Для визначення сонографічних критеріїв ефективності лікування хворих з рецидивами ГПЯ проведено ретроспективний аналіз даних сонографічного дослідження черевної порожнини, заочеревинного простору і малого таза у пацієнток, які лікувалися чи консультувалися в Національному інституті раку з 2000 до 2012 рр. з приводу ГПЯ.
При зіставленні результатів ультразвукових досліджень з операційними вивчали ультразвукову семіотику захворювання та визначали чутливість сонографії. Під час детального вивчення історій хвороб та амбулаторних карток ми встановили, що у 77% хворих на ГПЯ підвищення концентрації СА125 та дані сонографії корелювали між собою і незалежно підтверджували рецидив захворювання. У 11,1% пацієнток первинно підвищувався рівень СА125 від 36 до 100 од/мл за відсутності сонографічних даних про рецидив, а у 7,6% хворих рівень СА125 був нижчий від дискретного і не підвищувався в межах нормального діапазону, проте при сонографії визначалися ознаки рецидивування ГПЯ за 2–4 міс до підвищення (понад 33 од/мл) рівня СА125. При первинному лікуванні рівень СА125 у цих пацієнток був підвищеним.
Сонографічні прояви рецидиву захворювання на ГПЯ — це пухлинні вузли діаметром від 0,5 до 1,5 см, дрібнозернистої або «губчастої» солідної структури, округлої або неправильної форми, що локалізувалися у ділянці міхурово-маткової складки або над куксою піхви чи в латеральних каналах.
Пухлини розміром більш ніж 2 см мали солідну або кістозно-солідну будову. Слід зазначити, що рецидивні пухлини мали чіткі контури в переважній більшості випадків (81,6%), а також бугристі, нерівні (8,4%). Пухлини розміром більш ніж 1,5 см мали солідну або кістозно-солідну структуру (рис. 1).
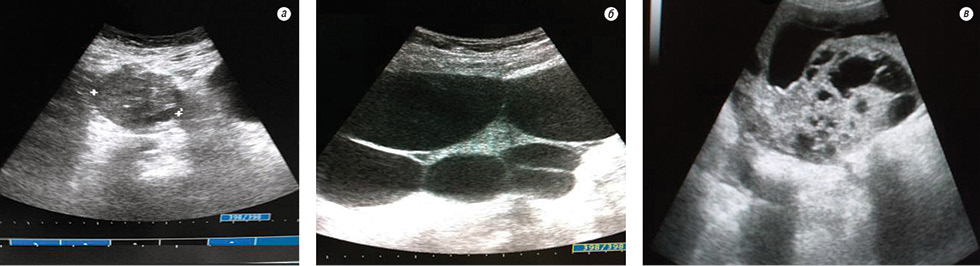
Клініко-ультразвуковими зіставленнями виявлено, що розмір пухлини, встановлений при лапаротомії, у цілому майже збігався з результатами сонограм (83,5%). Різниця коливалася в межах міліметрів. У деяких спостереженнях розміри пухлини при сонографії були помилково завищені від 1 до 6 см. Причиною сонографічних похибок, а також помилок гінекологічного огляду найчастіше був виражений злуковий процес — зрощені до пухлини петлі кишки визначалися як єдиний пухлинний вузол.
Сонографічна оцінка стану анатомічних структур та функціональних змін у них в результаті визначення характерних реакцій на пухлинний ріст дозволила удосконалити діагностику топографічних взаємовідносин між пухлиною і сусідніми органами та тканинами.
Деформація стінки сечового міхура, його погана наповнюваність, а також наявність пієлоектазій були ознакою пухлинної інфільтрації міхурово-маткової зв’язки і можливого вростання пухлини в сечовий міхур, що й підтвердилося у 3 хворих під час повторного циторедуктивного втручання. Пієлоектазія була першою непрямою ознакою метастатичного ураження клубових лімфовузлів.
У результаті зіставлення даних сонографії з інтраопераційними і морфологічними результатами визначено наступні ознаки операбельності хворих з рецидивами ГПЯ:
- наявність одного або декількох пухлинних вузлів переважно солідної структури з чітким рівним контуром, правильної форми, з ознаками повної або відносної рухливості, розташованих у малому тазі або черевній порожнині;
- відсутність віддалених метастазів ГПЯ у печінці, селезінці, заочеревинних лімфатичних вузлах.
При візуалізації множинних метастазів по парієтальній і вісцеральній очеревині та діафрагмі, зокрема наявність розповсюдженого пухлинного ураження ділянки малого таза, деформації стінок сечового міхура, вираженого злукового процесу, частіше свідчили про неможливість адекватного хірургічного втручання.
Одержані дані підтверджують, що сонографія — високоінформативний метод діагностики рецидивів ГПЯ з чутливістю 83,5%, специфічністю — 64%, позитивною прогностичною достовірністю — 56%, негативною прогностичною достеменністю — 66,4%.
Узагальнюючи результати клініко-сонографічних зіставлень, слід підкреслити, що подібні дослідження значно розширюють наші уявлення про можливості сонографії в діагностиці рецидивів ГПЯ. Дані паралелі повною мірою пояснюють варіабельність сонографічної картини, яка залежить від гістогенетичної будови пухлин яєчників, дозволяють проаналізувати можливість визначення інвазії пухлини в інші органи.
На сучасному етапі розвитку імунологічних методів дослідження та сонографії стає можливим визначати рецидив ГПЯ на ранній, навіть на доклінічній стадії розвитку хвороби.
На підставі зіставлення даних ультразвукового дослідження з інтраопераційними й морфологічними результатами можна виділити основні ознаки операбельності хворих з рецидивами ГПЯ:
- рецидивна пухлина солідної чи кістозно-солідної структури, рухома, з чітким горбистим контуром;
- не має віддалених множинних метастазів.
Додатковим критерієм оцінювання правильності сонографічних висновків при маркерпозитивних пухлинах є показники рівня СА125 в сироватці крові. У більшості спостережень (85%) за часом вони збігалися з даними сонографії.
Отже, сонографія в сукупності з визначенням пухлиноасоційованого маркера СА125 в сироватці крові є надійним методом діагностики хворих на рецидиви ГПЯ. Разом з тим слід підкреслити, що в групі хворих з маркернегативними пухлинами сонографія є єдиним широкодоступним методом, що дозволяє регулярно контролювати ефективність терапії і тим самим своєчасно корегувати тактику лікування.
Порівняльна оцінка обсягів хірургічних втручань на органах малого таза у хворих на ГПЯ показала гірший прогноз у хворих із серозними пухлинами після органозберігаючого лікування, зумовлений обсягом органозберігаючих операцій: вилущування пухлини, резекція яєчника, однобічна аднексектомія.
У хворих на ГПЯ з рецидивом пухлини після операцій, виконаних у традиційному обсязі, 8 хворим у процесі динамічного спостереження проведено хірургічне лікування. Строки виконання операцій — від 7 міс до 3 років. Проведено наступні хірургічні втручання: видалення рецидивної пухлини, локалізованої у малому тазі (5), усунення кишкової непрохідності, що виникла в результаті генералізації пухлинного росту (1), видалення муцинозної рідини з черевної порожнини при псевдоміксомі очеревини (2), при цьому 1 пацієнтка оперована двічі (рис. 2.).
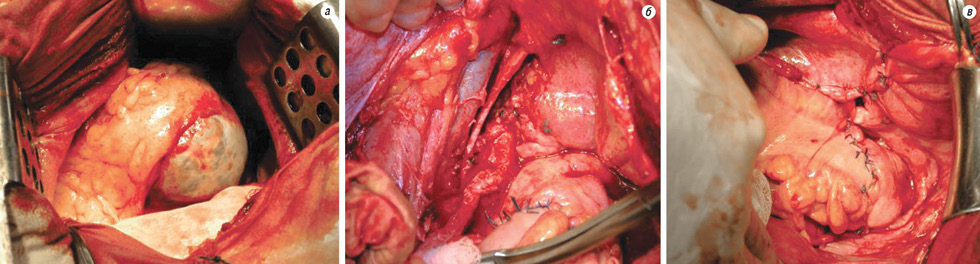
Серед хворих, що перенесли органозберігаючі операції на першому етапі лікування, 3 пацієнткам з рецидивом хвороби виконано повторні лапаротомії та пангістеректомії з резекцією великого сальника. Усім пацієнткам після виявлення прогресування ГПЯ проведено по 3–6 циклів післяопераційної поліхіміотерапії (ПХТ) за схемою РС (цисплатин 75 мг/м + циклофосфан 600 мг/м внутрішньовенно кожних 3 тиж).
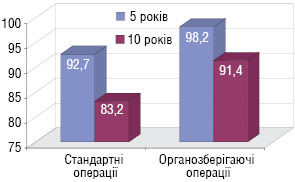
Як показав проведений аналіз, органозберігаюче лікування не погіршує віддалених результатів у хворих на ГПЯ I стадії. Це підтверджено результатами 5- і 10-річної виживаності. У групі стандартних операцій вона становила відповідно 92,7 і 83,2%, а в групі органозберігаючого лікування — 98,2 і 91,4% (рис. 3).
Отже, основним методом лікування хворих на ГПЯ є хірургічний. Для пацієнток старшої вікової групи оптимальним обсягом є пангістеректомія з обов’язковою резекцією великого сальника. Подальша хіміотерапія буде застосована як другий етап комплексного лікування за наявності обтяжувальних чинників прогнозу. Високі показники виживаності хворих молодого віку з початковими стадіями ГПЯ (47,6% пацієнток репродуктивного віку) підтверджує необхідність активного використання органозберігаючих хірургічних втручань.
За результатами дослідження, одним з найбільш важливих чинників розвитку рецидивів ГПЯ є недостатній обсяг хірургічного втручання. У лікуванні рецидивів ГПЯ велике значення надається хірургічному втручанню для виконання радикальної циторедуктивної операції, яка в подальшому доповнюється ад’ювантною ПХТ.
Подібна тактика дала позитивний ефект у лікуванні більшості пацієнток з рецидивом ГПЯ і забезпечила високий рівень виживаності.
Під час динамічного спостереження за хворими на ГПЯ після лікування суттєве значення має концентрація в сироватці крові СА125, підвищення якої в динаміці є імовірним чинником прогресування хвороби.
Нами вивчено також динаміку пухлиноасоційованого маркера СА125 та сонографії при консервативному лікуванні хворих з рецидивами ГПЯ.
За інформативністю ці методи не поступаються іншим і доступні широкому колу хворих. Затребуваність сонографії зумовлена тим, що пальпаторні дані для оцінки ефективності проведеного лікування суб’єктивні, а ендоскопічне або рентгенологічне дослідження пов’язане з променевим навантаженнями і певним ризиком розвитку ускладнень, що не дозволяє часто застосовувати ці методики. Такі високотехнологічні методи як магнітно-резонансна і позитронно-емісійна томографія мають досить високу інформативність, але вони високовартісні.
Додатковим критерієм оцінки правильності сонографічних висновків при маркерпозитивних пухлинах є показники рівня СА125 в сироватці крові. У більшості спостережень (85%) за часом вони збігаються з даними сонографії. Отже, сонографія в сукупності з визначенням пухлиноасоційованого маркера СА125 в сироватці крові є надійним методом діагностики хворих з рецидивами ГПЯ.
Висновки
1. Основним методом лікування хворих на ГПЯ є хірургічний. Оптимальним обсягом для пацієнток старшої вікової групи є пангістеректомія з обов’язковою резекцією великого сальника. Подальша хіміотерапія застосується як другий етап комплексного лікування за наявності обтяжуючих чинників прогнозу.
2. Органозберігаюче лікування не погіршує показників виживаності у хворих на ГПЯ, що підтверджується результатами 5- і 10-річної виживаності пацієнток після органозберігаючої (І група) і стандартної операцій (ІІ група), яка становила відповідно у хворих І групи 87,4 і 79,2%, ІІ групи — 80,1 і 72,3%.
3. Підвищують частоту рецидивів: білатеральне ураження яєчників (IВ стадія), доопераційний розрив капсули, а також недостатній обсяг хірургічного втручання.
4. Сонографія — високоінформативний метод діагностики рецидивів ГПЯ з чутливістю 83,5%, специфічністю — 64%, позитивною прогностичною вірогідністю — 56%, негативною прогностичною вірогідністю — 66,4%.
5. Додатковим критерієм оцінки правильності сонографічних висновків при маркерпозитивних пухлинах є показники рівня СА125 в сироватці крові. У більшості спостережень (85%) за часом вони узгоджуються з даними сонографії. Сонографія в сукупності з визначенням пухлиноасоційованого маркера СА125 в сироватці крові є надійним методом діагностики хворих з рецидивами ГПЯ.
6. У лікуванні рецидивів ГПЯ велике значення надається радикальній циторедуктивній операції, яка в подальшому доповнюється ад’ювантною ПХТ.
Література
1. Батталова Г.Ю., Новикова Е.Г. (2005) Современные представления о пограничных опухолях яичников. Вопросы онкологии, 51 (2): 173–181.
2. Новикова Е.Г., Г.Ю. Батталова (2007) Пограничные опухоли яичников. М. : Мед. информ. агентство: 152.
3. Баринов В.В. и др. (2007) Опухоли женской репродуктивной системы; под общ. ред. М.И. Давыдова, В.П. Летягина, В.В. Кузнецова. М. : Мед. информ. агентство: 376.
4. Olejek A. (2008) Guzy jajnika o granicznej zlosliwosci. Miedzynarodowy Kongres Rak Jajnika. Uniwersytet Jagiellonski Wzdzial Lekarski. Krakow: 13–14.
5. Fauvet R. et al. (2004) Restaging Surgery for Women with Borderline Ovarian Tumors. Cancer, 100 (6): 1145–1151.
6. Sherman M.E. et al. (2004) Survival among Women with Borderline Ovarian Tumors and Ovarian Carcinoma. Cancer, 100 (5): 1045–1052.
Рецидивы пограничных опухолей яичника
Луганcкий клинический областной онкологический диспансер
Резюме. Проведен анализ результатов лечения 106 больных пограничными опухолями яичника (ПОЯ). Полученные результаты свидетельствуют о достаточно благоприятном клиническом течении заболевания у пациентов с ПОЯ I стадии. Рецидивы возникали в разные сроки после хирургического лечения: от 1 до 12 лет. Доказано, что сонография в сочетании с определением маркера СА125 в сыворотке крови является надежным методом диагностики рецидива ПОЯ.
пограничные опухоли яичника, рецидивы пограничных опухолей яичника.














Leave a comment