Неоад’ювантна поліхіміотерапія в комбінованому лікуванні хворих на рак шлунка: обґрунтування призначення та оцінка ефективності
Щепотін І.Б., Колеснік О.О., Лукашенко А.В., Бурлака А.А., Розумій Д.О., Грабовий О.М., Халілеєв О.О., Разумейко І.В.
Резюме. У роботі подано аналіз ефективності комбінованого лікування хворих на рак шлунка (РШ) із застосуванням неоад’ювантного режиму поліхіміотерапії (НПХТ). Представлено результати власних досліджень із застосування НПХТ в режимі PELF. Виявлено кореляційні зв’язки між рівнем експресії молекулярного маркера VEGFR-1 та чутливістю клітин пухлин шлунка до НПХТ. Узагальнено дані зарубіжних авторів та власних досліджень про перспективи використання біологічних маркерів для визначення чутливості РШ до НПХТ. Проведений аналіз свідчить про практичну значимість використання маркерів для вдосконалення лікування хворих на РШ.
 Вступ
Вступ
Рак шлунка (РШ), незважаючи на стійке зниження рівня захворюваності, є однією з найбільш розповсюджених пухлин як в Україні, так і в інших країнах світу, щорічно призводячи до загибелі більш ніж 600 тис. хворих. Рівень захворюваності на РШ в країнах Євросоюзу становить 20 випадків на 100 тис. населення, смертності — 16 на 100 тис. населення [9]. В Україні у 2011 р. зареєстровано 25,32 випадка захворювання на 100 тис. населення, 62% хворих із вперше встановленим діагнозом померли протягом першого року, тому ця патологія залишається однією з найбільш важливих медичних та соціально-економічних проблем [4].
Встановлення діагнозу РШ на ранніх стадіях дозволяє досягти у хворих 5-річної виживаності у 80–90%. Результати лікування поширеного РШ (ІІІ–ІV стадії) не можна визнати задовільними, оскільки, за даними більшості авторів, лише близько 15–25% хворих переживають 5-річний термін [3, 10]. На момент встановлення діагнозу 70% пацієнтів у нашій країні не підлягають оперативному лікуванню у зв’язку з поширеністю пухлинного процесу, даній групі хворих проводять поліхіміотерапію (ПХТ). Радикальна резекція (R-0) є необхідною умовою ефективного лікування РШ [2].
Ефективність неоад’ювантної поліхіміотерапії (НПХТ) та ад’ювантної поліхіміотерапії (АПХТ) була підтверджена двома рандомізованими дослідженнями ІІІ фази. У Великобританії пацієнтам призначали 3 курси НПХТ та АПХТ, що забезпечило покращення загальної та безрецидивної виживаності порівняно з лише хірургічним лікуванням [14]. У Франції було проведено дослідження, що передбачало 2–3 курси НПХТ та 3–4 курси АПХТ, що також поліпшило загальну виживаність у порівнянні із групою, де проводили лише хірургічне лікування [6]. Варто зазначити, що АПХТ вдалось провести лише у 50% пацієнтів, тому автори вважають, що досягнутий ефект в основному обумовлений застосуванням НПХТ.
Навіть із застосуванням комбінованого лікування в обсязі радикальної резекції та АПХТ прогноз для пацієнтів із поширенням пухлини на серозну оболонку є вкрай незадовільним. За даними American Cancer Society, 5-річна виживаність при IIIA–IIIC стадії коливається в межах 9–20%. Біологічні особливості РШ обумовлюють його низьку чутливість до цитостатичних препаратів (об’єктивна відповідь на стандартне лікування досягається не більш ніж у 40% хворих) [6]. Крім того, специфічна протипухлинна терапія є досить дорогою, що обумовлює пошук методик оптимізації призначення хіміотерапії (ХТ) з урахуванням певних пухлинних факторів.
Пошук шляхів поліпшення результатів лікування хворих на РШ ведуть в різних напрямах, серед яких заслуговує на увагу використання НПХТ.
Матеріали та методи
У період з вересня 2010 по грудень 2011 рр. у науково-дослідному відділенні пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку проведено рандомізоване дослідження з вивчення ефективності комбінованого лікування хворих на резектабельний РШ (T2-4N0-3M0) із використанням НПХТ.
Хворим на РШ після стандартних методів обстеження та гістологічного підтвердження діагнозу проводили рандомізацію 1:1 за допомогою генератора випадкових чисел. Пацієнтам основної групи проводили 2 курси НПХТ за схемою PELF (епірубіцин 30 мг/м у 1-й та 5-й дні, цисплатин 40 мг/м у 1-й та 5-й дні, 5-фторурацил (5-ФУ) 300 мг/м 1–4 дні, лейковорин 100 мг/м 1–4 дні) із подальшим хірургічним лікуванням через 21 добу після останнього курсу НПХТ. Контрольна група отримувала лише хірургічне лікування. Усім хворим виконано стандартні хірургічні втручання — гастректомію чи субтотальну резекцію шлунка із бурсектомією та лімфодисекцією в обсязі D2.
Усім пацієнтам до початку лікування проводили імуногістохімічне дослідження біопсійного матеріалу пухлини шлунка на наявність експресії маркерів p-53, VEGFR-1. Так, використовуючи матеріал біопсії, визначали антигенний та рецепторний статус пухлин хворих на РШ із застосуванням імуногістохімічного дослідження за стандартною методикою. У якості первинних антитіл були застосовані моноклональні антитіла (МкАТ): Monoclonal Mouse Antibody to Human p53 Protein Clone DO-7, ready-to-use, Dako), Monoclonal Mouse Antibody to Human BCL Oncoprotein Clone 124, ready-to-use, Dako), поліклональнe антитілo Flt-1/VEGFR1 (Clon Ab-1, ready-to-use, Lab Vision). Для виявлення антигенних детермінант зрізи обробляли в Target Retrieval Solution (Dako) впродовж 30 хв при 960 °С. Для візуалізації реакції антиген-антитіло була застосована візуалізаційна система Dual link EnVision (Dako), хромоген AEC+Substrate-Chromogen (ready-to-use, Dako). Після проведення імуногістохімічної реакції зрізи дофарбовували гематоксиліном Мейєра і поміщали у середовище Faramount Agueous Medium.
Ефективність НПХТ оцінювали за результатами терапевтичного патоморфозу, рентгенологічних досліджень, ендоскопічного обстеження в динаміці. Вивчення динаміки зміни об’єму первинної пухлини проводили за даними 3-фазної спіральної комп’ютерної томографії (СКТ) із застосуванням методики «тугого наповнення» шлунка, яку виконували безпосередньо перед та через 3 тиж після 2 курсів НПХТ. В один день із отриманням зображень СКТ проводили відеофіброгастродуоденоскопію для оцінки макроскопічних змін стінки шлунка та пухлини.
Після оперативного лікування проводили гістологічне дослідження видаленого препарату із визначенням відсотка залишкової життєздатної пухлинної тканини. Ефективність комбінованого лікування оцінювали за результатами дослідження загальної виживаності та медіани безрецидивного періоду.
Статистичний аналіз отриманих даних проводили за допомогою програмного забезпечення STATISTICA 8.0. Для порівняння відмінностей груп використовували непараметричнй аналіз (Mann — Whitney test). Кореляційний зв’язок між вибірками розраховували за коефіцієнтом рангової кореляції Спірмена (r). Величини представлено як Мean±SЕМ, р<0,05 вважали статистично вірогідним.
Результати власних досліджень та їх обговорення
Проведено аналіз результатів лікування 36 хворих на РШ ІІ–IV стадії, із них 17 пройшли лікування в основній групі, 19 — у контрольній. Характеристику хворих представлено в табл. 1.
Таблиця 1. Характеристика досліджуваних груп хворих на РШ
| Показники | Основна група (НПХТ+Х), n (%) | Контрольна група (Х), n (%) |
|---|---|---|
| Кількість хворих Стадія TNM |
17 | 19 |
| II | 3 (17,6) | 2 (10,5) |
| IIIA | 6 (35,3) | 7 (36,8) |
| ІІІВ | 6 (35,3) | 5 (26,3) |
| IV Ступінь диференціювання пухлини |
2 (11,7) | 5 (26,3) |
| G1 | 4 (23,5) | 2 (10,5) |
| G2 | 4 (23,5) | 4 (21,1) |
| G3 | 3 (17,6) | 8 (42,1) |
| G4 | 6 (35, 3) | 5 (26,3) |
| Вік — медіана (роки) | 64±10,2 | 67±11,5 |
| Чоловіки | 8 (47,1) | 4 (21,1) |
| Жінки | 9 (52,1) | 15 (78,9) |
| Гастректомія (R0) | 12 (70,6) | 11 (57,8) |
| Субтотальна резекція шлунка (R0) | 5 (29,4) | 8 (42,2) |
*Дані наведено на основі післяопераційного стадіювання (pTNM). Х — хірургічне лікування.
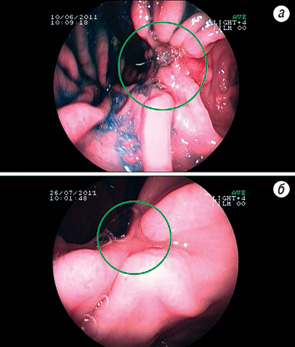
У всіх хворих основної групи було проведено оцінку ефективності НПХТ за допомогою СКТ. Точність визначення відповіді пухлин шлунка на терапію є критично важливим завданням у процесі проведення НПХТ. Загальноприйняті критерії «Response Evaluating Criteria in Solid Tumors (RECIST)» із використанням одновимірних методів визначення найдовшого із діаметрів вогнища ураження є широко розповсюдженою методикою оцінки терапевтичного ефекту в онкологічній практиці. Однак отримані нещодавно дані свідчать, що критерії RECIST можуть бути лімітованими через визначення розмірів вогнища лише у одній площині, що породжує неточності, зокрема при оцінці пухлин шлунка, гастроезофагеального з’єднання та органів шлунково-кишкового тракту (ШКТ) в цілому. Міжнародна організація International Cancer Imaging Society опублікувала повідомлення, метою якого було виправлення недоліків існуючих принципів оцінки, в якому запропонувала модифікувати критерії RECIST шляхом використання мультидетекторного ряду СКТ (MDCT) та утиліт вимірювання об’єму 3D-зображень. Результати використання утиліт у визначення об’єму в 3D-зображенні були продемонстровані в ряді досліджень [16]. Однак більшість із них присвячені оцінці ефекту терапії онкологічних захворювань паренхіматозних органів, і лише незначна частина дослідників вивчали ефективність даної методики на пухлинах ШКТ. Нещодавно A.J. Beer та K. Holzapfel представили дані про те, що волюмометрію первинних пухлин, локалізованих в гастроезофагеальному з’єднанні, за допомогою СКТ можна використовувати у ранній оцінці ефективності НПХТ. Автори зазначають, що дослідження можливо проводити після 2 тиж від початку лікування хворих [5, 12, 16]. Незважаючи на те що проведені дослідження довели інформативність СКТ і волюмометрії первинних пухлин ШКТ з точки зору оцінки їх відповіді на терапію, дослідники мали справу з анатомічно обмеженою ділянкою, а отже необхідні подальші дослідження.
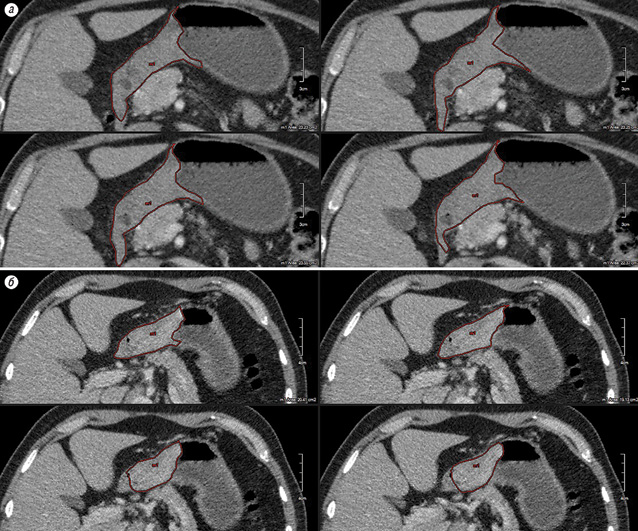
Застосування в дослідженні методу мультидетекторного ряду CКТ дозволило нам провести оцінку ефективності НПХТ. У нашій роботі виконано порівняльний аналіз 17 клінічних випадків за вищевказаною методикою до та після НПХТ у пацієнтів, що отримували комбіноване лікування (рис. 1). Аналіз отриманих результатів вимірювання об’єму пухлин шлунка до та після НПХТ продемонстрував її позитивний ефект, так, середній об’єм пухлин до проведення лікування становив 179±5,3 мм, а після —131±4,6 мм. Враховуючи відсутність критеріїв RECIST для первинних пухлин шлунка, неможливо остаточно класифікувати отримані результати, але вважаємо доцільним продовжити дослідження в цьому напрямку.
За період лікування хворих на РШ за схемою PELF не спостерігалося проявів токсичності вище II ступеня за шкалою NCIC-CTC.
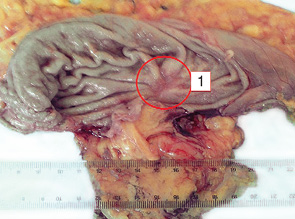
Хірургічне лікування проведено всім хворим основної та контрольної груп (табл. 2). В основній групі 17 хворим виконали R-0 резекції: у 64,7% випадків — гастректомію із бурсектомією та лімфодисекцією в обсязі D2; у 35,3% — дистальну субтотальну резекцію шлунка із бурсектомією та лімфодисекцією в обсязі D2. У групі контролю всім хворим проведено аналогічні радикальні хірургічні втручання, із них гастректомію із бурсектомією та D2-ліфмодисекцією — у 68,5% випадків, дистальні та проксимальні субтотальні резекції шлунка із бурсектомією та D2-лімфодисекцією — відповідно у 26,3 та 5,2%.
Таблиця 2. Результати хірургічного лікування (Х)
| Основна група (НПХТ+Х), n (%) | Контрольна група (Х), n (%) | |
|---|---|---|
| Ранні післяопераційні ускладнення | ||
| Пневмонія | – | 1 (5,2) |
| Панкреатит | 3 (17,6) | 1 (5,2) |
| Піддіафрагмальний абсцес | 2 (11,7) | 1 (5,2) |
| Коагулопатія | 2 (11,7) | – |
| Обсяг оперативного втручання | ||
| Гастректомія з бурсектомією та лімфодисекцією D2 | 11 (64,7) | 13 (68,5) |
| Дистальна субтотальна резекція шлунка з бурсектомією та лімфодисекцією D2 | 6 (35,3) | 5 (26,3) |
| Проксимальна субтотальна резекція шлунка з бурсектомією та лімфодисекцією D2 | – | 1 (5,2) |
При проведенні аналізу післяопераційних ускладнень в основній групі хворих було відзначено розвиток реактивного панкреатиту у 3 (17,6%) випадках, у 2 (11,7%) розвинувся піддіафрагмальний абсцес, у цих хворих також було зареєстровано коагулопатію протягом 3–4 днів. У групі контролю ускладнення виникли у 3 випадках: розвиток панкреатиту (5,3%), лівобічної нижньочасткової пневмонії (5,3%) та піддіафрагмального абсцесу (5,3%).
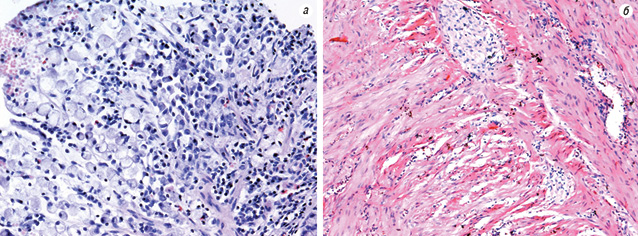
Аналіз терапевтичного патоморфозу у основній групі хворих після НПХТ показав, що мінімальним значенням залишкової життєздатної пухлини було 24,2±0,2%, а максимальним — 82± 0,7% (середнє значення — 57,6±1,3%).
При аналізі остаточних результатів гістологічного та цитологічного методів дослідження в групі хворих, які отримували НПХТ, рідше діагностували вільні клітини пухлини в змивах із черевної порожнини (5,8% в основній групі проти 26,3% в контрольній).
На сьогодні не існує рандомізованих досліджень III фази, присвячених НПХТ РШ. Проте опубліковано деякі результати досліджень II фази. Два дослідження було проведено в США із використанням внутрішньовенної НПХТ та подальшим промиванням черевної порожнини розчинами цитостатиків [1, 8]. У 95% пацієнтів було виконано оперативне втручання, у 71% з них — радикальну операцію. Медіана часу до прогресування становила 45 міс. У 1993 р. J. Hermans та співавтори провели метааналіз АПХТ РШ на підставі 14 мультицентрових клінічних досліджень (2096 пацієнтів) [11]. Зроблено висновок: АПХТ не сприяє підвищенню показника виживаності порівняно з хірургічним лікуванням. Але вже в 2001 р. J. MacDonald та співавтори довели ефективність післяопераційної хіміопроменевої терапії (5-ФУ із лейковорином+45 Гр) у 556 пацієнтів з РШ, медіана виживаності в групі тільки хірургічного лікування становила 27 міс проти 36 міс у групі комбінованого [14].
Раніше було показано, що схема PELF в ад’ювантному режимі покращує загальну виживаність у хворих на резектабельні та поширені форми РШ [8, 15]. Відомо, що група антрациклінових антибіотиків є провідними препаратами вибору у лікуванні РШ, оскільки мають ряд унікальних характеристик, серед яких висока ефективність щодо низькодиференційованих карцином, хороша проникність із кров’яного русла у перитонеальну порожнину та відсутність перехресної резистентності із 5-ФУ. Результати наших досліджень свідчать про ефективність НПХТ, тому ми вважаємо перспективним використання саме схеми PELF. Ефективність НПХТ проілюстровано на рис. 2–4.
Як уже зазначалося, первинна медикаментозна резистентність клітин пухлини до цитостатичної терапії поширена серед хворих на РШ. Тому актуальним напрямком досліджень є пошук молекулярних маркерів прогнозу, які асоціюються із цим феноменом. В останні роки проводять дослідження з вивчення молекулярних маркерів прогнозу ефективності ПХТ та прогнозу перебігу захворювання у пацієнтів із РШ [7].
Вважаємо за доцільне виділити деякі молекулярні фактори, експресія яких на клітинах пухлин шлунка може корелювати із терапевтичним ефектом хіміотерапевтичних агентів. У хворих на РШ негативна експресія р53 в клітинах пухлин корелює з терапевтичним ефектом, що підтверджено низкою досліджень [18]. За даними N. Boku і співавторів, медіана виживаності та терапевтичний ефект від застосованої ПХТ на основі препаратів платини були значно кращими у хворих, для яких характерною була негативна експресія VEGFR-1 у клітинах пухлин [7, 9]. Зараз активно вивчається прогностична значимість молекулярних маркерів bcl-2, HtrA-1, та Her2-neu відносно перебігу захворювання та ефективності ПХТ [17].
Основними маркерами прогнозу перебігу захворювання на РШ в Японії є раково-ембріональний антиген (РЕА), СА 19-9, СА 125. Чутливість РЕА та СА 19-9 становить від 16 до 65%, але при сумісному їх визначенні цей показник може сягати 85%. Останніми роками також з’являються відомості про високу специфічність та чутливість маркера СА 72-4. Аналіз факторів чутливості до ХТ, проведений у 2000 р. Японською науково-дослідною спілкою з призначення протиракової ХТ, показав, що хворі групи «чутливих», мали у 7 разів більше шансів на відповідь на цитостатики [13].
Проведений нами аналіз виявив кореляційну залежність чутливості клітин пухлин хворих на РШ до ПХТ за схемою PELF від експресії молекулярного маркера VEGFR-1, коефіцієнт кореляції R=0,57 (p<0,04), що свідчить про середній ступінь залежності кореляції даних. Більшість пухлин мали слабкопозитивну експресію в VEGF-1 та р-53. Кореляційна залежність для молекулярного маркера р-53 на даному етапі досліджень не була виявлена, R=-0,29 (р<0,04) (рис. 5).
Період спостереження за групами пацієнтів становив від 5 до 24 міс (медіана — 17 міс). У групі хворих, яким проводили НПХТ та подальше хірургічне лікування, зареєстровано 1 (5,8%) випадок прогресування та розвитку метастатичної хвороби (метастаз у праву легеню); у контрольній групі за період спостереження у 3 (15,8%) хворих зареєстровано розвиток метастатичної хвороби: у 2 випадках з локалізацією в печінку та легені, у 1 хворої діагностовано асцит.
Нами було проаналізовано економічну ефективність проведеного лікування хворих на поширений РШ. Згідно з даними Національного канцер-реєстру, за 2011 рік в Україні діагноз РШ було встановлено 11 637 пацієнтам. Із них з IV стадією захворювання — 3420 осіб, що приблизно відповідає показникам захворюваності за 2006–2007 рр. Середня вартість 1 курсу лікування становить близько 4700 грн. (з відповідною підтримувальною терапією та корекцією можливих ускладнень), схема лікування включає мінімум 4 курси, тому в сумі — 18 800 грн. Враховуючи той факт, що об’єктивний ефект при застосуванні стандартної схеми досягається лише у 40% пацієнтів, запропонований метод індивідуалізації лікування за рахунок відмови від призначення ХТ у хворих з хіміорезистентними пухлинами, є економічно обґрунтованим у зв’язку з можливою економією близько 37 млн грн. щорічно. Розроблені принципи можуть бути вдосконалені та застосовані при лікуванні РШ, що зробить надання медичної допомоги більш якісним та економічно ефективним.
Висновки
Комбіноване лікування хворих на резектабельні форми РШ із застосуванням НПХТ дозволяє отримати задовільні безпосередні результати, зменшити кількість рецидивів захворювання. Застосування НПХТ в режимі PELF є безпечним, не супроводжується значними токсичними проявами та не збільшує кількість післяопераційних ускладнень. НПХТ забезпечує ранню регресію первинних пухлин, що попереджує розвиток метастатичної хвороби. Доведено високу чутливість та специфічність маркера VEGFR-1 у хворих на РШ. Визначення чутливості до НПХТ відкриває перспективи досягнення обґрунтованого лікування у хворих на РШ та зниження загальної собівартості лікування.
Література
1. Беляев А.М., Багненко С.Ф., Рухляда Н.В. (2007) Внутрибрюшинная химиотерапия злокачественных опухолей брюшной полости: Монография. СПб. : ЭЛБИ — СПб. — 254 с.
2. Бондарь Г.В., Думанский Ю.В., Попович А.Ю. и др. (2006) Рак желудка: профилактика, диагностика и лечение на современном этапе. Онкология, 2(8): 171−175.
3. Давыдов М.И., Тер-Ованесов М.Д., Абдихакимов А.Н. и др. (2001) Рак желудка: что определяет стандарты хирургического лечения. Практическая онкология, 7(3): 18–24.
4. Рак в Україні, 2009–2010. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Національного канцер-реєстру України, К., 2011, 12: 108 с.
5. Beer A.J., Wieder H.A., Lordick F. et al. (2011) Adenocarcinomas of esophagogastric junction: multi-detector row CT to evaluate early response to neoadjuvant chemotherapy. Radiology: 472–80. Epub.
6. Buyse M.E., Pignon J. (2010) Meta-analyses of randomized trials assessing the interest of postoperative adjuvant chemotherapy and prognostic factors in gastric cancer. J. Clin. Oncol.: 246–76. Epub.
7. Boku N., Ohtsu A., Yoshida S. et al. (2010) Significance of biological markers for predicting prognosis and selecting chemotherapy regimens of advanced gastric cancer patients between continuous infusion of 5-FU and a combination of 5-FU and cisplatin. Jpn J. Clin. Oncol. P. — 275-281. Crookes P., Leichman C.G., Leichman L., Tan M. et al. (1997) Systemic chemotherapy for gastric carcinoma followed by postoperative intraperitoneal therapy. Cancer., 79: 1767–1775.
8. Fondevila C., Metges J.P., Fuster J. (2009) p53 and VEGF expression are independent predictors of tumour recurrence and survival following curative resection of gastric cancer. Br. J. Cancer.: 206–215.
9. Jemal A., et al. (2009) Cancer statistics. CA Cancer J. Clin., 4(59): 225–249.
10. Hermans J. et al. (1993) Adjuvant therapy after curative resection for gastric cancer: meta-analysis of randomized trials., J. Clin. Oncol.: 11: 1441–1447.
11. Holzapfel K., Rummeny E.J., Hannig C., Beer A.J. (2011) MSCT for staging and response evaluation of esophageal cancer. Radiologe, 47(2): 101–109.
12. Li G.C., Zhang Z., Ma X.J., Gu W.L., Wang Y.N., Li J. (2011) Are biomarkers correlated with recurrence patterns in patients with resectable gastric adenocarcinoma. Mol. Biol. Rep. Epub.
13. MacDonald J.S. et al. (2001) Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N. Engl. J. Med.: 345: 725–730.
14. Mari E. et al. (2008) Adjuvant Chemotherapy in Completely Resected Gastric Cancer: Sidebar: Context and Caveats. Journal of the National Cancer Institute: 388–398.
15. Prasad S.R., Jhaveri K.S., Saini S., Hahn P.F., Halpern E.F., Sumner J.E. (2010) CT tumor measurement for therapeutic response assessment: comparison of unidimensional, bidimensional, and volumetri ctechniques initial observations. Radiology.: 416–419.
16. Vincenzo C. et al. (2011) HtrA1, a potential predictor of response to cisplatin-based combination chemotherapy in gastric cancer. Histopathology.: 58: 669–678.
17. Yamada Y. et al. (2011) Molecular prognostic markers in advanced gastric cancer: Correlative study in the Japan Clinical Oncology Group trial JCOG9912. J. Clin. Oncol.: 734–756.
Неоадъювантная полихимиотерапия в комбинированном лечении больных раком желудка: обоснование назначения и оценка эффективности
Резюме. В работе проведен анализ эффективности использования неоадъювантной полихимиотерапии (НПХТ) в комбинированном лечении больных раком желудка (РЖ). Представлены результаты собственных исследований по применению НПХТ в режиме PELF в комбинированном лечении больных РЖ. Найдены корреляционные связи между уровнем экспрессии молекулярного маркера VEGFR-1 и чувствительности клеток опухоли желудка к химиотерапии. Обобщены данные зарубежных авторов и собственных исследований о перспективах использования биологических маркеров с целью изучения чувствительности клеток РЖ к НПХТ. Проведенный анализ свидетельствует о практической значимости их использования с целью усовершенствования лечения больных РЖ.
рак желудка, неоадъювантная полихимиотерапия, маркеры чувствительности.














Leave a comment