Ефективність комбінованого застосування ксеногенної протипухлинної вакцини та доксорубіцину в експерименті
Діденко Г.В. 1, Лісовенко Г.С.1, Потебня Г.П.1, Шпак Є.Г.1, Круць A.А.2, Кузьменко О.П.1, Карпенко О.П.1
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Київський національний університет ім. Тараса Шевченка
Резюме. На моделі карциноми легені Льюїс показано ефективність комбінованого застосування хіміотерапії та вакцинотерапії з використанням ксеногенної ембріональної вакцини, розробленої в Інституті експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України. Підібрано оптимальну схему комбінованої терапії, що включає введення доксорубіцину до проведення оперативного видалення пухлини, а вакцини — у ранній термін після операції, що забезпечує зростання індексу інгібіції метастазування до 98%. Встановлено, що при застосуванні комбінованого лікування у тварин на кінець експерименту відмічали підвищену цитотоксичність лімфоцитів і зниження рівня накопичення IgG до білкових екстрактів із клітин гомологічної пухлини.

Вступ
Актуальною проблемою при комплексному лікуванні хворих онкологічного профілю є цитосупресія, яку викликає застосування протипухлинних цитостатиків або іонізуючого випромінювання. Вона не тільки заважає досягненню максимальної ефективності протипухлинної терапії, але й у багатьох випадках призводить до виникнення ускладнень, що мають безпосередню загрозу для життя хворого. Тому особливу увагу приділяють дослідженням з використанням комбінованих схем специфічної адaптивної імунотерапії та протипухлинних препаратів — хіміоімунотерапії (ХІТ) [1–4]. Це пов’язано, по-перше, з можливістю елімінації під впливом хіміопрепаратів імуносупресивних факторів, по-друге, з індукцією так званої імуногенної загибелі пухлинних клітин [5–7].
У доклінічних та клінічних випробуваннях продемонстровано успіх у застосуванні комбінації протипухлинних вакцин (ПВ) з хіміотерапією для досягнення синергічного ефекту, навіть коли доза та схема введення відповідних агентів потребували оптимізації [2, 4, 8, 9]. Показано, що деякі препарати (доксорубіцин — Dox, циклофосфамід) індукують імунологічну загибель пухлинних клітин [3, 6, 7, 10], доцетаксел підвищує експресію пухлиноасоційованих антигенів, комплексів HLA-пептидів, таким чином сенсибілізуючи пухлину до індукованого вакциною Т-клітинного кілінгу [11].
Встановлено, що низькі дози зазначених препаратів можуть підвищувати терапевтичну ефективність деяких варіантів ПВ як у мишей з модельними пухлинами, так і в онкологічних хворих, за рахунок зменшення кількості Т-супресорів [5, 9, 12–14]. Вагомим обґрунтуванням для розробки схем ХІТ стала ідея короткочасної деплеції регуляторних CD4CD25 FoxP3 Т-лімфоцитів за допомогою низьких доз циклофосфаміду, що значно поліпшує терапевтичний ефект ПВ [15].
У клінічних дослідженнях М. von Mehren та співавторів [16] показано, що пацієнти, які попередньо отримували хіміотерапію, стають більш чутливими до дії ПВ. Вважають, що значно кращому результату може сприяти вакцинація пацієнтів зі зменшеним за рахунок дії хіміопрепарату об’ємом пухлини [17]. За даними S. Wang та співавторів [18], дія низьких доз хіміопрепаратів має істотніший вплив на мікрооточення пухлини за рахунок антиангіогенного ефекту, ніж на проліферативну активність пухлинних клітин. Отже, перехід до клінічних випробувань схем ХІТ обмежений низкою невирішених питань, пов’язаних із відсутністю обґрунтованих режимів і недостатнім розумінням механізмів індукції оптимальної імунної відповіді.
Розробка оптимальних доз, схем та режимів застосування вітчизняних ПВ при комплексному використанні з хіміопрепаратами з метою попередження рецидивів і метастазів та покращення якості життя онкологічних хворих є, безумовно, пріоритетним напрямком сучасної медичної науки і стане поштовхом до створення більш ефективних методів лікування пацієнтів з онкологічними захворюваннями. Це вказує на доцільність розробки та подальших досліджень таких режимів ХІТ, коли застосування біопрепаратів і цитостатиків сприятиме досягненню синергізму їхньої дії.
З урахуванням цього метою дослідження було розробити схему ХІТ на основі ксеногенної протипухлинної вакцини (КПВ), створеної на основі ембріональних протеїнів курки, ад’юванта мікробного походження [19] та низьких доз Dox, і дослідити її антиметастатичну та імуномодулюючу ефективність.
ОБ’ЄКТ і МЕТОДИ ДОСЛІДЖЕННЯ
Експерименти проведено на мишах лінії С57Вl (самці віком 2,5 міс та масою тіла 20–22 г розведення віварію Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України). Утримання тварин і робота з ними здійснювалися відповідно до загальноприйнятих міжнародних правил проведення досліджень на експериментальних тваринах. Як експериментальну модель використовували карциному легені Льюїс (КЛЛ).
Антиметастатичну дію комбінованих схем КПВ з Dox досліджували у мишей з мінімальною залишковою пухлинною хворобою. КЛЛ перещеплювали (по 2,5•10 клітин) у подушечку задньої кінцівки, на 20-ту добу після цього у всіх тварин під наркозом (тіопентал натрію по 60 мкг підшкірно) видаляли первинну пухлину шляхом відсікання дистального відрізка ураженої кінцівки з попереднім накладанням лігатури (хірургічне видалення пухлини — ХВП).
Сформовані такі дослідні групи: 1 — контроль пухлинного росту (КПР) — тварини з ХВП; 2 (Dox + ХВП) — тварини, які отримували Dox до проведення ХВП; 3 (ХВП + Dox) — тварини, які отримували Dox після ХВП; 4 (ХВП + КПВ) — тварини, які отримували ксеновакцину після ХВП; 5 (Dox + ХВП + КПВ) — тварини, які отримували Dox до проведення ХВП та ксеновакцину — після нього; 6 (ХВП + Dox + КПВ) — тварини, які після ХВП отримували Dox та ксеновакцину; 7 (КПВ + ХВП + Dox + КПВ) — тварини, які отримували ксеновакцину до ХВП та Dox і ксеновакцину після ХВП.
Dox вводили тричі, внутрішньоочеревинно, з інтервалом 48 год із розрахунку 0,04 мг/тварину на одне введення (2,0 мг/кг); мишам 2-ї та 5-ї групи — в неоад’ювантному режимі, на 14; 16 та 18-ту добу експерименту; мишам 3; 6 та 7-ї груп — в ад’ювантному режимі на 22; 24 та 26-ту добу (2; 4 та 6-ту добу після ХВП). КПВ готували згідно з [19] і вводили тричі по 0,3 мл підшкірно: мишам 4-ї та 5-ї груп на 3; 5 та 9-ту добу після ХВП, мишам 6-ї та 7-ї груп — починаючи з 3-ї доби після завершення введення Dox (9; 11 й 15-та доба після ХВП). У перерахунку на білок сумарна доза вакцини на весь курс становила 1 мг/тварину. Миші 7-ї групи, крім того, одержували КПВ до видалення пухлини (на 14; 16 та 18-ту добу після перещеплення КЛЛ), тому загальна доза ксеновакцини сягала 2 мг/тварину.
Антиметастатичний ефект оцінювали на 23-тю добу після ХВП (43-тя доба, відповідно, після прищеплення КЛЛ) за показниками кількості та об’єму метастазів у легенях: частота метастазування (%); середня кількість метастазів на 1 мишу; середній об’єм метастазів на 1 мишу. Індекс інгібіції метастазування (ІІМ) розраховували за формулою:
| ІІМ = | Ак • Вк — Ад • Вд | • 100%, |
| Ак • Вк |
де Ак і Ад — кількість тварин з метастазами в контрольній і дослідній групах; Вк і Вд — середня кількість метастазів тварин контрольної та дослідної груп.
Цитотоксичну активність (ЦТА) лімфоцитів (Лц), макрофагів (Мф), а також антитілозалежну цитотоксичність (АЗЦ) вказаних ефекторів визначали in vitro за допомогою МТТ-тесту [20] на 23-тю добу після ХВП. Як клітини-мішені використовували клітини КЛЛ. Вплив сироватки крові (СК) аналізували за індексом потенціювання (ІП):
ІП = [(АЗЦЛц/Мф – ЦТАЛц/Мф)/
ЦТАЛц/Мф]•100%
Також досліджували протипухлинну цитотоксичність СК та визначали методом імуноферментного аналізу рівень накопичення IgG до білкових екстрактів із клітин КЛЛ.
Статистичну обробку результатів проводили за загальноприйнятими методами варіаційної статистики. Результати дослідження подано як М±m, де М — середнє арифметичне значення, m — його стандартна похибка. Розбіжності оцінювали як вірогідні при p<0,05. Розрахунки та побудову графіків виконували з використанням прикладної програми OriginLab.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
У ході експерименту виявлено високу антиметастатичну ефективність деяких досліджених схем введення КПВ та/або Dox (табл. 1). Так, застосовані в якості монотерапії Dox у низькій дозі або ксеновакцина чинили істотний гальмувальний ефект на розвиток метастазів у легенях тварин, якщо їх вводили після ХВП (3-тя і 4-та групи тварин). При цьому кількість метастазів порівняно з контролем (1-ша група) зменшилася в 3,2 і 2,9 раза, ІІМ становив 68,69 і 80,84% відповідно. Середній об’єм метастазів у мишей, що одержували Dox, був в 6,4 раза меншим порівняно з аналогічним показником у контрольних тварин (5,53±3,88 і 35,59±13,92 мм/тварину; p<0,05), але частота метастазування при цьому була однаковою (88,0%). При використанні в монорежимі КПВ метастази у легенях реєстрували у 50% мишей, але їхній об’єм практично не відрізнявся від такого в контролі.
Таблиця 1. Показники антиметастатичної ефективності різних схем застосування КПВ та/або Dox у мишей з хірургічно видаленою КЛЛ
|
№ групи |
Характеристика групи |
Частота метастазування, % |
Кількість метастазів, шт./тварину |
ІІМ, % | Об’єм метастазів, мм/тварину |
| 1 | КПР (ХВП) | 88 | 10,38±3,17 | 35,59±13,92 | |
| 2 | Dox + ХВП | 100 | 25,0±10,64 | +173,7 | 230,67±136,68 |
| 3 | ХВП + Dox | 88 | 3,25±1,09* | −68,69 | 5,53±3,88* |
| 4 | ХВП + КПВ | 50 | 3,5±1,96* | −80,84 | 31,26±18,54 |
| 5 | Dox + ХВП + КПВ | 20 | 0,6±0,6* | −98,69 | 0,036±0,036* |
| 6 | ХВП + Dox + КПВ | 50 | 6,0±3,1 | −67,16 | 27,57±16,21 |
| 7 | КПВ + ХВП + Dox + КПВ | 100 | 20,43±5,24 | +123,66 | 124,95±54,53 |
*p<0,05 порівняно з показником контрольної групи (ХВП).
Максимальна реалізація антиметастатичного ефекту мала місце внаслідок застосування комбінації Dox до проведення ХВП, а ксеновакцини — після нього (5-та група). У цьому випадку частота метастазування знижувалася до 20%, кількість метастатичних вузлів у легенях тварин зменшувалася у 17 разів, ІІМ становив 98,69%, об’єм метастазів також був мінімальним (p<0,05).
При проведенні ХІТ після видалення пухлини (6-та група) позитивний ефект комбінованої схеми відзначали у зменшенні кількості мишей з метастазами у легенях до 50% та тенденції до скорочення середньої кількості метастазів (в 1,7 раза); ІІМ становив 67,16%, а об’єм метастазів вірогідно не відрізнявся від контрольного показника.
Слід зазначити, що ускладнення останньої комбінованої схеми шляхом додаткового введення КПВ на фоні росту первинної пухлини (7-ма група) не покращувало результати, а, навпаки, призводило до різкого погіршення кількісних та об’ємних характеристик метастазування (відповідно у 2 та 3,5 раза порівняно з контролем), що можна розцінювати як вірогідну стимуляцію метастазування. Аналогічну картину спостерігали також при схемі з неоад’ювантним режимом введення Dox (2-га група) — метастази були у 100% тварин, а їхній середній об’єм майже у 6,5 раза перевищував показник у контрольних нелікованих оперованих мишей.
Отже, оптимальною виявилася комбінована схема, що передбачає введення Dox до ХВП, а КПВ — мишам із мінімальною залишковою пухлинною хворобою (у ранній термін після ХВП). Можна зробити висновок в даному випадку про синергізм дії Dox та КПВ (5-та група), тому що ефект від застосування кожного з них окремо в аналогічних умовах (2-га і 4-та групи) значно поступався ефекту від використання цієї комбінованої схеми.
Протипухлинна імунна відповідь залежить від функціонування як специфічної (цитотоксичні Т-лімфоцити та плазматичні клітини), так і природної ланки імунітету (Мф). Застосування комбінованої ХІТ (5; 6 і 7-ма групи) ініціювало зміни в імунному стані пухлиноносіїв, а саме — достовірно призводило до активації ЦТА Лц: цитотоксичний індекс (ЦІ) становив відповідно 53,20±3,21; 62,15±4,37 та 62,95±2,71% порівняно з інтактними тваринами або контрольними мишами з видаленою пухлиною (38,20±2,05 і 41,94±1,45%) (табл. 2).
Таблиця 2. Цитотоксичність Лц у МТТ-тесті у мишей з хірургічно видаленою КЛЛ, що одержували КПВ та/або Dox
| № групи | Характеристика групи | ЦТА Лц (ЦІ), % | АЗЦ Лц (ЦІ), % | ІП, % |
| 1 | КПР (ХВП) | 41,94±1,45 | 90,6±0,72 | 116,03 |
| 2 | Dox + ХВП | 50,76±3,90 | 88,61±2,57 | 74,58 |
| 3 | ХВП + Dox | 40,77±1,35 | 45,72±1,8 | 12,13 |
| 4 | ХВП + КПВ | 40,29±1,63 | 75,86±6,71 | 88,27 |
| 5 | Dox + ХВП + КПВ | 53,20±3,21* | 24,29±6,63 | −119,02 |
| 6 | ХВП + Dox + КПВ | 62,15±4,37* | 38,64±5,64 | −37,83 |
| 7 | КПВ + ХВП + Dox + КПВ | 62,95±2,71* | 44,23±4,07 | −42,34 |
| 8 | Інтактні миші | 38,20±2,05 | 36,39±2,60 | −4,98 |
*p<0,05 порівняно з показником контрольної групи (ХВП).
У тварин, які після ХВП отримували вакцину або Dox в монорежимі (3-тя і 4-та групи), ЦТА Лц була близькою до контрольних показників. Цікаво, що додавання аутологічної СК до тесту з визначення ЦТА Лц призводило до протилежного ефекту: в усіх групах з комбінованим введенням КПВ та Dox це супроводжувалося зниженням цитотоксичності (в 1,4–2,2 раза), при монотерапії КПВ або Dox, навпаки, подібно до контрольної групи (ХВП), спостерігалося зростання ЦІ. Цікаво, що у мишей з найкращими показниками антиметастатичного ефекту, які одержували КПВ в монорежимі (4-та група) або в комбінації з Dox (5-та група) (див. табл. 1), протилежний вплив СК на ЦТА Лц був максимально вираженим — ІП становив +88,27 і −119,02%.
Дослідження активності перитонеальних Мф у мишей зазначених груп не показало вірогідної зміни показників їх ЦТА порівняно з контрольними групами (КПР та інтактні тварини) (табл. 3). Додавання до тесту аутологічної СК в такому випадку супроводжувалося однаковою тенденцією до підвищення ЦТА Мф як в 4-й і 5-й групах мишей з найвищим ІІМ (ІП 30,78 і 21,13%), так і в інтактних мишей (39,02%). Але в цілому результати вивчення АЗЦ Мф практично не відрізнялися в усіх досліджених групах.
Таблиця 3. Цитотоксичність Мф в МТТ-тесті у мишей з хірургічно видаленою КЛЛ, що одержували КПВ та/або Dox
| № групи | Дослідні групи | ЦТА Мф (ЦІ), % | АЗЦ (ЦІ), % | ІП, % |
| 1 | КПР | 29,60±5,16 | 34,75±3,60 | 17,40 |
| 2 | Dox + ХВП | 36,86±3,01 | 38,91±3,07 | 5,59 |
| 3 | ХВП + Dox | 33,24±5,58 | 35,72±2,69 | 7,44 |
| 4 | ХВП + КПВ | 28,80±1,13 | 37,67±2,20 | 30,78 |
| 5 | Dox + ХВП + КПВ | 28,49±1,72 | 34,52±1,48 | 21,13 |
| 6 | ХВП + Dox + КПВ | 26,57±2,03 | 29,22±4,12 | 9,99 |
| 7 | КПВ + ХВП + Dox + КПВ | 32,41±6,18 | 29,35±2,95 | −9,46 |
| 8 | Інтактні миші | 23,45±1,87 | 38,46±2,05 | 39,02 |
Відомо, що в процесі прогресування злоякісних новоутворень часто відбувається порушення рівноваги клітинної та гуморальної відповіді, що призводить до суттєвих змін імунних реакцій. Так, слід відзначити, що результати дослідження ЦТА СК у мишей дослідних груп зовсім не збігалися з одержаним антиметастатичним ефектом (рис. 1).
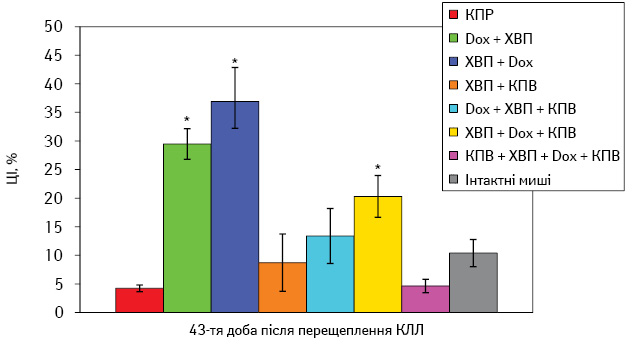 Рис. 1. ЦТА СК у мишей з хірургічно видаленою КЛЛ, що одержували КПВ та/або Dox*р≤0,05 порівняно з КПР
Рис. 1. ЦТА СК у мишей з хірургічно видаленою КЛЛ, що одержували КПВ та/або Dox*р≤0,05 порівняно з КПР
При оцінці цитотоксичності СК з’ясовано, що порівняно з контрольною групою (ХВП) вірогідно підвищеною вона була в 2-й та 3-й групах тварин, які одержували Dox в неоад’ювантному або ад’ювантному режимах, при цьому відбувався протилежний ефект щодо характеристик метастазування (ІІМ=+173,7 і −68,69%), тобто стимуляція або, навпаки, інгібіція метастазування. Крім того, низьку цитотоксичність СК спостерігали як у мишей з максимальним антиметастатичним ефектом (4-та та 5-та групи; ІІМ=−80,84 і −98,69%) при комбінованому введенні КПВ та Dox, так і в 7-й групі зі стимуляцією метастазування (ІІМ=+123,66%).
Щодо результатів рівня накопичення IgG до білкових екстрактів із клітин КЛЛ у СК дослідних тварин (рис. 2), то на 23-тю добу після ХВП у всіх дослідних та контрольних мишей 1–7-ї груп, незалежно від схем введення КПВ та/або Dox, спостерігали його підвищення порівняно з інтактними тваринами, але тільки у мишей з максимальним антиметастатичним ефектом (5-та група; Dox + ХВП + КПВ) цей показник був вірогідно нижчим за такий у групі оперованих контрольних тварин (ХВП). Тобто в цьому випадку на момент аналізу антиметастатичного ефекту можна констатувати, що чим ефективніша терапія, тим нижчий рівень тестованих IgG до антигенів гомологічної пухлини.
 Рис. 2. Рівень накопичення IgG до білкових екстрактів з клітин КЛЛ в СК у мишей з хірургічно видаленою КЛЛ, що одержували КПВ та/або Dox*р≤0,05 порівняно з КПР
Рис. 2. Рівень накопичення IgG до білкових екстрактів з клітин КЛЛ в СК у мишей з хірургічно видаленою КЛЛ, що одержували КПВ та/або Dox*р≤0,05 порівняно з КПР
Таким чином, за результатами досліджень ми можемо стверджувати, що специфічна протипухлинна імунотерапія на основі КПВ є дієвим і досить перспективним методом гальмування розвитку метастазів злоякісної пухлини. Підвищення ефективності ксеногенної вакцинотерапії цього типу може бути забезпечено за рахунок додаткових впливів, а саме низьких доз Dox. Розроблено оптимальну схему комбінованої терапії, що включає введення Dox до проведення ХВП, а КПВ — у ранній термін після ХВП (мишам із мінімальною залишковою пухлинною хворобою), яка забезпечує зростання ІІМ до 98%. Подібний ефект на момент аналізу антиметастатичної дії (23-тя доба після проведення ХВП; 43-тя доба після перещеплення КЛЛ) супроводжувався підвищенням цитотоксичності Лц та зниженням рівня накопичення IgG до білкових екстрактів із клітин гомологічної пухлини.
Слід зазначити, що перехід до клінічних випробувань схем ХІТ обмежений низкою невирішених питань, пов’язаних з відсутністю обґрунтованих режимів та недостатнім розумінням механізмів індукції оптимальної імунної відповіді. Це вказує на доцільність подальших досліджень таких режимів ХІТ, коли застосування біопрепаратів і цитостатиків сприятиме досягненню позитивного синергізму їхньої дії.
Список використаної літератури
1. Correale P., Cusi M.G., Micheli L. et al. (2006) Chemo-immunotherapy of colorectal carcinoma: preclinical rationale and clinical experience. Invest. New Drugs, 24(2): 99–110.
2. Guo C., Manjili M.H., Subjeck J.R. et al. (2013) Therapeutic cancer vaccines: past, present and future. Adv. Cancer Res., 119: 421–475.
3. Veltman J., Lambers M., Nimwegen M. et al. (2010) Low-dose cyclophosphamide synergizes with dendritic cell-based immunotherapy in antitumor activity. J. Biomed. Biotechnol., 2010: 798467. doi: 10.1155/2010/798467.
4. Zhao J., Huang Y., Liu D., Chen Y. (2014) Two hits are better than one: synergistic anticancer activity of α-helical peptides and doxorubicin/epirubicin. Oncotarget., 6(3): 1769–1778.
5. Gorbach O.I., Khranovska N.M., Skachkova O.V. et al. (2014) The chemoimmunotherapy based on dendritic cells and cisplatin in experiment. Biotechnol. Acta., 7(4): 85–91.
6. Ramakrishnan R., Assudani D., Nagaraj S. et al. (2010) Chemotherapy enhances tumor cell susceptibility to CTL-mediated killing during cancer immunotherapy in mice. J. Clin. Invest., 120(4): 1111–1124.
7. Kim D., Monie A., Tsai Y-C. et al. (2008) Enhancement of CD4+ T-cell help reverses the doxorubicin induced suppression of antigen-specific immune responses in vaccinated mice. Gene Ther., 15(16): 1176–1183.
8. Sheng Sow H., Mattarollo S.R. (2013) Combining low-dose or metronomic chemotherapy with anticancer vaccines. A therapeutic opportunity for lymphomas. OncoImmunology, 2(12): e27058.
9. Iinuma H., Fukushima R., Inaba T. et al. (2014) Phase I clinical study of multiple epitope peptide vaccine combined with chemoradiation therapy in esophageal cancer patients. J. Transl. Med., 12: 84.
10. Kepp O., Galluzzi L., Martins I. et al. (2011) Molecular determinants of immunogenic cell death elicited by anticancer chemotherapy. Cancer Metastasis Rev., 30: 61–69.
11. Garnett C.T., Schlom J., Hodge J.W. (2008) Combination of docetaxel and recombinant vaccine enhances T-cell responses and antitumor activity: effects of docetaxel on immune enhancement. Clin. Cancer Res., 14: 3536–3544.
12. Emens L.A., Asquith J.M., Leatherman J.M. et al. (2009) Timed sequential treatment with cyclophosphamide, doxorubicin, and an allogeneic granulocyte-macrophage colony-stimulating factor-secreting breast tumor vaccine: a chemotherapy dose-ranging factorial study of safety and immune activation. J. Clin. Oncol., 27(35): 5911–5918.
13. Wada S., Yoshimura K., Hipkiss E. et al. (2009) Cyclophosphamide augments antitumor immunity: studies in an autochthonous prostate cancer mode. Cancer Res.. 69(10): 4309–4318.
14. Храновська Н.М., Скачкова О.В., Горбач О.І. та ін. (2013) Хіміоімунотерапевтичний режим із застосуванням вакцини на основі дендритних клітин та низьких доз циклофосфаміду у мишей з карциномою легені Льюїс. Проблеми екологічної та медичної генетики і клінічної імунології, Вип. 5(113): 248–264.
15. Lutsiak M., Semnani R., Pascalis R. (2005) Inhibition of CD 4+CD 25+ T regulatory cell function implicated in enhanced immune response by low-dose cyclophosphamide. Blood, 105(7): 2862–2868.
16. von Mehren M., Arlen P., Gulley J. et al. (2001) The influence of granulocyte macrophage colony-stimulating factor and prior chemotherapy on the immunological response to a vaccine (ALVAC-CEA B7.1) in patients with metastatic carcinoma. Clin. Cancer Res., 7: 1181–1191.
17. Gulley J.L., Madan R.A., Schlom J. (2011) Impact of tumour volume on the potential efficacy of therapeutic vaccines. Current Oncol., 18: 150–157.
18. Wang S., Wenhong R., Jeffery L. et al. (2010) TRAIL and doxorubicin combination induces proapoptotic and antiangiogenic effects in soft tissue sarcoma in vivo. Clin. Cancer Res., 16(9): 2591–2604.
19. Патент на корисну модель № 77647 (UA). Спосіб одержання протипухлинної вакцини / Потебня Г.П., Діденко Г.В., Кузьменко О.П., Шпак Є.Г., Лісовенко Г.С., Черемшенко Н.Л., Симчич Т.В., Чехун В.Ф. (Україна); Опубл. 25.02.2013, Бюл. № 4.
20. Ohno M., Abe T. (1991) Rapid colorimetric assay for the quantification of leukemia inhibitory factor (LIF) and interleukin-6 (IL-6). J. Immunol. Meth., 145: 199–203.
Эффективность комбинированного применения ксеногенной противоопухолевой вакцины и доксорубицина в эксперименте
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
Киевский национальный университет им. Тараса Шевченко
Резюме. На модели карциномы легкого Льюис показано эффективность комбинированного применения химиотерапии и вакцинотерапии с использованием ксеногенной эмбриональной вакцины, разработанной в Институте экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины. Отобрано оптимальную схему комбинированной терапии, которая включает введение доксорубицина до проведения оперативного удаления опухоли, а вакцины — в ранние сроки после операции, что приводит к повышению индекса ингибиции метастазирования до 98%. Показано, что при применении комбинированного лечения у животных на конец эксперимента отмечали повышенную цитотоксичность лимфоцитов и снижение уровня накопления IgG к белковым экстрактам из клеток гомологичных опухолей.
ксеногенная противоопухолевая вакцина, антиметастатическая эффективность, комбинированная терапия.
Адреса:
Діденко Геннадій Васильович
03022, Київ, вул. Васильківська, 45
Інститут експериментальної патології,
онкології і радіобіології ім. Р.Є. Кавецького НАН України
E-mail: gennadij_d@mail.ru














Leave a comment